文章信息
- 张诗华, 赖晶, 倪琳, 宋平顺, 李辰荃, 郭朝晖
- ZHANG Shihua, LAI Jing, NI Lin, SONG Pingshun, LI Chenquan, GUO Zhaohui
- 基于ITS序列PCR-RFLP鉴别大蓟药材及饮片中掺伪飞廉、魁蓟的方法研究
- Identification of Cirsium japonicum, Carduus nutans and Cirsium leo by specific PCR-RFLP
- 天津中医药大学学报, 2023, 42(6): 780-785
- Journal of Tianjin University of Traditional Chinese Medicine, 2023, 42(6): 780-785
- http://dx.doi.org/10.11656/j.issn.1673-9043.2023.06.15
-
文章历史
收稿日期: 2023-08-07
2. 甘肃省药品检验研究院, 兰州 730070
2. Gansu Institute for Drug Control, Lanzhou 730070, China
大蓟作为常用中药材,2020年版《中国药典》一部中规定其为菊科植物蓟(Cirsium japonicum Fisch.ex DC.)的干燥地上部分,具有凉血、止血,化瘀解毒、消痈的功效,在临床上常用于衄血,吐血,尿血,便血,崩漏,外伤出血,痈肿疮毒[1]。飞廉(Carduus crispus L.)是菊科飞廉属二年生或多年生草本植物,收载于《卫生部药品标准藏药》第一册,具催吐,常用于消化不良,培根病,疮疖,痈疽等症[2]。魁蓟(Cirsium leo Nakai et Kitag.)是菊科蓟属植物,又名刺儿菜。大蓟作为市场主流商品,在商品流通中常常被混淆。三者均为菊科植物,因亲缘关系较近,性状、显微组织十分相似,化学成分的特异性不强,采用传统的鉴别方法难以鉴别,现行标准中缺乏专属性的检验方法。在中药市场中可能会存在以飞廉、魁蓟冒充大蓟或掺入到大蓟中进行买卖,这严重影响到临床用药安全。因此,建立一种将大蓟、飞廉、魁蓟等易混品种区分开的分子遗传标记鉴别方法显得尤为重要[3]。PCR-RFLP即聚合酶链式反应-限制性片段长度多态性,这种方法是在聚合酶链反应(PCR)的基础上,对特异性片段进行切割,然后通过琼脂糖凝胶电泳法进行检测,其具直观、灵敏、重现性好、专属性高等特点。近些年来,PCR-RFLP运用于石斛[4]、川贝母[5]的鉴别研究,快速筛选高纯合度天麻[6],木香[7]、当归[8]、罗布麻[9]、覆盆子[10]等中药材的真伪鉴别中得到应用。但将PCR-RFLP技术应用在大蓟真伪鉴别方面的研究较少,因此亟需建立一种鉴别大蓟及易混品的检测方法。本研究利用PCR-RFLP技术,筛选出飞廉和魁蓟的酶切位点,设计引物后对PCR-RFLP方法优化,建立了鉴别大蓟易混品飞廉、魁蓟的专属性检测方法。
1 材料与仪器 1.1 材料大蓟对照药材(批号:121411-201903)小蓟对照药材(批号:121436-201803)均购于中国食品药品检定研究院。本研究中的大蓟、小蓟、飞廉、魁蓟、丝路蓟、花叶滇苦菜样品均由甘肃省药品检验研究院宋平顺主任药师收集并鉴定。具体信息见表 1。
Plant Genomic DNA Kit 2000 preps植物DNA提取试剂盒、2×Taq PCR MasterMix、D200 DNA Marker(天根生化科技北京有限公司);2×Taq PCR StarMix(北京康润生物科技有限公司);2×Easy Taq PCR SuperMix(北京全式金生物技术股份有限公司);琼脂糖(Invitrogen公司);GelRed TM核酸凝胶染料(Biotium公司);限制性内切酶ApalI、限制性内切酶ZraI(NEB北京有限公司)。
1.3 仪器5424 R型高速冷冻离心机(德国艾本德公司);Dry Block Heater 2型恒温金属水浴锅(德国艾卡公司);VeritiTM 96-Well型PCR仪、Nano Drop one C型微量核酸定量仪(美国赛默飞世尔科技有限公司);Sub-cell GT型琼脂糖凝胶电泳仪(美国伯乐公司);GelDoc-IT 315凝胶成像系统(美国斯柏贸易北京有限公司)。
2 方法与结果 2.1 基因DNA的提取取药材细粉30 mg置于2 mL离心管中,按照Plant Genomic DNA Kit 2000 preps植物DNA提取试剂盒说明书提取样品的DNA(离心半径13 cm),另取大蓟对照药材、小蓟对照药材各30 mg,同法制成对照药材模板DNA溶液。将提取好的DNA模板于-20 ℃冰箱保存备用。
2.2 ITS片段扩增与测序样品采用ITS通用引物进行扩增,引物序列为ITS 2(F):5’-ATGCGATACTTGGTGTGAAT-3’;ITS3(R):5’-GACGCTTCTCCAGACTACAAT-3’反应体系总体积为50 μL,其中包含2×Taq PCR MasterMix 25 μL,正反引物各1 μL,DNA模板2 μL,用无菌水补足至50 μL。ITS扩增反应条件为94 ℃预变性5 min,30个循环(94 ℃ 30 s,56 ℃ 30 s,72 ℃ 30 s),72 ℃ 5 min。PCR产物由上海生工有限公司进行双向测序,以保证结果的有效性与准确性。
2.3 PCR-RFLP引物设计利用DNAMAN软件对测序得到的大蓟、飞廉和魁蓟ITS序列进行比对,查找合适稳定的变异位点,筛选出飞廉的酶切位点(GACGTC CTGCAG),魁蓟的酶切位点(GTGCAC CACGTG),通过Primer Premier 5.0软件设计含此酶切位点的鉴别引物3F-3R,送上海生工有限公司合成。引物序列为3F:5’-GGTGAACCTGCGGAAG-3’,3R:5’-GATGGTTCACGGGATTCT-3’。
2.4 琼脂糖凝胶电泳按照琼脂糖凝胶电泳法(四部通则0541),胶浓度为1.5%,胶中加入核酸凝胶染色剂GelRed;供试品、对照药材酶切反应溶液的上样量分别为8 μL,DNA分子量标记上样量为5 μL(0.5 μg/μL)。电泳结束后,取凝胶片在凝胶成像仪上或紫外透射仪上检视。
2.5 PCR扩增条件的优化分别选大蓟、小蓟、飞廉、魁蓟、丝路蓟、花叶滇苦菜一份样品对特异性鉴别引物进行PCR反应条件进行考察。
2.5.1 退火温度考察如图 1所示,在退火温度52、54、56 ℃时,样品非特异性扩增明显;退火温度58、60 ℃时,样品均在250~500 bp范围内检测到单一DNA条带;退火温度升至62 ℃时,样品扩增率降低;为了保证良好的重复性,因此选用58~60 ℃作为退火温度。
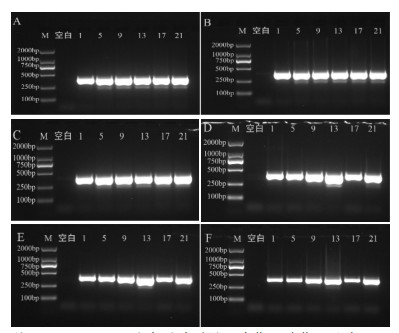
|
| 注:M. D2000 Marker;空白. 空白对照;1. 大蓟;5. 小蓟;9. 飞廉;13. 魁蓟;17. 丝路蓟;21. 花叶滇苦菜。A. 退火52 ℃;B. 退火54 ℃;C. 退火56 ℃;D. 退火58 ℃;E. 退火60 ℃;F. 退火2 ℃。 图 1 不同温度PCR扩增电泳图 |
如图 2所示,当循环次数为25时,样品扩增率低;循环次数为35时,样品出现非特异性扩增,不利于PCR-RFLP检测,为保证扩增的稳定性,选用30个循环。
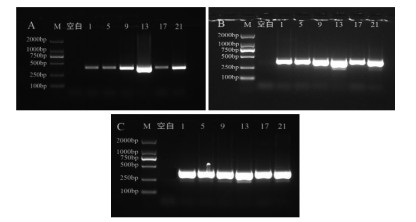
|
| 注:M. D2000 Marker;空白. 空白对照;1. 大蓟;5. 小蓟;9. 飞廉;13. 魁蓟;17. 丝路蓟;21. 花叶滇苦菜。A. 25循环;B. 30循环;C. 35循环。 图 2 不同循环数PCR扩增电泳图 |
如图 3所示,不同类型的聚合酶均在250~500 bp检测出单一DNA条带,表明所建立的PCR方法不受聚合酶类型的影响,本方法以2×Taq PCR MasterMix聚合酶作为该方法PCR反应的扩增酶。
|
| 注:M. D2000 Marker;空白. 空白对照;1. 大蓟;5. 小蓟;9. 飞廉;13. 魁蓟;17. 丝路蓟;21. 花叶滇苦菜。A. Easy Taq PCR SuperMix;B. 2×Taq PCR MasterMix;C. Taq PCRStarMix。 图 3 不同DNA聚合酶PCR扩增电泳图 |
综上所述,PCR反应总体积为25 μL,其中包括正反引物各0.5 μL,2×Taq PCR MasterMix 12.5 μL,DNA模板1 μL,无菌水补足至25 μL。反应条件为94 ℃ 5 min,30个循环(94 ℃ 30 s,58 ℃ 30 s,72 ℃ 30 s),72 ℃ 5 min。
2.6 酶切体系条件优化根据《中国药典》2020年版四部通则1001聚合酶链式反应法4测定法[11]中,反应产物检测中酶切反应总体积一般为20 μL,加入PCR扩增产物一般为5~10 μL,由此可见底物量不同也会影响酶切后的结果,因此考察了5、8和10 μL 3种不同的底物量。依据限制性内切酶种类选择适宜反应温度进行酶切,酶切反应时间通常为2~4 h,快速限制性内切酶的反应时间不超过1 h,所以同时对酶切时间也进行了考察。
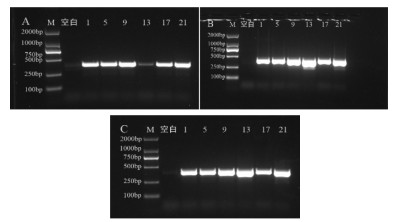
2.6.1 ZraI限制性内切酶酶切条件优化如图 4A-C所示,酶切时间依次设置为60、90、120 min,飞廉均被ZraI酶酶切成120 bp和259 bp两条DNA条带,从酶切后两条DNA的亮度和清晰度判断,酶切时间选为120 min。如图 4D-F所示,当底物量为5 μL时,底物量过低,影响结果判断;随着底物量的增大,酶切后的两条带DNA条带变亮,因此底物量选为8 μL。综上所述,ZraI限制性内切酶的酶切反应体系为:ZraI酶0.5 μL、NEBuffer 2 μL、扩增产物8 μL,无菌水补足至20 μL;反应条件为:37 ℃酶切120 min。
|
| 注:M. D2000 Marker;空白. 空白对照;1. 大蓟;5. 小蓟;9. 飞廉;13. 魁蓟;17. 丝路蓟;21. 花叶滇苦菜。A. 酶切60 min;B. 酶切90 min;C. 酶切120 min;D. 酶切底物5 μL;E. 酶切底物8 μL;F. 酶切底物10 μL。 图 4 ZraI酶不同酶切时间及底物量电泳图 |
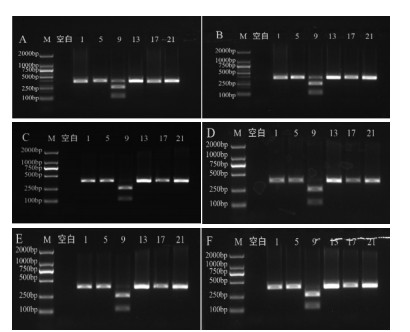
如图 5A-C所示,酶切时间依次设置为30、60、90 min,魁蓟均被ApaLI酶酶切成126 bp和253 bp两条DNA条带,随着酶切时间的增长,酶切后的两条DNA条带变亮,考虑条带的亮度和清晰度,酶切时间选为60 min。如图 5D-F所示,当底物量为5 μL时,底物过低,影响结果判断;底物量为10 μL时,底物过高,酶切效果不佳;当底物量选择为8 μL时,酶切效果最好。综上所述,ApaLI限制性内切酶反应体系:ApaLI酶0.5 μL、NEBuffer 2 μL、扩增产物8 μL,无菌水补足至20 μL;酶切反应条件为:37 ℃酶切60 min。
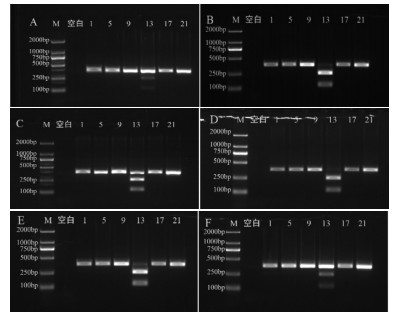
|
| 注:M. D2000 Marker;空白. 空白对照;1. 大蓟;5. 小蓟;9. 飞廉;13. 魁蓟;17. 丝路蓟;21. 花叶滇苦菜。A. 酶切30 min;B. 酶切60 min;C. 酶切90 min;D. 酶切底物5 μL;E. 酶切底物8 μL;F. 酶切底物10 μL。 图 5 ApalI酶不同酶切时间和底物量电泳图 |
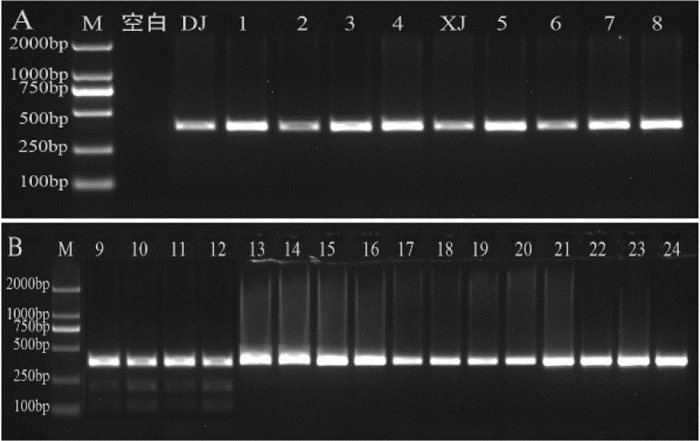
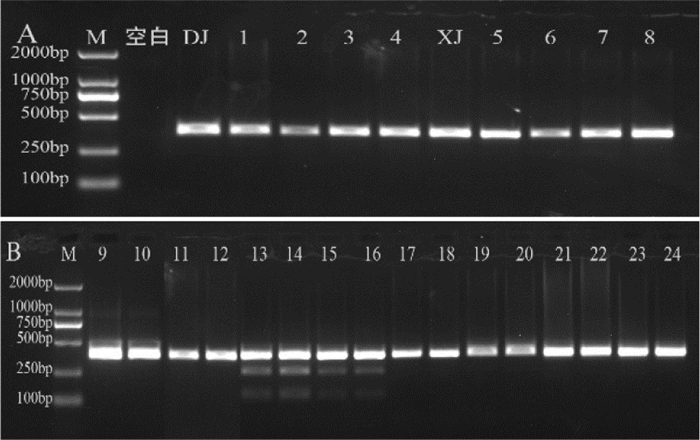
对不同产地的大蓟、飞廉、魁蓟等药材进行上述PCR-RFLP反应鉴别。结果发现所有样品均能扩增出一条379 bp的DNA条带。飞廉均被ZraI酶酶切成120 bp和259 bp两条DNA条带(结果见图 6);魁蓟均被ApaLI酶酶切成126 bp和253 bp两条DNA条带(结果见图 7)。由此可见该PCR-RFLP方法可以对大蓟的混伪品飞廉、魁蓟进行快速鉴别。
|
| 注:M. D2000 Marker;空白. 空白对照;DJ. 大蓟对照药材;1-4. 大蓟;XJ. 小蓟对照药材;5-8. 小蓟;9-12. 飞廉;13-16. 魁蓟;17-20. 丝路蓟;21-24. 花叶滇苦菜。 图 6 飞廉适应性考察电泳图 |
|
| 注:M. D2000 Marker;空白. 空白对照;DJ. 大蓟对照药材;1-4. 大蓟;XJ. 小蓟对照药材;5-8. 小蓟;9-12. 飞廉;13-16. 魁蓟;17-20. 丝路蓟;21-24. 花叶滇苦菜。 图 7 魁蓟适应性考察电泳图 |
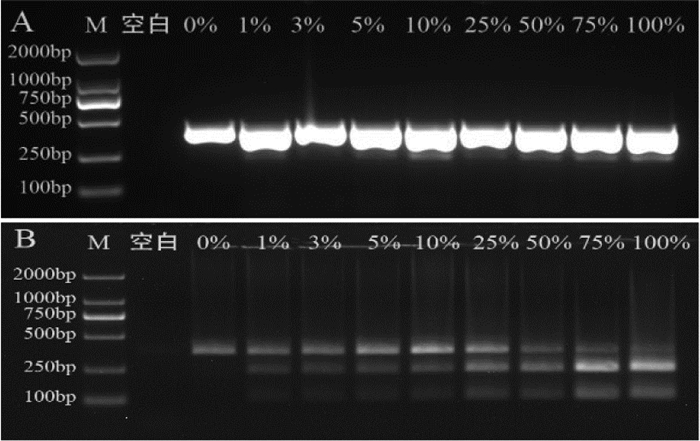
将易混品飞廉、魁蓟分别依次按照0%、1%、3%、5%、10%、25%、50%、75%、100% 的质量百分比比例掺入大蓟药材中,混合均匀后提取DNA,用PCR-RFLP方法鉴别。掺入比例为0% 的样品,检出一条379 bp的DNA条带,均未检出酶切后的两条DNA条带;大蓟中掺入1%飞廉时,检出很淡的两条DNA条带,但大蓟中掺入3% 以上的飞廉时,所有样品均检出120 bp和259 bp两条DNA条带(结果见图 8)。大蓟中掺入1%魁蓟时,也检出很淡的两条DNA条带,但大蓟中掺入3% 以上的魁蓟时,所有样品均检出126 bp和253 bp两条DNA条带(结果见图 9)。酶切条带的亮度与掺伪样品含量呈正相关,说明掺伪样品比例越高,酶切后条带越显著。
|
| 注:M. D2000 Marker;空白. 空白对照。 图 8 飞廉掺伪比例考察电泳结果图 |
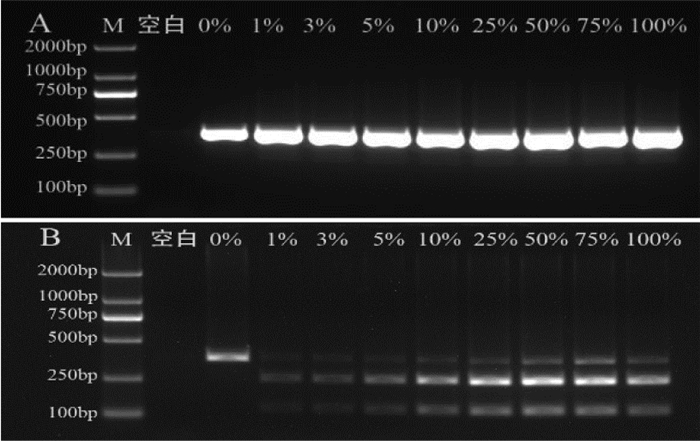
|
| 图 9 魁蓟掺伪比例考察电泳结果图 |
目前对大蓟、飞廉和魁蓟的研究多集中在药理药效和化学成分方面,对物种基原的鉴别研究甚少。李治昊等[12]对大蓟和魁蓟的含量进行测定,结果发现大蓟和魁蓟中均能检出蒙花苷和绿原酸。大蓟和魁蓟在药用方面具有极大相似性。此外还有研究发现,飞廉和魁蓟虽同属菊科植物,但不具有上述功效,所以不能代替大蓟药用。大蓟可抑制结核杆菌的生长[13]。万成杰[14]采用实时荧光定量PCR技术,研究大蓟中单体化合物HP01干预结核杆菌Kat G基因的转录。张景景等[15]研究表明ITS2序列可以作为鉴定大蓟药材及其近缘混伪品,但对于大蓟中掺入飞廉或者魁蓟并未有直接方法来鉴别。张峻铨等[16]对大蓟进行RAPD反应,采用SAS统计分析软件对样品的PCR结果进行了UPGMA(非加权类平均法)聚类分析表明,分子标记在蓟柄锈菌的划分与鉴定上具有很高的灵敏度与准确性。且来源地越靠近、孢子类型相同、采集时间越接近的样品亲缘关系越相近。
本实验通过对大蓟、飞廉和魁蓟三者的ITS序列对比分析,分别筛选出飞廉和魁蓟的特异性限制性内切酶位点,设计PCR扩增引物,建立了大蓟混伪品飞廉和魁蓟的PCR-RFLP快速鉴别方法。同时进行了掺伪实验,将不同比例的飞廉与魁蓟分别掺入到大蓟样品中,该PCR-RFLP方法可以检测出掺入1%的混伪品飞廉和魁蓟。因此本试验建立的PCR-RFLP方法稳定可行,专属性强、操作简单和反应灵敏等优点[5],可作为鉴别日常大蓟混伪品飞廉和魁蓟的方法。
PCR-RFLP方法虽已在生物鉴定中广泛应用,但其在一定方面存在局限性,只是用目标序列进行体外循环,如序列有替换、单点突变或者缺失都可能会导致错误结论[17]。同时本试验也存在一定局限性,例如样本量较少,在今后的研究中可收集更多的样本来验证结论。
| [1] |
国家药典委员会. 中华人民共和国药典(一部)[S]. 北京: 中国医药科技出版社, 2020: 26-27. National Pharmacopoeia Commission Pharmacopoeia of the People's Republic of China (Part 1)[S]. Beijing: China Pharmaceutical Science and Technology Press, 2020: 26-27. |
| [2] |
中华人民共和国卫生部. WS3-BC-0008-95, 中华人民共和国国家标准, 药品标准藏药第一册[S]. 北京: 中国标准出版社, 1995: 8. Ministry of Health of People's Republic of China. WS3-BC-0008-95, National Standard of the People's Republic of China, Drug Standard Volume I of Tibetan Medicine[S]. Beijing: China Standards Press, 1995: 8 |
| [3] |
冯成强, 唐晓晶, 黄璐琦, 等. 金钱白花蛇及其混淆品高特异性PCR的鉴别[J]. 中国中药杂志, 2006, 31(13): 1050-1053. FENG C Q, TANG X J, HUANG L Q, et al. High specific PCR identification of Bungarus multicinctus and its adulterants[J]. China Journal of Chinese Materia Medica, 2006, 31(13): 1050-1053. |
| [4] |
胡冲, 张亚中, 袁媛, 等. 霍山石斛的PCR-RFLP鉴别研究[J]. 药物分析杂志, 2020, 40(12): 2109-2115. HU C, ZHANG Y Z, YUAN Y, et al. Molecular identification of Dendrobiumhuoshanense by PCR-RFLP analysis[J]. Chinese Journal of Pharmaceutical Analysis, 2020, 40(12): 2109-2115. |
| [5] |
杨健, 李靖, 薛维娜, 等. 实时荧光定量PCR法鉴别川贝母掺伪[J]. 中成药, 2020, 42(5): 1262-1268. YANG J, LI J, XUE W N, et al. Identification adulteration in Fritillariae Cirrhosae by real-time fluorescence quantitative PCR method[J]. Chinese Traditional Patent Medicine, 2020, 42(5): 1262-1268. |
| [6] |
谢莹, 华中一, 赵玉洋, 等. 快速筛选高纯合度天麻PCR-RFLP鉴定方法[J]. 中国实验方剂学杂志, 2022, 28(17): 113-118. XIE Y, HUA Z Y, ZHAO Y Y, et al. Rapid screening of Gastrodia elata with high purity by PCR-RFLP identification[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2022, 28(17): 113-118. |
| [7] |
燕梦遥, 宋平顺, 赖晶, 等. 基于ITS序列PCR-RFLP鉴别木香、川木香和藏木香[J]. 南京中医药大学学报, 2022, 38(4): 339-346. YAN M Y, SONG P S, LAI J, et al. Identification of aucklandia Costus, Dolomiaea souliei and Inula racemosa by PCR-RFLP based on ITS sequence[J]. Journal of Nanjing University of Traditional Chinese Medicine, 2022, 38(4): 339-346. |
| [8] |
史中飞, 滕宝霞, 赖晶, 等. PCR-RFLP鉴别当归药材及饮片中掺混伪品: 欧当归的方法[J]. 中国实验方剂学杂志, 2021, 27(9): 168-175. SHI Z F, TENG B X, LAI J, et al. Identification of Levisticum officinale adulterated in Angelica sinensis by PCR-RFLP[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2021, 27(9): 168-175. |
| [9] |
刘流, 邰顺章, 支荣荣. PCR-RFLP法鉴别罗布麻与混淆品白麻及其psbA-trnH序列分析[J]. 药学与临床研究, 2021, 29(6): 411-415. LIU L, TAI S Z, ZHI R R. Distinguishing Apocynum venetum from its confusion Apocynum pictum with PCR-RFLP and sequence analysis of PsbA-trnH[J]. Pharmaceutical and Clinical Research, 2021, 29(6): 411-415. |
| [10] |
郑诚, 留钰秀, 袁莉霞, 等. 覆盆子及其近缘混淆品的PCR-RFLP鉴别研究[J]. 中国现代应用药学, 2022, 39(11): 1458-1463. ZHENG C, LIU Y X, YUAN L X, et al. Identification of Rubus chingii hu and its related confounders by PCR-RFLP[J]. Chinese Journal of Modern Applied Pharmacy, 2022, 39(11): 1458-1463. |
| [11] |
国家药典委员会. 中华人民共和国药典(四部)[S]. 北京: 中国医药科技出版社, 2020: 153. National Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China (Part 4)[S]. Beijing: China Pharmaceutical Science and Technology Press, 2020: 153. |
| [12] |
李治昊, 宋良科, 王小宁, 等. 大蓟-魁蓟-覆瓦蓟的蒙花苷和大蓟苷含量比较[J]. 中国中药杂志, 2013, 38(5): 674-677. LI Z H, SONG L K, WANG X N, et al. Content comparison of buddleoside and pectolinarin in Cirsium japonicum, C.leo and C.leducei[J]. China Journal of Chinese Materia Medica, 2013, 38(5): 674-677. |
| [13] |
刘艳霞, 杜宝中. 中草药抗菌活性研究进展[J]. 中国医药, 2021, 16(4): 622-625. LIU Y X, DU B Z. Research progress of antibacterial activity of Chinese herbal medicine[J]. China Medicine, 2021, 16(4): 622-625. |
| [14] |
万成杰. 大蓟抗结核杆菌成分的活性跟踪[D]. 贵阳: 贵州大学, 2021. WAN C J. Activity tracking of anti-Mycobacterium tuberculosis components from Cirsium japonicum[D]. Guiyang: Guizhou University, 2021. |
| [15] |
张景景, 祁晓婷, 张超, 等. ITS2序列鉴定大蓟、小蓟药材及其近缘混伪品[J]. 世界中医药, 2016, 11(10): 2126-2129. ZHANG J J, QI X T, ZHANG C, et al. Identification of Cirsium japonicum, Cirsium setosum and their adulterants based on ITS2 sequence[J]. World Chinese Medicine, 2016, 11(10): 2126-2129. |
| [16] |
张峻铨, 时焦, 韦建玉, 等. 烟田杂草小蓟锈病菌遗传多态性的RAPD分析[J]. 中国烟草科学, 2012, 33(3): 63-67. ZHANG J Q, SHI J, WEI J Y, et al. The analysis of Puccinia obtegens genetic polymorphic[J]. Chinese Tobacco Science, 2012, 33(3): 63-67. |
| [17] |
吴劲松, 张宇思, 刘薇, 等. 白及属药用植物DNA条形码的确立及其应用[J]. 药学学报, 2014, 49(10): 1466-1474. WU J S, ZHANG Y S, LIU W, et al. DNA barcoding research and its application on medicinal plants of Bletilla H. G. Reichenbach[J]. Acta Pharmaceutica Sinica, 2014, 49(10): 1466-1474. |
 2023, Vol. 42
2023, Vol. 42





