文章信息
- 王春洋, 杜雪晨, 庄铭, 安佳丽, 钟梦媛, 郑文科
- WANG Chunyang, DU Xuechen, ZHUANG Ming, AN Jiali, ZHONG Mengyuan, ZHENG Wenke
- 国际不良反应术语集对建立中医药不良反应术语集的启示
- Inspiration from the international terminology of adverse reaction to the establishment of the terminology of adverse reaction of traditional Chinese medicine
- 天津中医药大学学报, 2023, 42(6): 786-795
- Journal of Tianjin University of Traditional Chinese Medicine, 2023, 42(6): 786-795
- http://dx.doi.org/10.11656/j.issn.1673-9043.2023.06.16
-
文章历史
收稿日期: 2023-08-01
药品在临床的治疗过程中发挥着积极作用,但有时也会在治疗过程中出现严重的药品不良反应(ADR)从而给患者生命健康带来损害[1]。ADR是试验药物或者已上市药品安全性评价的重要参考数据,是药物警戒体系建设的基础[2]。从2015年到2019年,根据国家药品不良反应监测系统的数据,中国的ADR/药品不良事件(ADE)的总体报告数和严重报告数呈逐年增加的趋势。其中,中成药的ADR/ADE总体报告数为47.8万例次[3]。这得益于近年来我国药品警戒体系的逐步完善,同时,这一趋势也反映出中国药品不良反应监测评价工作仍有待进一步提高[4]。临床中ADR/ADE的有效发现和及时报告依赖于信息的准确采集与高效呈递,而规范的ADR术语集对于提高报告质量和信息呈递效率具有重要意义[5]。
在国家药物不良反应监测和药物临床试验过程中,受地区文化差异和语言表达习惯的影响,相同类型的ADR/ADE报告可能出现多种形式的表达,因不良反应术语不规范导致安全性信息难以准确呈递和系统分析的情况也时有发生[6]。随着药品市场的全球化和我国药品不良反应监测评价体系与能力的强化需要,ADR监测也逐步趋向于国际化[7],但与此同时跨语种翻译问题在一定程度上影响了药品监测报告中术语信息表达的准确性。因此将ADR/ADE术语进行标准化整理将有助于上市后药品的相关不良反应监测数据的高效互换与共享,能够在很大程度上保证描述用语的一致性[8]。
由于中国中医药不良反应术语标准化研制工作开始相对较晚,并缺乏相关的指导性标准,当前,中国药品不良反应术语的标准化研究并未有所突破,尤其是中医药领域的安全性评价,至今仍未有统一适用于中药临床试验和上市后药品不良反应监管的中药标准术语编码集[5]。虽然《监管活动医学词典》(MedDRA)术语集已在全球范围内广泛使用,中国药品监管部门也要求自2018年5月1日起全面使用MedDRA术语编码集[9],但以西医人体解剖结构分层编码的术语与以中医理论为基础的中医药中的“症状”并不相同,现有术语集并不能完全涵盖具有上千年历史的中医学,无法完全准确地描述中药不良反应[10-11]。为此,从构建特点、层级分布、特色功能等方面对国内外现有的相关不良反应术语集进行了简要梳理,通过整理总结现有术语集的优缺点,为未来建立符合中医药特点的标准化ADR术语集提供参考,促进中药全生命周期安全性评价体系的构建。
1 国际现有不良反应编码术语集当前,主要应用于国内外的四个不良反应术语集合包括:1)人用药品技术要求国际协调理事会(ICH)开发的MedDRA;2)乌普萨拉药品不良反应监测中心(UMC)制定的《WHO不良反应术语集》(WHOART);3)美国国家癌症研究所(NCI)制定的不良事件通用术语标准(CTCAE);4)风湿病结局评估工作组(OMERACT)制定的风湿病常见毒性标准。
2.1 《监管活动医学词典》(MedDRA) 2.1.1 词表概括MedDRA的研制充分满足了监管报告和药物研发者的信息需求[12]。因此在监管活动中被广泛应用,包括药品不良反应事件个案报告(ICSR)[13]、定期获益风险评估报告[14]、电子通用技术文档(eCTD)[15]等方面。其主要由医学状况(疾病、损伤和障碍/紊乱)、体征和症状类术语所构成[16]。
2.1.2 层级结构结合人体器官的层次性分类特点,MedDRA术语集具有固定的5级纵向层级结构,层级由高到低依次为系统器官分类(SOC)(27个),高位组语(HLGT)(337个),高位语(HLT)(1 737个),首选语(PT)(25 592个)和低位语(LLT)(85 668个),结构示意如图 1。其中低位语(LLT)构成了本术语集的最低层级,其上一级是首选语(PT),每个LLT只连接到一个PT,同一概念PT的不同LLT表达,有效地识别了不同语言、文化、地区间的原始数据的差异表达,在数据转换中起了重要作用。首选术语(PT)是用于表达某种单一医学概念的特定术语,包括症状、体征、疾病、诊断、适应症、检查、外科和内科手术、病史、社会史或家族史等,其具有一定的详细程度和特异性。高位语(HLT)是一种概括性术语,用于数据检索和表达,并且其特异性并不统一。它们通过解剖学、病理学、生理学、病因学或功能等特征与下一级的首选术语(PT)相关联。高级别组(HLGT)通过与一个或多个下级高级别术语(HLT)对应,基于解剖学、病理学、生理学、病因学或功能等特征进行分类。通过对HLT的分组归类,使HLGT的适用范围更宽,更助于术语的检索和表达。系统器官类别(SOC)是多级术语结构中的最高层级,其在不良反应数据检索中具有最广泛的概念,按分类标准可归纳为发病部位、病因学、目的3种[17]。
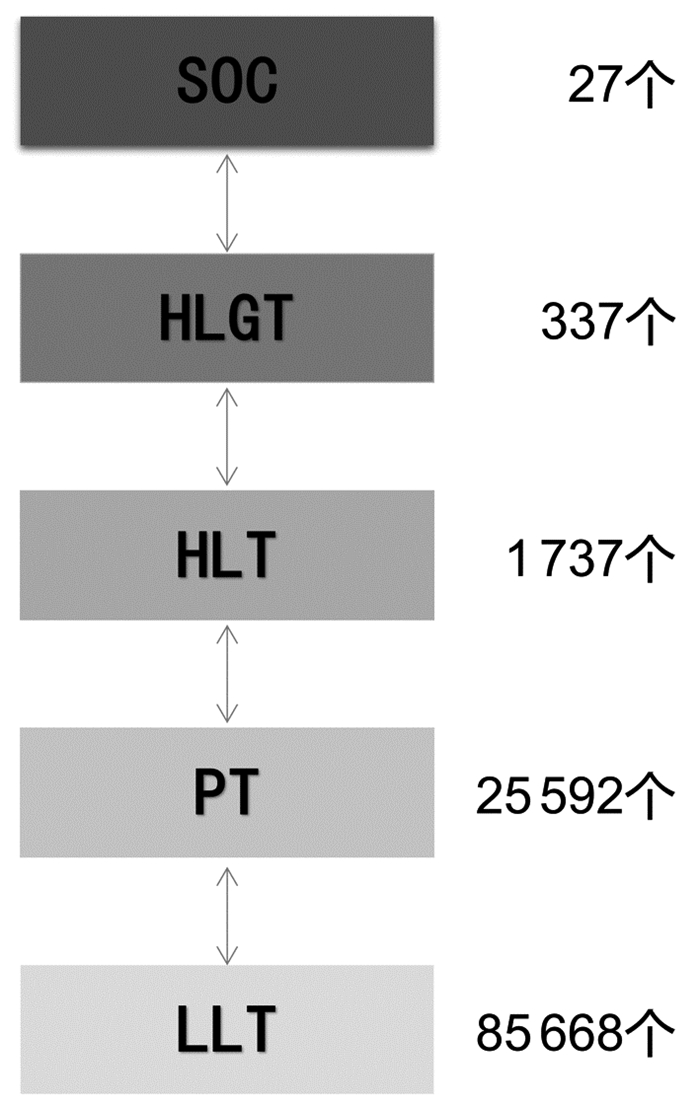
|
| 图 1 Med DRA(25.1版)术语集结构关系及数目 |
MedDRA内置分析查询工具(SMQ),主要为识别和检索可能的安全报告提供协助。每个SMQ是药物安全所关注的一种临床状况,由来源于不同的SOC首选语PT组成,概无其他LLT术语,例如:体征、症状、诊断、综合征、查体发现、实验室和其他生理检查数据等,通过链接安全性数据库,最终与具体病例相对应。这一功能为支持药物安全分析和报告起到了重要作用[18]。结构示意如图 2。
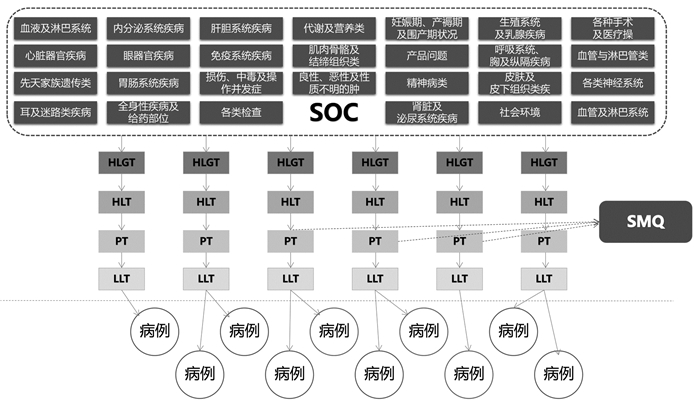
|
| 图 2 SMQ辅助病例检索结构示意图 |
首先MedDRA术语集的原始语种为英语,在全球范围应用的过程中,不同语种之间的翻译会造成术语信息的部分丢失。其次,MedDRA术语集的信息量庞大,术语相对较多,用户进行不良反应信息挖掘时,会出现信息分散的情况,导致信息检出的敏感度降低。最后,MedDRA术语集的普适性较好,但术语集的包容性不足,并未包含特色医学相关术语。
2.2 《WHO不良反应术语集》(WHO-ART) 2.2.1 词表概括WHO-ART为专业的药品不良反应术语集,主要整合编码与药品安全性相关的症状、体征、疾病、定性检验结果等,能对药品治疗过程中出现的不良反应信息进行高精度的编码。应用于新药开发、上市、检测不同阶段[19]。
2.2.2 层级结构结合人体器官的层次性分类结构特点,WHO-ART包含了4个层级术语,分别是系统器官分类(SOC),高位术语(HLT),首选术语(PT)和包含术语(IT)。各层级结构关系如图 3。其中系统器官分类(SOC)是主要用于不同目的信息输出的同一个系统器官的首选术语。高位术语(HLT)是一组有关的或具有相似条件的术语,便于信息的检索。首选术语(PT)是主要用于药品不良反应信息输入的常用术语。包含术语(IT)与首选术语密切相关,用于帮助将不良反应报告中的术语正确编码成对应的首选术语[20]。
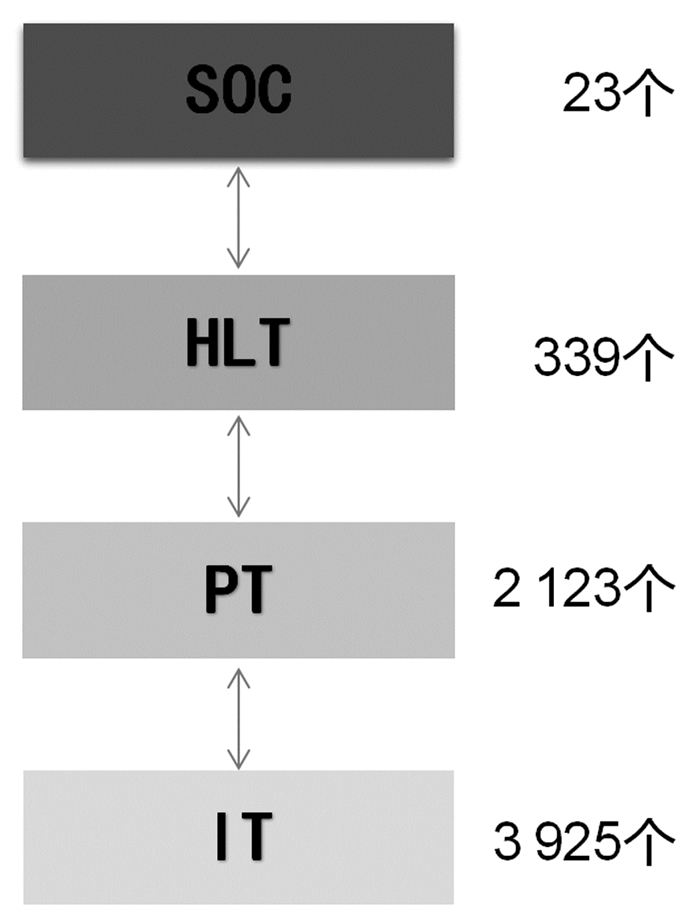
|
| 图 3 WHO-ART(2015版)术语集结构及数目 |
关键/重点术语(Critical terms):WHO-ART中,重点术语(Critical terms)是指被标记为“*”的术语,它是不良反应术语的子集,反映了严重的疾病状态,它的首选术语被标识为重点术语,与其相关的其他收录术语也被认为是重点术语[10]。这一功能可为临床医生及早识别严重不良反应提供帮助,如过敏性休克、再生障碍性贫血、多形性红斑等,结构示意图如图 4。
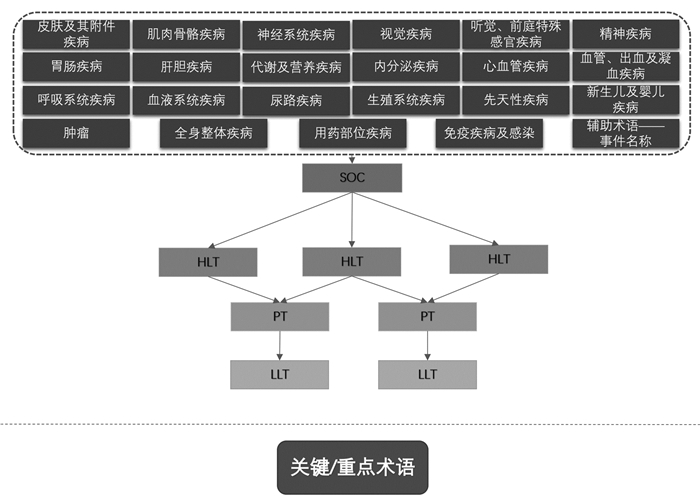
|
| 图 4 WHO-ART结构示意图 |
首先,WHO-ART术语集主要关注不良反应名称,对病名和病史进行编码时需辅助参考其他术语集,使得该术语集在实际使用中具有一定的局限性。其次,术语集更新较为滞后,未形成完善系统的术语集更新体系。最后,术语集的包容性不足,缺乏特色医学的相关术语。
2.3 《不良事件通用术语标准》(CTCAE) 2.3.1 词表概括为提高临床医务工作者和研究人员在对癌症的临床治疗或临床试验时所发生不良反应的准确识别和规范报告能力,通过对不良反应事件的定义和(严重性)等级分层,指导临床不良事件的规范化处置和严重性报告,对肿瘤治疗过程中不同器官系统的不良反应标准化定义和严重程度进行分级[21]。
2.3.2 层级结构CTCAE按照MedDRA的初级系统器官(SOC)分类进行分组,目前共有26个初级系统器官分类。在每个SOC里,不良事件术语都属于MedDRA低位语(LLT),目前有790个单项,不良事件被列出并伴随严重程度(1级至5级)作为特定的临床描述。最轻为1级:轻度;无症状或轻微;仅为临床或诊断所见;无须治疗,最严重为5级:代表与ADE相关的死亡。
2.3.3 特色功能不良反应事件严重性分级:根据系统器官分类,将不良反应事件分级描述其严重程度,从最轻的1级到最严重的5级,以便准确记录和报告药物不良反应。结构示意图如图 5。
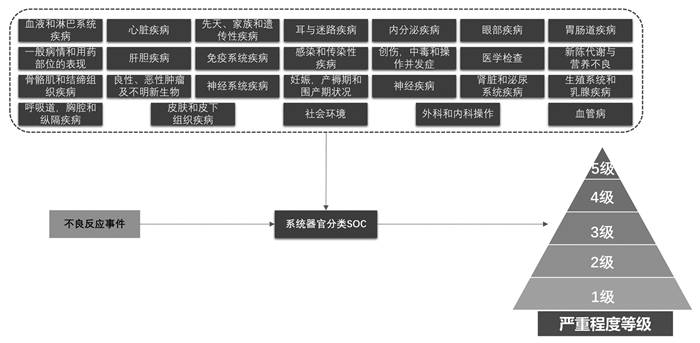
|
| 图 5 CTCAE术语结构示意图 |
CTCAE术语集的更新速度较慢,该术语集的原始术语为英语,仅有有限数量的语言版本,且中文版未对不良反应的严重程度进行详细说明,只对各个系统和器官可能出现的不良反应进行了简单的翻译[22]。
2.4 《风湿病常见毒性标准》(RCTC) 2.4.1 词表概括RCTC为提高临床试验不良事件评估和报告的一致性,促进研究人员、监管机构和从业人员区分风湿性疾病个体化和联合治疗的安全性概况的能力,明确了不良反应严重等级,有利于不良事件数据的管理。对风湿病治疗过程中不良反应事件的严重程度分级,指导临床治疗[23]。
2.4.2 层级结构RCTC按照MedDRA初级系统器官分类进行分组,通过对药物不良反应事件发生的频率和持续时间,以及事件的严重程度,包括对患者日常生活活动影响,对不良反应严重程度进行分级(4个等级,轻、中、重、危及生命),指导临床医生及时应对,结构示意图如图 6。最轻为1级轻度:无症状或短暂的(<1周),患者生活方式没有改变,没有药物治疗或非处方药治疗。最重为4级危及生命:严重残疾,特别是永久性残疾;住院时间>24h;永久研究停药。

|
| 图 6 RCTC术语结构示意图 |
ADR/ADE严重性分级:按照系统器官分类,明确ADR/ADE的定义,根据严重程度,结构示意图如图 6。
2.4.4 局限性/不足RCTC术语集更新速度较慢,用户数量较少,因此在实际应用中存在一定的局限性。
2.5 各术语集比较分析与启示以上国际现有术语集以不良反应术语为基础,呈多层级结构分布,但又各有侧重。WHO-ART与MedDRA术语集以人体系统器官分类为依据,将种类繁多的术语标准化。CTCAE和RCTC术语集在参照MedDRA结构基础上,针对专科疾病(如肿瘤、风湿免疫性疾病)临床试验或治疗中所发生的不良反应的标准化分级管理与上报。相比较单纯的术语标准化,增加了严重评级,但应用范围不如WHO-ART与MedDRA术语集。WHO-ART术语集已于2015年停止更新,MedDRA术语集目前已经覆盖126个国家,订阅机构达6400家,14种语言版本,在世界范围内普遍使用[5, 16],详细对比见表 1。
中国现用的MedDRA术语集从解剖、生理、病理等角度设立层级结构,将数量庞大的不良反应术语系统地分类归纳,但中医辨证是以中医基本原理为依据,从人体病变的虚实、阴阳表里、气血津液三方面进行论述;病机、病位与邪正盛衰的全面总结[24]。有研究[25-26]通过对《中医药学名词》[27]中诊法部分提到的中医症状学名词与MedDRA进行差异性研究,将中医名词按类似MedDRA的层级结构构建,这对研制中医药ADR编码术语具有一定的探索意义。这与现代医学有着本质的区别,中医整体观念和辨证论治的特点将疼痛按照不同部位与性质的分类表达,而西医却没有相关疼痛概念的分类。因此,中医药ADR编码术语集的层级结构并不能完全照搬MedDRA术语集,而是要在国际现有ADR术语集建设经验的基础上,结合中医药自身特点,扬长避短,构建符合我国临床实际需要的中医药ADR术语集。
3 中医药不良反应术语标准化的探讨 3.1 中医药ADR术语集构建概述数据显示2020年全国药品不良反应监测网络收到药品ADR/ADE报告83.0万份,其中中成药占11.9%,2020年中药ADR/ADE报告数量与2019年相比呈上升趋势[12],使中药在安全性问题方面受到广泛关注。因此,对中药安全性进行系统研究已成为创新驱动中医药高质量发展中的重要一步[28-29],规范中药ADR术语的编码无疑是进行相关研究的一个重要基础[25]。
中医药ADR术语集是对以中医基础理论为指导的中医学在临床实践中发生不良事件或不良反应症状整理的标准术语集合。新构建的中医药ADR术语集区别于现有的以人体解剖结构为分层依据的国际ADR术语集,其症状术语有着特定的内涵与外延。症状标准化是中医学现代发展内涵中的重要组成部分[30],规范的中医药ADR术语将更准确、科学地从中医理论角度阐释中医药治疗过程中出现的ADR/ADE症状的内涵。被呈递的ADR/ADE信息准确与否将直接影响到药物警戒重要内涵中的信号收集,进而最终影响到对药品的安全性评价[31]。
3.2 中医药ADR术语集层级结构内科疾病病种多,范围广,中医内科病症的命名原则主要是以病因、病机、病理产物、病位、主症、体征为依据[32]。中医药ADR术语集可借鉴国家统编的《中医内科学》教材的分类方法,确定中医领域知识节点以及节点之间的关系,以五脏为纲,将病症按照脏腑归属进行分类[23],从脏腑、经络、阴阳、气血方面进行分类,五级分层结构分别为中医SOC、HLGT、HLT、PT、LLT。SOC作为最高级,以脏腑、气血、筋脉为分类依据,并与多个下一级HLGT相连。HLGT以主症、病理产物为分类依据,并与多个下一级HLT相连。HLT以中医证型、病因、病机为分类依据,并与多个下一级PT相连。PT以症候为分类依据,并与多个下一级LLT相连。LLT作为最原始的症候术语,需不断地标化与更新。具体分层结构如图 7(以SOC中医脾胃系为例)。利用TRADOS软件的核心组件SDL MultiTerm进行术语库的导入与构建,通过SDL MultiTerm术语库管理功能,实现中医药ADR术语集规范术语的导入、调取和后续更新管理。SDL MultiTerm术语管理界面示意图如图 8。
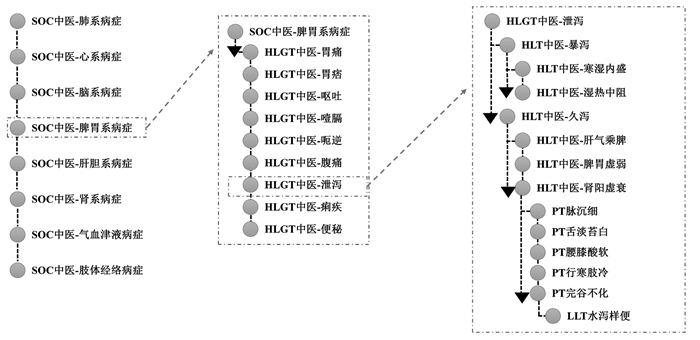
|
| 图 7 中医药ADR术语集编码分层结构示例 |
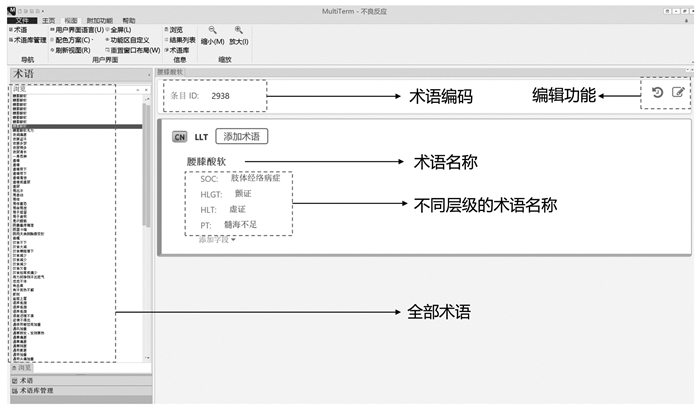
|
| 图 8 SDL MultiTerm术语管理界面示意图 |
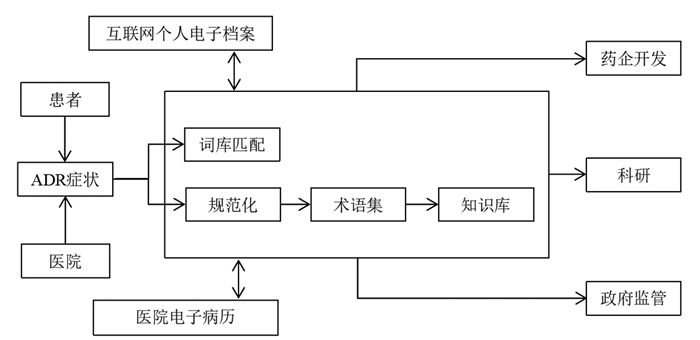
|
| 图 9 共建共享服务平台结构图 |
1)确定术语研究范围:收集现已发表的中医药文献病例报道或中药新药研发临床试验数据,并结合世卫组织发布的《世卫组织西太平洋区域传统医学国际标准术语》[24]等国际公认的中医药术语和临床医生、患者的问卷访谈等作为原始术语补充来源。2)成立研究指导组和课题组,包括MedDRA维护组织MSSO及国家ADR监测中心工作人员、医学术语专家(包括中医和西医)、中医临床各科具有丰富临床工作经验(例如5年以上)的临床医生、接受过中医药治疗的临床患者等各方利益代表。3)根据中医术语本身的特征,将其分为脏腑、气血、津液、经络等几个方面进行分类。4)中医学ADR编码术语制定后,在使用过程中,不断对术语集进行维护与更新。
3.4 中医药ADR术语集未来发展在未来,随着信息技术与中医学科的融合发展,中医药ADR术语集可通过构建共享服务平台的形式不断完善与更新,将患者个人和医疗机构作为ADR症状收集来源,通过与现有术语库关键词的自动匹配与人工规范化处理相结合的方式对术语集内容不断更新,不断完善的ADR术语管理平台对科研机构在提升药物安全性研究方面发挥作用,对医药企业来说,有效的安全性监测为提高药品质量和升级产品服务提供了方向;对监管机构来说,共建共享平台的建立为药品安全性监测提供了数据支持。同时,该平台也能为互联网个人电子档案、医院电子病历等需求提供服务,促进全民信息化健康监测,最终形成共建-共享的可循环发展模式,通过用户的检索与浏览和工作组的主动维护来共同实现对中医药ADR术语集的全周期管理[35]。
4 小结中医药学是汇聚了中国古代医药科学的智慧和经验,是对中华文明深层次认识和理解的重要体现,也是开启中华文明文化宝库的一把金钥匙。随着中医药国际化战略的快速推进,中医药安全性问题也备受关注,中医药不良反应术语标准化工作势在必行。因此,中药不良反应监测标准化工具和中医药理论的关系必须被正确地认识和处理,以及厘清这两者之间的联系,促进中医药国际化,促进中医近代化发展。
构建中药不良反应监测体系中的术语标准化,首先要掌握现代标准术语和中医理论之间的基本关系,以达到对中药ADR进行监测和表达的目标;其次,要充分认识到规范技术手段在中药国际化过程中发挥的桥梁作用,使之成为中药国际化的重要载体,从而弥补中药国际化的核心内容,促进中医药在国际上的地位;最后,要建立中医药标准化技术工具和现代化医疗技术工作之间的内在关系,使中医药认识的广泛性得到提高[36]。因此,中药不良反应监测体系中的术语标准化并非单纯的技术问题。
随着中药不良反应术语集的实际应用,术语集系统内容通过医院、企业、政府、科研单位等共享的形式将不断得到完善。助力政府监管部门形成完善的行业安全性监测规范的同时,逐渐满足我国中医药不良反应术语的特殊性、国际交流和国内医疗卫生信息化的需求。未来,将以问题为导向,在构建的不良反应标准术语集的基础上研究探索安全性监测报告评价的核心要素,为搭建真实世界安全性评价体系打好基础,最终加快分段式监管方式向全生命周期管理模式转变,数字化赋能基层监管工作,加快推进“十四五”期间药品安全治理体系和治理能力现代化。
| [1] |
ICH. 临床安全性资料的管理: 加速报告的定义与标准[EB/OL]. https://www.ich.org/products/efficacy/article/efficacyguidelines.html. ICH. Clinical safety information management: the definition and standard of accelerating report[EB/OL]. https://www.ich.org/products/efficacy/article/efficacyguidelines.html. |
| [2] |
王广平, 韩翠忍, 徐菊萍. 我国药物警戒体系共建共治研究与思考[J]. 中国医药导刊, 2021, 23(10): 777-782. WANG G P, HAN C R, XU J P. Research on the co-con-struction & co-governance of pharmacovigilance system in China[J]. Chinese Journal of Medicinal Guide, 2021, 23(10): 777-782. |
| [3] |
于洪礼, 逄瑜, 邵波, 等. 我国基本药物不良反应报告与监测情况浅析[J]. 中国药物警戒, 2021, 18(8): 766-768, 775. YU H L, PANG Y, SHAO B, et al. Current adverse drug reaction reporting and monitoring of essential medicines in China[J]. Chinese Journal of Pharmacovigilance, 2021, 18(8): 766-768, 775. |
| [4] |
国家药品监督管理局. 国家药监局关于进一步加强药品不良反应监测评价体系和能力建设的意见[EB/OL]. [11月15日]. https://www.nmpa.gov.cn/xxgk/fgwj/gzwj/gzwjyp/20200731134330152.html. National Medical Products Administration(NMPA) State food and drug administration on further strengthening the construction of adverse drug reaction monitoring and evaluation system and the ability to the opinions of the[EB/OL]. [15 November]. https://www.nmpa.gov.cn/xxgk/fgwj/gzwj/gzwjyp/20200731134330152.html. |
| [5] |
刘晶, 谢雁鸣, 盖国忠, 等. 药品不良反应术语集WHOART与MedDRA的应用探析[J]. 中国中药杂志, 2015, 40(24): 4728-4733. LIU J, XIE Y M, GAI G Z, et al. Application analysis of adverse drug reaction terminology WHOART and MedDRA[J]. China Journal of Chinese Materia Medica, 2015, 40(24): 4728-4733. |
| [6] |
苏设镇, 董凌云, 武志昂. 我国药物临床试验期间安全性数据快速报告的质量影响因素研究[J]. 中国新药杂志, 2020, 29(1): 73-80. SU S Z, DONG L Y, WU Z A. Study on quality influencing factors of expedited reporting of safety data during clinical trial of drugs in China[J]. Chinese Journal of New Drugs, 2020, 29(1): 73-80. |
| [7] |
国家药品不良反应监测年度报告(2018年)[J]. 中国药物评价, 2019, 36(6): 476-480. Annual report of national adverse drug reaction monitoring (2018)[J]. Chinese Journal of Drug Evaluation, 2019, 36(6): 476-480. |
| [8] |
刘慧英. 药品不良反应报告术语标准化程度的统计与分析[J]. 当代医学, 2014, 20(26): 122-123. LIU H Y. Statistics and analysis of standardization degree of adverse drug reaction reporting terminology[J]. Contemporary Medicine, 2014, 20(26): 122-123. DOI:10.3969/j.issn.1009-4393.2014.26.091 |
| [9] |
Products N M A. China NMPA technical guideline on the use of ICH tier 2 guidelines[EB/OL]. https://www.nmpa.gov.cn/xxgk/ggtg/qtggtg/20180125175101686.html.
|
| [10] |
谭业升. 试论中医跨文化译写的认知研究[J]. 英语研究, 2022, 20(1): 69-84. TAN Y S. Prolegomena to the cognitive studies of transcultural writing and translation of traditional Chinese medicine[J]. English Studies, 2022, 20(1): 69-84. |
| [11] |
国家药品监督管理局. 国家药品不良反应监测年度报告(2020年)[EB/OL]. [11月15日]. https://www.nmpa.gov.cn/xxgk/fgwj/gzwj/gzwjyp/20210325170127199.html. National Medical Products Administration (NMPA) National adverse drug reaction monitoring annual report (2020)[EB/OL]. [15 November]. https://www.nmpa.gov.cn/xxgk/fgwj/gzwj/gzwjyp/20210325170127199.html. |
| [12] |
Activities M D F R. Vision for MedDRA[EB/OL]. [10月18日]. https://www.meddra.org/about-meddra/vision.
|
| [13] |
ICH E2B Implementation Working Group. Implementation guide for electronic transmission of individual case safety reports (ICSRs) Version 5.02[EB/OL]. https://ich.org/page/e2br3-individual-case-safety-reporticsr-specification-and-related-files.
|
| [14] |
International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use (ICH). Periodic benefit-risk evaluation report(PBRER) E2C(R2)[EB/OL]. https://database.ich.org/sites/default/files/E2C_R2_Guideline.pdf.
|
| [15] |
International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use(ICH). Revision of M4E guideline on enhancing the format and structure of benefit-risk information in ich, efficacy-M4E[EB/OL]. https://admin.ich.org/sites/default/files/inline-files/M4E_R2_Step_4.pdf.
|
| [16] |
Anna C Zhao-Wong, 朱丽琳. 监管活动医学词典术语集简介与应用[J]. 中国药物警戒, 2022, 19(1): 74-78. WONG A C A, ZHU L L. An introduction to the Medical Dictionary for Regulatory Activities and its use[J]. Chinese Journal of Pharmacovigilance, 2022, 19(1): 74-78. |
| [17] |
MedDRA. MedDRA Hierarchy[EB/OL]. [11月15号]. https://www.meddra.org/how-to-use/basics/hierarchy.
|
| [18] |
MedDRA. Standardised MedDRA Queries[EB/OL]. [11月15日]. https://www.meddra.org/standardised-meddra-queries.
|
| [19] |
BROWN E G. Effects of coding dictionary on signal generation: A consideration of use of MedDRA compared with WHO-ART[J]. Drug Safety, 2002, 25(6): 445-452. |
| [20] |
汤小平. WHOART和MedDRA在药品不良反应监测中的应用[J]. 中国现代药物应用, 2015, 9(14): 285-286. TANG X P. Application of WHOART and MedDRA in adverse drug reaction monitoring[J]. Chinese Journal of Modern Drug Application, 2015, 9(14): 285-286. |
| [21] |
TROTTI A, COLEVAS A D, SETSER A, et al. CTCAE v3.0:development of a comprehensive grading system for the adverse effects of cancer treatment[J]. Seminars in Radiation Oncology, 2003, 13(3): 176-181. |
| [22] |
皋文君, 刘砚燕, 袁长蓉. 国际肿瘤化疗药物不良反应评价系统: 通用不良反应术语标准4.0版[J]. 肿瘤, 2012, 32(2): 142-144. GAO W J, LIU Y Y, YUAN C R. International evaluation system for adverse events of chemotherapeutic drugs in cancer treatment: CTCAE v4.0[J]. Tumor, 2012, 32(2): 142-144. |
| [23] |
STACH C M, SLOAN V S, WOODWORTH T G, et al. Rheumatology common toxicity criteria(RCTC): An update reflecting real-world use[J]. Drug Safety, 2019, 42(12): 1499-1506. |
| [24] |
崔柳君, 李琴, 张群. 老年社区获得性肺炎严重程度与LDH及中医证型的相关性研究[J]. 中国中医急症, 2022, 31(10): 1787-1790. CUI L J, LI Q, ZHANG Q. On the relationship between LDH, Traditional Chinese Medicine syndrome type distribution and the severity of community-acquired pneumonia in the elderly[J]. Journal of Emergency in Traditional Chinese Medicine, 2022, 31(10): 1787-1790. |
| [25] |
李庆娜, 陆芳, 赵阳, 等. 研制中医学不良反应编码术语集[J]. 中国循证医学杂志, 2018, 18(11): 1169-1172. LI Q N, LU F, ZHAO Y, et al. Development of coding terminologies on adverse drug reactions for traditional Chinese medicine[J]. Chinese Journal of Evidence-Based Medicine, 2018, 18(11): 1169-1172. |
| [26] |
李溪. 基于MedDRA的中药新药临床安全性评价术语编码数据库研究[D]. 北京: 北京中医药大学, 2012. LI X. Study on terminology coding database of clinical safety evaluation of new Chinese medicine based on MedDRA[D]. Beijing: Beijing University of Chinese Medicine, 2012. |
| [27] |
ZHENG J P, BIAN K, KE Y. Pondering the standardization of basic terms in traditional Chinese medicine[J]. Zhong Xi Yi Jie He Xue Bao=Journal of Chinese Integrative Medicine, 2005, 3(2): 166-168. |
| [28] |
陈凯先, 张卫东. 中药现代化与中药创新[J]. 中国食品药品监管, 2022(8): 4-13. CHEN K X, ZHANG W D. Modernization and innovation of traditional Chinese medicine[J]. China Food & Drug Administration Magazine, 2022(8): 4-13. |
| [29] |
肖小河. 中医药科学发展: 新时代, 新策略[J]. 中国中药杂志, 2019, 44(18): 3837-3841. XIAO X H. Development of traditional Chinese medicine: New Era and new strategy[J]. China Journal of Chinese Materia Medica, 2019, 44(18): 3837-3841. |
| [30] |
崔蒙, 范为宇, 尹爱宁, 等. 中医标准化发展现状分析[J]. 亚太传统医药, 2005, 1(1): 35-38. CUI M, FAN W Y, YIN A N, et al. Analysis on the current situation of Traditional Chinese Medicine standardization development[J]. Asia-Pacific Traditional Medicine, 2005, 1(1): 35-38. |
| [31] |
崔鑫, 王连心, 刘光宇, 等. 国际药物警戒体系对中药药物警戒体系建立的启示[J]. 中国中药杂志, 2021, 46(21): 5450-5455. CUI X, WANG L X, LIU G Y, et al. Enlightenment of international pharmacovigilance system on establishment of pharmacovigilance system of Chinese medicine[J]. China Journal of Chinese Materia Medica, 2021, 46(21): 5450-5455. |
| [32] |
赵红玉, 吴晓丹, 杨勇. 从主病主证角度探析君药[J]. 中医药信息, 2014, 31(5): 39-41. ZHAO H Y, WU X D, YANG Y. Research on the definition of sovereign herb from the perspective of major disease and major syndrome[J]. Information on Traditional Chinese Medi- cine, 2014, 31(5): 39-41. |
| [33] |
林燕, 赵程博文, 翟双庆. 基于国家统编教材的现代中医内科学理论体系框架初探[J]. 中华中医药杂志, 2017, 32(6): 2505-2509. LIN Y, ZHAO C, ZHAI S Q. First exploration on theoretical system framework of modern internal medicine of TCM based on national textbooks[J]. China Journal of Traditional Chinese Medicine and Pharmacy, 2017, 32(6): 2505-2509. |
| [34] |
WHO international standard terminologies on traditional medicine in the Western Pacific Region[EB/OL]. [15 November]. https://apps.who.int/iris/handle/10665/206952.
|
| [35] |
何清行. 语义相似度算法研究与医学术语服务平台的实现[D]. 长沙: 湖南大学, 2017. HE Q H. Research on semantic similarity algorithm and realization of medical term service platform[D]. Changsha: Hunan University, 2017. |
| [36] |
武志昂, 毕开顺. 中药现代化与药品不良反应监测[J]. 药物流行病学杂志, 2006, 15(4): 246-247. WU Z A, BI K S. Modernization of traditional Chinese medicine and monitoring of adverse drug reactions[J]. Chinese Journal of Pharmacoepidemiology, 2006, 15(4): 246-247. |
 2023, Vol. 42
2023, Vol. 42





