文章信息
- 李静雅, 卢云, 肖艳余, 高晨霞, 任晓亮, 陈美玲
- LI Jingya, LU Yun, XIAO Yanyu, GAO Chenxia, REN Xiaoliang, CHEN Meiling
- 氧化石墨烯及其衍生物在中药有效成分应用方面的研究进展
- Application of graphene oxide and its derivatives in active ingredients of traditional Chinese medicine: a review
- 天津中医药大学学报, 2023, 42(6): 802-811
- Journal of Tianjin University of Traditional Chinese Medicine, 2023, 42(6): 802-811
- http://dx.doi.org/10.11656/j.issn.1673-9043.2023.06.18
-
文章历史
收稿日期: 2023-08-05
在当前新型冠状病毒肺炎大流行期间,以“三药三方”为代表的中药在防治新冠肺炎中起到积极作用,研究表明,“三药三方”在改善新冠肺炎重症患者临床症状、加快病毒清除率、缩短核酸转阴时间、促进肺部炎症吸收等方面有良好效果,被广泛认可,中药在临床上的优势也逐渐体现[1]。但中药有效成分作为药效物质基础存在自身局限性,长期以来限制了中药在临床上的应用,成为中医药现代化发展的瓶颈。第一,中药组分复杂且传统提取分离手段低效,难以实现中药有效成分的高通量分析,进而阻碍中药的进一步开发利用[2-3]。第二,中药有效成分的药理活性虽得到了临床实践的验证,但其溶解性差,生物利用度低、稳定性不足,阻碍了中药成药的药物研发可行性[4-6]。因此需要寻找新的方式更快速高效地提取分离中药有效成分,并寻找能改善中药有效成分成药性的方法,促进中药临床应用与发展。
近年来,氧化石墨烯(GO)及其衍生物在食品、环境检测及生物医学等领域已广泛应用于样品前处理中待测组分富集、药物递送等研究[7-8],在中药有效成分辅助提取、分离纯化与抗肿瘤方面表现出巨大潜力。GO以芳香环为骨架,边缘和平面含有大量羧基、羟基、羰基和环氧基等,提供了可进行化学修饰的活性位点,具有高比表面积和丰富的功能基团[9]。一方面,在π-π堆垛、氢键、静电等作用下有优异的吸附性,在中药有效成分提取分离纯化方面的优势逐渐显现;另一方面,具有较高的药物装载能力和良好的生物相容性,在提高药物的靶向性、缓释性、降低药物毒性等方面发挥重要作用。本文从GO及其衍生物结构和性质出发,综述了近几年来GO及其衍生物在中药有效成分应用方面的研究进展,为GO及其衍生物在中药领域进一步发展提供参考。
1 GO结构与性质2004年,英国曼彻斯特大学的K. S. Novoselov和A. K. Geim两位教授通过机械剥离法用胶带首次从高度定向热解石墨上逐层剥离得到了单层石墨烯[10-12]。石墨烯是由碳原子sp2杂化连接堆积而成的单层二维蜂窝状晶格结构的材料,具有卓越的导电性和导热性以及比表面积大(理论计算值2 630 m2/g),在材料学、生物医学等众多领域都有巨大的应用潜力[13]。GO作为石墨烯的氧化衍生物,同样具有比表面积大等优点,又因其片层上存在含氧基团极大增强了其生物相容性。
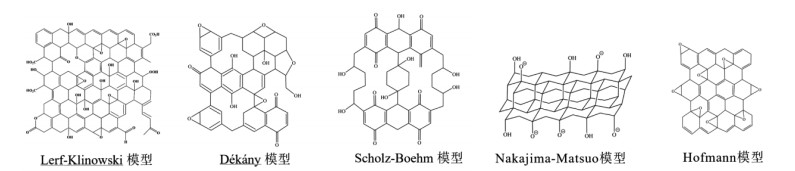
根据Lerf-Klinowsk模型[14],GO几乎是平坦的碳网格,只有连接-OH基团的碳是略微扭曲的四面体构型,致使片层上存在着一些褶皱。GO结构可分为两片区域:含有未氧化苯环的芳香区和含有脂肪六元环的区域,根据氧化程度的不同,两片区域的相对大小产生变化,羧基和羰基修饰在结构片层边缘,羟基和环氧基则修饰在片层表面。因此,Lerf-Klinowsk模型很好地解释了GO的亲水性、酸性、良好的吸附性和生物相容性等优异性质。极性含氧基团的引入使得GO在水中和极性溶剂中分散性良好,纳米级尺寸和广阔的平面结构与π共轭结构赋予其良好的生物相容性,是高效载药和给药最有利的纳米载体之一[15]。羧基和酚羟基的电离赋予GO酸性,可催化水解细胞壁辅助提取中药有效成分[16]。片层上的褶皱与孔隙使GO具有更大的比表面积,联合丰富的含氧基团为表面改性提供了活性中心,同时通过氢键作用,π-π堆垛作用,静电作用,范德华力等[17-18]非共价作用吸附有机染料,金属离子等物质,此外,GO制备方法成熟,易通过变性达到多重功能,便于回收利用,在吸附分离领域已经崭露头角[19]。
1.1 GO功能化GO的优异性能使其在众多领域都有应用,已成为碳材料家族最有应用前景的成员之一,通过对其结构进行化学调控和功能化修饰,可改善其实际应用缺陷,进一步放大优势,同时根据需要赋予其新功能特性。GO衍生物主要来自于GO与功能分子的共价功能化或非共价功能化,功能分子主要包括有机小分子或者聚合物等[20]。见图 1。
1.1.1 共价功能化共价修饰是功能分子通过共价键接枝在GO材料表面的方法,GO片层的活性含氧基团和芳香环可通过酯化反应、醚化反应、酰胺化反应等[22-23]得到比较稳定的复合物材料。Xu等[24]通过酰胺化反应,利用GO表面的羧基共价引入氨基化的六臂聚乙二醇得到在生理溶液中具有良好稳定性和生物相容性的纳米复合物,用于递送疏水性抗癌药物紫杉醇。Yang等[25]利用温敏特性的三嵌段共聚物与GO表面共价锚定,构建了基于荧光热响应嵌段共聚物功能化的GO纳米复合物的高效温度传感平台。
1.1.2 非共价功能化非共价修饰是利用功能分子与GO之间氢键、范德华力、静电作用、π-π堆垛等进行功能化。例如Ganesan等利用Fe3O4与GO之间的静电作用获得Fe3O4@GO复合材料,避免因Fe3O4纳米颗粒在GO上的共价作用而导致可吸附面积的减少,制备的复合材料在吸附后可有效分离并实现多次循环利用。Zhang等[26]通过π-π堆垛将蟛蜞菊内酯(Wed)和吲哚菁绿(ICG)共负载在GO表面,构建协同的化疗、PTT与PDT三联效应的多功能给药系统,与传统治疗策略相比,ICG-Wed-GO有望在肿瘤治疗中发挥更大的潜力。
与共价法相比,非共价修饰产生的相互作用相对较弱,但多个非共价键协同作用可以产生高度稳定的修饰,此外,它们很容易在整个GO表面实现,在某些情况下是可逆的,不会破坏GO的结构和性质[20]。共价结合使GO与功能分子之间通过强的界面相互作用紧密结合,形成稳定的复合物,但在这个过程中可能导致GO片层之间共轭结构的破坏,进而影响其性质[27]。然而当共价后GO稳定性和较强的功能特性可被预期时,共价修饰通常较好。
2 GO及其衍生物在中药有效成分提取分离方面的应用 2.1 GO辅助提取中药有效成分中药有效成分是中药发挥疗效的物质基础,也是中药安全有效和质量控制的关键,分离纯化中药有效成分,去除无效成分和有毒成分,减少服用剂量,以制作优良的中药制剂已成为必然[28]。中药有效成分提取较常用的方法是溶剂提取法,即利用相似相溶原理,根据有效成分极性差异选取合适的溶剂进行提取。但中药材常以植物的根、茎、叶等部位入药,在溶剂中不易润湿,且植物细胞壁的存在使得溶剂难以渗透入细胞内,因此仅用溶剂提取存在提取率低,提取效率慢等问题[29],因此亟须寻找一种行之有效的提取方式。GO含有丰富的含氧基团,在辅助中药提取过程中可作为酸催化剂水解破坏细胞壁中主要成分纤维素,促进有效成分浸出,提高中药有效成分提取速率。
Kitano等[30]使用含有-SO3H、-COOH和-OH的不定形石墨烯片水解桉树和稻草纤维得到水溶性β-1,4-葡聚糖和单糖,且颗粒状催化剂可以很容易的从糖类溶液中分离,且因其良好的稳定性而允许被重复使用且不降低催化活性。Wei等[16]利用GO作催化剂水解黄芩细胞壁,并通过SEM观察提取后药渣,结果表明GO对细胞壁水解和乙醇溶液中黄酮类化合物的浸出具有协同作用,相比乙醇回流提取显著提高了总黄酮提取率,并通过单因素考察发现GO的用量是决定催化反应活性和影响提取过程的关键参数,GO剂量为1.1 mg/g时总黄酮产量最高,随着GO的添加,提取液pH显著降低,黄酮类物质结构被破坏。苏学军等[31]研究GO辅助乙醇回流提取荞麦黄酮,以正交试验优化提取工艺,在最优工艺条件下,GO辅助乙醇回流提取荞麦黄酮总量为7.39 mg/g,相比乙醇回流提取增加了1.19 mg/g,提取过程中提取温度是对提取量影响最为显著的因素,温度过高时荞麦黄酮提取量降低,可能与GO和荞麦黄酮结构被破坏有关。
组成植物细胞壁的纤维素是一种不溶于水的β-1,4-葡聚糖集合体,在水中会紧密聚集保护β-1,4-糖苷键免受催化水解,因此纤维素的水解需要在硫酸等强酸催化剂下进行,然而,液体酸催化剂从均相反应混合物中分离成本高、效率低,GO作为固体酸催化剂因其独特结构具有显著优势:第一,比表面积大,反应底物与酸催化活性位点的接触更充分。第二,GO的含氧基团通过氢键与纤维素中的β-1,4-糖苷键紧密结合,同时在片层上构建了催化活性位点和吸附位点,催化活性显著提高。第三,制备方法成熟,可通过过滤[24]、透析[32]等方法从液体中分离,便于循环利用,作为催化剂有良好的稳定性。
2.2 GO在中药有效成分分离方面的应用从中药粗提物中获得纯化合物通常要经过多步分离纯化,常用的分离纯化方法[33]包括溶剂萃取、膜分离法、色谱法等,其中以碳纳米管[34-35]、高分子材料[36-37]、树脂[38-39]等为吸附剂的固相萃取法应用最广泛,是中药有效成分分析测定前基质去除和分析物富集的常用方法[40]。吸附剂是固相萃取法的关键,吸附剂的选择性越高,所得分析物的纯度和含量越高,分析方法的灵敏度也随之提高。但传统吸附剂对目标组分的亲和力和选择性较差,使得固相萃取方法在中药有效成分分离方面的进一步应用受到限制。GO富含褶皱与孔隙,吸附容量大,其表面含氧官能团为实现选择性吸附提供了丰富的结合位点[41-42];另一方面GO的平面结构不仅极大地降低了吸附时的空间位阻,而且其表面离域大π键可以通过π-π堆积作用与普遍存在于中药中,同样具有π键的中药有效成分紧密结合[43],使得GO作为吸附剂在分离纯化中药有效成分应用中具有显著优势。
2.2.1 常规固相萃取固相萃取(SPE)[44]是基于液-固色谱理论,根据目标分析物与干扰组分在萃取剂上吸附能力的差异进行分离,是目前应用最广泛的样品前处理技术。Liang等[45]通过在注射器中合成GO分散体,制备整体式固相萃取柱,分离纯化黄连上清片中的季铵生物碱,富集得到生物碱的回收率相比未经GO改性的注射器整体柱显著提高,且不受样品加载速度影响,缩短了样品处理时间,重复使用50次后回收率仍在85%以上,实现了中药有效成分的高效分离纯化。Liu等[46]制备双羧基硅烷改性GO与二氧化硅复合物(TSPSA@GO@SiO2)萃取人体尿液中的黄连碱、血根碱、盐酸小檗碱和白屈菜红碱,4种生物碱回收率范围为81.3%~110.6%,相比未添加GO的复合物回收率(60%~95%)和市售C18固体吸附剂的回收率(25.1%~75.0%)更高,表明GO相比传统吸附剂具有更强的吸附能力。虽然GO作为吸附剂用于常规固相萃取相比传统吸附剂具有诸多优势,但常规固相萃取本身具有样品与吸附剂接触面积小、分离受样品基质影响大、不适用于固体样品等缺点,从而研究开发了许多新萃取形式。
2.2.2 磁性固相萃取磁性固相萃取(magnetic solid phase extraction,MSPE)[47]是一种利用磁性或可磁化吸附剂从溶液或悬浮液中富集目标组分的分散固相萃取技术,其优势是目标组分吸附到吸附剂表面后,在外部磁力的作用下,可随吸附剂从基质中分离。利用Fe3O4等磁性基团修饰GO,一方面,可以通过外加磁场实现吸附剂的快速分离,减少吸附剂的损失,提高重复利用率,另一方面,可以使吸附剂直接分散在样品溶液中,增加固体与液体之间的接触面积从而实现快速吸附平衡,缩短提取时间。Nasiri等[48]利用Fe3O4与GO制备磁性吸附剂纯化红豆杉愈伤组织提取液中的紫杉醇,提高紫杉醇纯度同时去除愈伤组织培养物中的杂质,经响应面分析,愈伤组织衍生色素去除率达96.35%,紫杉醇纯度达30.60%,吸附剂经过9次重复利用后,回收率仍保持在85%以上,吸附容量和磁性特征几乎保持不变,证明制备的磁性吸附剂具有高回收性和稳定的吸附性,可用于天然成分的预纯化研究。虽然在SPE基础上进一步发展衍生MSPE在样品前处理中取得诸多进展,但MSPE因缺少特异性修饰对目标组分选择性弱,因而又研究发展了许多选择性强的分离技术。
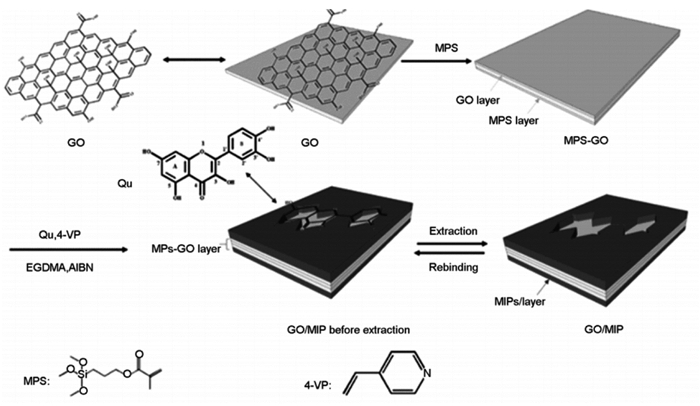
2.2.3 分子印迹技术分子印迹聚合物(MIPs)[49]是一类由人工合成的选择性吸附剂,原理是模拟抗原-抗体识别机制,制备具有与模板分子尺寸、形状和官能团互补的结合位点的聚合物,实现对目标化合物的特异性识别,在各个领域都有广泛应用。Zhao等[50]以槲皮素为模板分子,制备了GO分子印迹聚合物(GO/MIP),竞争吸附实验表明,在含有槲皮素、山柰酚、芦丁的混合溶液中,GO/MIP对槲皮素的吸附量显著高于其他成分,对槲皮素有较好选择性,吸附动力学结果显示,GO/MIP对槲皮素的吸附平衡时间(30 min)明显短于不含GO的MIPs吸附平衡时间(6 h),饱和吸附量(30.61 mg/g)显著高于不含GO的MIPs(19.08 mg/g),表明GO/MIP可用于黄酮类化合物中槲皮素的特异性测定和快速分离。见图 2。Dramou等[41]以槲皮素为模板,制备磁性GO分子印迹聚合物(MGO/MIP),吸附平衡时对槲皮素饱和吸附量达369 mg/g,与报道未添加GO的纳米复合材料相比具有高吸附容量。对MGO/MIP的吸附选择性研究表明,MGO/MIP对槲皮素有高选择性,对结构类似物木犀草素也有一定的吸附能力,对非结构类似物氨氯地平吸附能力弱,将MGO/MIP用于绿茶和血清样品中的槲皮素、木犀草素的分离测定,分析方法显示出良好的线性关系、精密度与准确性和较低的检测限,重复利用9次后回收率仍在80%以上,表明MGO/MIP可用于黄酮类物质特异性分离测定且有安全环保的优势。
3 GO及其衍生物在中药有效成分抗肿瘤方面的应用 3.1 中药有效成分功能化修饰GO因其独特层状结构和丰富含氧基团相比其他无机纳米材料具有更强吸附性、亲水性和分散性等优势,含氧官能团的存在为功能化修饰提供活性位点。因研究表明GO在盐溶液和生理溶液中易团聚产生絮状物,限制了其应用,所以对GO进行功能化修饰显得至关重要[51]。且非功能化GO大多只具有被动靶向性,在人体内呈非特异性分布,容易被内皮网状系统清除,因此利用抗体分子、生物膜等对GO进行功能化修饰,加载靶头,增加主动靶向性是其在抗肿瘤领域应用的重要突破口[52]。
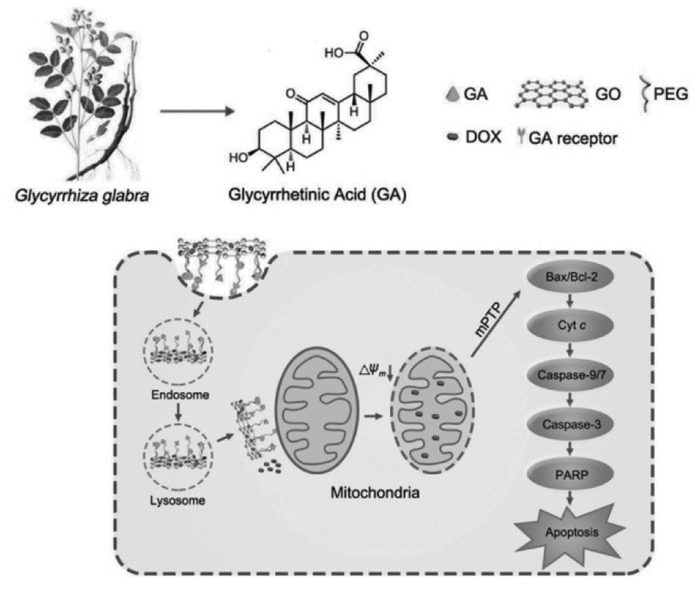
中药有效成分在肿瘤治疗方面具有独特优势,除通过本身药理活性稳定病灶部位、减轻症状、优化生存质量和延长生存期外,已有研究证明中药有效成分可通过靶向肿瘤细胞因子及受体、肿瘤微环境等发挥抗肿瘤效果[53-54]。如Negishi等[55]研究证明,大鼠肝细胞膜上有大量甘草次酸(GA)特异性结合蛋白,该蛋白结合位点在肝脏肿瘤细胞的表达是正常组织的1.5~5倍。Ismair等[56]发现,甘草酸(GL)是大鼠和人肝脏细胞特异性转运体的抑制剂,从而可参与肝细胞摄取和胆道排泄。因此,GL、GA可用于GO功能化修饰与肝脏细胞上特异性受体结合赋予高度靶向性。
高艳丽[57]在无有机溶剂和表面活性剂条件下制备肝靶向载体甘草酸-氧化石墨烯复合物(GL-GO),经紫外、红外等光谱表征GL与GO之间通过氢键作用力非共价结合,负载量达5.19 mg/mL且GL释放呈pH依赖性。Zhang等[58]进一步研究发现GA可作为线粒体靶向配体,增强线粒体的通透性促进药物吸收,制备了GA功能化GO并将其作为靶向递送阿霉素到肝脏线粒体的有效载体(GA-NGO@DOX),载药量达(1.10±0.05)mg/mg,体内外机制研究表明GA-NGO@DOX导致线粒体膜电位下降,激活MMA通路,与非GA功能化载体相比具有更强的诱导细胞凋亡能力和抗癌效果且表现出低毒性,可作为有效的药物递送工具。见图 3。
3.2 中药有效成分递送现代研究表明,中药多数成分均具有生物活性,临床发挥疗效具有对机体多成分、多靶点复合调节的特点,已广泛用于多种疾病的预防、诊断及治疗[59]。但中药抗肿瘤活性组分普遍具有水溶性差、肿瘤靶点治疗效果差、血液循环周期短等缺陷,严重制约了其在临床上的推广使用[4]。纳米递药系统可有效避免这些缺点,纳米粒子能够通过增强渗透和滞留效应提高在肿瘤部位的聚集,提高药效并降低毒副作用[60],目前用于中药抗肿瘤活性组分给药的纳米材料主要包括[61]无机纳米材料、有机纳米材料、生物纳米材料和复合纳米材料,GO等无机纳米材料因其易于制备、生物相容性好、表面活性区域广,而成为近年来生物医药领域的研究热点[62]。
3.2.1 改善药物水溶性研究表明,毛萼乙素对乳腺癌、结肠癌、肺癌等多种肿瘤细胞增殖均有较好的抑制作用,但其水溶性差,生物利用度低,临床应用受到限制[63]。徐志远等[64]通过酰胺化反应制备了聚乙二醇(PEG)接枝的GO(GO-PEG),制备的载体在水中和生理性盐溶液中可长期稳定存在,具有良好的亲水性和生物相容性,负载毛萼乙素后,载药率达18.8%,体外实验表明,载体对肿瘤细胞基本无毒,载药体系对细胞杀伤力明显高于游离药物,GO-PEG有效改善了毛萼乙素水溶性,提高抗肿瘤活性,有良好应用前景。汪祎燕[65]通过酯化反应和自组装技术制备了新型羧基化氧化石墨烯-β-环糊精药物载体(Gene-COO-β-CD)在水溶液中分散性良好且无细胞毒性,用于包合盐酸小檗碱(BH),包合后BH热稳定性提高(137 ℃),溶解度提高8.02倍。
3.2.2 缓控释药物,增强抗肿瘤活性Farahnaz等[66]利用化学法制备了装载绿原酸(CA)的GO纳米复合物(CAGO),载药率达13.1%,pH7.4环境下在103 h释放率达73%,相比CA与GO物理混合物在134 min内完成释放具有显著的缓释性,MTT结果显示GO对癌细胞系(HepG2、A549、Hela细胞)没有明显毒性,游离CA对癌细胞毒性明显,IC50值分别为40.5、39.8、44.0 μg/mL,装载后CAGO毒性进一步增强,IC50值最低,分别为29.1、31.2、39.2 μg/mL,表明GO用于制备抗癌缓控释制剂和增强药物抗肿瘤活性的潜力。Zhang等[67]制备透明质酸(HA)和聚醚胺(PEA)与GO的共价化合物(GO-PEA-HA)装载抗肿瘤活性成分槲皮素(Que),释放结果表明Que装载后pH敏感性提高,GO-PEA-HA/Que在亚酸性肿瘤微环境下表现出高释放行为,在中性条件下表现出低释放行为。药代动力学和体内药效学研究中,GO-PEA-HA/Que相比Que的Cmax和AUC0-∞大幅增加,CL降低,给药21 d后,Que和GO-PEA-HA/Que肿瘤生长率分别为944.6%和469.0%,表明GO-PEA-HA/Que可提高Que在体内的有效浓度,对肿瘤抑制作用更强且更稳定。Bao等[68]利用壳聚糖(CS)与GO共价功能化得到GO-CS具有良好的水溶性和生物相容性,喜树碱(CPT)与GO-CS通过非共价作用力结合为NGO-CS-CPT,药物体外释放行为显示37 ℃下72 h累积释放17.5%,并且与游离CPT相比NGO-CS-CPT对HepG2细胞和Hela细胞的毒性更显著。
3.3 化疗-光热法协同治疗肿瘤光热治疗(PTT)是将光敏材料注射入人体,并通过靶向识别技术聚集在肿瘤组织附近,在外部光源照射下将光能转化为热能,提高肿瘤局部区域温度,杀死癌细胞的一种治疗方法[69]。PTT可以定向杀伤癌细胞而不损伤正常组织及细胞,治疗时间短,治疗效果明显,创伤小,见效快,结合其他癌症治疗方式,往往可以达到更好的抗肿瘤效果[70-71]。PTT法兴起后,迄今已有金属纳米颗粒、碳基纳米材料、有机染料等在肿瘤光热治疗方面得到广泛应用。金属纳米颗粒具有较强的光热转换效率但价格昂贵,有机染料光稳定性较差,抗光漂白性弱,相比之下碳基纳米材料光热转换面积大,载药性能好,易功能化,生物相容性好,成为光热治疗肿瘤的热点。
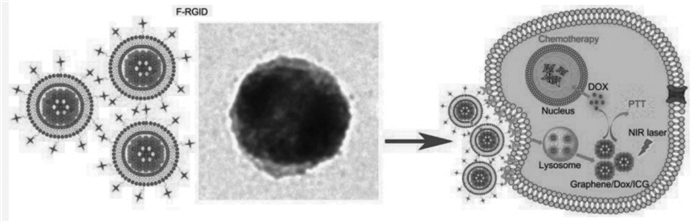
GO对近红外光吸收能力强,可在近红外光照射下将光能转化为热能,是一种良好的光热材料。Robinson等[72]制备了具有高近红外光吸收率和生物相容性的纳米级还原氧化石墨烯片(nano-rGO)用于潜在的PTT治疗,nano-rGO通过聚乙二醇聚合物链非共价功能化得以在生理溶液中保持稳定并通过与靶向肽结合靶向U87MG癌细胞实现高效光消融。因GO同时具有高光热转换效率和强载药能力,除用于肿瘤光热治疗外,还可作为光敏剂载体,扮演双重角色,实现光热和光动力治疗的协同。Li等[73]以载光敏剂吲哚菁绿(ICG)和阿霉素的GO作为内核,嵌入靶向分子叶酸的红细胞膜作为外壳,靶向递送药物到肿瘤部位,再结合GO和ICG的光热效应消融肿瘤。见图 4。
4 GO及其衍生物在中药有效成分应用方面的局限性和研究难点GO在中药有效成分应用方面显示出巨大发展潜力,并逐步应用于各种疾病的治疗当中,但同时也存在许多局限性以待解决。1)GO对中药有效成分的影响:GO用于中药有效成分的提取可根据GO尺寸大小采用过滤、透析等方法从提取液中分离,但少量残留是不可避免的,由于GO含有丰富官能团可与中药有效成分结合,中药有效成分的结构也可能会被破坏,这同时会引起其他物理性质发生变化,因此要充分考虑GO性质与中药药物的结构特性。2)GO生物安全性:由于GO的不可生物降解性,递送中药有效成分时其代谢和排出过程中可能会沉积在肺部、肝脏等,造成肺部损伤或者慢性肝毒性,具有潜在的长期毒性问题,需要对其进行全面毒性试验,促进其临床转化。此外,GO的尺寸、结构、表面修饰基团对其体内行为的影响尚不清楚,需要进一步研究。3)GO纳米制剂的质量控制:纳米制剂制备过程中中药性质可能会改变,甚至产生毒性和不良反应,因此需要系统的安全生产标准规范,严格把控质量标准,简化合成步骤,减少批量差异,实现从基础研究到临床试验再到大规模生产的顺利过渡。
5 总结与展望中药是中华民族长期与疾病斗争的智慧结晶,凭借其多成分、多疗效及安全性高等优势已广泛应用于多种疾病治疗,吸引了世界各国研究者的关注。但中药有效成分普遍溶解性差、组织渗透性差、体内消除快且半衰期短,无法得到充分利用。无机纳米材料GO在中药有效成分方面的应用有助于提高提取分离效率,改善中药有效成分溶解性、增强靶向性、缓释效应、提高疗效,减少中药有效成分临床应用的局限性,但同时也存在一些问题。首先,GO辅助提取中药有效成分过程中因为温度升高部分GO结构破坏而无法起到催化作用,而未被破坏的GO催化水解细胞壁促进有效成分浸出同时吸附有效成分,使得提取溶剂中有效成分减少,这也是不可忽视的。因此,GO辅助提取中药有效成分还应考虑被吸附成分的解吸附,进一步增加目标组分提取率。其次,GO对中药有效成分的分离纯化大多基于对材料的修饰改造或构建SPE、MSPE等多种萃取形式增加吸附选择性而忽略了解吸附过程对有效成分的选择性,吸附与解吸过程受pH、温度、离子浓度、洗脱剂极性等因素的影响,可以利用协同作用进一步提高材料选择性。第三,GO及其衍生物大多通过非共价方式与具有芳香环结构的中药单体成分结合,方法简单但结合后易断裂,在体内长循环中可能会造成药物的提前释放或泄漏,导致药效降低,且中药有效成分结构复杂、数量繁多,不应只局限于特定结构物质,对材料或中药有效成分改性促进多种中药组分以及中药多组分与材料的结合构建稳定的药物递送系统将是未来发展的方向。虽然GO及其衍生物在食品、环境检测及生物医学领域已有广泛应用,但在中医药领域的应用仍处在摸索阶段,随着中医药在世界范围内的广泛应用,促进学科交叉协作,深入挖掘纳米材料在中医药发展中的潜力指日可待。
| [1] |
CAPODICE J L, CHUBAK B M. Traditional Chinese herbal medicine-potential therapeutic application for the treatment of COVID-19[J]. Chinese Medicine, 2021, 16(1): 24. DOI:10.1186/s13020-020-00419-6 |
| [2] |
PENG L, WANG Y Z, ZENG H, et al. Molecularly imprinted polymer for solid-phase extraction of rutin in complicated traditional Chinese medicines[J]. The Analyst, 2011, 136(4): 756-763. DOI:10.1039/C0AN00798F |
| [3] |
WANG D D, GAO D, XU W J, et al. Magnetic molecularly imprinted polymer for the selective extraction of hesperetin from the dried pericarp of Citrus reticulata Blanco[J]. Talanta, 2018, 184(7): 307-315. |
| [4] |
KALEPU S, NEKKANTI V. Improved delivery of poorly soluble compounds using nanoparticle technology: A review[J]. Drug Delivery and Translational Research, 2016, 6(3): 319-332. DOI:10.1007/s13346-016-0283-1 |
| [5] |
QIAO L, HAN M S, GAO S J, et al. Research progress on nanotechnology for delivery of active ingredients from traditional Chinese medicines[J]. Journal of Materials Chemistry B, 2020, 8(30): 6333-6351. DOI:10.1039/D0TB01260B |
| [6] |
RAMALINGAM P, KO Y T. Improved oral delivery of resveratrol from N-trimethyl chitosan-g-palmitic acid surface-modified solid lipid nanoparticles[J]. Colloids and Surfaces B, Biointerfaces, 2016, 139(2): 52-61. |
| [7] |
ZARE P, ALEEMARDANI M, SEIFALIAN A, et al. Graphene oxide: Opportunities and challenges in biomedicine[J]. Nanomaterials, 2021, 11(5): 1083. DOI:10.3390/nano11051083 |
| [8] |
FARJADIAN F, ABBASPOUR S, SADATLU M A A, et al. Recent developments in graphene and graphene oxide: Properties, synthesis, and modifications: a review[J]. ChemistrySelect, 2020, 5(33): 10200-10219. DOI:10.1002/slct.202002501 |
| [9] |
DREYER D R, PARK S, BIELAWSKI C W, et al. The chemistry of graphene oxide[J]. Chemical Society Reviews, 2010, 39(1): 228-240. DOI:10.1039/B917103G |
| [10] |
GEIM A K, NOVOSELOV K S. The rise of graphene[J]. Nature Materials, 2007, 6(3): 183-191. DOI:10.1038/nmat1849 |
| [11] |
NOVOSELOV K S, GEIM A K, MOROZOV S V, et al. Electric field effect in atomically thin carbon films[J]. Science, 2004, 306(5696): 666-669. DOI:10.1126/science.1102896 |
| [12] |
NOVOSELOV K S, JIANG D, SCHEDIN F, et al. Two-dimensional atomic crystals[J]. Proceedings of the National Academy of Sciences of the United States of America, 2005, 102(30): 10451-10453. |
| [13] |
SERVICE R F. Materials science. Carbon sheets an atom thick give rise to graphene dreams[J]. Science, 2009, 324(5929): 875-877. DOI:10.1126/science.324_875 |
| [14] |
LERF A, HE H Y, FORSTER M, et al. Structure of graphite oxide revisited[J]. The Journal of Physical Chemistry B, 1998, 102(23): 4477-4482. DOI:10.1021/jp9731821 |
| [15] |
DANIYAL M, LIU B, WANG W. Comprehensive review on graphene oxide for use in drug delivery system[J]. Current Medicinal Chemistry, 2020, 27(22): 3665-3685. DOI:10.2174/13816128256661902011296290 |
| [16] |
WEI F Y, WANG X, ZHANG X Y. Application of graphene oxide as a catalyst to accelerate extraction of total flavonoids and the hydrolysis of baicalin from Radix scutellaria[J]. Separation and Purification Technology, 2014, 133(12): 421-428. |
| [17] |
QI Y C, YANG M L, XU W H, et al. Natural polysaccharides-modified graphene oxide for adsorption of organic dyes from aqueous solutions[J]. Journal of Colloid and Interface Science, 2017, 486(7): 84-96. |
| [18] |
WANG J, CHEN B L. Adsorption and coadsorption of organic pollutants and a heavy metal by graphene oxide and reduced graphene materials[J]. Chemical Engineering Journal, 2015, 281(6): 379-388. |
| [19] |
DE TOFFOLI A L, MACIEL E V S, FUMES B H, et al. The role of graphene-based sorbents in modern sample preparation techniques[J]. Journal of Separation Science, 2018, 41(1): 288-302. DOI:10.1002/jssc.201700870 |
| [20] |
LIU J Q, TANG J G, GOODING J J. Strategies for chemical modification of graphene and applications of chemically modified graphene[J]. Journal of Materials Chemistry, 2012, 22(25): 12435-12452. DOI:10.1039/c2jm31218b |
| [21] |
DREYER D R, TODD A D, BIELAWSKI C W. Harnessing the chemistry of graphene oxide[J]. Chemical Society Reviews, 2014, 43(15): 5288-5301. DOI:10.1039/C4CS00060A |
| [22] |
DO QUYEN CHAU N, REINA G, RAYA J, et al. Elucidation of siRNA complexation efficiency by graphene oxide and reduced graphene oxide[J]. Carbon, 2017, 122(7): 643-652. |
| [23] |
YANG Y F, SONG X H, YUAN L A, et al. Synthesis of PNIPAM polymer brushes on reduced graphene oxide based on click chemistry and RAFT polymerization[J]. Journal of Polymer Science Part A: Polymer Chemistry, 2012, 50(2): 329-337. DOI:10.1002/pola.25036 |
| [24] |
XU Z Y, WANG S, LI Y J, et al. Covalent functionalization of graphene oxide with biocompatible poly(ethylene glycol) for delivery of paclitaxel[J]. ACS Applied Materials & Interfaces, 2014, 6(19): 17268-17276. |
| [25] |
YANG H, PAEK K, KIM B J. Efficient temperature sensing platform based on fluorescent block copolymer-functionalized graphene oxide[J]. Nanoscale, 2013, 5(13): 5720-5724. DOI:10.1039/c3nr01486j |
| [26] |
ZHANG X W, LUO L Y, LI L, et al. Trimodal synergistic antitumor drug delivery system based on graphene oxide[J]. Nanomedicine: Nanotechnology, Biology, and Medicine, 2019, 15(1): 142-152. DOI:10.1016/j.nano.2018.09.008 |
| [27] |
崔冬辉, 史冰峰, 朱文晶, 等. 聚合物功能化氧化石墨烯的制备及应用的最新研究进展[J]. 分子科学学报, 2021, 37(5): 377-397. CUI D H, SHI B F, ZHU W J, et al. Recent progress in preparation and application of polymer functionalized graphene oxide[J]. Journal of Molecular Science, 2021, 37(5): 377-397. |
| [28] |
屠鹏飞, 姜勇, 郭晓宇. 新形势下中药创新药物的发现与研发[J]. 中国中药杂志, 2015, 40(17): 3423-3428. TU P F, JIANG Y, GUO X Y. Discovery, research and development forinnovative drug of traditional Chinese medicine under new situations[J]. China Journal of Chinese Materia Medica, 2015, 40(17): 3423-3428. |
| [29] |
李慧婷, 伍振峰, 万娜, 等. 浸提辅助剂在中药提取中的应用及研究进展[J]. 中国实验方剂学杂志, 2017, 23(23): 212-219. LI H T, WU Z F, WAN N, et al. Application and research progress of extraction auxiliary agents in extraction of traditional Chinese medicine[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2017, 23(23): 212-219. |
| [30] |
KITANO M, YAMAGUCHI D, SUGANUMA S, et al. Adsorption-enhanced hydrolysis of beta-1, 4-glucan on graphene-based amorphous carbon bearing SO3H, COOH, and OH groups[J]. Langmuir: the ACS Journal of Surfaces and Colloids, 2009, 25(9): 5068-5075. DOI:10.1021/la8040506 |
| [31] |
苏学军, 裘可, 范文赟. 氧化石墨烯辅助乙醇提取荞麦壳中总黄酮的工艺研究[J]. 中国饲料, 2022(9): 108-112. SU X J, QIU K, FAN W Y. Study on the process of extracting total flavonoids from buckwheat hulls with graphene oxide-assisted ethanol[J]. China Feed, 2022(9): 108-112. DOI:10.15906/j.cnki.cn11-2975/s.20220921 |
| [32] |
BHUNIA P, KUMAR M, DE S. Fast purification of graphene oxide solution by continuous counter current hollow fibre dialysis: a step towards large scale production[J]. The Canadian Journal of Chemical Engineering, 2019, 97(S1): 1596-1604. DOI:10.1002/cjce.23380 |
| [33] |
王凯, 岳宣峰. 中药有效成分分离纯化技术应用进展[J]. 榆林学院学报, 2005, 15(3): 21-23. WANG K, YUE X F. Progress in techniques of effective component separation from Chinese traditional medicine[J]. Journal of Yulin University, 2005, 15(3): 21-23. |
| [34] |
CAI Y Q, JIANG G B, LIU J F, et al. Multiwalled carbon nanotubes as a solid-phase extraction adsorbent for the determination of bisphenol A, 4-n-nonylphenol, and 4-tert-octylphenol[J]. Analytical Chemistry, 2003, 75(10): 2517-2521. DOI:10.1021/ac0263566 |
| [35] |
WANG Z H, XIA J F, HAN Q A, et al. Multi-walled carbon nanotube as a solid phase extraction adsorbent for analysis of indole-3-butyric acid and 1-naphthylacetic acid in plant samples[J]. Chinese Chemical Letters, 2013, 24(7): 588-592. DOI:10.1016/j.cclet.2013.04.015 |
| [36] |
GILART N, MARCÉ R M, FONTANALS N, et al. A rapid determination of acidic pharmaceuticals in environmental waters by molecularly imprinted solid-phase extraction coupled to tandem mass spectrometry without chromatography[J]. Talanta, 2013, 110(2): 196-201. |
| [37] |
MOAZZEN E, EBRAHIMZADEH H, AMINI M M, et al. A high selective ion-imprinted polymer grafted on a novel nanoporous material for efficient gold extraction[J]. Journal of Separation Science, 2013, 36(11): 1826-1833. DOI:10.1002/jssc.201300147 |
| [38] |
BRATKOWSKA D, DAVIES A, FONTANALS N, et al. Hypercrosslinked strong anion-exchange resin for extraction of acidic pharmaceuticals from environmental water[J]. Journal of Separation Science, 2012, 35(19): 2621-2628. DOI:10.1002/jssc.201200451 |
| [39] |
KARADAŞ C, TURHAN O, KARA D. Synthesis and application of a new functionalized resin for use in an on-line, solid phase extraction system for the determination of trace elements in waters and reference cereal materials by flame atomic absorption spectrometry[J]. Food Chemistry, 2013, 141(2): 655-661. DOI:10.1016/j.foodchem.2013.03.042 |
| [40] |
PȽOTKA-WASYLKA J, SZCZEPAŃSKA N, OWCZAREK K, et al. Miniaturized solid phase extraction[M]//Comprehensive Analytical Chemistry. Amsterdam: Elsevier, 2017: 279-318.
|
| [41] |
DRAMOU P, ITATAHINE A, FIZIR M, et al. Preparation of novel molecularly imprinted magnetic graphene oxide and their application for quercetin determination[J]. Journal of Chromatography B, Analytical Technologies in the Biomedical and Life Sciences, 2019, 1124(12): 273-283. |
| [42] |
LI Y H, DU Q J, LIU T H, et al. Comparative study of methylene blue dye adsorption onto activated carbon, graphene oxide, and carbon nanotubes[J]. Chemical Engineering Research and Design, 2013, 91(2): 361-368. DOI:10.1016/j.cherd.2012.07.007 |
| [43] |
WANG Y K, GAO S T, ZANG X H, et al. Graphene-based solid-phase extraction combined with flame atomic absorption spectrometry for a sensitive determination of trace amounts of lead in environmental water and vegetable samples[J]. Analytica Chimica Acta, 2012, 716(2): 112-118. |
| [44] |
ZHANG C, XING H F, YANG L R, et al. Development trend and prospect of solid phase extraction technology[J]. Chinese Journal of Chemical Engineering, 2022, 42(6): 245-255. |
| [45] |
LIANG X J, WANG L C, WANG S, et al. Direct preparation of a graphene oxide modified monolith in a glass syringe as a solid-phase extraction cartridge for the extraction of quaternary ammonium alkaloids from Chinese patent medicine[J]. Journal of Separation Science, 2017, 40(22): 4411-4419. DOI:10.1002/jssc.201700856 |
| [46] |
LIU H M, GUO Y, WANG X S, et al. Double carboxyl silicane modified graphene oxide coated silica composite as sorbent for solid-phase extraction of quarternary alkaloids[J]. Analytical Methods, 2015, 7(1): 135-142. DOI:10.1039/C4AY02172J |
| [47] |
SAFARIKOVA M, SAFARIK I. Magnetic solid-phase extraction[J]. Journal of Magnetism Magnetic Materials, 1999, 194(1-3): 108-112. DOI:10.1016/S0304-8853(98)00566-6 |
| [48] |
NASIRI J, NAGHAVI M R, MOTAMEDI E, et al. Carbonaceous sorbents alongside an optimized magnetic solid phase extraction (MSPE) towards enrichment of crude Paclitaxel extracts from callus cultures of Taxus baccata[J]. Journal of Chromatography B, 2017, 1043(11): 96-106. |
| [49] |
CHEN L X, WANG X Y, LU W H, et al. Molecular imprinting: Perspectives and applications[J]. Chemical Society Reviews, 2016, 45(8): 2137-2211. |
| [50] |
ZHAO X F, DUAN F F, CUI P P, et al. A molecularly-imprinted polymer decorated on graphene oxide for the selective recognition of quercetin[J]. Carbon, 2019, 145(7): 773. |
| [51] |
ZHANG X, YANG R, WANG C, et al. Cell biocompatibility of functionalized graphene oxide[J]. Acta Physico-Chimica Sinica, 2012, 28(6): 1520-1524. |
| [52] |
DEPAN D, SHAH J, MISRA R D K. Controlled release of drug from folate-decorated and graphene mediated drug delivery system: synthesis, loading efficiency, and drug release response[J]. Materials Science and Engineering: C, 2011, 31(7): 1305-1312. |
| [53] |
HU W H, DUAN R, XIA Y T, et al. Binding of resveratrol to vascular endothelial growth factor suppresses angiogenesis by inhibiting the receptor signaling[J]. Journal of Agricultural and Food Chemistry, 2019, 67(4): 1127-1137. |
| [54] |
HU K L, MIAO L, GOODWIN T J, et al. Quercetin remodels the tumor microenvironment to improve the permeation, retention, and antitumor effects of nanoparticles[J]. ACS Nano, 2017, 11(5): 4916-4925. |
| [55] |
NEGISHI M, IRIE A, NAGATA N, et al. Specific binding of glycyrrhetinic acid to the rat liver membrane[J]. Biochimica et Biophysica Acta, 1991, 1066(1): 77-82. |
| [56] |
ISMAIR M G, STANCA C, HA H R, et al. Interactions of glycyrrhizin with organic anion transporting polypeptides of rat and human liver[J]. Hepatology Research: the Official Journal of the Japan Society of Hepatology, 2003, 26(4): 343-347. |
| [57] |
高艳丽. 甘草酸-石墨烯复合材料的制备及其在新型靶向药物运输体系中的应用研究[D]. 青岛: 青岛大学, 2012. GAO Y L. Synthesis of glycyrrhizin-graphene composite materials and application as a novel targeting drug delivery system[D]. Qingdao: Qingdao University, 2012. |
| [58] |
ZHANG C, LIU Z F, ZHENG Y, et al. Glycyrrhetinic acid functionalized graphene oxide for mitochondria targeting and cancer treatment in vivo[J]. Small, 2018, 14(4). |
| [59] |
史同瑞, 刘宇, 王爽, 等. 肠道菌群与中草药有效成分代谢[J]. 中国微生态学杂志, 2014, 26(4): 479-482. SHI T R, LIU Y, WANG S, et al. The interaction of intestinal microflora and metabolism of effective ingredients from Chinese herbal medica[J]. Chinese Journal of Microecology, 2014, 26(4): 479-482. |
| [60] |
LIU Z, CHEN K, DAVIS C, et al. Drug delivery with carbon nanotubes for in vivo cancer treatment[J]. Cancer Research, 2008, 68(16): 6652-6660. |
| [61] |
周建平. 纳米技术在药物递送中的应用与展望[J]. 中国药科大学学报, 2020, 51(4): 379-382. ZHOU J P. Application and prospect of nanotechnology in the drug delivery system[J]. Journal of China Pharmaceutical University, 2020, 51(4): 379-382. |
| [62] |
BOGART L K, POURROY G, MURPHY C J, et al. Nanoparticles for imaging, sensing, and therapeutic intervention[J]. ACS Nano, 2014, 8(4): 3107-3122. |
| [63] |
ZHAO Y, NIU X M, QIAN L P, et al. Synthesis and cytotoxicity of some new eriocalyxin B derivatives[J]. European Journal of Medicinal Chemistry, 2007, 42(4): 494-502. |
| [64] |
徐志远, 李永军, 史萍, 等. 功能化石墨烯负载毛萼乙素抗肿瘤制剂的研究[J]. 有机化学, 2013, 33(10): 2162-2168. XU Z Y, LI Y J, SHI P, et al. Functionalized graphene oxide as a nanocarrier for loading and delivering of eriocalyxin B[J]. Chinese Journal of Organic Chemistry, 2013, 33(10): 2162-2168. |
| [65] |
汪炜燕. 新型功能化氧化石墨烯药物载体的合成及其性能研究[D]. 南京: 南京师范大学, 2011. WANG W Y. Synthesis and properties of novel functionalized graphene oxide drug carriers[D]. Nanjing: Nanjing Normal University, 2011. |
| [66] |
ZHANG L M, XIA J G, ZHAO Q H, et al. Functional graphene oxide as a nanocarrier for controlled loading and targeted delivery of mixed anticancer drugs[J]. Small, 2010, 6(4): 537-544. |
| [67] |
ZHANG Q, HUANG X, PU Y Q, et al. pH-sensitive and biocompatible quercetin-loaded GO-PEA-HA carrier improved antitumour efficiency and specificity[J]. Artificial Cells, Nanomedicine, and Biotechnology, 2018, 46(sup3): S28-S37. |
| [68] |
BAO H Q, PAN Y Z, PING Y, et al. Chitosan-functionalized graphene oxide as a nanocarrier for drug and gene delivery[J]. Small, 2011, 7(11): 1569-1578. |
| [69] |
LIU S, PAN X T, LIU H Y. Two-dimensional nanomaterials for photothermal therapy[J]. Angewandte Chemie (International Ed in English), 2020, 59(15): 5890-5900. |
| [70] |
TAY Z W, CHANDRASEKHARAN P, CHIU-LAM A, et al. Magnetic particle imaging-guided heating in vivo using gradient fields for arbitrary localization of magnetic hyperthermia therapy[J]. ACS Nano, 2018, 12(4): 3699-3713. |
| [71] |
JIANG X X, ZHANG S H, REN F, et al. Ultrasmall magnetic CuFeSe2 ternary nanocrystals for multimodal imaging guided photothermal therapy of cancer[J]. ACS Nano, 2017, 11(6): 5633-5645. |
| [72] |
ROBINSON J T, TABAKMAN S M, LIANG Y Y, et al. Ultrasmall reduced graphene oxide with high near-infrared absorbance for photothermal therapy[J]. Journal of the American Chemical Society, 2011, 133(17): 6825-6831. |
| [73] |
LI J A, HUANG X Y, HUANG R, et al. Erythrocyte membrane camouflaged graphene oxide for tumor-targeted photothermal-chemotherapy[J]. Carbon, 2019, 146(8): 660-670. |
 2023, Vol. 42
2023, Vol. 42