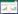文章信息
- 唐华靖, 罗雅歌, 杨磊, 徐宝欣, 徐静雅, 苗琳, 柴丽娟, 张晗, 王怡, 毛浩萍
- TANG Huajing, LUO Yage, YANG Lei, XU Baoxin, XU Jingya, MIAO Lin, CHAI Lijuan, ZHANG Han, WANG Yi, MAO Haoping
- 基于脂质代谢组学研究羟基红花黄色素A治疗高脂血症LDLR-/-小鼠的作用机制
- To investigate the mechanism of Hydroxysafflor yellow A in the treatment of hyperlipidemia in LDLR-/- mice based on lipid metabolomics
- 天津中医药大学学报, 2024, 43(1): 1-7
- Journal of Tianjin University of Traditional Chinese Medicine, 2024, 43(1): 1-7
- http://dx.doi.org/10.11656/j.issn.1673-9043.2024.01.01
-
文章历史
收稿日期: 2023-09-30
2. 悦康药业集团股份有限公司, 北京 100176
2. Youcare Pharmaceutical Group Co., Ltd., Beijing 100176, China
高脂血症是人体内脂代谢发生紊乱的一种现象,其特征主要是体内总胆固醇(TC)、三酰甘油(TG)、低密度脂蛋白胆固醇(LDL-C)含量升高,以及高密度脂蛋白胆固醇(HDL-C)降低[1]。高脂血症主要由饮食失调、肥胖、遗传性疾病或其他疾病引起[2]。此外,高脂血症可导致脂肪肝[3]、冠状动脉粥样硬化性心脏病[4]、糖尿病[5]、动脉粥样硬化[6]等疾病。目前,临床上有许多药物用于治疗高脂血症,包括他汀类药物、胆汁酸螯合剂、依折麦布片等,但这些药物可能引起肝脏毒性、腹痛、便秘等不良反应[7]。中医药治疗高脂血症具有其独特的优势,因而受到越来越多的关注。
红花(Carthamustinctorius L.)为菊科植物红花干燥的花,具有活血通经、化瘀止痛功效,是传统活血化瘀类中药[8]。活血化瘀类中药与高脂血症关系紧密,大量研究表明,活血化瘀类中药具有调节血脂作用[9-11]。从红花中提取分离得到的羟基红花黄色素A(HSYA),该成分是红花活血化瘀功效的主要有效成分[12]。现代药理实验表明,HSYA具有调节脂肪代谢、保护肝脏作用[13-14]。在2017年《红花黄色素临床应用中国专家共识》中明确HSYA具有调脂作用,有研究表明HSYA可以通过促进小鼠3T3-LI前脂肪细胞激素敏感脂肪增殖分化、减少前脂肪细胞数量达到降低血脂的目的[15-16]。为了进一步了解HSYA对高脂血症的作用机制,本实验基于脂质组学技术,采用高脂饲料诱导LDLR-/-小鼠构建高脂血症模型,研究HSYA对高脂饲料诱导的高脂血症LDLR-/-小鼠脂质代谢的调节作用,旨在为临床应用HSYA提供科学实验依据。
1 材料与方法 1.1 实验动物健康雄性LDLR-/-小鼠,7周龄,购于北京维通达生物技术有限公司,许可证号:SCXK(京)2019-0002。动物饲养于天津中医药大学动物中心动物屏障系统,饲养环境温度、湿度和换气次数由中央系统自动控制,温度维持在20~26 ℃,相对湿度维持在40%~70%,光照为12 h明暗交替。适应性喂养1周,期间大鼠自由进食饮水。实验方案符合天津中医药大学动物伦理委员会的规定,伦理编号:TCM-LAEC2022083。
1.2 主要仪器小型台式冷冻离心机(德国Eppendorf公司),涡旋混合器(美国Labnet公司),全自动生化仪(深圳迈瑞生物医疗电子股份有限公司),荧光显微镜(德国蔡司公司),-80 ℃冰箱(日本Sanyo公司);AB sciex6500+(美国SCIEX公司)。
1.3 主要药品与试剂HSYA(悦康药业集团股份有限公司),AST、ALT、TG、TC和LDL-C全自动生化试剂盒(深圳迈瑞生物医疗股份有限公司,批号:140222011、140121004、141720007、141621008、142020006),辛伐他汀(北京索莱宝公司,批号:1109F021),异丙醇(天津市风船化学试剂科技有限公司,批号:20200722)。
1.4 分组与干预适应性喂养1周后,将28只雄性LDLR-/-小鼠分为对照组(n=5)与高脂组(n=23)。对照组喂养普通饲料,高脂组喂养高脂饲料(TD88137),高脂饲料喂养6周后,全自动生化仪检测小鼠血清中LDL-C含量,根据LDL-C水平平均分为4组,即模型组、辛伐他汀组、HSYA低剂量(3.8 mg/kg)组、HSYA高剂量(7.6 mg/kg)组。对照组、模型组腹腔注射生理盐水,HSYA低剂量组、HSYA高剂量组均腹腔注射相应剂量HSYA,辛伐他汀组灌胃给药,给药11周,给药期间同时给予高脂饲料饲养。
1.5 观察指标及方法 1.5.1 全自动生化仪检测小鼠血清中ALT、AST、TG、TC、LDL-C含量将小鼠全血置于离心机离心,离心条件为4 ℃,3 500 r/min,离心15 min,分离血清,离心半径为10 cm,使用全自动生化分析仪检测小鼠血清中AST、ALT、TG、TC、LDL-C含量。
1.5.2 苏木精-伊红(HE)染色将小鼠肝脏用10%的福尔马林进行固定,固定时间为48 h,然后将其用石蜡进行包埋处理后,切成厚度为5 μm的切片,将切片进行HE染色,用光学显微镜对染色后的切片进行观察。
1.5.3 油红O染色将肝脏组织固定,切片厚度为5 μm。油红O染色法进行肝组织染色,并在显微镜下观察肝细胞脂质蓄积病理学变化。
1.5.4 血清脂质组学研究血清样本处理:取100 μL血清于1.5 mL的离心管中,加入300 μL预冷的异丙醇,涡旋5 min后,放入-20 ℃冰箱孵育1 h,14 000 r/min,4 ℃离心20 min(离心半径为10 cm),取上清至进样小瓶,待测。质控样品(QC)样本:从每个样本中取10 μL血清至1.5 mL的离心管中,涡旋5 min,加2倍体积的异丙醇,同法处理,制备QC样本。
实验条件:仪器采用AB sciex6500+,方法为三重四极质谱仪的多反应监测(MRM),每个样品分别采用正负两种模式分析(不同模式监控不同离子对)。使用ACQUITY UPLC BEH C8色谱柱(Waters,1.7 μm,2.1 mm×100 mm)进行液相色谱分离。流动相由水相(A)和有机相(B)组成,A相为水:甲醇:乙腈(3∶1∶1)+5 mmol/L醋酸铵(质谱级),B相为异丙醇+5 mmol/L醋酸铵。梯度洗脱设置为:0~0.5 min,20%B;0.5~1.5 min,20%~40%B;1.5~3 min,40%~60%B;3~13 min,60%~100%B;13~14 min,100%B;流速0.3 mL/min,进样量为2 μL。质谱(MS)通用参数设置为:气温400 ℃,离子喷雾电压5 500 V,喷雾气(GS1)、辅助加热气(GS2)均为50 psi,气帘气为35 psi。
数据处理:采用OS软件进行峰识别、脂质鉴定、峰提取、峰对齐及定量等处理,提取得到的数据。对OS提取得到的数据,进行总峰面积归一化处理。将得到的数据矩阵导入SIMCA-P 14.1软件,进行主成分分析(PCA)、正交偏最小二乘判别分析(OPLS-DA)、置换检验等多元统计分析。筛选差异代谢物的通用标准为:变量投影重要性值(VIP) > 1,同时P < 0.05。其中P来源于单变量分析方法(t检验),而VIP来源于多变量分析方法(OPLS-DA模型),物质的VIP越大,说明该物质对造成组间差异的贡献度越大。
1.6 统计学分析采用SPSS 21.0软件进行统计学分析,实验数据以均数±标准差(x±s)表示,采用单因素方差分析进行组间比较,方差齐时选用LSD检验方法,方差不齐时选用Dunnett’s T3检验方法,P < 0.05表示差异具有统计学意义。
2 结果 2.1 HSYA对高脂血症LDLR-/-小鼠血脂含量的影响与对照组比较,模型组LDLR-/-小鼠血清中LDL-C、TC、TG含量升高(P < 0.05)。与模型组比较,HSYA低、高剂量组LDLR-/-小鼠血清中LDL-C、TC、TG含量降低(P < 0.05)。结果表明,HSYA可以降低高脂血症LDLR-/-小鼠血清中LDL-C、TC、TG含量,发挥降低血脂的作用。见表 1。
与对照组比较,模型组LDLR-/-小鼠血清中ALT、AST含量升高(P < 0.05)。与模型组比较,HSYA低剂量组LDLR-/-小鼠血清中ALT、AST含量降低(P < 0.05),HSYA高剂量组LDLR-/-小鼠血清中ALT、AST含量有下降趋势,但差异无统计学意义(P > 0.05)。结果表明,低剂量HSYA可以降低高脂血症LDLR-/-小鼠血清中ALT、AST含量,减轻高脂血症引起的LDLR-/-小鼠肝脏损伤。见表 2。
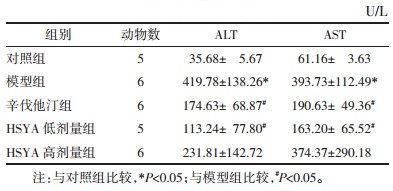
对照组LDLR-/-小鼠肝细胞形态正常,细胞内无脂滴分布,肝索排列整齐,肝窦清晰。模型组LDLR-/-小鼠可见肝组织脂肪变性明显,出现大小不等的脂滴浸润,肝细胞排列紊乱。HSYA低、高剂量组LDLR-/-小鼠脂滴浸润减少,肝细胞围绕中央静脉排列规则,肝细胞结构完整,脂肪变性改善。见图 1。
|
| 注:A,对照组;B,模型组;C,辛伐他汀组;D,HSYA低剂量组;E,HSYA高剂量组。 图 1 各组LDLR-/-小鼠肝脏组织HE染色结果(×100) |
对照组LDLR-/-小鼠肝脏组织中未见橘红色脂滴;模型组肝脏组织内出现大量橘红色脂滴,体积较大,且部分脂滴融合成片,提示肝组织内存在大量脂质蓄积;HSYA各剂量组LDLR-/-小鼠肝脏组织内脂滴密度有所减少,脂质蓄积情况得到改善。见图 2。

|
| 注:A,对照组;B,模型组;C,辛伐他汀组;D,HSYA低剂量组;E,HSYA高剂量组。 图 2 各组LDLR-/-小鼠肝脏组织油红O染色结果(×100) |
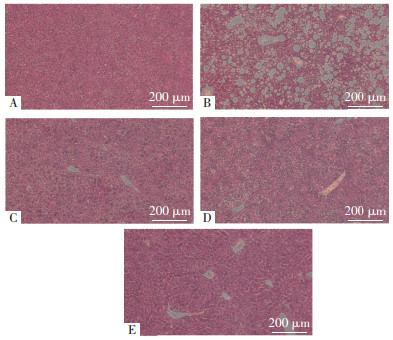
脂质亚类相对含量分析结果显示,与对照组比较,模型组LDLR-/-小鼠血清中磷脂酸(PA)、磷脂酰乙醇胺(PE)、磷脂酰甘油(PG)、磷脂酰肌醇(PI)、二氢神经酰胺(DCER)、己糖神经酰胺(HCER)、乳糖神经酰胺(LacCer)、葡萄糖基神经酰胺(GluCer)、二酰甘油(DAG)、鞘磷脂(SM)、TG等含量升高(P < 0.05)。与模型组比较,HSYA高剂量组LDLR-/-小鼠血清中磷脂酰胆碱(PC)、溶血磷脂酰乙醇胺(LPE)、溶血磷脂酰肌醇(LPI)、PA、PE、PI、DCER、DAG含量下降(P < 0.05)。初步表明HSYA具有改善高脂血症LDLR-/-小鼠血清脂质代谢紊乱的作用。见图 3。
|
| 注:与对照组比较,*P < 0.05;与模型组比较,#P < 0.05。 图 3 HSYA对高脂血症LDLR-/-小鼠血清脂质含量的影响(x±s,n=5或6) |
OPLS-DA分析显示,各组样本代谢谱分离度较高,提示组间脂质代谢差异明显(图 4A与图 4C)。使用置换检验(n=200)对模型进行过拟合分析,以保证模型的有效性。结果显示Q2均小于0,提示模型不存在过拟合现象(图 4B与图 4D),模型可以较好地解释各组样本间的差异。
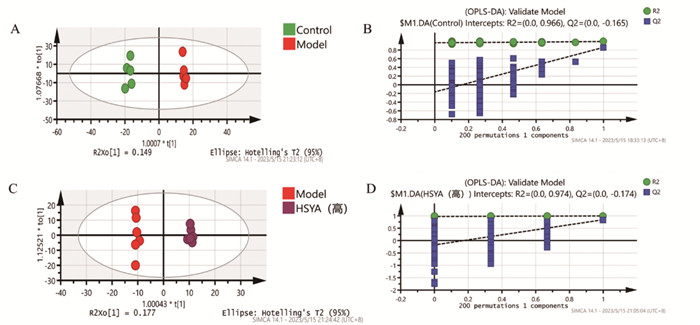
|
| 注:Control,对照组;Model,模型组;HSYA(高),HSYA高剂量组。 图 4 各组OPLS-DA得分图和置换检验拟合图 |
经分析,模型组和对照组筛选的差异性脂质分子(VIP > 1,P < 0.05)共有14种,其中FFA(20∶2)呈下降趋势,升高的脂质分子有13种,根据亚类进行归属,可分为PE类5个、FFA类1个、PI类3个、PG类3个、PA类1个。其中HSYA治疗后与模型组出现相反趋势的脂质分子有19种,具有差异性的脂质分子包括PE(18∶0/18∶1)、PE(18∶0/18∶2)、PE(18∶0/20∶3)、PE(18∶0/20∶4)、PE(O-18∶0/18∶1)、PE(O-18∶0/20∶4)、LPE(18∶1)、LPE(20∶4)、FFA(22∶4)、PI(18∶0/18∶2)、PI(16∶0/18∶1)、PI(18∶1/18∶1)、LPI(18∶0)、PG(18∶1/16∶1)、PG(18∶1/18∶1)、PG(18∶1/18∶2)、PA(18∶1/18∶1)(VIP > 1,P < 0.05),其中FFA(20∶2)、FFA(22∶5)(VIP > 1,P > 0.05)差异无统计学意义,提示HSYA可以通过调节LDLR-/-小鼠血清中PE、LPE、FFA、PI、LPI、PG、PA等脂质分子改善高脂血症LDLR-/-小鼠脂质代谢紊乱情况。见图 5。
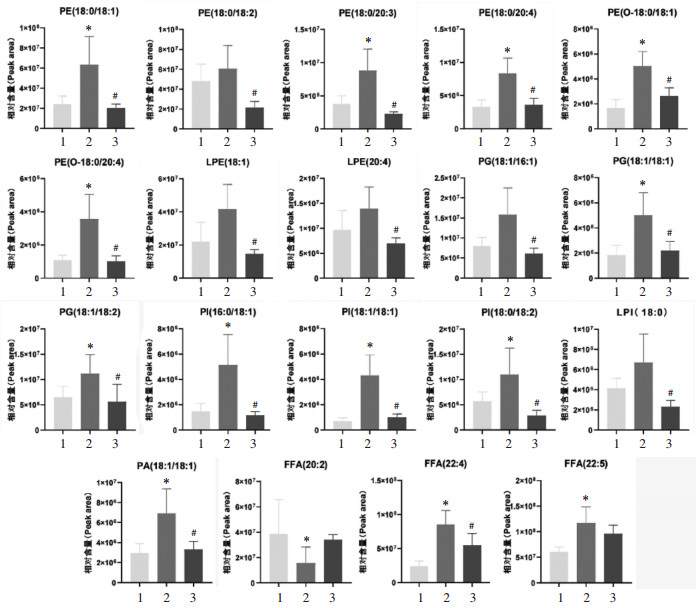
|
| 注:1,对照组;2,模型组;3,HSYA高剂量组。与对照组比较,*P < 0.05;与模型组比较,#P < 0.05。 图 5 HSYA对高脂血症LDLR-/-小鼠血清脂质分子的影响(x±s,n=5或6) |
高脂血症是一种脂质代谢紊乱性疾病,被认为是发生代谢综合征和增加动脉粥样硬化风险的主要因素之一[17]。目前可以通过调节血脂活性成分和降低血脂,改善肝脏脂质蓄积和脂肪变性,保护肝功能,从而达到治疗效果[18]。能量摄入过多与消耗减少失衡是导致高脂血症的主要原因,持续摄入高能量、高脂肪食物可能会引起脂质代谢紊乱,并且会诱导慢性代谢疾病。高胆固醇饮食是导致高脂血症的主要危险因素[19],通过高脂饲料喂养构建高脂血症小鼠模型是目前用来筛选或评价降血脂药物的常用方法[20-21]。本研究采用高脂饲料喂养造成小鼠脂质代谢异常,构建小鼠高脂血症模型,检测小鼠血清中TC、TG、LDL-C、ALT、AST含量,观察肝脏组织病理变化,研究HSYA对高脂血症LDLR-/-小鼠血脂代谢异常的影响。结果显示,与对照组比较,模型组LDLR-/-小鼠血清中TC、TG、LDL-C含量升高,与相关文献报道一致,证明LDLR-/-小鼠高脂血症模型建立成功。肝脏是高脂血症引起的血脂代谢紊乱直接连累的脏器,在血脂代谢中发挥重要作用。研究表明,高脂血症能够引起肝组织脂肪空泡和肝脏脂质蓄积,导致肝细胞出现不同程度损伤[22-23]。与对照组比较,模型组小鼠血清中ALT、AST含量升高,肝脏脂肪变性,脂质蓄积,表明高脂血症LDLR-/-小鼠发生了肝脏损伤。与模型组比较,HSYA两组LDLR-/-小鼠血清中TC、TG、LDL-C、ALT、AST含量降低,肝脏脂肪变性得到改善,脂质蓄积减少。以上结果表明,HSYA对高脂血症LDLR-/-小鼠脂质代谢紊乱和肝脏损伤具有一定防治作用。
脂质代谢紊乱可能引起机体代谢紊乱,导致脂质代谢效率低下,从而诱导肥胖与血脂异常,并导致高脂血症的发生[24]。本研究通过脂质亚类结果分析,初步明确HSYA对高脂血症LDLR-/-小鼠血清中脂质代谢紊乱具有治疗作用。高脂血症与甘油磷脂代谢紊乱之间呈正相关关系[25-26]。甘油磷脂可以根据其取代基分为PC、PG、PE[27]。甘油磷脂代谢在炎症性疾病和高脂血症发展中起关键作用[28]。与对照组比较,模型组LDLR-/-小鼠血清中与甘油磷脂代谢相关的脂质异常增多,如PE(18∶0/18∶1)、PE(18∶0/20∶3)、PE(18∶0/20∶4)、PE(O-18∶0/18∶1)、PE(O-18∶0/20∶4)。同时发现LDLR-/-小鼠血清中甘油磷脂的种类和相对含量均高于其他脂质,与模型组比较,HSYA组LDLR-/-小鼠血清中PE(18∶0/18∶1)、PE(18∶0/18∶2)、PE(18∶0/20∶3)、PE(18∶0/20∶4)、PE(O-18∶0/18∶1)、PE(O-18∶0/20∶4)的水平降低。HSYA除通过调节PE外,还可以通过对血清中LPE、PG、DAG和PI进行调节影响甘油磷脂代谢,表明HSYA在调节脂质紊乱中发挥关键作用,从而抑制高脂血症的进展。
综上所述,本研究通过高脂饲料模拟临床高脂血症病理状态,在明确HSYA具有治疗高脂血症LDLR-/-小鼠作用的基础上,运用脂质组学技术阐明了HSYA对高脂血症LDLR-/-小鼠血清脂质代谢的影响,发现HSYA通过调节甘油磷脂代谢改善高脂血症LDLR-/-小鼠脂质代谢紊乱,进一步丰富了其治疗高脂血症LDLR-/-小鼠的作用机制,为其临床应用提供了新依据。
| [1] |
GUO W L, PAN Y Y, LI L, et al. Ethanol extract of Ganoderma lucidum ameliorates lipid metabolic disorders and modulates the gut microbiota composition in high-fat diet fed rats[J]. Food & Function, 2018, 9(6): 3419-3431. |
| [2] |
YAO Y S, LI T D, ZENG Z H. Mechanisms underlying direct actions of hyperlipidemia on myocardium: an updated review[J]. Lipids in Health and Disease, 2020, 19(1): 23. DOI:10.1186/s12944-019-1171-8 |
| [3] |
胡慧明, 朱彦陈, 朱巧巧, 等. 实验性高脂血症动物模型比较分析[J]. 中国中药杂志, 2016, 41(20): 3709-3714. |
| [4] |
BARRIOS V, ESCOBAR C, CICERO A F G, et al. A nutraceutical approach(Armolipid Plus) to reduce total and LDL cholesterol in individuals with mild to moderate dyslipidemia: review of the clinical evidence[J]. Atherosclerosis Supplements, 2017, 24(1): 1-15. |
| [5] |
NARASIMHULU C A, SINGLA D K. BMP-7 attenuates sarcopenia and adverse muscle remodeling in diabetic mice via alleviation of lipids, inflammation, HMGB1, and pyroptosis[J]. Antioxidants, 2023, 12(2): 331. DOI:10.3390/antiox12020331 |
| [6] |
HURTUBISE J, MCLELLAN K, DURR K, et al. The different facets of dyslipidemia and hypertension in atherosclerosis[J]. Current Atherosclerosis Reports, 2016, 18(12): 82. DOI:10.1007/s11883-016-0632-z |
| [7] |
STROES E S, THOMPSON P D, CORSINI A, et al. Statin-associated muscle symptoms: impact on statin therapy-European Atherosclerosis Society Consensus Panel Statement on Assessment, Aetiology and Management[J]. European Heart Journal, 2015, 36(17): 1012-1022. DOI:10.1093/eurheartj/ehv043 |
| [8] |
吴振华. 中药红花研究进展的概述[J]. 世界最新医学信息文摘, 2019, 19(34): 33-34. |
| [9] |
张玉昆, 冯月男, 卞敬琦, 等. 丹参饮对高脂血症模型大鼠降脂机制的研究[J]. 上海中医药杂志, 2021, 55(11): 80-84. |
| [10] |
李思博, 闫美怡, 刘阳. 降血脂中药功效分类及作用机制研究进展[J]. 辽宁中医药大学学报, 2021, 23(5): 166-169. |
| [11] |
陈文林, 范湘旭, 梁芳, 等. 祛湿活血降脂方慰脐法治疗高脂血症性脂肪肝疗效观察[J]. 山西中医, 2021, 37(5): 45-47. DOI:10.3969/j.issn.1000-7156.2021.05.019 |
| [12] |
张翅, 赵炳祥, 徐慧燕, 等. 红花黄色素纯化工艺研究及应用[J]. 中国食品添加剂, 2022, 33(6): 87-94. |
| [13] |
鲍巧玲. 红花黄色素氯化钠注射液联合曲美他嗪治疗不稳定性心绞痛患者疗效及对血脂和动脉粥样硬化斑块的影响[J]. 中国老年学杂志, 2018, 38(22): 5386-5388. DOI:10.3969/j.issn.1005-9202.2018.22.004 |
| [14] |
HE Y H, LIU Q, LI Y X, et al. Protective effects of hydroxysafflor yellow A (HSYA) on alcohol-induced liver injury in rats[J]. Journal of Physiology and Biochemistry, 2015, 71(1): 69-78. DOI:10.1007/s13105-015-0382-3 |
| [15] |
陈可冀, 付长庚, 丛伟红, 等. 红花黄色素临床应用中国专家共识[J]. 中国中西医结合杂志, 2017, 37(10): 1167-1173. DOI:10.7661/j.cjim.20170621.182 |
| [16] |
唐红, 鲁道旺, 杨詹詹, 等. 羟基红花黄色素A的药理学研究进展[J]. 广州化工, 2017, 45(14): 20-22. |
| [17] |
KARR S. Epidemiology and management of hyperlipidemia[J]. American Journal of Managed Care, 2017, 23(2): S139-S148. |
| [18] |
张伟宝, 田相同, 冯玲, 等. 中医辨证治疗高脂血症的研究进展[J]. 湖北中医杂志, 2023, 45(2): 57-61. |
| [19] |
TSAI TY, CHU LH, LEE CL, et al. Atherosclerosis-preventing activity of lactic acid bacteria-fermented milk-soymilk supplemented with Momordica charantia[J]. Journal of Agricultural and Food Chemistry, 2009, 57(11): 2065-2071. |
| [20] |
OSTO M, LUTZ T A. Translational value of animal models of obesity-focus on dogs and cats[J]. European Journal of Pharmacology, 2015, 75(9): 240-252. |
| [21] |
胡滨, 陈一资, 苏赵. 西瓜籽油辅助降血脂功能研究[J]. 中国油脂, 2017, 42(2): 56-62. |
| [22] |
肖凤琴, 何群, 邵帅, 等. 荷丹三七降脂片对高脂血症大鼠脂代谢及Nrf2、γ-GCS基因mRNA表达的影响[J]. 中国医院药学杂志, 2019, 39(24): 2473-2478. |
| [23] |
LIU H Z, LIU Z L, ZHAO S P, et al. Protective mechanism of Panax notoginseng saponins on rat hemorrhagic shock model in recovery stage[J]. Cell Biochemistry and Biophysics, 2014, 70(3): 1719-1724. |
| [24] |
ZHANG T H, CHEN J, TANG X Y, et al. Interaction between adipocytes and high-density lipoprotein: new insights into the mechanism of obesity-induced dyslipidemia and atherosclerosis[J]. Lipids in Health and Disease, 2019, 18(1): 223. |
| [25] |
MIAO H, CHEN H, PEI S W, et al. Plasma lipidomics reveal profound perturbation of glycerophospholipids, fatty acids, and sphingolipids in diet-induced hyperlipidemia[J]. Chemico-biological Interactions, 2015, 228(4): 79-87. |
| [26] |
DALEBROUX Z D. Cues from the membrane: bacterial glycerophospholipids[J]. Journal of Bacteriology, 2017, 199(2): 111-119. |
| [27] |
PAAPSTEL K, KALS J, EHA J, et al. Inverse relations of serum phosphatidylcholines and lysophosphatidylcholines with vascular damage and heart rate in patients with atherosclerosis[J]. Nutr Metab Cardiovasc Dis, 2018, 28(9): 44-52. |
| [28] |
LI S, JIN S N, SONG C W, et al. The metabolic change of serum lysophosphatidylcholines involved in the lipid lowering effect of triterpenes from Alismatis rhizoma on high-fat diet induced hyperlipidemia mice[J]. Journal of Ethnopharmacology, 2016, 177(1): 10-18. |
 2024, Vol. 43
2024, Vol. 43