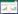文章信息
- 韩红叶, 余雅琴, 张强, 孙雨颉, 康宁
- HAN Hongye, YU Yaqin, ZHANG Qiang, SUN Yujie, KANG Ning
- 毛酸浆内酯通过抑制STAT3诱导人乳腺癌MCF-7细胞凋亡
- Physapubescin induced human breast cancer MCF-7 cells apoptosis by inhibiting STAT3
- 天津中医药大学学报, 2024, 43(1): 8-14
- Journal of Tianjin University of Traditional Chinese Medicine, 2024, 43(1): 8-14
- http://dx.doi.org/10.11656/j.issn.1673-9043.2024.01.02
-
文章历史
收稿日期: 2023-10-09
2. 天津中医药大学医学技术学院, 天津 301617;
3. 武汉市黄陂区人民医院肿瘤科, 武汉 430300
2. School of Medical Technology, Tianjin University of Traditional Chinese Medicine, Tianjin 301617, China;
3. Department of Oncology, Wuhan Huangpi District People's Hospital, Wuhan 430300, China
乳腺癌发病率在女性恶性肿瘤中位居首位,中国乳腺癌发病率逐年攀升,严重危害女性健康[1]。目前,常用的化疗药物在有效杀伤肿瘤细胞的同时对正常细胞也产生了较大的杀伤作用,由此引发严重的不良反应,进而限制其在临床上的使用[2]。中药在有效治疗肿瘤的同时还能够改善身体机能,提高患者生存质量,这种治疗作用逐渐得到临床专家的认可[3]。因此,从中药及其活性成分中开发治疗乳腺癌的药物成为可能。乳腺癌在中医古代文献中的记载归属于“乳石痈”“乳岩”“乳栗”等范畴[4],其发病病机与乳腺癌患者癌毒壅结乳房及痰瘀热毒、肝经郁火、癌毒走注等邪实证候密切相关[5]。因此,乳腺癌的治疗以具有清热解毒、活血化瘀、化痰散结功效的药物为主。
毛酸浆(Physalis pubescens L.)又称“洋姑娘”“姑茑”“姑娘果”和“菇娘儿”,是茄科酸浆属的1年生草本植物,具有清热解毒、化痰利咽、利尿通淋等功效[6],作为药食两用的中药材具有重要研究价值。毛酸浆内酯(PPB)是从毛酸浆中分离提取得到的睡茄内酯类化合物,现代药理研究表明PPB对多种肿瘤细胞具有显著的生长抑制作用[7]。本课题组前期研究表明PPB对正常人外周血单核细胞(hPBMC)及裸鼠各脏器均无明显毒副作用[8],并且可以诱导人乳腺癌MCF-7细胞发生内源性和外源性凋亡[9],但其具体机制尚不清楚。信号转导和转录激活因子3(STAT3)作为一种转录因子,常常通过影响细胞周期[10]、细胞凋亡[11]或自噬[12]等参与各种实体恶性肿瘤的发生发展。多项研究证实STAT3的异常激活会导致下游靶基因B淋巴细胞瘤-2(Bcl-2)的激活,抑制细胞凋亡,进而促进肿瘤细胞增殖[13]。基于文献调研和课题组前期研究结果,本研究主要探讨STAT3在PPB诱导MCF-7细胞凋亡中发挥的作用。
1 材料和方法 1.1 主要试剂和仪器PPB由本课题组制备所得,经高效液相(HPLC)鉴定其纯度≥96%[14],结构式见图 1。无菌条件下,将其溶解于二甲基亚砜(DMSO)中,配成浓度为50 mmol/L原液储存于-20 ℃备用。常用试剂和仪器有:RPMI-1640培养基(美国Gibco公司,货号31800022);胎牛血清(以色列BI公司,货号04-001-1ACS);青链霉素混合液100×(北京索莱宝科技有限公司,货号P1400);噻唑蓝(MTT,北京索莱宝科技有限公司,货号906M051);Hoechst 33342荧光分子探针(Invitrogen);STAT3抑制剂S3I-201(Selleck,货号S1155);STAT3小干扰RNA(siRNA,上海吉玛制药技术有限公司);Lipofectamine 2000(Thermo Fisher);高内涵成像仪(IN Cell Analyzer 2500HS);全自动化学发光分析仪(Tanon,型号5200);酶标仪(Bio Tek,型号SN 254962);二氧化碳(CO2)恒温培养箱(Heal Force,型号HF90)。
|
| 注:A,PPB的化学结构式;B,PPB诱导MCF-7细胞发生凋亡的荧光显微镜观察结果;C,PPB诱导MCF-7细胞发生凋亡结果(x±s,n=4)。与0 μmol/L的PPB比较,*P < 0.01,**P < 0.001。 图 1 PPB诱导MCF-7细胞凋亡情况 |
人乳腺癌MCF-7细胞购自中国科学院典型培养物保藏委员会细胞库,用含10%胎牛血清和1%青链霉素混合液100×的RPMI-1640培养基,于37 ℃、5%CO2恒温培养箱中培养。
1.3 荧光染色法分析细胞凋亡情况将MCF-7细胞接种于6孔板,待贴壁生长24 h后,小心弃去培养基,每孔加入含药培养基,PPB终浓度为0、4、8、16 μmol/L。待药物作用48 h后,吸弃培养基,加入含有1 μg/mL Hoechst 33342的完全培养基避光染色30 min,再次吸弃培养基,磷酸缓冲盐溶液(PBS)清洗1~2次,立刻用荧光显微镜观察细胞凋亡情况并拍照计数,具体方法详见参考文献[15]。
1.4 MTT检测药物对细胞的生长抑制率将MCF-7细胞以3×103个/孔接种于96孔板,贴壁生长24 h后吸弃培养基,加入含不同浓度(5、10、20 μmol/L)STAT3抑制剂S3I-201的完全培养基50 μL,作用1 h后,每孔再加入50 μL完全培养基或含16 μmol/L PPB的完全培养基,于CO2恒温培养箱中培养。48 h后吸弃培养基,每孔加入100 μL的10%MTT溶液作用2.5 h。再吸弃培养基,每孔加入150 μL的DMSO溶解蓝紫色甲臜结晶,使用酶标仪于490 nm波长下测吸光度(A),并按以下公式计算抑制率:抑制率(%)=(A对照品-A样品)÷(A对照品-A空白)×100%。
1.5 蛋白免疫印迹(Western Blot)法考察蛋白表达水平将收集到的细胞溶解于RIPA裂解液中,置于冰上裂解30 min,4 ℃、12 000 r/min离心10 min,离心半径为18 cm。离心结束后收集上清,采用二喹啉甲酸(BCA)蛋白浓度测定试剂盒检测各样品蛋白浓度,加入5×上样缓冲液,在金属浴中于95 ℃反应5 min使蛋白变性,样品于-20 ℃条件下储存。实验时,将样品用十二烷基硫酸钠聚丙烯酰胺凝胶(SDS-PAGE)电泳分离,然后转移至PVDF膜上,用5%脱脂奶粉封闭1 h,加入稀释好的一抗于4 ℃冰箱孵育过夜,第2天加入二抗在摇床上孵育1 h。最后将条带浸于化学发光试剂中后立刻取出,使用全自动化学发光分析仪曝光条带。
1.6 siRNA转染敲降MCF-7细胞中STAT3基因将处于对数生长期的MCF-7细胞接种至96孔板或6孔板中,使其贴壁生长24 h。转染前1~2 h更换成双无培养基培养细胞。使用双无培养基稀释转染试剂Lipofectamine 2000轻轻混匀,室温放置5 min。使用双无培养基稀释STAT3 siRNA,轻轻混匀,室温放置5 min。随后将稀释好的Lipofectamine 2000与稀释好的siRNA等体积轻轻混匀,室温放置20 min,以便形成siRNA/Lipofectamine 2000复合物。弃去原有培养基,加入配制好的含siRNA/Lipofectamine 2000复合物的双无培养基,并轻轻晃动,将培养板放入CO2恒温培养箱中转染8 h,吸弃上清更换为含16 μmol/L PPB的完全培养基。
1.7 统计学分析所有实验至少重复3次。数据以均数±标准差(x±s)表示,实验结果采用SPSS 20.0统计软件进行单因素方差分析,组间两两比较采用LSD法。P<0.05为差异具有统计学意义。
2 结果 2.1 PPB诱导人乳腺癌MCF-7细胞凋亡前期课题组运用MTT、克隆形成实验及Western Blot法研究发现PPB可以诱导人乳腺癌MCF-7细胞凋亡[9],本研究进一步使用Hoechst 33342荧光分子探针对细胞核进行染色标记,分析PPB诱导MCF-7细胞发生凋亡。结果显示对照组细胞核形态完整,呈现均一的高强度蓝色荧光,而PPB处理后细胞形态发生明显改变,细胞大小和形态不均一,且出现典型的凋亡形态特征,即细胞核固缩呈致密浓染,染色质边集、凝聚,核碎片,凋亡比率呈剂量依赖性上升,这些结果进一步证明PPB可以诱导MCF-7细胞凋亡。见图 1。
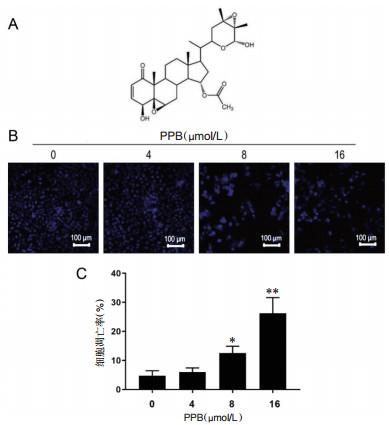
2.2 利用生物信息学方法预测PPB抗乳腺癌的潜在机制通过SwissTargetPrediction数据库(http://www.swisstargetprediction.ch/)和pharmmaper数据库(http://www.lilab-ecust.cn/pharmmapper/)分析了PPB可能的作用靶点,剔除重复后得到124个可能靶点。乳腺癌疾病靶点来源于GEO数据库(https://www.ncbi.nlm.nih.gov/)的基因芯片GSE45827,该芯片包含了130个乳腺癌样本和11个正常乳腺样本,使用乳腺癌样本对比正常样本,共得到14 743个差异基因。对PPB和乳腺癌疾病靶点的交集进行分析,发现共有82个共同靶点,见图 2A。
|
| 注:A,PPB靶点与乳腺癌疾病靶点的韦恩图;B,乳腺癌患者差异基因火山图分析;C,STAT3低表达和高表达患者的生存期差异;D,基于TCGA-BREAST数据对STAT3进行单基因GSEA分析。 图 2 生物信息学方法预测PPB抗乳腺癌的潜在机制 |
于共同靶点中筛选在乳腺癌中表达差异的基因,以P < 0.05为条件筛选得到差异表达基因,Log2FC值> 2输出为上调基因,Log2FC值< -2输出为下调基因,见图 2B。乳腺癌组织中STAT3上调,且STAT3高表达的患者生存期较短,见图 2C。为了确定STAT3的相关信号通路,进一步将TCGA-KIRC数据集与GSE42568数据集中的乳腺癌样本合并,根据基因表达中位数分为高表达组和低表达组,使用GeneSet Enrichment Analysis(GSEA)软件进行分析,见图 2D,单基因GSEA揭示了乳腺癌组织中STAT3的上调与凋亡信号通路(NES=-1.6,P=0.009)呈负相关。而前期研究结果表明PPB能够诱导人乳腺癌MCF-7细胞凋亡[9],由此推测STAT3可能参与PPB诱导MCF-7细胞凋亡。
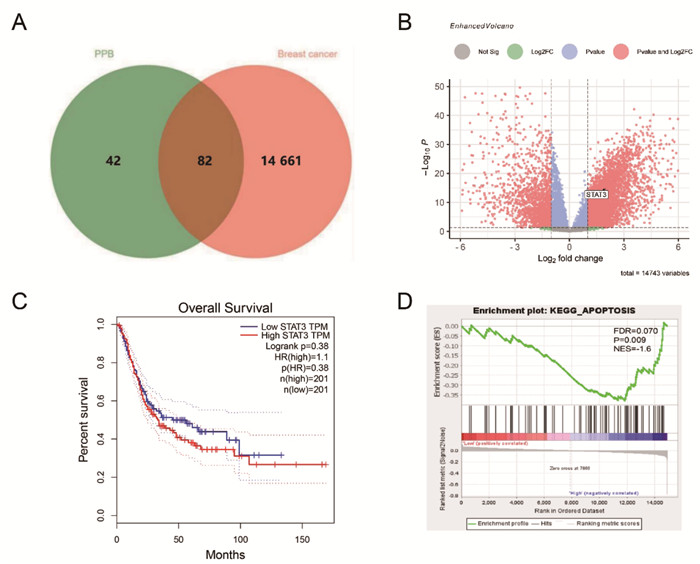
2.3 PPB抑制STAT3磷酸化基于上述生物信息学结果,本研究采用Western Blot法考察0~16 μmol/L的PPB作用48 h对MCF-7细胞中STAT3蛋白表达的影响。结果如图 3A及图 3B所示,STAT3及其磷酸化形式的蛋白表达水平随PPB剂量增加而显著减少,说明PPB能够抑制MCF-7细胞中STAT3的磷酸化。
|
| 注:A,PPB对MCF-7细胞中STAT3磷酸化影响条带图;B,PPB对MCF-7细胞中STAT3磷酸化影响结果(x±s,n=4)。与0 μmol/L的PPB比较,*P < 0.01,**P < 0.001。 图 3 PPB抑制STAT3磷酸化情况 |
尽管上述结果证明PPB能够抑制STAT3的磷酸化,但STAT3是否参与了PPB抑制MCF-7细胞的生长仍不明确。因此,本研究先采用STAT3的特异性抑制剂S3I-201预处理MCF-7细胞1 h,再以不同剂量的PPB作用48 h,MTT法检测细胞生长情况。结果如图 4A所示,S3I-201显著促进了PPB对MCF-7细胞的生长抑制作用,提示STAT3在PPB抑制MCF-7细胞的生长过程中发挥了促进细胞存活的作用。
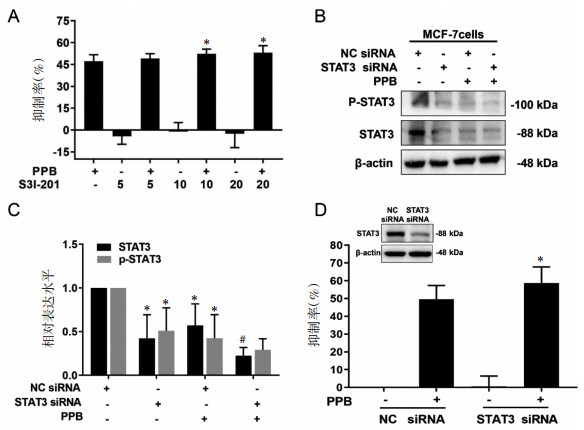
|
| 注:A,S3I-201在PPB抑制MCF-7细胞生长中的作用(x±s,n=8);与单加PPB组比较,*P < 0.05。B,敲降STAT3对PPB作用MCF-7细胞中STAT3表达影响条带图。C,敲降STAT3对PPB作用MCF-7细胞中STAT3表达的影响情况(x±s,n=4);与NC siRNA组比较,*P < 0.01;与NC siRNA+PPB组比较,#P < 0.01。D,Western Blot法检测STAT3 siRNA敲降作用结果的条带图及STAT3 siRNA在PPB抑制MCF-7细胞生长中的作用情况(x±s,n=6);与NC siRNA+PPB组比较,*P < 0.05。 图 4 PPB通过抑制STAT3抑制MCF-7细胞的生长情况 |
采用siRNA敲降MCF-7细胞中的STAT3基因,敲降作用效果见图 4D。再通过Western Blot法考察PPB处理对STAT3的影响,结果如图 4B及图 4C所示,与siRNA阴性对照组(NC siRNA组)比较,STAT3 siRNA组STAT3表达明显下降。此外,与NC siRNA组相比,PPB+NC siRNA组显著抑制了STAT3磷酸化,而PPB+STAT3 siRNA组较PPB+NC siRNA组对p-STAT3的抑制作用更强。这一结果与图 3A、图 3B一致,说明PPB确实能够抑制STAT3磷酸化。本研究又采用MTT法考察敲降STAT3后,PPB对MCF-7细胞的生长抑制作用,结果如图 4D所示,与NC siRNA+PPB组相比,STAT3 siRNA+PPB组的细胞生长抑制率显著增加,说明敲降STAT3促进了PPB对MCF-7细胞的生长抑制作用,该结果与STAT3抑制剂S3I-201一致,共同说明PPB通过抑制STAT3抑制了MCF-7细胞的生长。
2.5 PPB通过抑制STAT3诱导MCF-7细胞凋亡采用Western Blot法检测STAT3敲降后对MCF-7细胞中内源性凋亡蛋白Bcl-2、Bcl-2相关X蛋白(Bax)、细胞色素c(Cytochrome c)、半胱氨酸天冬氨酸蛋白酶9(Caspase9)和外源性凋亡蛋白半胱氨酸天冬氨酸蛋白酶8(Caspase8)及多聚ADP核糖聚合酶(PARP)的影响。结果如图 5所示,PPB+NC siRNA显著抑制抗凋亡蛋白Bcl-2的表达,增加促凋亡蛋白Bax的表达(图 5A、图 5B);在增加Cytochrome c、裂解的Caspase8(Cleaved-Caspase8)、裂解的Caspase9(Cleaved-Caspase9)及裂解的PARP(Cleaved-PARP)表达的同时降低Caspase9、Caspase8及PARP的表达(图 5A、图 5C、图 5D、图 5E、图 5F),而这些现象在敲降STAT3之后进一步增强。以上结果表明PPB通过抑制STAT3诱导MCF-7细胞发生凋亡。
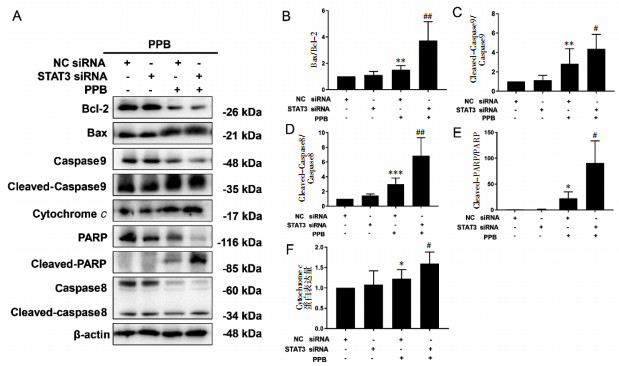
|
| 注:A,敲降STAT3对PPB作用MCF-7细胞凋亡蛋白的影响条带图;B,Bax/Bcl-2比值(x±s,n=6);C,Cleaved-Caspase9/Caspase9比值(x±s,n=10);D,Cleaved-Caspase8/Caspase8比值(x±s,n=8);E,Cleaved-PARP/PARP比值(x±s,n=3);F,Cytochrome c蛋白表达情况(x±s,n=8)。与NC siRNA组比较,*P < 0.05,**P < 0.01,***P < 0.001;与NC siRNA+PPB组比较,#P < 0.05,##P < 0.01。 图 5 PPB通过抑制STAT3诱导MCF-7细胞凋亡情况 |
睡茄内酯类化合物是一种天然存在的甾体类化合物,主要存在于茄科植物睡茄属、曼陀罗属、假酸浆属及酸浆属中,现代药理研究表明该类化合物对多株肿瘤细胞显示出良好的抗肿瘤活性[16-17]。PPB正是从酸浆属植物毛酸浆中分离提取出来的一种睡茄内酯类化合物,前期课题组研究已经发现PPB可以诱导人乳腺癌MCF-7细胞发生内源性和外源性凋亡[8],本研究运用荧光染色法再次证实PPB可以诱导MCF-7细胞发生凋亡。随后,本研究进一步探究了STAT3通路在PPB诱导MCF-7细胞凋亡中发挥的作用。
据报道,STAT3的过度激活已见于多种肿瘤类型,包括乳腺癌、肝癌、肺癌、肾癌等[18]。当肿瘤细胞中的STAT3被异常激活时,会导致生长因子受体酪氨酸激酶和抗凋亡分子的连续转录,使得肿瘤细胞获得持续增殖能力[19]。因此,STAT3是肿瘤领域值得探究的一个靶点。本研究生物信息学结果也表明STAT3在乳腺癌中高表达,且预后不良,进一步研究发现,PPB能够以剂量依赖性的方式抑制STAT3磷酸化,并且与文献报道的STAT3促肿瘤作用一致[19]。STAT3抑制剂S3I-201及siRNA预处理均可显著增加PPB对MCF-7细胞的生长抑制作用,说明STAT3促进MCF-7细胞存活,而PPB正是通过抑制STAT3磷酸化抑制MCF-7细胞生长。研究还发现PPB作用MCF-7细胞后,不仅抑制磷酸化STAT3(p-STAT3)的蛋白表达,而且还抑制STAT3的蛋白表达,这与其他药物作用于乳腺癌细胞只降低抑制STAT3磷酸化水平不同[20],且与之前的研究——PPB诱导人肝癌HepG2细胞死亡中只影响了STAT3的磷酸化,而对STAT3表达无显著影响的结果也不尽相同。因此,研究推测PPB可能通过降低STAT3的表达进一步抑制STAT3的磷酸化,而具有更强的抗肿瘤活性。
肿瘤细胞发生凋亡抵抗是其持续增殖的主要原因之一[21]。多项研究显示STAT3的激活主要通过影响由线粒体诱导的内源性凋亡途径,进而保护肿瘤细胞免受凋亡[22]。具体来说,STAT3常常影响Bcl-2家族蛋白,该家族蛋白在凋亡途径中的调节作用极为关键,是细胞凋亡的中央控制器,如研究发现沉默STAT3可以导致人胃癌BGC-823细胞活力显著降低、细胞凋亡增加以及Bcl-2表达减弱[23]。竹节香附素A通过抑制由活性氧介导的STAT3激活促进Bax表达,进而抑制非小细胞肺癌细胞的凋亡与增殖[24]。本研究中的生物信息学结果也提示PPB和乳腺癌疾病的共同靶点STAT3与凋亡呈负相关关系,提示STAT3可能参与PPB诱导MCF-7细胞凋亡。与该分析结果一致,Western Blot结果也提示siRNA敲降STAT3可以进一步促进PPB对MCF-7细胞内源性凋亡蛋白Bax、Bcl-2、Cytochrome c、Caspase9的作用。另外,本研究还首次发现siRNA敲降STAT3之后,PPB能够影响MCF-7细胞中外源性凋亡蛋白Caspase8的表达。这些结果表明PPB抑制STAT3不仅诱导人乳腺癌MCF-7细胞发生内源性凋亡,还可以发生外源性凋亡。
本研究证实了PPB通过抑制STAT3通路诱导MCF-7细胞发生内源性和外源性凋亡,所获结果丰富了PPB抗乳腺癌的机制,为其抗乳腺癌的临床应用奠定了理论基础及依据。然而,乳腺癌发生发展是多基因、多因素相互作用的结果,PPB抑制乳腺癌生长的详细机制仍有待于进一步深入研究。
| [1] |
YAMADA D, OHDE S, KAJIURA Y, et al. Relationship between breast density, breast cancer subtypes, and prognosis[J]. Clinical Breast Cancer, 2022, 22(6): 560-566. DOI:10.1016/j.clbc.2022.04.005 |
| [2] |
BARZAMAN K, KARAMI J, ZAREI Z, et al. Breast cancer: biology, biomarkers, and treatments[J]. International Immu-nopharmacology, 2020, 84(3): 106-115. |
| [3] |
ZHANG X Y, QIU H, LI C S, et al. The positive role of traditional Chinese medicine as an adjunctive therapy for cancer[J]. Bioscience Trends, 2021, 15(5): 283-298. DOI:10.5582/bst.2021.01318 |
| [4] |
王进军, 石锴, 杨是修, 等. 从中医角度探讨肝主疏泄功能与乳腺癌的关系[J]. 时珍国医国药, 2022, 33(3): 687-689. DOI:10.3969/j.issn.1008-0805.2022.03.50 |
| [5] |
谷雨, 吴勉华. 国医大师周仲瑛辨治乳腺癌临证经验[J]. 中华中医药杂志, 2020, 35(10): 4975-4978. |
| [6] |
VICAS L G, JURCA T, BALDEA I, et al. Physalis alkekengi L. extract reduces the oxidative stress, inflammation and apoptosis in endothelial vascular cells exposed to hyperglycemia[J]. Molecules, 2020, 25(16): 3747. DOI:10.3390/molecules25163747 |
| [7] |
程理. 肾型谷氨酰胺酶(KGA)抑制剂——毛酸浆内酯的抗肿瘤活性研究[D]. 武汉: 华中科技大学, 2017.
|
| [8] |
何昕雅, 张强, 曹世杰, 等. 毛酸浆活性成分PPB诱导人肝癌HepG2细胞凋亡[J]. 中国药理学与毒理学杂志, 2019, 33(9): 709. |
| [9] |
余雅琴, 何昕雅, 张强, 等. 毛酸浆内酯诱导人乳腺癌MCF-7细胞凋亡的机制研究[J]. 天津中医药大学学报, 2022, 41(4): 465-470. |
| [10] |
MOHAN C D, RANGAPPA S, NAYAK S C, et al. Paradoxical functions of long noncoding RNAs in modulating STAT3 signaling pathway in hepatocellular carcinoma[J]. Biochimica et Biophysica Acta Reviews on Cancer, 2021, 187(1): 188-195. |
| [11] |
XUE J, YU Q. Knockdown of GALNT7 promotes cell apoptosis and autophagy of breast cancer cells by inactivation of STAT3[J]. European Journal of Gynaecological Oncology, 2022, 43(4): 223-229. |
| [12] |
WITALISZ-SIEPRACKA A, KLEIN K, ZDÁRSKY B, et al. The multifaceted role of STAT3 in NK-cell tumor surveillance[J]. Frontiers in Immunology, 2022, 13(9): 947-958. |
| [13] |
QUEZADA M J, PICCO M E, VILLANUEVA M B, et al. BCL2L10 is overexpressed in melanoma downstream of STAT3 and promotes cisplatin and ABT-737 resistance[J]. Cancers, 2020, 13(1): 78. DOI:10.3390/cancers13010078 |
| [14] |
于生洋, 夏桂阳, 孙佳文, 等. 毛酸浆果实化学成分的分离与鉴定[J]. 中草药, 2018, 49(19): 4500-4506. DOI:10.7501/j.issn.0253-2670.2018.19.006 |
| [15] |
HUANG G D, ZOU B Y, LYU J Z, et al. Notoginsenoside R1 attenuates glucose-induced podocyte injury via the inhibition of apoptosis and the activation of autophagy through the PI3K/Akt/mTOR signaling pathway[J]. International Journal of Molecular Medicine, 2017, 39(3): 559-568. DOI:10.3892/ijmm.2017.2864 |
| [16] |
MANDLIK INGAWALE D S, NAMDEO A G. Pharmacological evaluation of Ashwagandha highlighting its healthcare claims, safety, and toxicity aspects[J]. Journal of Dietary Supplements, 2021, 18(2): 183-226. DOI:10.1080/19390211.2020.1741484 |
| [17] |
YANG Y Y, XIANG K, SUN D J, et al. Withanolides from dietary tomatillo suppress HT1080 cancer cell growth by targeting mutant IDH1[J]. Bioorganic & Medicinal Chemistry, 2021, 36(5): 116-119. |
| [18] |
KISHIMOTO M, KOMINE M, SASHIKAWA-KIMURA M, et al. STAT3 activation in psoriasis and cancers[J]. Diagnostics, 2021, 11(10): 303-306. |
| [19] |
GHARIBI T, BABALOO Z, HOSSEINI A, et al. Targeting STAT3 in cancer and autoimmune diseases[J]. European Journal of Pharmacology, 2020, 87(8): 173-180. |
| [20] |
KIM B, LEE K Y, PARK B. Minecoside promotes apoptotic progression through STAT3 inactivation in breast cancer cells[J]. Oncology Letters, 2022, 23(3): 94. DOI:10.3892/ol.2022.13214 |
| [21] |
SINGH P, LIM B. Targeting apoptosis in cancer[J]. Current Oncology Reports, 2022, 24(3): 273-284. DOI:10.1007/s11912-022-01199-y |
| [22] |
AZIZ M A, SARWAR M S, AKTER T, et al. Polyphenolic molecules targeting STAT3 pathway for the treatment of cancer[J]. Life Sciences, 2021, 26(8): 118-129. |
| [23] |
XU Y M, FENG S N, NIU B. Silencing Stat3 inhibits viability and induces apoptosis in BGC-823 human gastric cancer cell line[J]. Official Publication of the Biological Stain Commission, 2021, 96(1): 76-81. DOI:10.1080/10520295.2020.1770332 |
| [24] |
LI L, CHEN M B, LI G, et al. Raddeanin A induced apoptosis of non-small cell lung cancer cells by promoting ROS-mediated STAT3 inactivation[J]. Tissue & Cell, 2021, 71: 101-107. |
 2024, Vol. 43
2024, Vol. 43