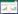文章信息
- 张世科, 何慧, 王宇, 孙嘉婧, 莫潇林, 刘晶, 于淑雪, 朱婧锦, 梁杏, 高维滨
- ZHANG Shike, HE Hui, WANG Yu, SUN Jiajing, MO Xiaolin, LIU Jing, YU Shuxue, ZHU Jingjin, LIANG Xing, GAO Weibin
- 耳迷走神经电刺激治疗多囊卵巢综合征患者负性情绪的临床观察
- Clinical observation of auricular vagus nerve electrical stimulation in the treatment of negative emotions in patients with polycystic ovary syndrome
- 天津中医药大学学报, 2024, 43(1): 30-36
- Journal of Tianjin University of Traditional Chinese Medicine, 2024, 43(1): 30-36
- http://dx.doi.org/10.11656/j.issn.1673-9043.2024.01.05
-
文章历史
收稿日期: 2023-08-28
2. 南方科技大学盐田医院康复医学科, 深圳 518081;
3. 黑龙江中医药大学附属第一医院中医妇科, 哈尔滨 150040;
4. 黑龙江中医药大学, 哈尔滨 150006;
5. 黑龙江中医药大学附属第二医院全国名老中医药专家传承工作室, 哈尔滨 150001
2. Department of Rehabilitation Medicine, Southern University of Science and Technology Yantian Hospital, Shenzhen 518081, China;
3. Gynecology of Traditional Chinese Medicine, The First Affiliated Hospital of Heilongjiang University of Chinese Medicine, Harbin 150040, China;
4. Heilongjiang University of Chinese Medicine, Harbin 150006, China;
5. National Famous Old Chinese Medicine Expert Inheritance Studio, The Second Affiliated Hospital of Heilongjiang University of Chinese Medicine, Harbin 150001, China
多囊卵巢综合征(PCOS)的发病率为5%~10%[1],是引起继发性闭经和无排卵性不孕的主要原因,严重影响妇女身心健康。PCOS尚缺乏根治方法,临床治疗多以生活方式干预或应用糖皮质激素、促排卵药物等控制为主,但长期服药容易引起肝肾损伤等不良反应[2]。PCOS不仅影响女性生殖内分泌功能,且易诱发严重的远期并发症并导致抑郁或焦虑等负性情绪,给患者造成长期的身体与精神负担[3]。PCOS患者更易出现抑郁、焦虑等问题[4],情绪障碍是PCOS研究的新兴热点。但目前对PCOS患者心理状态的治疗却鲜有关注,临床迫切需要寻找安全有效的治疗方法,而中医药疗法成为一个重点探讨方向[5]。中医认为PCOS符合“肾-天癸-冲任-胞宫”的生殖脏象理论,现代医家认为其与下丘脑-垂体-卵巢(HPO)轴理论相符[6],而针灸治疗PCOS的作用机制与调整HPO轴密切相关[7]。耳迷走神经电刺激在改善负性情绪方面发挥了显著优势,笔者基于电刺激耳迷走神经能够调整下丘脑功能的理论基础,尝试研究经皮电刺激耳迷走神经治疗PCOS的积极作用[8-9]。国际普遍将生活方式干预作为PCOS患者的一线治疗方案[10],课题组采用生活方式干预联合耳迷走神经电刺激疗法治疗PCOS患者,且与单独的生活方式干预进行比较,观察疗效并初步探讨其作用机制。
1 资料与方法 1.1 一般资料选取2021年11月—2022年11月于深圳市盐田区人民医院收治的60例PCOS患者,根据不同治疗方案,采用随机数字表法分为耳迷走神经电刺激+生活方式干预组(电刺激组)与生活方式干预组(对照组)。电刺激组30例患者,年龄20~ 37岁,平均年龄(28.99±3.58)岁;病程6个月~4年,平均病程(2.20 ±0.35)年;平均体质量(64.85 ± 9.50)kg。对照组30例患者,年龄21~38岁,平均年龄(29.59±3.76)岁;病程7个月~5年,平均病程(2.47±0.50)年;平均体质量(65.50±8.90)kg。两组PCOS患者在一般资料方面比较,差异无统计学意义(P>0.05),具有可比性。
本研究已经获得深圳市盐田区人民医院伦理委员会批准(伦理批号:YY20211106)。电脑随机数由独立调查员生成,并保存在密封的不透明信封中。当符合条件的患者被纳入时,由未实施盲法的医生按照信封上的编号顺序查看其随机分配的小组,并为患者分配治疗师及针灸医生,对专门进行治疗前后量表评估的治疗师实施盲法,由治疗师对所有患者进行生活方式干预,独立的针灸医生对电刺激组患者进行针灸治疗。
1.2 病例选择 1.2.1 诊断标准依据指南制定PCOS诊断标准[11-12]。1)必要条件:月经稀发、闭经或不规则子宫出血。2)①痤疮、多毛等高雄激素的临床体征或实验室生化检查提示高雄激素血症;②超声检查提示单侧或双侧卵巢直径2~9 mm的窦状卵泡≥12个和(或)卵巢体积≥10 mL。在满足必要条件后,以上两点符合其一即可诊断。
1.2.2 纳入标准1)年龄20~40岁。2)符合上述PCOS的诊断标准。3)肝郁证候评分≥3分。4)焦虑自评量表(SAS)评分、抑郁自评量表(SDS)评分达到轻度或以上。5)近1年内无生育愿望且无需要进行不孕治疗的计划。6)自愿参加本次研究并签署知情同意书。
1.2.3 排除标准1)其他可能引起高雄激素和导致排卵异常的疾病。2)合并其他内分泌系统疾病等导致的无排卵性月经失调。3)合并内科、外科严重原发性疾病或伴有恶质性病变。4)近3个月服用过抗抑郁/焦虑类药物或糖皮质激素类药物、糖代谢调节类药物。5)合并严重躯体疾病而无法配合针刺干预。6)具有严重精神障碍或认知障碍等而难以有效沟通。
1.2.4 剔除、脱落、中止标准1)未按照规定治疗或资料不全等影响疗效评价。2)发生严重不良事件或不能耐受治疗而被中止试验。3)试验期间检查确定妊娠。
1.3 治疗方法两组停经3个月以上的患者,均给予炔雌醇环丙孕酮片(简称达英-35,拜耳医药保健有限公司,国药准字HJ20210029)口服,每次1片(规格:每片含醋酸环丙孕酮2 mg、炔雌醇0.035 mg),每日1次,于自然月经或撤退性出血的第5天开始,连续服用21 d,停药待月经来潮后进入治疗周期。
1.3.1 对照组予生活方式干预,参照文献制定该方案[13]。饮食指导:改变膳食结构和食量,禁止油炸食品、高脂高糖饮食、快餐饮料等,每日减少500~ 1 000 kcal食物摄入(早餐以碳水化物为主者改为牛奶或无糖豆浆,午餐饮食如常,晚餐主食量减半,其他时间饥饿可以增加青瓜、西红柿、苹果、绿色蔬菜等,禁止增加面包或糖果等);运动指导:每日至少完成30~40 min规律有氧运动(心率>120次/min),运动速度大于6 km/h,每次运动时间多于10 min,记录为1次运动量,每日运动量>3次[跑步运动者以手机软件监测,每次跑步持续10 min以上且距离>1 km,累计大于3次(或者满足每日30 min以上且距离>3 km,监测数据每日汇报给医生进行统计)]。
1.3.2 电刺激组在对照组治疗基础上予耳迷走神经电刺激疗法。操作:参照参考文献[14],患者取仰卧位,在双侧耳甲区各选取2个点,常规消毒,选用0.20 mm×25 mm的一次性针灸针,斜刺2~3 mm,连接KWD-808Ⅱ型电针仪(常州英迪电子医疗器械有限公司),每侧耳甲区连接1组导线,设置为疏波(2 Hz)、电流0.5 mA,以患者能耐受为宜,2 d治疗1次,每次30 min,每周治疗3次,1个月为1个疗程,连续治疗3个疗程。
1.4 观察指标 1.4.1 量表评分患者治疗前后完成SAS[15]及SDS[16]评分,客观评估患者抑郁和焦虑状态。SAS和SDS均有20个条目,每个条目的评分为1(很少)、2(有时)、3(经常)、4(总是)分,其中SAS的第5、9、13、17、19个条目为反序计分,SDS的第2、5、6、11、12、14、16、17、18、20个条目为反序计分,将SAS或SDS中全部问题的得分相加,得到1个最低20分、最高80分的原始分数,然后将其转换为标准分数。SDS的标准分数(SDS-SS)或SAS的标准分数(SAS-SS)等于原始分数×1.25(结果取四舍五入至最近的整数)。在中国,SAS-SS≥50分被认为焦虑,50~59分为轻度,60~69分为中度,≥70分为重度[15]。对中国人群而言,SDS-SS≥53分为抑郁样状态,53~62分为轻度,63~72分为中度,≥73分为重度[17]。
1.4.2 中医症状评分参照国家标准《中医临床诊疗术语:证候部分》[18]:1)情志抑郁。2)太息时作。3)胸胁胀满不适。4)少腹胀闷窜痛。5)女性患者月经前乳房胀痛。6)女性患者月经前情志失常。7)脉弦。每1项分为无症状、轻度、中度、重度4级,评分为0~3分,所得总分为该患者的中医症状评分。
1.4.3 体质量指数(BMI)患者治疗前后由同1名记录者在固定时间记录体质量、身高并计算BMI,BMI=体质量(kg)/身高(m)2。
1.4.4 血糖代谢指标患者治疗前后空腹抽取肘静脉血2 mL,检测空腹胰岛素(FINS)、空腹血糖(FBG),并计算稳态模型胰岛素抵抗指数(HOMA-IR)[19],HOMA-IR=FBG(mmol/L)×FINS(mmol/L)÷22.5。
1.4.5 炎症因子患者治疗前后空腹抽取肘静脉血2 mL,在离心半径8 cm、3 000 r/min条件下离心10 min,取上清液,采用酶联免疫吸附法检测患者血清白细胞介素(IL)-1、IL-6和肿瘤坏死因子-α(TNF-α)水平[20]。
1.5 统计学方法使用SPSS 21.0软件进行统计分析,符合正态分布的计量资料以均数±标准差(x±s)表示,组内不同时间点的比较采用重复测量方差分析,组间同一时间点的比较采用两独立样本t检验;非正态分布的计量资料比较采用Mann-Whitney U检验,组内不同时间点的比较采用Friedman秩和检验。计数资料以例数及百分率(%)表示,组间比较采用卡方检验,P<0.05为差异有统计学意义。
2 结果 2.1 SAS、SDS评分比较治疗前,两组患者的SAS、SDS评分比较,差异无统计学意义(P>0.05)。治疗后,电刺激组患者SAS、SDS评分较治疗前降低(P<0.05);对照组患者SAS、SDS评分较治疗前降低,但差异无统计学意义(P>0.05);电刺激组患者SAS、SDS评分低于对照组(P<0.05)。见表 1。
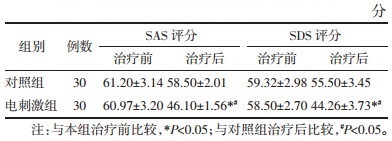
治疗前,两组患者的中医症状评分比较,差异无统计学意义(P>0.05)。治疗后,电刺激组患者的中医症状评分较治疗前降低(P<0.05);对照组患者的中医症状评分较治疗前降低(P<0.05);电刺激组患者的中医症状评分低于对照组(P<0.05)。见表 2。
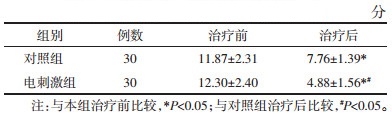
治疗前,两组患者BMI比较,差异无统计学意义(P>0.05)。治疗后,两组患者BMI较治疗前下降(P<0.05);电刺激组患者BMI低于对照组,但差异无统计学意义(P>0.05)。见表 3。
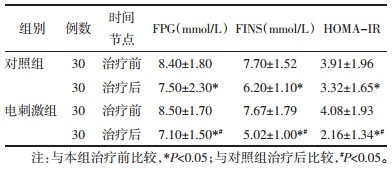
治疗前,两组患者FBG、FINS、HOMA-IR比较,差异无统计学意义(P>0.05)。治疗后,两组患者FBG、FINS、HOMA-IR较治疗前下降(P<0.05);电刺激组患者FBG、FINS、HOMA-IR低于对照组(P<0.05)。见表 4。
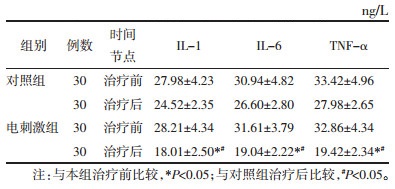
治疗前,两组患者IL-1、IL-6、TNF-α比较,差异无统计学意义(P>0.05)。治疗后,电刺激组患者IL-1、IL-6、TNF-α较治疗前降低(P<0.05);对照组患者IL-1、IL-6、TNF-α较治疗前降低,但差异无统计学意义(P>0.05);电刺激组患者IL-1、IL-6、TNF-α低于对照组(P<0.05)。见表 5。
治疗期间,两组患者均未出现明显不良反应,电刺激组采用耳迷走神经电刺激疗法的不良反应主要为3例患者拔针后皮下少量出血,经局部按压处理后好转,部分患者针后偶感耳甲区刺痛,可忍受,无逃避反应,无耳鸣、耳聋等不适发生。
3 讨论国外报道约21%~40%的PCOS患者出现抑郁状态,35%左右的PCOS患者出现焦虑状态[21]。国内报道PCOS患者出现抑郁状态的约为27%,出现焦虑状态的约为15%,其中14%~44.4%的患者兼具抑郁和焦虑症状[22]。1项研究指出PCOS患者比健康人群更容易罹患抑郁症及焦虑症,PCOS是这两种心理疾病的危险因素[23]。PCOS患者的抑郁及焦虑评分多处于轻中度状态,因此重视PCOS患者的负性情绪十分必要,尤其是需要根据其发病机制选择适宜的对症治疗技术。
PCOS的发病主要集中在女性生育期,《素问·病机气宜保命集》中记载“妇人童幼……天癸既行,皆从厥阴论之……”叶天士在《临证指南医案》中言“女人以肝为先天也”,《胎产指南·调经章》述“女子之性,执拗偏急,愤怒妒忌,以伤肝气”。因此,育龄期妇女更以“肝气”为病最多,一则肝主情志,“妇人经水不调,多因气郁所致”,二则盼子心切出现烦躁焦虑,肝郁不舒,冲任失和。古代中医无PCOS的具体病名,以疏肝调气为其主要治疗原则,可促进胞脉气血运行。耳迷走神经在耳甲区有唯一的体表分布,耳甲区的耳穴有肝、内分泌、交感穴等可以调节情绪的耳穴,刺激此处使得PCOS患者肝气得疏,气血、冲任调畅,则病可愈。
焦虑的发病机制之一即神经内分泌功能紊乱,以下丘脑-垂体-肾上腺(HPA)轴等释放的激素异常为主[24],HPA轴异常也被认为是抑郁症发病的另一机制[25],提示PCOS患者的HPA轴紊乱可能增加其产生焦虑或抑郁的风险。PCOS受HPO轴及HPA轴的支配调节,笔者认为经皮耳迷走神经电刺激可能经“耳迷走神经-孤束核-下丘脑”调节HPA轴和HPO轴,而对PCOS起到治疗作用[8-9]。精神障碍通常与自主神经功能紊乱有关,Stener等[26]研究发现交感神经的兴奋性与PCOS存在一定关联,且可以通过低频电针刺激降低其兴奋性。迷走神经作为副交感神经,刺激迷走神经可以起到抑制交感神经兴奋性的作用,因此猜测耳迷走神经电刺激改善PCOS患者负性情绪的作用机制可能与改善PCOS患者自主神经功能紊乱有关。
肥胖是PCOS患者常见的代谢紊乱症状之一,人们对与肥胖相关的健康风险研究越来越多。Pastore等[27]指出肥胖PCOS患者抑郁症的发生率和严重程度均显著高于正常体质量的PCOS患者,BMI是影响PCOS女性抑郁症的主要因素之一。研究证实PCOS组焦虑、抑郁状态与BMI显著相关,表明BMI对PCOS不孕患者的身心产生影响[28-29]。肥胖大鼠的即刻早期反应蛋白c-Fos,在进食后迷走神经传入信号整合的第1个中心部位孤束核的中央区和尾侧较瘦鼠显著降低,表明肥胖与迷走神经传入信号的减少有关[30]。其次,肥胖的发生多伴随迷走神经传入神经元对周围信号的敏感性下降,刺激迷走神经也被证实能够治疗中重度肥胖[31]。本研究还发现耳迷走神经电刺激对降低PCOS患者BMI效果优于对照组,但差异无统计学意义,可能与样本量较小有关,下一步可以通过大样本研究进一步验证。
Franks等[32]证实胰岛素抵抗在PCOS女性的姐妹中具有可遗传特性,是发生PCOS的原因之一。田国华等[28]研究发现PCOS患者焦虑、抑郁状态与HOMA-IR显著相关,HOMA-IR是影响其发生的重要因素。Ahren等[33]研究证实副交感神经系统能够调节胰腺分泌胰岛素的第1个峰值,而迷走神经则是副交感神经系统的主要组成部分。临床研究证实耳甲电针可以显著降低糖耐量受损患者的FBG及餐后2 h血糖[34],还能够改善胰岛素抵抗状态[35]。经皮耳迷走神经刺激可以明显改善Zucker糖尿病大鼠的血清胰岛素浓度[36]。本研究中,耳迷走神经电刺激明显改善了PCOS患者的FINS、FBG及HOMA-IR,认为耳迷走神经电刺激除能够改善PCOS患者负性情绪外,还可以改善PCOS患者的FINS、FBG及HOMA-IR。
2001年Kelly等[37]首次发现PCOS患者处于低度慢性炎症状态,Spritzer等[38]研究证实PCOS患者血液及卵巢内长期存在较高炎症水平。李昕[22]指出低度慢性炎症状态对PCOS患者的情绪障碍产生重要影响,炎症因子表达异常与抑郁症、焦虑症的发病高度相关。PCOS患者长期处于“代谢性炎症”状态,血清炎症水平与胰岛素抵抗呈正相关[39]。对一些因重度抑郁自杀的患者进行检查,发现其TNF-α、IL-6和IL-1β表达显著升高[40]。抗抑郁药物能够降低抑郁症患者血清中TNF-α、IL-1β、IL-6水平,并使抑郁状态得到改善[41]。自此,慢性低级别炎症被广泛认为是PCOS的发病途径之一,激活抗炎通路可能为PCOS提供新的治疗靶点。自20世纪90年代末以来,迷走神经一直被认为是抗炎调节通路的核心部分,迷走神经的抗炎功能是通过胆碱能抗炎途径(ChAP)和HPA轴实现的[42]。在本研究中,耳迷走神经电刺激能够明显降低PCOS患者血清炎症因子(IL-1、IL-6、TNF-α)水平,认为耳迷走神经电刺激除能够改善PCOS患者焦虑、抑郁等负性情绪外,还可以改善PCOS患者的血清炎症因子。
社会的发展导致疾病谱不断发生变化,借助西医关于疾病的病因认识来创新研究中医新治疗技术,可以更好地使患者获益[43]。杨红等[44]认为PCOS的病因与长期处于慢性炎症状态相关,其中IL-6与PCOS患者体内的亚临床炎症状态关系最为密切。Zhuang等[45]发现PCOS患者体内的IL-6可以通过调控蛋白激酶B(AKT)/信号转导和转录激活因子3(STAT3)信号通路,调节脂肪细胞增殖,从而引起肥胖与代谢异常[46]。肥胖可以进一步诱发胰岛素抵抗,同时,IL-6可以通过调节胰岛素受体底物-1(IRS-1)抑制胰岛素信号通路,诱导胰岛素抵抗的发生[47]。胰岛素抵抗可以代偿性引起高胰岛素血症,继而引发PCOS[48]。下丘脑具有内分泌和自主神经调节功能,下丘脑炎症是PCOS最主要的中枢神经特征性改变[48]。肥胖不仅会在下丘脑引发炎症,还会在大脑的其他区域引发炎症,从而影响情绪。此外,炎性细胞因子水平的增加可以影响HPA轴功能,HPA轴在情绪等方面起重要作用。目前的研究发现迷走神经是可以调节下丘脑的外周神经,因此,从刺激迷走神经方面着手研究针刺治疗PCOS等疾病是可行的。
综上所述,耳迷走神经电刺激可以明显改善PCOS患者的焦虑和抑郁状态,还可能改善糖代谢及炎症反应,值得进一步研究。
| [1] |
WITCHEL S F, TEEDE H J, PEÑA A S. Curtailing pcos[J]. Pediatric Research, 2020, 87(2): 353-361. DOI:10.1038/s41390-019-0615-1 |
| [2] |
单丽华, 王世帅, 叶利群. 滋肾健脾养宫汤结合屈螺酮炔雌醇治疗多囊卵巢综合征的疗效及对激素及妊娠结局影响[J]. 中华中医药学刊, 2023, 41(1): 242-245. |
| [3] |
AZZIZ R, MARIN C, HOQ L, et al. Health care-related economic burden of the polycystic ovary syndrome during the reproductive life span[J]. The Journal of Clinical Endocrinology & Metabolism, 2005, 90(8): 4650-4658. |
| [4] |
GREENWOOD E A. The puzzle of polycystic ovary syndrome, depression, and anxiety[J]. Fertility and Sterility, 2019, 112(5): 821-822. DOI:10.1016/j.fertnstert.2019.07.011 |
| [5] |
陶丽群, 王津, 李万雅, 等. 苍附导痰丸加畲药山腊梅叶治疗肥胖型多囊卵巢综合征疗效及对血清LH、FSH的影响[J]. 中华中医药学刊, 2022, 40(5): 202-205. |
| [6] |
常惠, 王喜军, 吴效科. 基于生殖脏象理论探析: 多囊卵巢综合征的中医病机[J]. 世界科学技术-中医药现代化, 2018, 20(7): 1192-1196. |
| [7] |
申怡, 王静. 针灸调节下丘脑-垂体-卵巢轴治疗多囊卵巢综合征的研究进展[J]. 中国中西医结合杂志, 2022, 42(5): 625-632. |
| [8] |
张世科, 何慧, 高维滨, 等. 经皮电刺激耳迷走神经治疗多囊卵巢综合征的机制探讨[J]. 针刺研究, 2020, 45(2): 164-168. |
| [9] |
ZHANG S K, HE H, WANG Y, et al. Transcutaneous auricular vagus nerve stimulation as a potential novel treatment for polycystic ovary syndrome[J]. Scientific Reports, 2023, 13(1): 7721. DOI:10.1038/s41598-023-34746-z |
| [10] |
TEEDE H J, MISSO M L, COSTELLO M F, et al. Recommendations from the international evidence-based guideline for the assessment and management of polycystic ovary syndrome[J]. Human Reproduction, 2018, 33(9): 1602-1618. DOI:10.1093/humrep/dey256 |
| [11] |
中华医学会妇产科学分会内分泌学组及指南专家组. 多囊卵巢综合征中国诊疗指南[J]. 中华妇产科杂志, 2018, 53(1): 2-6. |
| [12] |
ROTTERDAM ESHRE/ASRM-SPONSORED PCOS CONSENSUS WORKSHOP GROUP. Revised 2003 consensus on diagnostic criteria and long-term health risks related to polycystic ovary syndrome (PCOS)[J]. Human Reproduction, 2004, 19(1): 41-47. DOI:10.1093/humrep/deh098 |
| [13] |
张浩琳, 霍则军, 王海宁, 等. 针刺改善多囊卵巢综合征患者负性情绪: 随机对照研究[J]. 中国针灸, 2020, 40(4): 385-390. |
| [14] |
张世科, 何慧. 耳穴贴压联合耳迷走神经电刺激治疗轻中度产后抑郁症的疗效及对患者心理状态和生活质量的影响[J]. 河北中医, 2022, 44(3): 476-479, 500. |
| [15] |
ZUNG W W. A rating instrument for anxiety disorders[J]. Psychosomatics, 1971, 12(6): 371-379. DOI:10.1016/S0033-3182(71)71479-0 |
| [16] |
ZUNG W W. A self-rating depression scale[J]. Archives of General Psychiatry, 1965, 12(1): 63-70. DOI:10.1001/archpsyc.1965.01720310065008 |
| [17] |
DUNSTAN D A, SCOTT N. Assigning clinical significance and symptom severity using the zung scales: levels of misclassification arising from confusion between index and raw scores[J]. Depression Research and Treatment, 2018, 20(18): 925-937. |
| [18] |
国家技术监督局. 中华人民共和国国家标准中医临床诊疗术语: 证候部分[M]. 北京: 中国标准出版社, 2004: 58.
|
| [19] |
杨娟, 刘英, 黄健, 等. 针药人工周期疗法对痰湿型多囊卵巢综合征胰岛素抵抗患者临床疗效及部分作用机制观察[J]. 中国针灸, 2017, 37(11): 1163-1168. |
| [20] |
周雨禾, 马宏博, 李克明, 等. 加味黄连温胆汤联合西药治疗PCOS伴IR痰湿证的疗效及对肠道菌群的影响研究[J]. 中药新药与临床药理, 2021, 32(10): 1543-1548. |
| [21] |
KERCHNER A, LESTER W, STUART S P, et al. Risk of depression and other mental health disorders in women with polycystic ovary syndrome: a longitudinal study[J]. Fertility and Sterility, 2009, 91(1): 207-212. DOI:10.1016/j.fertnstert.2007.11.022 |
| [22] |
李昕. 多囊卵巢综合征心理问题及管理[J]. 中国实用妇科与产科杂志, 2019, 35(3): 295-297. |
| [23] |
COONEY L G, LEE I, SAMMEL M D, et al. High prevalence of moderate and severe depressive and anxiety symptoms in polycystic ovary syndrome: a systematic review and meta-analysis[J]. Human Reproduction, 2017, 32(5): 1075-1091. DOI:10.1093/humrep/dex044 |
| [24] |
BELAN M, PELLETIER C, BAILLARGEON J P. Alanine aminotransferase is a marker of lipotoxicity consequences and hyperandrogenemia in women with polycystic ovary syndrome[J]. Metabolic Syndrome and Related Disorders, 2017, 15(3): 145-152. DOI:10.1089/met.2016.0119 |
| [25] |
OTTE C, GOLD S M, PENNINX B W, et al. Major depressive disorder[J]. Nature Reviews Disease Primers, 2016, 2(3): 160-165. |
| [26] |
STENER E, JEDEL E, JANSON P O, et al. Low-frequency electroacupuncture and physical exercise decrease high muscle sympathetic nerve activity in polycystic ovary syndrome[J]. American Journal of Physiology Regulatory, Integrative and Comparative Physiology, 2009, 297(2): R387-R395. DOI:10.1152/ajpregu.00197.2009 |
| [27] |
PASTORE L M, PATRIE J T, MORRIS W L, et al. Depression symptoms and body dissatisfaction association among polycystic ovary syndrome women[J]. Journal of Psychosomatic Research, 2011, 71(4): 270-276. DOI:10.1016/j.jpsychores.2011.02.005 |
| [28] |
田国华, 张建芳, 武雁, 等. PCOS不孕患者的抑郁、焦虑发生率及其影响因子的分析[J]. 临床医学研究与实践, 2022, 7(7): 6-8. |
| [29] |
EMEKSIZ H C, BIDECI A, NALBANTOǦLU B, et al. Anxiety and depression states of adolescents with polycystic ovary syndrome[J]. Turkish Journal of Medical Sciences, 2018, 48(3): 531-536. |
| [30] |
KONTUREK S J, KONTUREK J W, PAWLIK T, et al. Brain-gut axis and its role in the control of food intake[J]. Journal of Physiology and Pharmacology, 2004, 55(1 Pt 2): 137-154. |
| [31] |
张隆江, 申晓军. 迷走神经在肥胖发生和治疗中的作用研究进展[J]. 中华肥胖与代谢病电子杂志, 2019, 5(3): 153-156. |
| [32] |
FRANKS S, WEBBER L J, GOH M, et al. Ovarian morphology is a marker of heritable biochemical traits in sisters with polycystic ovaries[J]. The Journal of Clinical Endocrinology and Metabolism, 2008, 93(9): 3396-3402. DOI:10.1210/jc.2008-0369 |
| [33] |
AHREN B, LARSSON H. Impaired glucose tolerance (IGT) is associated with reduced insulin-induced suppression of glucagon concentrations[J]. Diabetologia, 2001, 44(11): 1998-2003. DOI:10.1007/s001250100003 |
| [34] |
HUANG F, DONG J X, KONG J, et al. Effect of transcutaneous auricular vagus nerve stimulation on impaired glucose tolerance: a pilot randomized study[J]. BMC Complementary and Alternative Medicine, 2014, 14(4): 203. |
| [35] |
GANCHEVA S, BIERWAGEN A, MARKGRAF D F, et al. Constant hepatic ATP concentrations during prolonged fasting and absence of effects of Cerbomed Nemos® on parasympathetic tone and hepatic energy metabolism[J]. Molecular Metabolism, 2018, 7(1): 71-79. |
| [36] |
ZHANG Z X, LI S Y, WANG Y, et al. Effect of transcutaneous auricular vagus nerve stimulation on fasting blood glucose and serum insulin concentration in Zucker diabetes fatty rats[J]. World Journal of Acupuncture-Moxibustion, 2021, 31(3): 212-217. DOI:10.1016/j.wjam.2021.05.002 |
| [37] |
KELLY C C, LYALL H, PETRIE J R, et al. Low grade chronic inflammation in women with polycystic ovarian syndrome[J]. The Journal of Clinical Endocrinology and Metabolism, 2001, 86(6): 2453-2455. DOI:10.1210/jcem.86.6.7580 |
| [38] |
SPRITZER P M, LECKE S B, SATLER F, et al. Adipose tissue dysfunction, adipokines, and low-grade chronic inflammation in polycystic ovary syndrome[J]. Reproduction, 2015, 149(5): R219-R227. DOI:10.1530/REP-14-0435 |
| [39] |
MALDONADO-BOUCHARD S, PETERS K, WOLLER S A, et al. Inflammation is increased with anxiety and depression-like signs in a rat model of spinal cord injury[J]. Brain, Behavior, and Immunity, 2016, 51(5): 176-195. |
| [40] |
AMITAI M, TALER M, BEN-BARUCH R, et al. Increased circulatory IL-6 during 8-week fluoxetine treatment is a risk factor for suicidal behaviors in youth[J]. Brain, Behavior, and Immunity, 2020, 55(9): 301-308. |
| [41] |
MAIER S F, GOEHLER L E, FLESHNER M, et al. The role of the vagus nerve in cytokine-to-brain communication[J]. Annals of the New York Academy of Sciences, 1998, 840(10): 289-300. |
| [42] |
SALAMA M, AKAN A, MUELLER M R. Transcutaneous stimulation of auricular branch of the vagus nerve attenuates the acute inflammatory response after lung lobectomy[J]. World Journal of Surgery, 2020, 44(9): 3167-3174. DOI:10.1007/s00268-020-05543-w |
| [43] |
张世科, 何慧, 刘勇, 等. 电针治疗产后性功能障碍伴尿失禁: 前瞻性病例系列研究(英文)[J]. World Journal of Acupuncture-Moxibustion, 2022, 32(3): 208-212. |
| [44] |
杨红, 李嘉, 张司明, 等. 针药结合治疗多囊卵巢综合征的临床疗效及对血清IL-6的影响[J]. 上海中医药杂志, 2023, 57(3): 62-66. |
| [45] |
ZHUANG Z, PAN X, ZHAO K, et al. The effect of interleukin-6(IL-6), interleukin-11(IL-11), signal transducer and activator of transcription 3(STAT3), and AKT signaling on adipocyte proliferation in a rat model of polycystic ovary syndrome[J]. Medical Science Monitor, 2019, 26(25): 7218-7227. |
| [46] |
BOOTS C E, JUNGHEIM E S. Inflammation and human ovarian follicular dynamics[J]. Seminars in Reproductive Medicine, 2015, 33(4): 270-275. DOI:10.1055/s-0035-1554928 |
| [47] |
张杏, 连方. 炎症细胞因子白介素-6、肿瘤坏死因子-α、转化生长因子-β1在多囊卵巢综合征中作用机制及临床意义的研究进展[J]. 中国性科学, 2022, 31(1): 47-50. |
| [48] |
木良善, 赵越, 乔杰. 肥胖与多囊卵巢综合征的关联性及潜在机制[J]. 中华生殖与避孕杂志, 2018, 38(4): 343-349. |
 2024, Vol. 43
2024, Vol. 43