文章信息
- 蔡明慧, 王玉明, 刘京
- CAI Minghui, WANG Yuming, LIU Jing
- 基于UPLC-Q-TOF-MS技术和网络药理学探讨配伍甘草降低附子心脏毒性的作用机制
- Exploring the effect of licorice aconite on reducing cardiotoxicity based on UPLC-Q-TOF-MS and network pharmacology
- 天津中医药大学学报, 2024, 43(10): 881-891
- Journal of Tianjin University of Traditional Chinese Medicine, 2024, 43(10): 881-891
- http://dx.doi.org/10.11656/j.issn.1673-9043.2024.10.04
-
文章历史
收稿日期: 2024-05-10
2. 国家中医针灸临床医学研究中心, 天津 300381;
3. 天津中医药大学中药学院, 天津 301617
2. National Clinical Research Center for Chinese Medicine Acupuncture and Moxibustion, Tianjin 300381, China;
3. School of Chinese Materia Medica, Tianjin University of Traditional Chinese Medicine, Tianjin 301617, China
附子最初记载于《神农本草经》,为毛茛科植物乌头的子根加工品。附子性辛,味甘,大热,有毒,归心、肾、脾经,具有回阳救逆、补火助阳、散寒止痛功效,对亡阳虚脱、心阳不足、寒湿痹痛等多种病症具有较好治疗效果[1]。现代药理研究发现附子用于临床具有显著的抗心律失常、抗炎、镇痛、抗肿瘤等药理作用[2]。但是附子因为具有毒性而极易引起神经、呼吸、循环等系统的不良反应[3],故在临床使用时受限。配伍用药是中医特色之一,中医多以配伍用药起到协同、拮抗、减毒等效果。经文献调查得知,《伤寒论》与《金匮要略方论》中涉及附子临床运用的条文共60篇,其中与附子合用频率最高的药物为炙甘草与甘草。甘草具有补脾益气、清热解毒、调和诸药等作用,为附子与甘草的配伍奠定了基础,并为历代医家广泛应用[4]。因此,本实验通过超高效液相色谱-四极杆-飞行时间质谱(UPLC-Q-TOF-MS)技术与网络药理学方法探究配伍甘草后,降低附子心脏毒性的机制,为附子临床安全合理应用提供依据。
1 仪器与材料 1.1 仪器Waters ACQUITY UPLC(Waters公司,美国),医用离心机(长沙高新技术产业开发区湘仪离心机仪器有限公司),电子天平(天津马衡基仪器有限公司),电子调温电热套(天津市静海县工兴电器厂)。
1.2 药材与试剂娃哈哈纯净水(杭州娃哈哈集团有限公司),甲酸(天津市科密欧化学有限公司),乙腈(天津市康科德科技有限公司),无水乙醇(天津市江天化工技术股份有限公司)。甘草饮片与附子饮片(河北美威药业股份有限公司)。
2 方法 2.1 样品溶液制备 2.1.1 蒸馏水提取精密称取甘草、附子、甘草+附子各1 g,分别用10、8倍量蒸馏水回流提取2次,每次1 h,合并滤液,用蒸馏水分别定容至250 mL,12 000 r/min离心15 min取上清液(离心半径8.6 cm),得到甘草单煎样品溶液、附子单煎样品溶液和甘草-附子合煎液,并置于-20 ℃冰箱保存。
2.1.2 乙醇提取精密称取甘草、附子、甘草+附子各1 g,分别用10、8倍量50%乙醇回流提取2次,每次1 h,合并滤液,用50%乙醇分别定容至250 mL,12 000 r/min离心15 min取上清液(离心半径8.6 cm),得到甘草单煎样品溶液、附子单煎样品溶液和甘草-附子合煎液,并置于-20 ℃冰箱保存。
2.2 色谱条件色谱柱:UPLC BEH C18(2.1 mm×100 mm,1.7 μm);流动相:0.1%甲酸-水(A)-0.1%甲酸-乙腈(B),梯度洗脱(0~1 min,1%B;1~2 min,1%~5%B;2~10 min,5%~30%B;10~15 min,30%~50%B;15~20 min,50%~70%B;20~24 min,70%~99%B);体积流量:0.5 mL/min;柱温:25 ℃;进样量:5 μL。
2.3 质谱条件正离子电离模式下,使用电喷雾电离源(ESI源)、高纯液氮作为辅助喷雾电离和脱溶剂气体,质谱扫描范围:50~1 000 m/z;毛细管电压:3.0 kV;干燥器温度:325 ℃;干燥气体流速:10 mL/min;脱溶剂气体流速:600 L/h;离子源温度:120 ℃;脱溶剂气体温度:350 ℃;锥孔气体流速:50 L/h;扫描范围:50~2 000 m/z。
2.4 网络药理学分析中药具有多成分、多靶点、多途径等特征,导致传统中医药的作用机制不清楚。而网络药理学以组学研究为基础,以高通量筛选、网络可视化和网络分析为技术手段,揭示和分析“药物-基因-靶点-疾病”多层次、多角度的生物网络关系,并据此预测其可能的作用机制,对阐明其药理疗效及机制具有重要借鉴意义。
2.4.1 附子单煎液和甘草配伍附子后化学成分的靶点收集通过成分分析获得附子单煎液与甘草-附子合煎后的化学成分,再以类药性(DL)≥0.18、口服生物利用度(OB)≥30%作为条件对已经获取的数据进行筛选。将筛选后化学成分的Canonical SMILES格式导入Swiss Target Prediction数据库,设置物种为人(Homo sapiens)进行相关靶点收集,筛选出Probability>0并删除重复项。
2.4.2 心脏毒性相关疾病靶点收集为收集心脏毒性相关疾病靶点,选择DisGeNet数据库(https://www.disgenet.org/)和Gene Card数据库(http://www.genecards.org/),分别在两个数据库中以“cardiotoxicity”“cardiac injury”“heart failure”为关键词进行检索,收集相关疾病靶点。在DisGeNet数据库中筛选出Score gda>0.1的数据,在Gene Card数据库筛选出category中Protein coding组分和Relevance score≥平均值的数据。
2.4.3 药物主要成分与疾病交集靶点将“2.4.1”项中收集到的单煎附子成分靶点与甘草附子合煎液成分靶点与“2.4.2”项中收集到的疾病靶点分别导入微生信作图软件(https://www.bioinformatics.com.cn/),由此可以得到相关Venn图和交集靶点,即附子导致心脏毒性的靶点及甘草-附子治疗心脏毒性的靶点。
2.4.4 构建中药-成分-靶点-疾病网络图将已经收集到的单煎附子化学成分相关靶点与甘草-附子合煎液化学成分相关靶点、疾病相关靶点按照文献方法[5],对数据进行处理后制作网络文件、属性文件并导入应用生物信息分析软件Cytoscape 3.6.1中,分别绘制中药-成分-靶点-疾病网络图。
2.4.5 构建蛋白相互作用网络PPI将“2.4.3”项中收集到的附子产生心脏毒性的靶点和甘草-附子治疗心脏毒性的靶点数据分别导入STRING平台(https://cn.string-db.org/)进行分析,设置物种为人(Homo sapiens),创建蛋白质相互作用网络,筛选最低要求交互值为high confidence 0.700。
2.4.6 基因本体论(GO)富集分析及Kyoto京都基因与基因组百科全书(KEGG)富集分析通过David数据库(https://david.ncifcrf.gov/)查找富集基因,将“2.4.3”项中收集到的交集基因导入数据库,选择OFFICIAL GENNE SYMBOL并设置物种为Homo sapiens,进行GO(包括分子功能、生物过程、细胞组成)和KEGG富集分析。
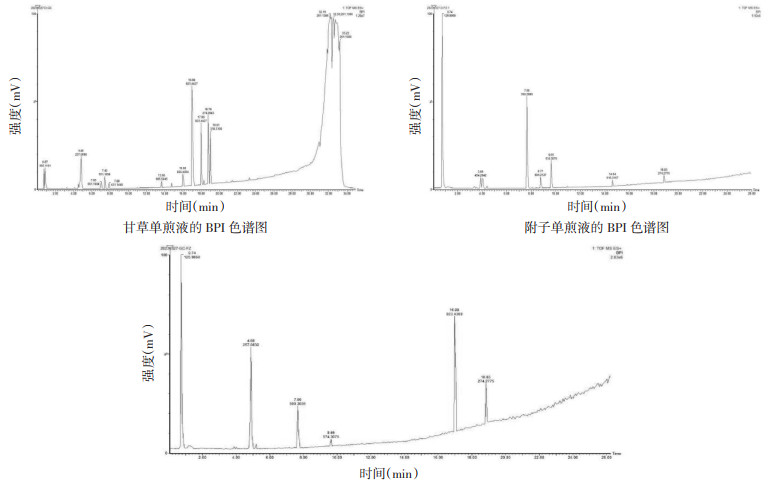
3 结果 3.1 UPLC-Q-TOF-MS色谱图采集基于上述色谱条件,对单煎液与合煎液提取物分别检索鉴定正离子流模式的基峰离子(BPI)色谱图见图 1。提示色谱图基线平稳,色谱峰分离效果良好,由此可知在上述色谱条件下的数据分析采集范围内,单煎液与合煎液中的各类成分得到很好地分离与鉴别。
|
| 甘草-附子合煎液的BPI色谱图 图 1 单煎液与合煎液提取物BPI色谱图 |
UPLC-Q-TOF-MS检测分析发现通过传统水煎方法,药物成分溶出困难,水提液的质谱分析信号明显少于50%乙醇提取液。50%乙醇作为有机溶剂,能够更加全面地提取药材中的有效成分。为了全面考察附子-甘草配伍减毒机制,实验中选择了醇提液进行质谱分析,明确配伍前后化学成分的改变,进而探索其配伍减毒机制,为临床用药提供理论依据。对比自建质谱数据库并依据二级质谱信息进行物质定性分析,根据相应值筛选并去除重复部分后,附子单煎液共鉴定得到化合物65种,甘草单煎液共鉴定得到化合物21种,甘草-附子合煎液共鉴定得到化合物71种。在乙醇提取得到的样品溶液中,对比单煎液与合煎液,发现附子单煎液有31种成分没有出现在合煎液中,甘草单煎液有9种成分没有出现在合煎液中,而合煎液有27种自建数据库中包含的成分但没有在单煎液中出现,推测其原因可能是由于配伍引起的成分变化。具体成分见开放科学(资源服务)标识码(OSID)。
3.1.2 结果分析附子具有明确的心脏毒性,而甘草则能够调和诸药,两者配伍作为经典药对也被广泛应用于中医临床之中。利用UPLC-Q-TOF-MS技术,对样品溶液进行分析并比对自建数据库,根据相应值进行筛选与去除重复部分后,甘草单煎液共鉴定得到化合物21种,主要成分为18β-甘草次酸(18β-Glycyrrhetinic Acid)、甘草内酯(3β,22β-Dihydroxy-11-oxoolean-12-en-30-oic acid γ-lactone)、芒柄花黄素(Formononetin)、甘草素(Liquiritigenin)等;附子单煎液共鉴定得到化合物65种,主要成分为乌头碱(Aconitine)、次乌头碱(Hypaconitine)、新乌头碱(Mesaconitine)等;甘草-附子合煎液共鉴定得到化合物71种。大量实验表明,甘草的主要成分是多糖类化合物、黄酮化合物和三萜类物质,其中甘草甜素可以水解为2个分子葡萄糖醛酸与1个分子的甘草次酸。附子经过炮制后,剧毒成分双酯型生物碱会转化为单酯型,其毒性大大降低。甘草与附子配伍后,甘草的水解产物葡萄糖醛酸可以与附子乌头类生物碱的羟基结合,生成低毒或无毒的络合物并随尿排出体外,从而达到降低附子毒性的作用。已有实验证明,附子配伍甘草后,乌头碱在大鼠体内的半衰期(t1/2)缩短,提示乌头碱的消除速度加快,说明甘草对附子具有解毒作用。甘草类黄酮和异甘草素能够使乌头碱诱发的动物心律失常持续时间明显减少,表明其有缓解乌头碱诱发的大鼠心律失常作用。附子-甘草合煎液能够在一定程度上减缓附子中6种生物碱类成分在大鼠体内的吸收,从而降低了附子毒性。
综上所述,甘草配伍附子后确实会引起附子有效成分的变化。附子生品主要含双酯型生物碱,经煎煮或炮制后可以水解转化为单酯型生物碱,后者可以进一步水解为醇胺型生物碱,其中酯键的数量决定了附子的毒性。配伍甘草会对附子的化学成分产生影响,也是甘草配伍附子解毒增效的理论基础。同时,甘草皂苷类成分可能通过调节线粒体能量代谢,预防或改善附子脂溶性生物碱诱导的心律失常现象,从而发挥拮抗附子心脏毒性作用。
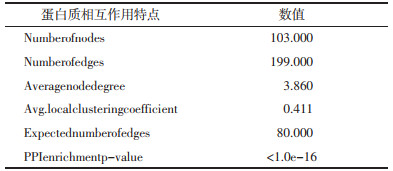
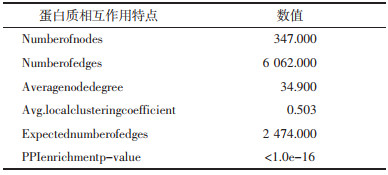
3.2 网络药理学分析 3.2.1 成分靶点及心脏毒性疾病靶点收集将采用HPLC-Q-TOF-MS技术获得的附子单煎液化学成分,按照DL≥0.18且OB≥30%的条件筛选后得到6个成分。将其化学成分的Canonical SMILES格式导入Swiss Target Prediction数据库进行筛选后获得236个靶点,删除重复项后剩余137个靶点。甘草-附子合煎液的化学成分经筛选后得到71个,将其化学成分的Canonical SMILES格式导入Swiss Target Prediction数据库进行筛选后获得2 454个靶点,删除重复项后剩余712个靶点。以“cardiotoxicity” “cardiac injury”“heart failure”为关键词分别在DisGeNet数据库和Gene Card数据库中进行检索,按要求筛选后共得到6 196个靶点,删除重复项后得到4 009个靶点。通过Venn图可知附子单煎液的潜在靶点与心脏毒性疾病靶点共有103个交集靶点,甘草-附子合煎液的潜在靶点与心脏毒性疾病靶点共有436个交集靶点。见图 2。
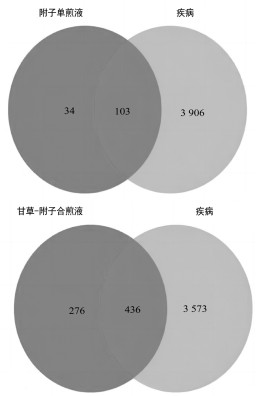
|
| 图 2 潜在靶点与疾病靶点Venn图 |
将收集到的相关数据导入Cytoscape 3.6.1软件中,分别绘制附子单煎液和甘草-附子合煎液的中药-成分-靶点-疾病网络图。见图 3。
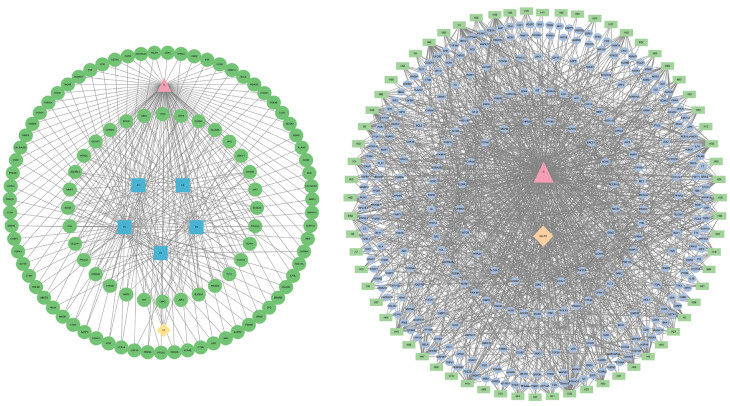
|
| 注:A,附子单煎液;B,甘草-附子合煎液。圆形、椭圆形部分为药物与疾病的相关靶点,正方形、矩形部分为药物成分,三角形部分为疾病,菱形部分为药物。 图 3 中药-成分-靶点-疾病网络图 |
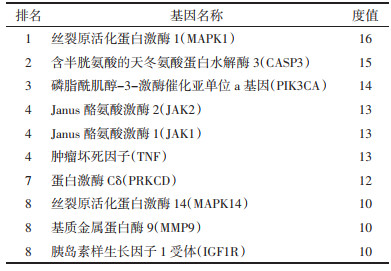
将“3.2.1”项收集到的成分与疾病的交集靶点分别导入STRING平台进行分析,得到附子-心脏毒性相关靶点的蛋白质相互作用网络以及附子单煎液、甘草-附子-心脏毒性相关靶点蛋白质相互作用网络,见OSID及表 1、表 2。同时分别对候选靶点进行度值评价,计算每个节点度值,排名前10位的度值见表 3、表 4。
对附子单煎液的核心靶点进行GO富集分析,从生物过程来看,主要涉及对外源性刺激的反应(GO:0009410)、钙介导的信号传导(GO:0019722)、与对尼古丁的反应(GO:0035094)等途径;从细胞组分来看,主要为细胞膜(GO:0005886)、细胞膜整体组件(GO:0005887)、膜筏(GO:0045121)等区域;从分子功能来看,主要体现在蛋白质丝氨酸/苏氨酸/酪氨酸激酶活性(GO:0004712)、神经递质受体活性(GO:0030594)、G蛋白偶联5-羟色胺受体活性(GO:0004993)等方面,见图 4。结果中P值越小,表明该基因在GO中富集越多。在David数据库中筛选出排名前10位的通路,其主要调节的通路包括肿瘤途径、神经活性配体-受体相互作用、乙型肝炎、晚期糖基化终末产物(AGE)-晚期糖基化终末产物受体(RAGE),见图 5。
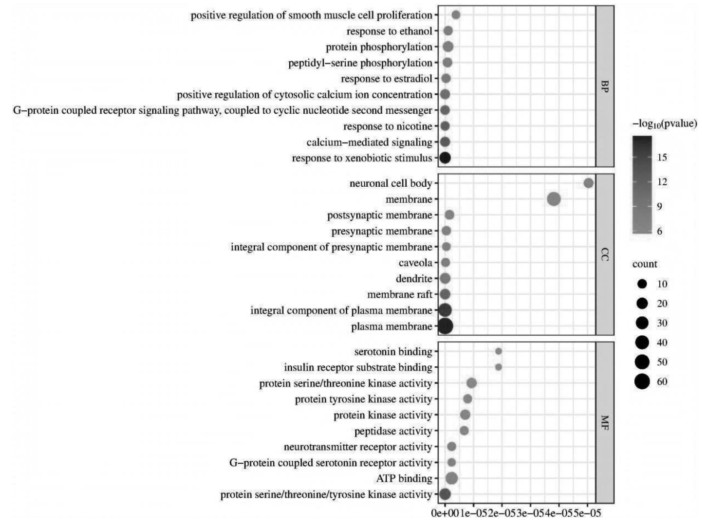
|
| 图 4 附子单煎液GO富集分析气泡图 |
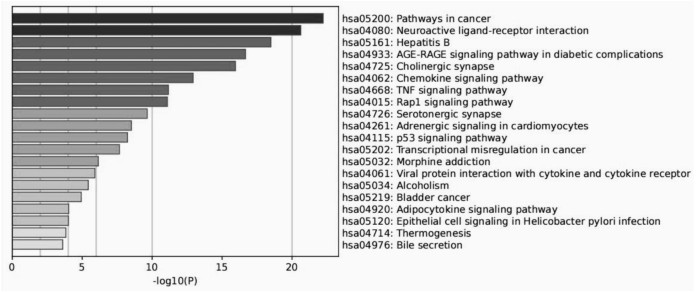
|
| 图 5 附子单煎液的KEGG富集分析柱状图 |
对甘草-附子合煎液的核心靶点进行GO富集分析,结果见图 6。从生物过程来看,主要涉及细胞凋亡过程的负调控(GO:0043066)、对外源性刺激的反应(GO:0009410)、蛋白质磷酸化(GO:0006468)等途径;从细胞组分来看,主要涉及细胞膜(GO:0005886)、细胞膜的组成(GO:0005887)、膜筏(GO:0045121)等区域;从分子功能来看,主要体现在酶结合(GO:0019899)、蛋白质丝氨酸/苏氨酸/酪氨酸激酶活性(GO:0004712)、蛋白激酶活性(GO:0004672)等方面。结果中P值越小,表明该基因在GO中富集越多。在David数据库中筛选出排名前10位的通路,其主要调节的通路包括肿瘤通路、脂质与动脉粥样硬化、乙型肝炎、流体剪切应力与动脉粥样硬化等,见图 7。
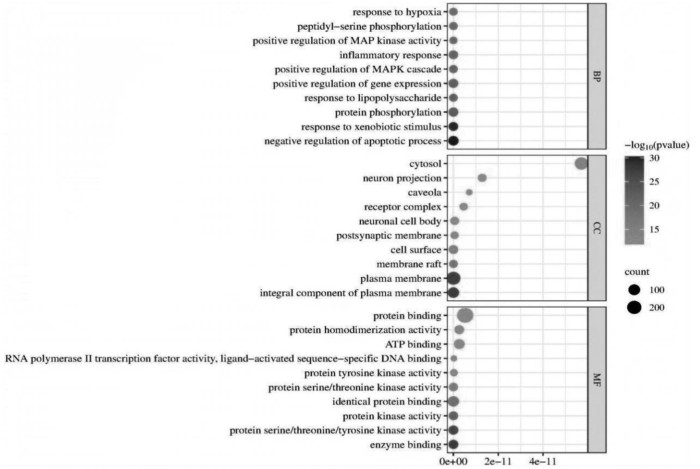
|
| 图 6 甘草-附子合煎液的GO富集分析气泡图 |
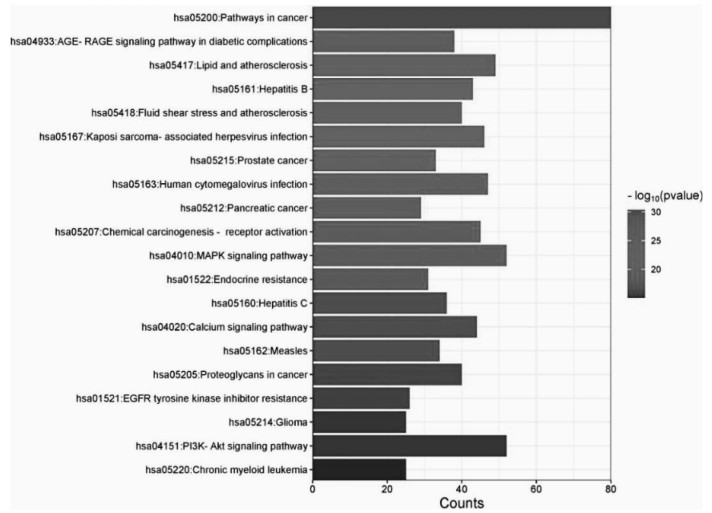
|
| 图 7 甘草-附子合煎液的KEGG富集分析柱状图 |
本实验对附子醇提液的65种化学成分进行分析,并运用网络药理学构建了中药-活性成分-作用靶点-疾病网络。网络分析结果表明有5种化学成分与附子产生心脏毒性有关,根据度值排序分别为2,7-Dideacetyl-2,7-dibenzoyl-taxayunnanine F、乙酰乌头碱(Acetylaconitine)、3-乙酰乌头碱(3-Acetylaconitin)、异塔拉萨定(Isotalatizidine)、脱氧乌头碱(Deoxyaconitine)。乌头碱可以对心脏心肌细胞膜造成严重损害,进而大量激活细胞膜上的钠离子(Na+)转运通道,从而使大量的Na+流入心肌细胞,造成心肌细胞膜去极化速度加快,导致其功能出现异常。乌头碱能够刺激交感神经使其兴奋,从而释放大量儿茶酚胺,打乱心肌细胞的正常节律,导致快速性心律失常发生。
对103个交集靶点进行分析,结果显示MAPK1、CASP3、PIK3CA、JAK2、JAK1等为附子产生心脏毒性的关键靶点。MAPK1被激活后可以通过磷酸化激活其下游的多种蛋白激酶、磷脂酶及转录因子,在心血管细胞的各项生理过程发挥重要作用,并且有研究表明MAPK1在心肌纤维化的信号调控中发挥重要作用[6]。CASP3是含半胱氨酸的天冬氨酸蛋白水解酶(CASP)家族介导细胞凋亡的关键执行分子,有研究表明,CASP3的高表达与心肌细胞凋亡密切相关,CASP3表达上调提示心肌细胞凋亡增加,促进心室重构[7];研究表明,当PIK3CA的表达下调时,可以抑制心肌成纤维细胞增殖,促进细胞早期凋亡,减少Ⅰ型、Ⅲ型胶原的产生,并下调生长刺激表达基因2蛋白(ST2)的表达水平对抗心肌纤维化[8];JAK2受白细胞介素、肿瘤坏死因子等多种细胞因子的介导,通过血管内皮细胞增殖、细胞缺氧损伤等多个病理过程对心血管疾病造成影响[9];JAK1广泛表达于生物体内各个组织细胞中,是一条具有细胞因子刺激的信号转导通路,其参与细胞增殖、分化、凋亡及免疫调节等多种生物学过程,JAK1可以激活信号转导和转录激活因子3(STAT3)。慢性心力衰竭模型大鼠STAT3活性增强,其磷酸化比例显著升高,表明心肌组织转向心力衰竭的关键是STAT3信号上调,并且STAT3可以诱导辅助细胞(Th)向Th1或Th2分化,调控Th1/Th2平衡,进而抑制病毒复制,阻止病毒性心肌炎的发生[10]。
3.2.7 基于网络药理学探究配伍甘草降低附子心脏毒性的作用机制网络药理学分析结果表明18β-甘草次酸(18β-Glycyrrhetinic Acid)、甘草查尔酮A(Licochalcone-A)、Lipo-14-O-Anisoylbikhaconine、雪乌碱(penduline)、Aconicarchamine B等化学成分与降低附子的心脏毒性有关。甘草次酸可以通过抑制氧化应激和下调半胱氨酸天冬氨酸蛋白酶-3(Caspase-3)/Bcl-2相关X蛋白(Bax)/B淋巴细胞瘤-2(Bcl-2)凋亡信号通路,对心脏骤停心肺复苏大鼠的心脏功能发挥保护作用[11],并且次乌头碱、甘草次酸、甘草苷配伍之后可以对慢性心力衰竭所引起的左心室肥大、心功能障碍具有拮抗作用[12]。甘草查尔酮A可以有效防止心肌梗死后的心肌损伤,甘草查尔酮A可以明显减少急性心肌梗死小鼠心肌细胞内的活性氧聚集,同时谷胱甘肽表达和过氧化氢酶活力升高,丙二醛表达降低,推测其作用机制可能是通过激活核转录因子E2相关因子2(Nrf2)/血红素氧合酶-1(HO-1)通路来发挥抗氧化应激效应[13]。
对436个交集靶点进行分析,结果显示AKT1、TNF、GAPDH、TP53、VEGFA、SRC、IL-1β、EGFR、CASP3、MYC等为甘草-附子降低心脏毒性的关键靶点。研究表明,AKT1的下调可能是增加小鼠心肌缺血再灌注易损性的重要因素。TP53诱导的糖酵解和凋亡调控因子可以减少机体的糖酵解,同时还可以保护机体免受氧化应激。现代研究发现,凋亡调控因子与各种心血管系统疾病之间也存在密切联系[14]。GAPDH是线粒体自噬发生的关键蛋白,GAPDH异常表达或聚集会直接引起线粒体自噬不足,导致无功能线粒体增加,最终致使心肌细胞死亡,因此降低GAPDH的异常聚集或异常表达有利于急性缺血再灌注后心肌细胞保护。血管内皮生长因子(VEGF)是一种能够显著增加局部皮肤血管通透性和单核细胞渗出的蛋白质,同时还能够促进血管内皮细胞的生成与血管生成,被称为血管通透因[15]。IL-1β是白细胞介素-1(IL-1)家族中的两种激动剂之一,参与冠状动脉粥样硬化性心脏病的进展,如易损斑块破裂特发性扩张型心肌病能够引发心力衰竭、心律失常等症状[16]。含半胱氨酸的天冬氨酸蛋白水解酶(CASP)家族能够介导细胞凋亡,而CASP3在凋亡早期即被激活,可以使相应的细胞质基质、细胞核产物发生裂解,最终导致细胞凋亡。高表达的CASP3主要与心肌细胞的凋亡密不可分。亦有实验研究表明,抑制CASP3表达能够减轻老年慢性心力衰竭大鼠的心肌损伤情况,从而达到改善心功能的目的。
3.2.8 基于网络药理学探讨配伍甘草减毒的作用机制附子单煎液与疾病共存在103个交集靶点,甘草-附子合煎液与疾病共有436个共同靶点,按照度值进行排序,包括AKT1、GAPDH、TP53、VEGFA、SRC等可能与甘草的配伍解毒有关。对比附子单煎液与甘草-附子合煎液通过David数据库对交集基因进行的GO富集分析结果,从生物过程来看,配伍甘草可能从细胞凋亡过程的负调控、对脂多糖的反应、基因表达的正调控、丝裂原活化蛋白激酶(MAPK)级联的正调控、炎症反应、MAPK激酶活性的正调控、对缺氧的反应等过程来降低附子的心脏毒性;从细胞组分来看,可能涉及细胞表面、受体复合体、神经元投射、细胞质基质等细胞区域;从分子功能来看,可能与酶结合、相同蛋白质结合、RNA聚合酶Ⅱ转录因子活性、配体激活的序列特异性DNA结合蛋白、蛋白质同源二聚体活性、蛋白质结合等方面有关。KEGG的富集结果表明流体剪切应力与动脉粥样硬化、胰腺肿瘤、化学致癌-受体激活、MAPK信号通路、丙型肝炎、钙离子信号通路、麻疹、胶质瘤、慢性粒细胞白血病等相关。
4 讨论与小结附子被誉为“回阳救逆第一品”,是传统中药,在现代临床应用中具有十分重要的地位,但其使用范围也因其毒性受到限制,所以对附子毒性成分的研究及其临床用药指导至关重要。目前,附子已经分离、鉴定得到的化学成分有122种,包括生物碱类化合物、黄酮类化合物等。其中,已经发现和鉴定的主要生物碱有105种,以C19-二萜生物碱为主。生物碱类化合物与附子的某些药理活性相关,同时也存在较高的毒性[17],尤其是二萜类生物碱,包括乌头碱、中乌头碱、下乌头碱等双酯型二萜类生物碱和苯甲酰乌头原碱、苯甲酰次乌头原碱等单酯型二萜类生物碱[18]。附子内的毒性成分能够使迷走神经兴奋,表现出恶心、呕吐、手足发麻、呼吸困难、消化道烧灼感、急性心源性脑缺血综合征、突发性死亡等中毒症状,或直接产生心脏毒性,主要表现为心律失常[19]。乌头碱中毒事件在世界范围内仍有发生,患者常出现心血管、神经、胃肠等多种体征及症状合并,死亡的主要原因是难治性室性心动过速和心脏骤停[20]。现代研究发现,附子配伍甘草后可以通过调节糖酵解、脂质代谢、三羧酸循环和氨基酸代谢中氮的代谢等生物代谢途径实现减毒效果[21]。减毒途径主要包含两个方面,一是甘草酸在体内的水解产物为葡萄糖醛酸,它可以与乌头类生物碱的羟基结合,生成低毒或无毒的葡萄糖醛酸络合物,经尿液排出体外[22];二是附子-甘草配伍合煎过程中,甘草皂苷、黄酮等成分与附子乌头类生物碱等成分能够根据成分酸碱作用结合而逐渐沉积,使合煎液中的酯型生物碱含量减少,达到减毒效果[23]。目前大多认为附子中的二萜类生物碱,包括双酯型、单酯型和脂类生物碱,甘草中的三萜皂苷类(如甘草酸、甘草次酸)、黄酮类(如甘草素)和香豆素类化合物等成分是两者配伍发挥“减毒增效”作用的主要物质基础[24]。
通过David数据库对交集基因进行GO功能富集分析与KEGG通路富集分析,结果表明附子单煎会产生心脏毒性,主要涉及胆碱能突触、血清素能突触等过程,与趋化因子信号通路、Ras相关蛋白1(Rap1)信号通路、心肌细胞的肾上腺素能信号传导通路、p53信号通路等有关。延髓头端腹外侧区(RVLM)是交感神经活动和心血管功能调控的重要整合中枢,乙酰胆碱及其受体在该区分布广泛。有实验表明,胆碱能传递在自发性高血压病大鼠RVLM中增强,激活RVLM中的M型受体会引起血压升高、交感神经兴奋、诱发心力衰竭等心脑血管疾病[25];5-羟色胺(5-HT)具有抑制心肌细胞瞬时外向钾电流的作用,此作用通过激动5-HT2受体,启动磷脂酶C信号转导途径,进一步激活蛋白激酶,从而抑制心肌细胞瞬时外向钾电流。趋化因子存在4个半胱氨酸残基,可以通过同源G蛋白偶联受体刺激细胞迁移,在免疫系统的发育和动态平衡中发挥重要作用。实验表明,在心肌梗死小鼠心肌中的C-X-C基序趋化因子配体10(CXCL10)和编码CXC趋化因子受体3信使RNA(CXCR3 mRNA)表达水平上调,CXCR3+/CD45+白细胞、CXCR3+/CD3+T淋巴细胞和CXCR3+肌成纤维细胞数量显着增加,并且内源性CXCL10可以保护梗死心肌免受过度纤维化重塑,从而限制活化的肌成纤维细胞浸润[26]。实验证实,环腺苷酸直接激活的交换蛋白(Epac)/Rap1信号通路在H9c2心肌细胞缺氧复氧损伤中发挥关键作用,H9c2心肌细胞缺氧复氧后其细胞内的Epac信号分子被激活,表达水平上调,其下游Rap1的活性形式Rap1-鸟苷三磷酸(GTP)与钙/钙调蛋白依赖性蛋白激酶Ⅱ(CaMK-Ⅱ)的表达水平均上调,细胞外调节蛋白激酶(ERK)的磷酸化水平显著提高,导致细胞内钙离子超载,致使心肌细胞活性降低,损伤程度增加[21];β-肾上腺素能受体(β-AR)信号通路异常是心力衰竭的重要特征,β-AR在心肌的生理调节中发挥基础性作用,而β-AR系统过度激活会促进衰竭心脏的纤维化进程,诱导成纤维细胞增殖、胶原分泌、迁移并向肌成纤维细胞表型转化[27]。p53基因可以表达于心肌细胞,且会在缺血、缺氧和再灌注损伤过程中表达增强。已有实验证实心肌细胞发生过氧化损伤时可能激活了由p53介导的Caspase-3凋亡途径,诱导相应的心肌细胞发生凋亡[28]。
通过David数据库对交集基因进行GO功能富集分析与KEGG通路富集分析,结果表明配伍甘草发挥减毒效应的作用机制主要涉及细胞凋亡过程的负调控、对外源性刺激的反应、蛋白质磷酸化等过程,与AGE-RAGE信号通路、MAPK信号通路、磷脂酰肌醇-3-激酶(PI3K)-蛋白激酶B(AKT)信号通路等有关。考虑到心力衰竭、心肌损伤等病理进程中,会出现细胞凋亡水平、蛋白激酶磷酸化水平显著提高的情况,因此抑制心肌细胞凋亡水平可以起到拮抗心力衰竭的效果,从而改善心肌细胞功能,保护心肌细胞免受病理损伤。同时,抑制蛋白激酶磷酸化水平也可以起到改善心功能的效果。MAPK信号通路是真核生物信号传递网络中的重要途径之一,它可以参与细胞增殖、分化、凋亡以及生理、病理条件下的应激反应等多个重要生命过程。既往研究表明,MAPK信号通路中的MAPK激酶ERK蛋白及蛋白激酶AKT蛋白的磷酸化水平与心肌细胞表型改变及心肌肥厚密切相关[19]。PI3K/AKT信号通路广泛存在于细胞中,参与细胞生长、繁殖并调节细胞分化。现代研究发现,附子中的成分附子去甲乌药碱可以通过引起PI3K/AKT级联反应,减轻缺血再灌注引起的心肌细胞损伤[29]。AGE通过诱导心肌和血管组织的氧化应激与炎症,被确定为心血管疾病发病和进展背后的关键病因。当AGE激活RAGE时,核转录因子-κB及其RAGE靶基因随之上调,进而会加重氧化应激程度并引发炎症与纤维化反应。上述情况均会导致危及生命的心血管事件的发生与进展。
西医研究表明,附子的主要化学成分是双酯二萜类生物碱,同时双酯二萜类生物碱也是产生毒性作用的主要化学成分,其毒性作用主要集中于心血管系统与中枢神经系统[30]。最新研究表明,甘草配伍附子发挥减毒作用的机制主要包括利用人源有机阴离子转运多肽1B1(hOATP1B1)、人源有机阴离子转运多肽1B3(hOATP1B3)、人源有机阳离子转运蛋白1(hOCT1)、人源有机阳离子转运蛋白3(hOCT3)作为介导乌头类生物碱进入肝脏和(或)肾脏的转运过程的关键摄取转运蛋白,同时甘草可以通过抑制这些关键摄取转运蛋白来减轻由减少暴露引起的毒性[31]。甘草通过上调细胞色素P450家族3A(CYP3A)的表达来促进附子毒性成分的代谢,进而改善心肌能量代谢紊乱,缓解心力衰竭进展[32]。上述实验以蛋白为介导阐述了配伍甘草解毒的作用机制,本实验则选用网络药理学的方法探究配伍甘草发挥减毒效应的作用通路,为后续研究提供了新思路。本研究从毒性成分入手,分析了配伍甘草能够降低附子心脏毒性的原因。构建了中药-活性成分-靶点-疾病网络、PPI网络,并进行GO功能富集分析和KEGG通路富集分析,结果表明甘草-附子合煎液的活性成分18β-甘草次酸(甘草次酸)、甘草查尔酮A、雪乌碱等可能与AKT1、GAPDH、TP53、VEGFA、SRC等关键靶点相关,并通过MAPK信号通路、PI3K-AKT信号通路、钙离子信号通路等发挥降低附子心脏毒性的作用,为中医临床使用甘草-附子药对提供理论依据。
| [1] |
国家药典委员会. 中华人民共和国药典[M]. 北京: 中国医药科技出版社, 2020: 155-168.
|
| [2] |
孙森凤, 姜雪, 张颖颖. 附子药理作用研究进展[J]. 山东化工, 2017, 46(11): 65-67. DOI:10.3969/j.issn.1008-021X.2017.11.025 |
| [3] |
蒋旭萍. 附子毒性成分及不良反应[J]. 实用中医内科杂志, 2018, 32(12): 73-75. |
| [4] |
郭丽丽, 唐雪春. 《伤寒论》、《金匮要略方论》中附子应用特点的文献研究[J]. 新中医, 2011, 43(11): 108-109. |
| [5] |
何亚州. 温中益气方对来源于外泌体的miR-320a调控PIK3CA防治慢性心力衰竭心肌纤维化的研究[D]. 南宁: 广西中医药大学, 2019.
|
| [6] |
邓芳隽, 李晓凤, 杜武勋, 等. 基于JAK2/STAT3通路及糖皮质激素受体探讨胸痞方治疗冠心病合并抑郁症作用机制研究[J]. 辽宁中医药大学学报, 2022, 24(7): 26-33. |
| [7] |
郭鹏, 关立克. JAK1信号通路在心脑血管疾病中的意义[J]. 吉林医学, 2017, 38(1): 175-178. DOI:10.3969/j.issn.1004-0412.2017.01.071 |
| [8] |
刘熔, 崔彦杰, 宋金萍. Wnt/β-catenin信号通路在TNF-α诱导的心肌细胞损伤和凋亡中的作用研究[J]. 国际检验医学杂志, 2023, 44(8): 920-926. DOI:10.3969/j.issn.1673-4130.2023.08.005 |
| [9] |
张丽. 环状RNA circACSL1通过miR-8055/MAPK14加重心肌炎症及心肌损伤的机制研究[D]. 济南: 山东大学, 2022.
|
| [10] |
肖丽. 血清MMP2和MMP9在急性心肌梗死诊断中应用的研究[D]. 大连: 大连医科大学, 2022.
|
| [11] |
李姚娜, 杨慧宇. TP53诱导的糖酵解和凋亡调控因子在常见心血管疾病中的研究进展[J]. 中国医药, 2023, 18(4): 599-602. |
| [12] |
张卫光, 夏家骝, 田珑, 等. 低能量氦氖激光照射增加大鼠心肌血管内皮生长因子的表达[J]. 解剖学报, 2003, 34(6): 642-644. DOI:10.3321/j.issn:0529-1356.2003.06.018 |
| [13] |
ZHOU G H, TANG L Y, ZHOU X D, et al. A review on phytochemistry and pharmacological activities of the processed lateral root of Aconitum carmichaelii Debeaux[J]. Journal of Ethnopharmacology, 2015, 160(2): 173-193. |
| [14] |
高艳, 谢灵燕, 卢志强. 附子毒理及减毒增效配伍的研究进展[J]. 天津药学, 2020, 32(1): 65-69. DOI:10.3969/j.issn.1006-5687.2020.01.018 |
| [15] |
黎明. 附子的毒性与临床应用[J]. 中国医药指南, 2011, 9(14): 116-117. DOI:10.3969/j.issn.1671-8194.2011.14.085 |
| [16] |
姜波, 常晶晶, 张春蕾, 等. 附子心脏毒性及配伍减毒增效机制研究进展[J]. 药物评价研究, 2021, 44(6): 1346-1353. |
| [17] |
PAN Q H, HUI D, HU C X. A variant of IL-1β is associated with the risk and blood lipid levels of myocardial infarction in eastern Chinese individuals[J]. Immunological Investigations, 2022, 51(5): 1162-1169. DOI:10.1080/08820139.2021.1914081 |
| [18] |
涂丁元. 构建心力衰竭基因表达调控网络并验证SRSF3在其中的作用机制[D]. 上海: 中国人民解放军海军军医大学, 2021.
|
| [19] |
于武华, 钟凌云. 附子的强心作用及其机理研究进展[J]. 江西中医药, 2021, 52(3): 77-80. |
| [20] |
WASIM R, MAHMOOD T, SIDDIQUI M H, et al. Aftermath of AGE-RAGE Cascade in the pathophysiology of cardiovascular ailments[J]. Life Sciences, 2022, 307(11): 1208-1216. |
| [21] |
何瑶, 章津铭, 高飞, 等. 附子甘草配伍减毒增效作用机制研究进展及展望[J]. 中药与临床, 2013, 4(3): 62-65. |
| [22] |
吴嘉瑞, 蔺梦娟, 刘鑫馗. 基于网络药理学的"水牛角-珍珠母"药对作用机制研究[J]. 中国医院用药评价与分析, 2018, 18(1): 18-22, 29. |
| [23] |
张博成, 徐艳, 龚韧, 等. 老年慢性心力衰竭患者血清microRNA-208a、CASP3与心室重构和预后的关系[J]. 中国现代医学杂志, 2023, 33(7): 66-72. DOI:10.3969/j.issn.1005-8982.2023.07.011 |
| [24] |
杨明, 刘小彬, 黄庆德. 附子甘草配伍减毒增效机理探析[J]. 时珍国医国药, 2003, 14(4): 197-198. DOI:10.3969/j.issn.1008-0805.2003.04.003 |
| [25] |
王新婷, 鲁成, 史天云, 等. β肾上腺素能受体信号通路调控心力衰竭心肌纤维化作用机制的研究进展[J]. 中国当代医药, 2022, 29(24): 23-27. DOI:10.3969/j.issn.1674-4721.2022.24.007 |
| [26] |
薛伟栋, 翟昌林, 钱钢. 基于p53信号通路探讨木香烃内酯对H9C2心肌细胞过氧化损伤的保护作用[J]. 中国中医药科技, 2023, 30(2): 225-228. |
| [27] |
付楠, 周惠芬, 何昱, 等. 次乌头碱、甘草苷及甘草次酸配伍对慢性心力衰竭大鼠的心肾保护作用研究[J]. 中国中西医结合杂志, 2018, 38(8): 974-978. |
| [28] |
王雪. 甘草查尔酮A对小鼠心肌梗死的保护效应及其作用机制[D]. 扬州: 扬州大学, 2022.
|
| [29] |
陈新. 基于PI3K/Akt信号通路研究大黄附子汤加减治疗慢性肾衰竭大鼠的机制[D]. 福州: 福建中医药大学, 2017.
|
| [30] |
周思思, 马增春, 梁乾德, 等. 基于UPLC/Q-TOF-MS分析附子煎煮过程中化学成分的变化[J]. 中西医结合学报, 2012, 10(8): 894-900. |
| [31] |
罗维. 基于cGAS-STING信号通路的甘草抗炎作用新机制研究[D]. 成都: 成都中医药大学, 2023.
|
| [32] |
NI L L, MIAO P, JIANG J, et al. Glycyrrhiza uralensis promote the metabolism of toxic components of Aconitum carmichaeli by CYP3A and alleviate the development of chronic heart failure[J]. PLoS One, 2022, 17(6): 700-709. |
 2024, Vol. 43
2024, Vol. 43