文章信息
- 王喆, 郭流漓, 刘祎曼, 庄朋伟, 任明
- WANG Zhe, GUO Liuli, LIU Yiman, ZHUANG Pengwei, REN Ming
- 低剂量参麦方调控HIF-1/VEGF信号通路对心力衰竭大鼠的改善作用
- The improvement effect of low-dose Shenmai Recipe on heart failure rats by regulating HIF-1/VEGF signaling pathway
- 天津中医药大学学报, 2024, 43(10): 900-906
- Journal of Tianjin University of Traditional Chinese Medicine, 2024, 43(10): 900-906
- http://dx.doi.org/10.11656/j.issn.1673-9043.2024.10.06
-
文章历史
收稿日期: 2024-05-10
2. 天津中医药大学附属保康医院, 天津 300193
2. Tianjin University of Traditional Chinese Medicine Baokang Hospital, Tianjin 300193, China
心力衰竭(HF)是由心脏超负荷和损伤引起的一种异质性临床综合征,是导致发病和死亡的主要原因,也是目前日益严重的临床与公共卫生问题之一[1-2]。据预测,至2030年将会有超过800万的成年人遭受HF影响[3]。该病发病机制复杂,多种因素均可以促使心脏重塑,并且心血管重塑通常伴随血管生成受损,因此,促进血管新生、改善脉管血运对于HF的防治显得极为重要。中医药治疗HF具有多成分、多靶点、多途径的特点,能够有效改善HF患者临床症状及不良反应,降低住院率[4]。本研究中的参麦方源于《症因脉治》,由红参、麦冬组成,其中红参主治体虚欲脱、肢冷脉微、气不摄血等症状,麦冬主治肺胃阴虚、心烦、失眠等症状,具有益气固脱、养阴补心之效,在治疗HF的临床实践中获得颇多良效[5-6]。缺氧诱导因子-1α(HIF-1α)主要通过激活血管生成基因及其受体的转录来促进心肌血管生成[7],血管内皮生长因子A(VEGFA)是最有效的促血管生成因子,能够促进血管生成[8],而缺氧诱导因子-1(HIF-1)信号通路的重要下游基因是血管内皮生长因子(VEGF)[9],HIF-1/VEGF信号通路在血管生成、稳定和成熟中发挥重要作用[10]。然而目前对于参麦方治疗HF心血管生成的机制与HIF-1/VEGF信号通路的相关性研究相对较少,本研究通过腹腔注射盐酸多柔比星制备HF动物模型,并采用参麦方进行治疗,拟分析其对HIF-1/VEGF信号通路的影响,并阐述其作用机制。
1 实验材料及方法 1.1 实验动物55只SPF级雄性SD大鼠,体质量(200±20)g,购自北京斯贝福生物技术有限公司,许可证号:SCXK(京)2019-0010。饲养于天津中医药大学SPF级动物中心,分笼喂养,自由摄食与饮水,适应环境后进行实验。
1.2 药物、试剂及仪器 1.2.1 药物制备参麦方组成:红参、麦冬(比例为1∶1)购自河北美威药业股份有限公司,并对药物进行煎煮浓缩。按照人-大鼠体表面积换算(1∶6.25),将参麦方给药剂量设定为1.1、5.4 g/kg(相当于临床等效剂量的1、5倍)。旋蒸浓缩至1 g/mL,4 ℃保存,灌胃依照不同剂量进行稀释。
1.2.2 主要试剂与仪器 1.2.2.1 主要试剂注射用盐酸多柔比星(深圳万乐药业有限公司,批号:H44024359),氨基端前脑钠素(NT-proBNP)酶联免疫吸附(ELISA)试剂盒(武汉伊莱瑞特生物科技股份有限公司,货号:E-EL-R3023),大鼠内皮素-1(ET-1)ELISA试剂盒(武汉基因美科技有限公司,货号:JYM0591Ra),一氧化氮(NO)检测试剂盒(碧云天生物技术,产品编号:S0021S),CD31兔多克隆抗体(美国Abcam公司,批号:AB281583),VEGFA小鼠单克隆抗体(武汉爱博泰克生物科技有限公司,批号:3523013119),HIF-1α小鼠单克隆抗体(品牌:赛默飞世尔科技有限公司,货号:PL205612)。
1.2.2.2 主要仪器酶标仪(infinite200Pro),实时定量聚合酶链式反应(PCR)仪(美国Bio-rad公司),Vevo 2100成像系统(加拿大VisualSonics公司),24孔离心机(德国Eppendorf有限公司),旋转蒸发器(天津科诺仪器设备有限公司)。
1.3 实验方法 1.3.1 大鼠HF模型构建将55只大鼠依次编号,随机分为4组:正常组(10只)、模型组(15只)、参麦高剂量组(15只)、参麦低剂量组(15只)。将10 mg的盐酸多柔比星溶于6.7 mL生理盐水中,配制成1.5 mg/mL的注射液,现用现配。正常组10只大鼠等体积腹腔注射蒸馏水1.5 mL/kg,其余45只大鼠均给予腹腔注射盐酸多柔比星1.5 mg/kg,均每周2次,连续注射8周,累积剂量为24 mg/kg。在8周末对4组存活的大鼠进行超声心动图检查以检测左心室功能,结果提示以左心室短轴缩短率(FS) < 30%为慢性HF造模成功的标准[11]。实验过程中,模型组死亡5只并剔除造模失败的大鼠3只,参麦高剂量组死亡7只,参麦低剂量组死亡5只,最后对各组剩余大鼠(正常组10只、模型组7只、参麦高剂量组8只、参麦低剂量组10只)进行取材并分析。
1.3.2 给药方法实验采用“边造模边给药”的方式进行,从实验第1天起,各给药组大鼠分别给予参麦方高剂量(5.4 g/kg)、低剂量(1.1 g/kg)灌胃,正常组和模型组大鼠给予等量蒸馏水灌胃,均为每日1次,连续灌胃8周。
1.4 指标检测 1.4.1 心功能相关指标测定采用Vevo 2100成像系统测定大鼠心功能情况,包括左心室射血分数(LVEF)、左心室短轴缩短率(LVFS)。以上参数均连续测量3个心动周期并取平均值。
1.4.2 心脏病理学检测取大鼠心脏组织,10%甲醛固定,经脱水、石蜡包埋处理后制成切片,采用苏木精-伊红(HE)染色及马松(Masson)染色进行病理切片染色,光学显微镜下观察心肌组织的病理变化。
1.4.3 免疫组织化学CD31染色取大鼠心脏组织,10%甲醛固定,经脱水、石蜡包埋处理后制成切片,进行CD31染色,经CD31染色后的阳性细胞呈棕色,光学显微镜下观察心肌组织血管的变化情况,并利用ImageJ软件测定心肌组织血管阳性表达量。
1.4.4 实时荧光定量聚合酶链式反应(RT-qPCR)取适量心肌组织,加入适量裂解液提取总RNA,后进行逆转录,使用RT-qPCR仪进行扩增,预变性,95 ℃15 min,PCR反应,40个循环,95 ℃10 s,60 ℃30 s,内参基因为β-actin,使用2-ΔΔCt方法计算相对表达量。引物由上海生工生物工程公司设计合成,引物序列见表 1。
向组织中加入RIPA组织/细胞裂解液进行裂解,冰上匀浆,15 000 r/min,4 ℃离心(离心半径12 cm)后取上清液,二喹啉甲酸(BCA)定量法测定蛋白浓度。100 ℃水浴锅中变性5 min,4%~12%预制胶电泳,转移至PVDF膜,采用快速封闭液封闭处理20 min,GAPDH、VEGFA、HIF-1α一抗4 ℃孵育过夜,TBST洗膜,二抗室温1 h,TBST洗膜,显影曝光,ImageJ软件量化灰度值,以目的蛋白灰度值与内参GAPDH灰度值的比值表示该蛋白表达水平。
1.4.6 统计学方法应用Graph Pad Prim 9.0统计学软件对数据进行分析。计量资料符合正态分布且满足方差齐性时,以均数±标准差(x±s)表示,多组间比较采用单因素方差分析,两两比较采用LSD法。P<0.05为差异有统计学意义。
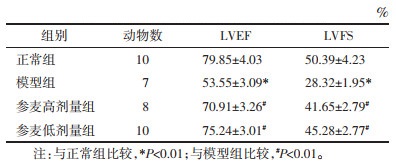
2 结果 2.1 各组大鼠心功能指标情况超声心动图检测结果显示,与正常组比较,模型组大鼠心功能指标LVEF、LVFS降低,差异有统计学意义(P<0.01);与模型组比较,参麦高、低剂量组大鼠LVEF、LVFS升高,差异有统计学意义(P<0.01)。见图 1、表 2。
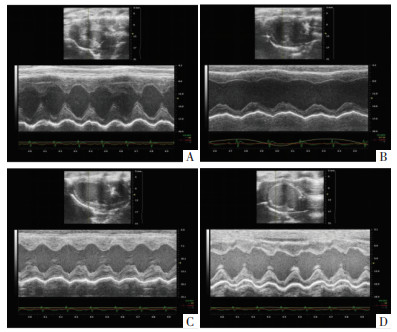
|
| 注:A,正常组;B,模型组;C,参麦高剂量组;D,参麦低剂量组。 图 1 各组大鼠超声心动图 |
HE染色结果显示,正常组大鼠心肌组织结构正常,组织间未见明显炎性细胞浸润;模型组大鼠心肌细胞排列紊乱,表现出肥大、变形,结构模糊,细胞间隙变大,细胞核破碎,心肌组织损伤严重;参麦高、低剂量组大鼠均不同程度地改善了心肌损伤情况,心肌细胞排列规则,细胞核清晰可见,炎性细胞浸润较少,其中参麦低剂量组表现与正常组接近。见图 2。
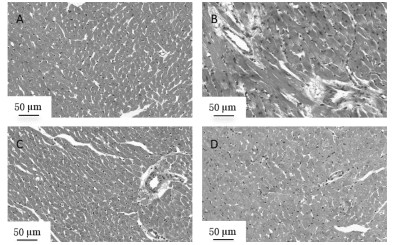
|
| 注:A,正常组;B,模型组;C,参麦高剂量组;D,参麦低剂量组。 图 2 各组大鼠HE染色情况(×200) |
Masson染色结果显示,正常组大鼠心肌细胞形态一致,心肌纤维排列整齐;模型组大鼠心肌细胞可见网状连接、排列不规律、分布杂乱、染色不均,胶原组织显著增多,心肌组织纤维化严重;参麦高、低剂量组大鼠心肌胶原纤维沉积情况有所改善,心肌组织胶原纤维较为规整,表现出一定的抗纤维化作用,其中参麦低剂量组改善效果较为明显。见图 3。
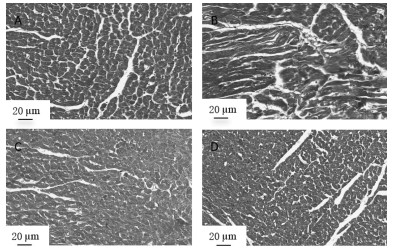
|
| 注:A,正常组;B,模型组;C,参麦高剂量组;D,参麦低剂量组。 图 3 各组大鼠Masson染色情况(×400) |
免疫组织化学CD31染色结果显示,与正常组比较,模型组大鼠微血管密度(MVD)表达减少(P<0.01);与模型组比较,参麦高、低剂量组大鼠心肌细胞中MVD表达升高(P<0.05或P<0.01)。见图 4、图 5。
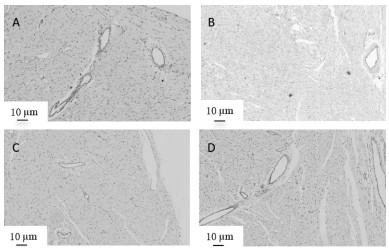
|
| 注:A,正常组;B,模型组;C,参麦高剂量组;D,参麦低剂量组。 图 4 各组大鼠免疫组织化学CD31染色图(×100) |
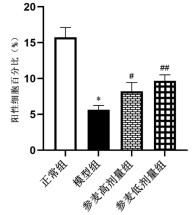
|
| 注:与正常组比较,*P<0.01;与模型组比较,#P<0.05,##P<0.01。 图 5 各组大鼠免疫组织化学检测结果比较(x±s,n=3) |
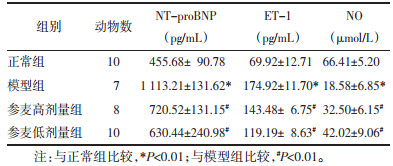
通过ELISA法检测各组大鼠NT-proBNP、ET-1、NO水平,结果显示与正常组比较,模型组大鼠NT-proBNP、ET-1浓度升高(P<0.01),NO浓度降低(P<0.01);与模型组比较,参麦高、低剂量组大鼠NT-proBNP、ET-1浓度降低(P<0.01),NO浓度上升(P<0.01),参麦低剂量组效果更佳。见表 3。
RT-qPCR结果显示,与正常组比较,模型组大鼠IL-6、IL-1β、TNF-α、VCAM-1 mRNA表达水平升高,HIF-1α、VEGFA mRNA表达水平降低,差异具有统计学意义(P<0.01);与模型组比较,参麦高、低剂量组大鼠IL-6、IL-1β、TNF-α、VCAM-1 mRNA表达量降低,HIF-1α、VEGFA mRNA表达量升高,部分差异具有统计学意义(P<0.05或P<0.01)。见图 6。
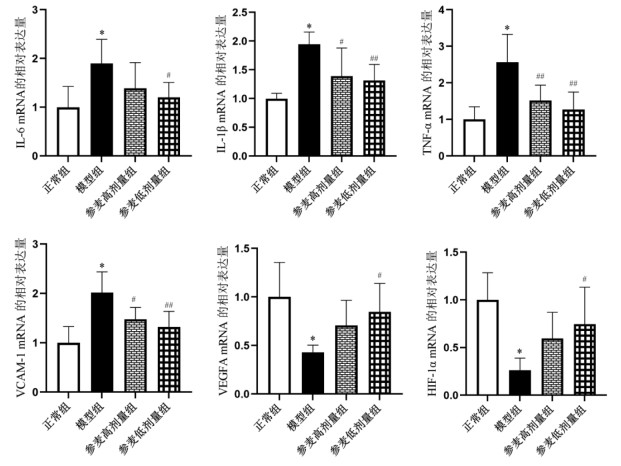
|
| 注:与正常组比较,*P<0.01;与模型组比较,#P<0.05,##P<0.01。 图 6 各组大鼠心脏组织mRNA表达水平(x±s,n=3) |
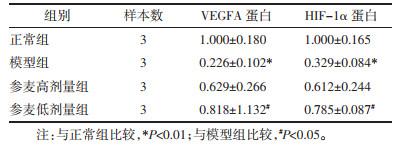
Western Blot结果显示,与正常组比较,模型组大鼠HIF-1α和VEGFA蛋白表达量降低,差异具有统计学意义(P<0.01);与模型组比较,参麦高、低剂量组HIF-1α和VEGFA蛋白表达量上升,其中参麦低剂量组升高显著(P<0.05)。见图 7、表 4。
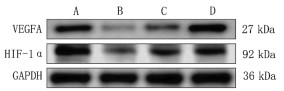
|
| 注:A,正常组;B,模型组;C,参麦高剂量组;D,参麦低剂量组。 图 7 各组大鼠VEGFA、HIF-1α、GAPDH蛋白表达条带图 |
中医将HF归为“心悸”“喘证”“胸痹”“水肿”等范畴,胸闷、心悸、呼吸困难等临床症状与现代HF相似,其病机以心气不足与心阴、心阳亏虚为本,即气阴两虚致心气不足,阳气虚损,进而阳虚水泛,气虚血瘀水停[12]。血管对应中医之脉或血络,为气血运行通道,唯有血脉充盈,才能运载血液发挥濡养心脏的功能。相对而言,心气充沛,则血脉有力,气血得运[13]。因此,心血的正常运行离不开心气推动、脉道通利及心阴与心阳之间的调和。参麦方别名参麦饮,源于《症因脉治》,由红参、麦冬组成,具有益气固脱、养阴补心之效,主治气虚喘逆、虚热、脉浮大、按之则空或见濡软、散大无神。方中红参甘、温,入脾、肺、心经,补脾益肺,益气摄血,复脉固脱。麦冬甘、寒,入心经,养阴生津,润肺清心。红参与麦冬配伍加强了益气养阴作用[14],符合中医对HF基本病机的认识,临床应用确有疗效。
红参是治疗HF常用的补气药之一。现代药理学研究表明,参麦方中红参及其成分具有促进微循环、抗氧化、抗疲劳、增强免疫功能等作用[15]。研究证实,红参水煎液能够提升HF大鼠LVEF、降低NT-proBNP含量,其机制可能是通过增强抗氧化能力,降低氧化应激水平,进而发挥对心脏的保护作用[16],与本研究结果一致。麦冬的化学成分具有保护心血管、抗炎、抗氧化、抗衰老、免疫调节等药理作用[17]。其中,麦冬皂苷D不仅能够对抗血管内皮细胞凋亡[18],对心肌细胞缺氧复氧损伤亦具有保护作用[19]。
阿霉素是一种广谱、高效的蒽环类抗肿瘤药物。研究表明,阿霉素可以建立稳定、可靠、经济的HF动物模型[20]。因此,本研究选择阿霉素建立HF动物模型。炎症性疾病实质上参与内皮功能障碍的发展,最常见的心脏炎症相关细胞因子是TNF-α、白细胞介素、心肌营养因子-1等,这些蛋白质能够在炎症细胞与心肌细胞之间发挥作用,并与HF的进展程度成正比[21-22]。研究表明,参麦注射液可以降低HF患者血清中的炎症因子水平,改善血管内皮细胞损伤导致的功能障碍,从而进一步保护心功能[23]。本研究发现,模型组大鼠心肌组织IL-6、IL-1β、TNF-α和VCAM-1 mRNA表达量升高,HE染色显示心肌组织间存在明显的炎性细胞浸润情况,Masson染色显示心肌组织纤维化严重,给予不同剂量的参麦方治疗后,IL-6、IL-1β、TNF-α和VCAM-1 mRNA表达量降低,炎性细胞浸润情况得到改善,心肌纤维化减轻,提示参麦方具有较好的抗炎、抗纤维化作用,与上述文献报道类似。
本研究前期使用网络药理学预测得出参麦方防治HF的作用机制可能与HIF-1/VEGF信号通路相关,并且已有研究表明,提高大鼠心肌组织中的HIF-1和VEGF mRNA表达量能够显著促进血管新生并改善心功能[24]。因此,本研究主要围绕此通路开展研究。HF的发展通常伴随血管生成受损,据报道,毛细血管稀疏、心肌组织氧合减少会导致HF发生[25]。血管生成的关键调节因子VEGF由心肌细胞响应HIF-1α信号而产生,并且能够作用于内皮细胞上的VEGF受体2从而刺激血管生成[26]。NO能够调节心肌功能,对心脏具有保护作用,过量的活性氧与NO生物利用度降低会导致心脏损伤[27]。ET-1是内皮功能障碍的标志物,并且能够诱导促炎信号表达,抑制ET-1通路可以显著改善HF大鼠的血管舒缩内皮功能及存活率[28]。既往研究显示,HIF-1/VEGF信号通路可以促进HF大鼠血管新生[10]。曾玉玲等[29]研究表明,参麦注射液能够通过上调VEGF、蛋白激酶B(AKT)等蛋白表达量,促进心肌梗死大鼠心肌血管新生。此外,有研究证实参麦注射液能够显著增加心肌缺血大鼠心脏血管CD31表达,并升高VEGF基因表达,促进血管生成,从而改善心肌缺血再灌注损伤后的心脏功能[30]。本研究发现,模型组大鼠血清ET-1含量升高,NO含量降低,免疫组织化学CD31染色显示血管内皮受损,HIF-1α、VEGFA基因、蛋白含量下降,给予低、高剂量参麦方治疗后ET-1含量下降,NO含量升高,新生血管密度增加,HIF-1α、VEGFA基因、蛋白含量均呈现不同程度上调,其中低剂量参麦方对HIF-1α、VEGFA的上调作用更加明显,提示低剂量参麦方具有较好的促血管新生作用。推测参麦方可能通过促进血管新生,改善心肌组织供氧,抑制炎性因子表达,进而改善HF。
综上,参麦方能够抑制炎症反应,减轻心肌损伤,促进生理性血管新生,上调HIF-1α、VEGFA基因、蛋白表达,降低IL-1β、TNF-α等炎性因子表达,其作用机制可能与HIF-1/VEGF信号通路相关。但需要指出的是,考虑到不能明确参麦方与阳性对照药物治疗HF的作用机制是否相同,本研究并未设置阳性药组,且本研究的验证实验尚不够全面,只从某些方面阐释了血管新生,未来有待进一步探讨和补充。
| [1] |
SNIPELISKY D, CHAUDHRY S P, STEWART G C. The many faces of heart failure[J]. Cardiac Electrophysiology Clinics, 2019, 11(1): 11-20. DOI:10.1016/j.ccep.2018.11.001 |
| [2] |
TOMASONI D, ADAMO M, LOMBARDI C M, et al. Highlights in heart failure[J]. ESC Heart Fail, 2019, 6(6): 1105-1127. DOI:10.1002/ehf2.12555 |
| [3] |
TRUBY L K, ROGERS J G. Advanced heart failure: epidemiology, diagnosis, and therapeutic approaches[J]. JACC Heart Fail, 2020, 8(7): 523-536. DOI:10.1016/j.jchf.2020.01.014 |
| [4] |
陈英男, 陈铭泰, 徐翀, 等. 中医药防治心力衰竭进展[J]. 长春中医药大学学报, 2023, 39(12): 1394-1399. |
| [5] |
寿旦, 楼益平. 参麦注射液治疗气阴两虚型慢性心力衰竭的临床观察[J]. 浙江中医杂志, 2022, 57(5): 340. DOI:10.3969/j.issn.0411-8421.2022.05.012 |
| [6] |
陈秀珍. 参麦注射液对慢性心力衰竭患者的治疗效果研究[J]. 中西医结合心血管病电子杂志, 2021, 9(22): 32-34. |
| [7] |
WU C N, CHEN F, HUANG S, et al. Progress on the role of traditional Chinese medicine in therapeutic angiogenesis of heart failure[J]. Journal of Ethnopharmacology, 2023, 301(1): 115-127. |
| [8] |
ZOU J, FEI Q, XIAO H, et al. VEGF-A promotes angiogenesis after acute myocardial infarction through increasing ROS production and enhancing ER stress-mediated autophagy[J]. Journal of Cellular Physiology, 2019, 234(10): 17690-17703. DOI:10.1002/jcp.28395 |
| [9] |
程顺昇, 徐超凡, 康蕊, 等. 中药通过促进血管新生抗心力衰竭的研究进展[J]. 实用心脑肺血管病杂志, 2023, 31(12): 22-26. DOI:10.12114/j.issn.1008-5971.2023.00.302 |
| [10] |
张岚, 武永新, 张涛, 等. 藁本内酯调控PKD1/HIF-1α/VEGF通路对心力衰竭大鼠的改善作用[J]. 吉林大学学报(医学版), 2024, 50(1): 42-49. |
| [11] |
叶嘉豪, 李琳, 钟森杰, 等. 真武汤对慢性心力衰竭大鼠心室重构的影响[J]. 中国中医基础医学杂志, 2022, 28(9): 1419-1422. |
| [12] |
闫安平. 生脉散加味对气阴两虚型慢性心力衰竭患者利尿剂抵抗的改善作用[J]. 现代中西医结合杂志, 2021, 30(23): 2576-2580. DOI:10.3969/j.issn.1008-8849.2021.23.014 |
| [13] |
周桢, 王倩, 方荣. 基于心主血脉理论的滋阴养血法治疗脓毒症心肌病研究进展[J]. 辽宁中医杂志, 2022, 49(4): 212-214. |
| [14] |
陈瑶, 周德生. 参麦饮与生脉饮之异同探讨[J]. 光明中医, 2011, 26(12): 2563-2564. DOI:10.3969/j.issn.1003-8914.2011.012.115 |
| [15] |
樊伟旭, 詹志来, 侯芳洁, 等. 红参的化学成分及药理作用研究进展[J]. 天然产物研究与开发, 2021, 33(1): 137-149. |
| [16] |
温玉, 胡琨建, 李欧, 等. 红参水煎液对心衰大鼠心功能及氧化应激的影响[J]. 中国中医急症, 2022, 31(4): 584-587. DOI:10.3969/j.issn.1004-745X.2022.04.006 |
| [17] |
万梅绪, 原景, 张燕欣, 等. 麦冬提取物及其有效成分的药理作用研究进展[J]. 药物评价研究, 2023, 46(8): 1819-1826. |
| [18] |
黄小燕, 王宇光, 王怡, 等. 麦冬皂苷D通过上调CYP2J2/EETs抗AngⅡ诱导的内皮细胞凋亡[J]. 中国中药杂志, 2018, 43(2): 377-384. |
| [19] |
赵玲琳, 张勇, 薛慧, 等. 麦冬皂苷D对大鼠心肌细胞缺氧复氧损伤的保护作用及机制研究[J]. 中国循环杂志, 2022, 37(2): 178-184. DOI:10.3969/j.issn.1000-3614.2022.02.012 |
| [20] |
王洁, 段坤坤, 王亚峰. 心力衰竭动物模型建立方法的研究现状[J]. 西北民族大学学报(自然科学版), 2022, 43(1): 52-57. DOI:10.3969/j.issn.1009-2102.2022.01.010 |
| [21] |
GODO S, SHIMOKAWA H. Endothelial functions[J]. Arterioscler Thromb Vasc Biol, 2017, 37(9): 108-114. |
| [22] |
KIM S J, MESQUITA F C P, HOCHMAN-MENDEZ C. New biomarkers for cardiovascular disease[J]. Texas Heart Institute Journal, 2023, 50(5): 381-387. |
| [23] |
孙鹏, 吉伟丽, 臧金鹏, 等. 参麦注射液联合尼可地尔对心衰患者的临床疗效[J]. 中成药, 2019, 41(10): 2550-2552. DOI:10.3969/j.issn.1001-1528.2019.10.056 |
| [24] |
王士凯, 张檑, 孙平, 等. 芪苈强心胶囊对心力衰竭大鼠心室重构及HIF-1和VEGF表达的影响[J]. 江苏医药, 2021, 47(10): 984-987. |
| [25] |
JUNI R P, KOCKEN J M M, ABREU R C, et al. MicroRNA-216a is essential for cardiac angiogenesis[J]. Molecular Therapy: the Journal of the American Society of Gene Therapy, 2023, 31(6): 1807-1828. DOI:10.1016/j.ymthe.2023.04.007 |
| [26] |
LOTHER A, DENG L, HUCK M, et al. Endothelial cell mineralocorticoid receptors oppose VEGF-induced gene expressionand angiogenesis[J]. The Journal of Endocrinology, 2019, 240(1): 15-26. DOI:10.1530/JOE-18-0494 |
| [27] |
MOLLACE R, SCARANO F, BAVA I, et al. Modulation of the nitric oxide/cGMP pathway in cardiac contraction andrelaxation: potential role in heart failure treatment[J]. Pharmacological Research, 2023, 196(10): 1069-1081. |
| [28] |
SHANTSILA E, WRIGLEY B J, BLANN A D, et al. A contemporary view on endothelial function in heart failure[J]. European Journal of Heart Failure, 2012, 14(8): 873-881. DOI:10.1093/eurjhf/hfs066 |
| [29] |
曾玉玲, 李世阁, 占德进. 参麦注射液促进心肌梗死模型大鼠心肌血管新生[J]. 基础医学与临床, 2021, 41(11): 1624-1628. DOI:10.3969/j.issn.1001-6325.2021.11.012 |
| [30] |
LIU X, TAN W X, YANG F W, et al. Shengmai injection reduces apoptosis and enhances angiogenesis after myocardial ischaemia and reperfusion injury in rats[J]. Biomed Pharmacother, 2018, 104(5): 629-636. |
 2024, Vol. 43
2024, Vol. 43