文章信息
- 王铭扬, 王清泉, 张军平
- WANG Mingyang, WANG Qingquan, ZHANG Junping
- 基于AVP-V2R-AQP2通路探讨益气活血方干预慢性心力衰竭水潴留的实验研究
- Experimental study on the intervention of Yiqi Huoxue Prescription on water retention in chronic heart failure based on AVP-V2R-AQP2 pathway
- 天津中医药大学学报, 2024, 43(10): 915-923
- Journal of Tianjin University of Traditional Chinese Medicine, 2024, 43(10): 915-923
- http://dx.doi.org/10.11656/j.issn.1673-9043.2024.10.08
-
文章历史
收稿日期: 2024-05-21
2. 国家中医针灸临床医学研究中心, 天津 300381
2. National Clinical Research Center for Chinese Medicine Acupuncture and Moxibustion, Tianjin 300381, China
慢性心力衰竭(CHF)是指由于各方面因素影响引发的心脏结构改变和(或)功能异常,累及心脏正常功能进而出现的心脏相关疾病[1]。相关统计结果表明,近年来中国心血管疾病(CVD)的发病率逐年上升,每年CHF新发患者约50万例,发病率为0.7%~0.9%,且有较高的病死率,预后往往不良[2]。随着中国人口老龄化的上升以及城市化进程推进,CHF已经成为中国CVD领域重要的公共卫生问题。
CHF患者多伴有水肿、腹水、胸水等症状,其主要原因是患者心脏输出量不足。随着相关研究的深入,揭示了心脏与肾脏在疾病发展过程中的关系,并以心肾综合征来命名此类疾病。肾脏功能不全可以归因于神经内分泌、氧化应激、血流动力学以及药物干预等因素[3]。其主要原因在于肾素-血管紧张素-醛固酮(RASS)和交感神经系统(SNS)激活,心脏输出量降低,中心静脉压升高导致肾脏血管阻力增加与静脉压升高[4]。CHF诱发的肾功能障碍使肾脏出现水钠潴留,引起细胞外液增加,从而加重心脏负荷,心脏功能进一步恶化。随着研究的不断深入,人们发现肾脏水钠潴留的机制是肾血流量减少,肾小球的滤过率降低,近曲小管和远曲小管对水的重吸收作用增强[5]。研究并干预CHF水潴留的机制成为研究者当下着眼的重点之一。
中医认为CHF属于“胸痹”范畴,其基本病机在于“本虚标实”。病程之初,心脉受损导致的心气亏虚为虚证,气虚不利血行而致瘀血内停、阳虚水泛为实证[6]。“心为五脏六腑之大主”作为脏腑学说中的代表,认为心脏节律有序,跳动有力从而推动血液的正常运行输布,保护脉道流畅。又因血脉共起于心,血脉同源,心、血、脉协同调节周身脏腑正常运行,故治疗CHF当以益气活血法为其中重要治则之一,由黄芪、丹参、三七、降香4味中药组成的益气活血方是益气活血法的代表方药。现代药理学研究证明,以上述4味中药为主的益气活血类方药具有改善CHF患者心肌供血、降低心肌耗氧量、促进血管新生、缓解水潴留症状等作用[7]。大量临床研究表明,益气活血方治疗CHF疗效确切,能够改善CHF患者水潴留状态[8-9]。但其起效机制尚不完全明确,围绕水通道蛋白角度开展的相关研究较为少见,故本研究以水通道蛋白为切入点探究益气活血方干预CHF水潴留的机制。
1 材料 1.1 实验动物SPF清洁级雄性Sprague-Dawley(SD)大鼠,体质量(250±20)g,购自北京市华阜康实验动物有限公司[许可证号为SCXK(京)2014-0004]。本实验经天津中医药大学实验动物伦理委员会批准(编号:TCMLAEC20170043)。动物饲养于中国医学科学院放射医学研究所,12 h/12 h交替照明,室温维持22~24 ℃,自由摄食,饮水不限。实验中严格遵守减少、替代、优化的“3R原则”,给予充分人道主义关怀。
1.2 药物益气活血方所用药物为颗粒剂,购自天津中医药大学第一附属医院国药堂,临床处方剂量为黄芪30 g(批号:1804002),丹参15 g(批号:18003095),降香10 g(批号:1810029),三七粉1.5 g(批号:1806026)。卡托普利片购自上海衡山药业有限公司,批号:国药准字H31021353。
1.3 试剂氨基末端脑利钠肽前体(NT-proBNP)酶联免疫吸附(ELISA)试剂盒(武汉华美生物工程有限公司,批号:P16860);精氨酸加压素(AVP)ELISA试剂盒(武汉华美生物工程有限公司,批号:P16468);兔多抗GAPDH(杭州贤至生物有限公司,批号:AB-P-R001);兔多抗水通道蛋白2(AQP2,美国博士德生物工程有限公司,批号:PB9474);兔多抗pS256-AQP2(英国Abcam公司,批号:Ab111346);兔多抗抗利尿激素V2型受体(V2R,英国Abcam公司,批号:Bs10014R);辣根过氧化物酶(HRP)标记的羊抗兔二抗(武汉博士德,批号:BA1054);RIPA裂解液(上海碧云天,批号:P0013B);二喹啉甲酸(BCA)试剂盒(上海碧云天,批号:P0010)。
1.4 仪器小动物超声仪Vevo2100及其配套的气体麻醉装置(型号:VS4153);切片机(德国LEICA,型号:RM2235);光镜(德国LEICA,型号:DM3000);酶标仪(美国thermofisher公司,型号:mμlISKANMK3);包埋系统(德国LEICA,型号:HistoCore)。
2 方法 2.1 CHF大鼠模型构建将120只雄性SD适龄大鼠依照随机数字表法随机分为假手术组(10只)和造模组(110只),采用左侧冠状动脉前降至结扎法复制SD大鼠心肌梗死(MI)模型。假手术组于左侧冠状动脉前降支处穿线不结扎。模型组大鼠于左前降支(左心耳与肺动脉圆锥之间)穿过心肌后结扎,深1.5~2 mm,宽2~3 mm。结扎部位变为紫绀为结扎成功。
2.2 动物分组、造模、给药造模组大鼠麻醉后死亡2只,术中死亡25只,术后4周内死亡10只。术后4周应用小动物超高分辨率超声系统评价造模是否成功[造模成功标准为射血分数(EF)<50%],成模率为68.49%,造模成功大鼠50只。造模成功大鼠随机分为模型组、卡托普利组及益气活血低、中、高剂量组,每组10只。中药方剂组成为黄芪、丹参、三七、降香,购自天津中医药大学第一附属医院,剂型为颗粒剂,剂量基于临床处方进行配比(黄芪30 g,丹参15 g,降香10 g,三七1.5 g),即成人每日服用56.5 g。根据成人临床剂量按照体表面积法计算灌胃剂量,卡托普利组为13.5 mg/(kg·d),益气活血低、中、高剂量组分别为2.5、5、10 g/(kg·d),给药组按照大鼠单次灌胃量1 mL/100 g加入蒸馏水制备成混悬液,模型组与假手术组每日给予等体积蒸馏水灌胃,每日1次,各组均给药干预8周。干预期间各组大鼠均未出现死亡。
2.3 观测指标与检测方法 2.3.1 心功能超声检测分别于造模4周后及给药8周后,对实验对象进行超声检测,对其心功能进行评价。左侧胸部剃毛备皮,将大鼠置于麻醉盒内采用异氟烷进行麻醉,术中行低浓度异氟烷麻醉。充分固定大鼠头部和四肢,胸部涂抹耦合剂。在超声检查时选择探头MS-250,采集M-Mode图像,计算相关参数。每只大鼠检测3个心动周期,取平均值。
2.3.2 大鼠血清NT-proBNP、AVP检测依照ELISA实验方法,将大鼠血清样本稀释200倍后,设置标准品孔与样本孔,每孔添加标准品或待测样本100 μL,混匀后敷上板贴37 ℃孵育2 h。依次加入生物素标记抗体工作液100 μL,37 ℃孵育1 h。依次加入HRP标记亲和素工作液100 μL,37 ℃孵育1 h。每孔加入底物溶液90 μL,37 ℃避光显色15~30 min。后加入终止溶液,每孔50 μL,终止反应。5 min内采用酶标仪在450 nm波长测量各孔光密度值(A值)。
2.3.3 苏木精-伊红(HE)染色观察大鼠心肌组织及肾脏组织病理变化将大鼠心脏及肾脏组织固定于10%甲醛溶液中,经梯度乙醇脱水、透明、浸蜡、包埋等步骤制作石蜡切片。后经二甲苯脱蜡、梯度乙醇脱水、苏木素染核、分化、流水冲洗后伊红复染、梯度酒精脱水、透明、树脂胶封片,光学显微镜下观察结果并拍照。
2.3.4 免疫组织化学法观察大鼠AQP2、pS256-AQP2位置及分布假手术组、模型组、卡托普利组及益气活血各剂量组分别随机抽取6个肾脏样本石蜡切片脱蜡至水,抗原修复液修复组织,待其降至室温后取出玻片,采用pH=7.4的磷酸缓冲盐溶液(PBS)冲洗3遍,3%双氧水(H2O2)溶液阻断内源性酶原,pH=7.4的PBS冲洗3遍,滴加稀释山羊血清,室温下封闭30 min,滴加稀释后一抗AQP2,稀释倍数:GAPDH为1 000倍、AQP为21 000倍、pS256-AQP为21 000倍,4 ℃湿盒环境下孵育过夜。加酶标二抗,PBS充分冲洗,每次3 min,共3次。对切片进行充分干燥后滴加HRP标记二抗,50 000倍稀释,37 ℃孵育30 min。各切片滴加3,3’-二氨基联苯胺(DAB)显色液,光镜下观察切片染色情况,棕黄色为阳性表现,颜色明显时需要进行充分冲洗。苏木素复染,分化,PBS冲洗返蓝。结束后放入至梯度乙醇脱水,透明,各2 min,将切片自然干燥。通过树脂封片,400倍光镜观察,选取5个高倍视野采集图片,然后输入到ImageJ软件中进行分析,确定阳性表达面积及均值。
2.3.5 蛋白免疫印迹(Western Blot)法检测大鼠肾脏AQP2、pS256-AQP2、V2R蛋白表达情况称取洗净后的肾脏样本20 mg,充分研磨后加入磷酸酶抑制剂进行裂解,采用BCA试剂盒对蛋白含量进行检测。待其稀释、变性后开展凝胶电泳操作,且根据要求进行转膜处理。随后震荡1 h,向其中加入一抗,4 ℃孵育过夜,TBST洗膜3次后加入二抗,随后室温环境孵育1 h,洗膜后进行电化学发光(ECL)显影操作,使用ImageJ软件进行分析确定目的蛋白表达水平。
2.4 统计学方法采用SPSS 21.0处理实验数据,对各组数据进行正态性检验后,数据符合正态分布时,组间比较采用单因素方差分析,符合方差齐性采用LSD检验,方差不齐采用Dunnett’s T3检验;数据不符合正态分布或数据为等级资料则采用非参数检验(Kruskal-Wallis秩和检验)。各组间比较采用方差分析中均数的两两比较,数据均以均数±标准差(x±s)表示。P < 0.05为差异有统计学意义。
3 结果 3.1 大鼠一般状态假手术组大鼠饮食正常,毛色顺滑,体质量正常增加,活动能力正常。模型组大鼠精神不振,进食量下降,毛发光泽明显下降,同时出现肢体水肿现象。各给药组大鼠一般状态均有不同程度改善,饮食状况尚可,毛发有光泽,活动能力增强,四肢水肿不明显。
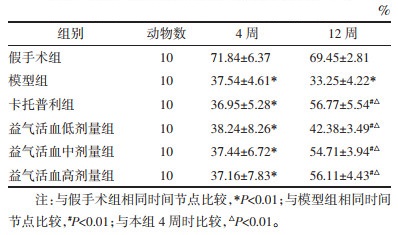
3.2 对CHF大鼠心脏质量指数(HWI)与左心室质量指数(LVMI)的影响大鼠HWI结果提示,与假手术组比较,模型组大鼠HWI升高,差异具有统计学意义(P < 0.01);与模型组比较,卡托普利组及益气活血中、高剂量组HWI均可见不同程度降低,差异有统计学意义(P < 0.01)。大鼠LVMI结果显示,与假手术组比较,模型组大鼠LVMI升高,差异有统计学意义(P < 0.01);与模型组比较,各给药组均能不同程度降低LVMI水平,差异有统计学意义(P < 0.05或P < 0.01)。见表 1。
造模后4周采用小动物超声成像技术测定其心脏左心室功能。结果表明,与假手术组比较,其余各组大鼠左心室扩张明显,室壁运动水平下降,各组大鼠EF均可见不同程度降低,差异有统计学意义(P < 0.01)。在药物干预8周后再次测定大鼠左心室功能,结果表明,与假手术组比较,模型组大鼠室壁运动能力减弱,心室活动度降低,EF仍较低,差异有统计学意义(P < 0.01);与模型组比较,各给药组大鼠EF升高,差异有统计学意义(P < 0.01)。给药8周后,卡托普利组及益气活血低、中、高剂量组大鼠EF较术后4周均有不同程度提升,差异有统计学意义(P < 0.01)。见表 2。
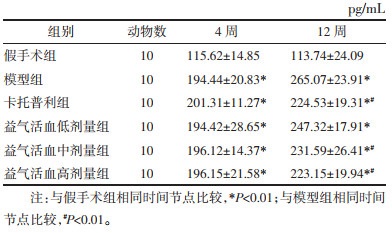
大鼠血清NT-proBNP结果表明,与假手术组比较,造模后4周各组大鼠血清NT-proBNP升高,差异有统计学意义(P < 0.01)。给药干预8周后,模型组及各给药组大鼠血清NT-proBNP水平持续上升(P < 0.01);与模型组比较,卡托普利组及益气活血中、高剂量组能够降低血清NT-proBNP水平,差异有统计学意义(P < 0.01)。见表 3。
HE染色后发现,假手术组大鼠心肌细胞形态完整,排列整齐,对应的细胞核位置正常,未见明显细胞水肿,未见炎症细胞。模型组大鼠心肌形态不完整,存在较多肿大及坏死心肌细胞,可见明显炎性细胞浸润及心肌纤维化现象。与模型组比较,卡托普利组及益气活血中、高剂量组心肌细胞完整性、心肌细胞肿大及坏死、炎症细胞浸润及心肌纤维化情况均有不同程度改善。益气活血低剂量组改善效果不明显。见图 1。
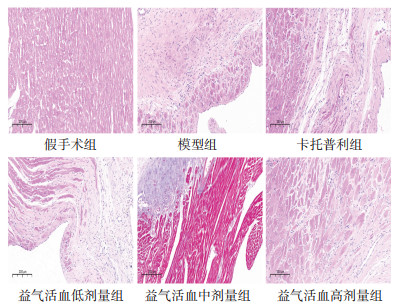
|
| 图 1 12周后各组大鼠心肌组织HE染色情况(×200) |
HE染色后发现,假手术组大鼠肾小管上皮细胞形态规则,肾小管管腔宽度正常。模型组大鼠肾小管上皮细胞排列紊乱,细胞水肿明显,肾小管管腔明显狭窄,伴有少量炎性细胞及纤维化组织。卡托普利组及益气活血中、高剂量组大鼠肾小管上皮细胞形态未见明显变化,水肿不明显,管腔狭窄程度较模型组改善,未见炎症细胞及纤维化组织。与模型组比较,益气活血低剂量组未见明显变化。见图 2。
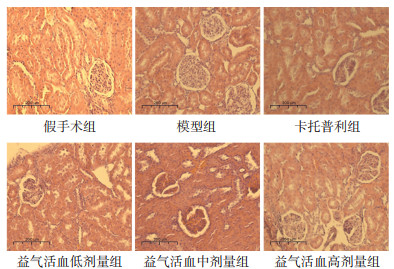
|
| 图 2 12周后各组大鼠肾脏组织HE染色情况(×200) |
免疫组织化学法统计阳性面积结果显示,各组大鼠AQP2多见于肾脏集合管部位。与假手术组比较,模型组大鼠AQP2阳性面积增加,差异有统计学意义(P < 0.01);与模型组比较,卡托普利组及益气活血各剂量组大鼠AQP2阳性面积减少,差异有统计学意义(P < 0.05或P < 0.01)。见图 3、图 4。

|
| 图 3 各组大鼠肾脏AQP2表达情况(×400) |
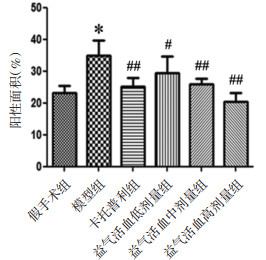
|
| 注:与假手术组比较,*P<0.01;与模型组比较,#P<0.05,##P<0.01。 图 4 各组大鼠肾脏AQP2阳性表达面积(x±s,n=10) |
免疫组织化学法统计阳性面积结果显示,各组大鼠肾脏pS256-AQP2主要表达于肾脏集合管上皮细胞附近。与假手术组比较,模型组大鼠阳性面积增加,差异有统计学意义(P < 0.01);与模型组比较,卡托普利组及益气活血各剂量组大鼠阳性面积减少,差异有统计学意义(P < 0.01)。见图 5、图 6。
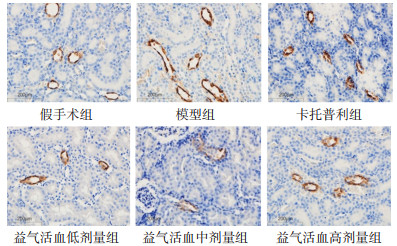
|
| 图 5 各组大鼠肾脏pS256-AQP2表达情况(×400) |
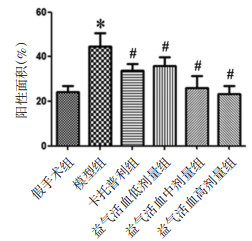
|
| 注:与假手术组比较,*P<0.01;与模型组比较,#P<0.01。 图 6 各组大鼠肾脏pS256-AQP2阳性表达面积(x±s,n=10) |
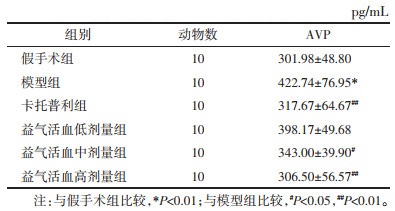
采用ELISA法检测大鼠血清中AVP水平变化,结果表明,与假手术组比较,模型组大鼠血清AVP水平上升,差异有统计学意义(P < 0.01);与模型组比较,卡托普利组及益气活血中、高剂量组大鼠血清AVP水平下降,差异有统计学意义(P < 0.05或P < 0.01)。见表 4。
采用Western Blot法检测大鼠肾脏V2R蛋白水平,结果表明,与假手术组比较,模型组大鼠肾脏V2R表达水平增加,差异有统计学意义(P < 0.01);与模型组比较,各给药组大鼠肾脏V2R表达水平降低,差异有统计学意义(P < 0.01)。见图 7。
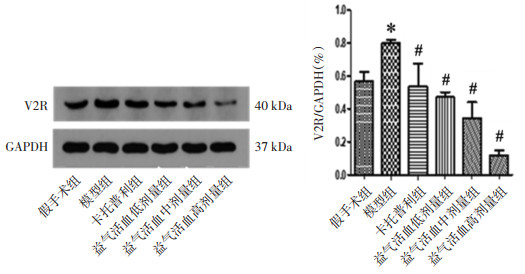
|
| 注:与假手术组比较,*P<0.01;与模型组比较,#P<0.01。 图 7 各组大鼠肾脏V2R表达情况(x±s,n=10) |
采用Western Blot法检测大鼠肾脏AQP2表达水平,结果表明,与假手术组比较,模型组大鼠肾脏AQP2表达水平上升,差异有统计学意义(P < 0.05);与模型组比较,各给药组大鼠AQP2表达水平降低,差异有统计学意义(P < 0.05或P < 0.01)。见图 8。
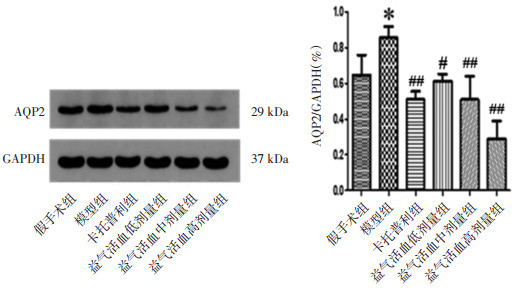
|
| 注:与假手术组比较,*P<0.05;与模型组比较,#P<0.05,##P<0.01。 图 8 各组大鼠肾脏AQP2表达情况(x±s,n=10) |
采用Western Blot法检测大鼠肾脏pS256-AQP2表达水平,结果表明,与假手术组比较,模型组大鼠肾脏pS256-AQP2表达水平上升,差异有统计学意义(P < 0.01);与模型组比较,各给药组大鼠肾脏pS256-AQP2表达水平降低,差异有统计学意义(P < 0.01)。见图 9。
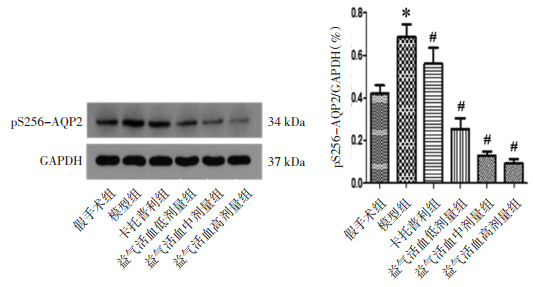
|
| 注:与假手术组比较,*P<0.01;与模型组比较,#P<0.01。 图 9 各组大鼠肾脏pS256-AQP2表达情况(x±s,n=10) |
祁含章等[10]与施琦等[11]就CVD的病理机制进行深入分析,提出了“血-脉-心-神”一体观的治疗理念,为CHF患者的治疗提供了新思路。该理论通过阴阳学说、脏腑、藏象学说相结合,全面系统地分析了疾病病理变化过程中的病机变化[12]。《素问·痿论》中提到“心主身之血脉”,即心脏主宰全身血液循环。心脏通过推动心气来促进血液流动,血液携带营养物质滋养四肢百骸,而脉络乃血液运行通道,脉道通畅则血液循环顺畅。《素问·脉要精微论》中提到:“夫脉者,血之府也。”意味着全身的血液和营气通过脉络源源不断运行,形成一个周身循环的通道。心气的推动、温煦和收摄作用使心脏能够有节律地搏动。脉管的舒张和收缩功能正常,脉道畅通,血液顺畅流动,从而滋养脏腑。如果心脏受损,心气不足,无法推动血液流动,气血不足导致血液凝滞或血液流动缓慢,无法滋养心脏,进一步导致脉络舒缩无序,心脏受损加重,心脏功能减弱,形成恶性循环。神的稳定依赖于血液滋养,如果血脉失调,心失濡养,心脏功能受损,造成心神失养,思维和意识活动便会随之减弱。反之,神志活动紊乱,五脏遭受过度刺激,导致气血紊乱,损伤血脉,心体与心神共同受病,出现焦虑、抑郁、失眠和烦躁等症状。
心力衰竭日久,五脏皆损,正气损耗,外邪易侵,病情易于反复,久病难治,阴阳两虚。《推求师意》中云:“及乎水火既济,全在阴精上承,以安其神;阳气下藏,以安其志。”另有云“五脏之伤,穷必及肾”,心本乎于肾,肾为先天之本,有资助他脏之功。肾气亏虚,不能上资于心,则心体失荣,君火失用。脾能化生水谷,滋养他脏,脾失健运,化生乏源,心体失养,痰饮内聚。水湿、痰饮、瘀血等病理产物上犯上焦,阻碍气化,出现水肿、呼吸困难等症状。故通过益气活血之法,在促进血管通畅、修复损伤、滋养心脏的同时改善CHF水潴留情况,符合中医对CHF病因病机认识[13]。
益气活血方为CHF临床治疗的常用方剂之一,其主要组分为黄芪、丹参、三七、降香,其中黄芪为君,丹参为臣,降香、三七为佐使。黄芪补益心气,在治疗时可以行血祛瘀;丹参、三七促进血液运行,同时清心除烦,对心神具有一定滋养作用;降香化瘀理气,益气活血效果显著。现代药理学研究发现,黄芪多糖干预后,小鼠同型半胱氨酸(HCY)、核转录因子-κB(NF-κB)、D-二聚体水平明显降低[14]。黄芪甲苷对大鼠肾脏转化生长因子-β1(TGF-β1)的表达水平具有一定调节作用,同时还可以促进结缔组织生长因子mRNA的表达,能够有效抑制CHF过程中的肾脏衰竭[15]。相关实验研究结果表明,三七总皂苷对CHF大鼠血清中的炎症具有一定抑制作用,有效减轻了心肌细胞的凋亡水平[16]。降香的多种组分对心肌具有保护作用,同时还能够发挥良好的抗氧化、抗凝作用,干预效果显著[16]。
AQP2为一种关键的水通道蛋白,和机体内的水液代谢密切相关。其主要分布于哺乳动物的细胞膜上,可以有效调节水分运输过程。研究表明,AQP2在肾脏的集合管中广泛表达,集合管对机体的水平衡状态具有调节作用,而水分的重吸收则主要与AVP存在相关性[17]。研究发现AVP对血浆渗透压存在一定调节作用,其主要在神经垂体中储存与释放,在机体的水液代谢中发挥多方面调节作用,并通过抗利尿激素V2R在收集导管中发挥相关调节作用。AVP对AQP2在囊泡内的移位起到促进作用。此外,其还可以增加集合管主细胞对水的通透性,提高渗透压[18]。在V2R介导的腺苷酸环化酶(ACs)刺激、环磷酸腺苷(cAMP)升高和蛋白激酶A(PKA)激活条件下,AQP2水平增加[19]。研究发现CHF初期阶段,心脏功能下降后,心脏会出现一系列代偿性变化,从而确保心输出量正常。研究发现肾素-血管紧张素-醛固酮(RASS)系统激活为主要表现,这种系统激活会导致肾小管的远曲小管对钠离子的通透性发生改变,引起体液潴留。此外,CHF患者的心输出量下降,促进AVP分泌,AVP浓度增加后,全身血管阻力随之增加,而心输出量会出现一定程度下降[20]。AVP对肾脏集合管主细胞中的V2R具有一定刺激作用,进而提高水重吸收水平,加重水潴留状态[21]。卡托普利可以抑制正常大鼠肾内髓质AQP2 mRNA的表达,同时促进肾脏内部的AQP2经尿液排出体外。故本研究采用卡托普利作为阳性药物进行干预[22]。本研究结果表明,采用益气活血方治疗后,大鼠血清AVP水平明显下降,肾脏中V2R受体水平降低,从而降低了肾脏对水的重吸收作用,改善了CHF大鼠的水潴留情况,且与应用卡托普利相比疗效相当。
研究发现,AQP2羧基末端的丝氨酸256位点是PKA磷酸化的特异性位点,可以促进AQP2聚合至细胞表面。实验研究表明,电子显微镜下观察到pS256-AQP2在细胞膜和细胞内的小泡中均存在一定表达,也反映出在正常AVP表达水平下,AQP2同样在丝氨酸256位点发生磷酸化,且借此发挥相关作用[23]。由此也反映出丝氨酸256位点对于AQP2发挥其功能具有显著影响,也决定了AQP2的转运结果。另有研究表明,益气活血类方药能够有效改善CHF大鼠心脏功能,降低肾脏组织AQP2表达水平[24]。应用芪苈强心胶囊同样能够改善CHF大鼠的心功能及AQP2表达水平[25]。对比上述研究,本研究结果明确了益气活血方中黄芪、丹参、降香、三七配伍对于CHF大鼠肾脏功能障碍的调节作用。益气活血方对CHF大鼠进行干预后,其肾脏AQP2、pS256-AQP2水平下降,明确了益气活血方的干预可以对AQP2在肾脏的表达进行有效调节,其机制可能是通过降低磷酸化水平促使其转移至肾集合管细胞膜,从而有效降低水的重吸收水平。本研究为应用“血-脉-心-神”一体观理论辨治CHF提供了证据支持,同时为益气活血法的方药治疗CHF提供了新的潜在通路及干预靶点。
| [1] |
HEIDENREICH P. Heart failure management guidelines: new recommendations and implementation[J]. Journal of Cardiology, 2024, 83(2): 67-73. DOI:10.1016/j.jjcc.2023.10.009 |
| [2] |
SAVARESE G, BECHER P M, LUND L H, et al. Global burden of heart failure: a comprehensive and updated review of epidemiology[J]. Cardiovascular Research, 2023, 118(17): 3272-3287. DOI:10.1093/cvr/cvac013 |
| [3] |
COSTANZO M R. The cardiorenal syndrome in heart failure[J]. Heart Failure Clinics, 2020, 16(1): 81-97. DOI:10.1016/j.hfc.2019.08.010 |
| [4] |
MCCALLUM W, TESTANI J M. Updates in cardiorenal syndrome[J]. The Medical Clinics of North America, 2023, 107(4): 763-780. DOI:10.1016/j.mcna.2023.03.011 |
| [5] |
PACKER M, WILCOX C S, TESTANI J M. Critical analysis of the effects of SGLT2 inhibitors on renal tubular sodium, water and chloride homeostasis and their role in influencing heart failure outcomes[J]. Circulation, 2023, 148(4): 354-372. DOI:10.1161/CIRCULATIONAHA.123.064346 |
| [6] |
何晓腾, 张艳, 张伟, 等. 基于"肾藏精主水"理论探析慢性心衰与水通道蛋白的相关性[J]. 实用中医内科杂志, 2024, 38(3): 19-21. |
| [7] |
杨柳枝, 戴小华, 许小松. 益气温阳活血利水法联合西医常规方法治疗慢性心衰合并顽固性水肿临床研究[J]. 中医药临床杂志, 2024, 36(2): 333-337. |
| [8] |
孙恒, 邢作英, 徐晓燕, 等. 基于NT-proBNP探究益气活血法治疗冠心病心力衰竭(气虚血瘀证)临床疗效的相关影响因素[J]. 时珍国医国药, 2023, 34(9): 2160-2164. DOI:10.3969/j.issn.1008-0805.2023.09.28 |
| [9] |
李博玉, 戈志华, 封亚丽, 等. 补肾益气活血汤治疗心肾气虚血瘀型慢性心力衰竭的疗效观察[J]. 中医药学报, 2023, 51(9): 82-86. |
| [10] |
祁含章, 施琦, 严志鹏, 等. 基于"血-脉-心-神"一体观论治慢性心力衰竭[J]. 中华中医药杂志, 2023, 38(8): 3703-3706. |
| [11] |
施琦, 漆仲文, 严志鹏, 等. 基于"病-证-时"理念辨治冠心病的证治初探[J]. 中华中医药杂志, 2023, 38(3): 1147-1150. |
| [12] |
谢盈彧, 方子寒, 李渊芳, 等. 国医大师阮士怡运用育心保脉理论辨治心力衰竭经验[J]. 中国中西医结合杂志, 2020, 40(11): 1388-1391. DOI:10.7661/j.cjim.2020.0212.002 |
| [13] |
张傲, 漆仲文, 王铭扬, 等. 张军平谨守病机顺应四时方证辨治慢性心力衰竭[J]. 中医学报, 2021, 36(12): 2602-2605. |
| [14] |
吴雍真, 李倩, 管连城, 等. 黄芪多糖调节维生素D/p38MAPK/ERK信号通路改善庆大霉素致肾小管上皮细胞损伤的机制[J]. 时珍国医国药, 2021, 32(10): 2312-2315. DOI:10.3969/j.issn.1008-0805.2021.10.02 |
| [15] |
WANG F C, HUANG S Y, CHEN Q G, et al. Chemical characterisation and quantification of the major constituents in the Chinese herbal formula Jian-Pi-Yi-Shen pill by UPLC-Q-TOF-MS/MS and HPLC-QQQ-MS/MS[J]. Phytochem Analysis, 2020, 31(6): 915-929. DOI:10.1002/pca.2963 |
| [16] |
LIU J J, WANG Y T, QIU L, et al. Saponins of Panax notoginseng: chemistry, cellular targets and therapeutic opportunities in cardiovascular diseases[J]. Expert Opin Investig Drugs, 2014, 23(4): 523-539. DOI:10.1517/13543784.2014.892582 |
| [17] |
QIU Z W, JIANG T, LI Y J, et al. Aquaporins in urinary system[J]. Advances in Experimental Medicine and Biology, 2023, 139(8): 155-177. |
| [18] |
ZHAO X D, LIANG B E, LI C L, et al. Expression regulation and trafficking of aquaporins[J]. Advances in Experimental Medicine and Biology, 2023, 139(8): 39-51. |
| [19] |
XU C M, YI X L, TANG L, et al. Differential regulation of autophagy on urine-concentrating capability through modulating the renal AQP2 expression and renin-angiotensin system in mice[J]. American Journal of Physiology. Renal Physiology, 2023, 325(4): 503-518. DOI:10.1152/ajprenal.00018.2023 |
| [20] |
MANOLIS A A, MANOLIS T A, MANOLIS A S. Neurohumoral activation in heart failure[J]. International Journal of Molecular Sciences, 2023, 24(20): 15472-15477. DOI:10.3390/ijms242015472 |
| [21] |
CHRIST-CRAIN M, GAISL O. Diabetes insipidus[J]. Presse Medicale, 2021, 50(4): 1040-1049. |
| [22] |
TAN C J, ZENG J, WU G, et al. Xinshuitong Capsule extract attenuates doxorubicin-induced myocardial edema via regulation of cardiac aquaporins in the chronic heart failure rats[J]. Biomed Pharmacother, 2021, 144(11): 1122-1126. |
| [23] |
CHEUNG P W, BOUKENNA M, BABICZ R S E, et al. Intracellular sites of AQP2 S256 phosphorylation identified using inhibitors of the AQP2 recycling itinerary[J]. American Journal of Physiology-Renal Physiology, 2023, 324(2): 152-167. DOI:10.1152/ajprenal.00123.2022 |
| [24] |
孔繁达, 张艳, 朱爱松, 等. 补肾活血方对慢性心力衰竭大鼠心功能及肾组织水通道蛋白2的影响[J]. 中医杂志, 2019, 60(6): 522-526. |
| [25] |
张健, 崔向宁, 曹戬. 芪苈强心胶囊对改善慢性心力衰竭大鼠心功能及AQP-2表达的影响[J]. 中国实验方剂学杂志, 2014, 20(10): 183-187. |
 2024, Vol. 43
2024, Vol. 43