文章信息
- 黄成硕, 林娴, 陈驹, 郑锦畅, 梁振, 郭伟雄, 陈继铭
- HUANG Chengshuo, LIN Xian, CHEN Ju, ZHENG Jinchang, LIANG Zhen, GUO Weixiong, CHEN Jiming
- 基于STING/NF-κB信号通路探讨蓟黄素对小鼠类风湿性关节炎的影响
- The effect of cirsimaritin on rheumatoid arthritis in mice based on STING/NF-κB signaling pathway
- 天津中医药大学学报, 2024, 43(11): 987-991
- Journal of Tianjin University of Traditional Chinese Medicine, 2024, 43(11): 987-991
- http://dx.doi.org/10.11656/j.issn.1673-9043.2024.11.05
-
文章历史
收稿日期: 2024-05-05
2. 广东医科大学附属医院超声医学科, 湛江 524001;
3. 广东医科大学附属医院药学部, 湛江 524001
2. Department of Ultrasound Medicine Center, Affiliated Hospital of Guangdong Medical University, Zhanjiang 524001, China;
3. Department of Pharmacy, Affiliated Hospital of Guangdong Medical University, Zhanjiang 524001, China
类风湿性关节炎(RA)是一种慢性全身性自身免疫性疾病,其特征是进行性关节破坏、骨侵蚀、滑膜增生、免疫细胞浸润和炎症因子产生[1-2]。RA的发病机制尚未完全阐明,可能涉及炎症、免疫等[3]。目前RA的药物治疗包括糖皮质激素、传统的非甾体抗炎药和新的生物制剂[4-6]。大多数RA患者在使用上述药物治疗后可以达到临床缓解,而约30%的RA患者仍会受到当前治疗的不良影响[7]。甲氨蝶呤作为临床上最常用的抗RA药物,长期服用具有肝毒性。因此,仍然有必要为RA寻找新的治疗方法。
蓟黄素属于菊科蓟属草本植物中的黄酮类化合物。其药理活性多样,如抗炎、抗氧化、免疫调节、抗病毒、抗抗菌、肿瘤等,研究价值较高。有研究发现蓟黄素可通过下调NF-κB信号转导途径抑制甲型流感病毒复制。基于上述证据,设想蓟黄素可否通过影响STING/NF-κB信号通路改善RA?目前也尚未有相关研究报道。本研究拟通过胶原免疫法建立小鼠RA模型,探讨蓟黄素对RA的影响。
1 材料 1.1 动物40只雌性C57BL/6小鼠购自辽宁长生生物技术股份有限公司,适应性培养1周,即8周龄(20~25 g)时用于实验。动物合格证号:SCXK(辽)2021-0005。实验方案经广东医科大学动物实验伦理委员会批准,伦理批准号:GDMU-2022-000715。
1.2 仪器SL-M200酶标仪购于深圳市三莉科技有限公司;XRS-3398电脑全自动石蜡切片机购于北京西润斯仪器仪表有限公司;DYCZ24DN电泳仪购于北京六一生物科技有限公司。
1.3 药物与试剂蓟黄素(≥98%,四川省维克奇生物科技有限公司,批号:20210216);甲氨蝶呤片(德国SANDOZ公司,规格:2.5 mg/片,批号:HK36225);肿瘤坏死因子α(TNF-α)、白细胞介素1β(IL-1β)、白细胞介素6(IL-6)和白细胞介素10(IL-10)ELISA检测试剂盒(武汉华美生物工程有限公司,批号分别为CSB-E04741,CSB-E08054,CSB-E04639和CSB-E04594);超氧化物歧化酶(SOD)和丙二醛(MDA)检测试剂盒(南京建成生物工程研究所,批号分别为20220916和20220918);干扰素基因刺激因子(STING)、p-NF-κB p65和NF-κB单抗(Cell Signaling Technology公司,批号分别为20210212、20220123和20210325)。
2 方法 2.1 分组与给药所有小鼠随机分为4组,每组10只,分别为空白对照组(Sham)、模型组(CIA)、甲氨蝶呤组(MTX,1 mg/kg)和蓟黄素组(JHS,100 mg/kg)。其中CIA组、MTX组和JHS组小鼠经异氟烷麻醉后采用多点(尾根部和背部)注射牛Ⅱ型胶原蛋白乳化剂诱导关节炎(CIA)小鼠模型,而空白对照组小鼠注射等量生理盐水。CIA造模成功后,MTX组小鼠灌胃给予甲氨蝶呤,给药剂量为1 mg/kg,JHS组小鼠灌胃给予蓟黄素,给药剂量为100 mg/kg,每周给药1次,连续给药4周。
2.2 小鼠CIA模型的建立所有实验操作均在SPF级环境中进行,参照文献[8]CIA造模方法进行造模,具体步骤如下:首先5%异氟烷麻醉小鼠,牛Ⅱ型胶原蛋白乳化剂共免疫小鼠2次。将牛Ⅱ型胶原蛋白乳化剂(100 μg)分别于小鼠尾根部以及背部进行多点皮内注射诱导首次免疫。于首次免疫的第21 d,再次将同样剂量的牛Ⅱ型胶原蛋白乳化剂分别于小鼠尾根部以及背部进行多点皮内注射以加强免疫。
2.3 取材给药4周后,对小鼠的后爪进行拍照,小鼠摘眼球取血,常温静置1 h,3000 r/min离心15 min,离心半径87 mm,分离血清,-20 ℃保存,待测,分离左右膝关节,左侧膝关节于10%中性甲醛浸泡保存,右侧膝关节保存于-80 ℃冰箱。
2.4 膝关节形态学观察取小鼠左侧膝关节,10%多聚甲醛中常温固定过夜,0.5 M EDTA-PBS溶液(pH7.8)常温脱钙14 d,流水冲洗过夜,70%~100%酒精梯度脱水,二甲苯透明5 min,石蜡包埋,切片,厚度为6 μm,随后对切片进行苏木精-伊红染色,显微镜下观察拍照。
2.5 血清炎症因子和氧化应激损伤相关指标水平检测取小鼠血清,根据试剂盒说明书检测步骤,分别检测各组小鼠血清中TNF-α、IL-1β、IL-6、IL-10、MDA水平和SOD活性。
2.6 免疫荧光法观察膝关节STING/NF-κB通路关键蛋白表达水平免疫荧光法分别检测STING、p-NF-κB p65和NF-κB p65水平,膝关节石蜡切片后分别经二甲苯、70%乙醇、90%乙醇、无水乙醇和纯化水水化后,使用0.5% TritonX-100溶液通透15 min,PBS洗片3次,2 min/次,1%牛血清白蛋白37 ℃封闭2 h,不洗,7 ℃冰箱中孵育一抗STING(1:1 000)、p-NF-κB p65(1:1 000)和NF-κB(1:1 000),PBS洗片3次,2 min/次,荧光标记二抗(1:300)室温孵育30 min,中性树胶封片后,共聚焦荧光显微镜下观察并拍照。
2.7 Western blot检测STING/NF-κB通路关键蛋白表达水平取右侧膝关节,液氮下研磨成粉末,使用骨组织蛋白提取试剂盒提取总蛋白,BCA试剂盒检测其含量,每孔加入50 μg蛋白并进行SDS-PAGE电泳。将蛋白质印迹在硝化纤维素滤膜上。将膜在室温下放入5%脱脂奶粉中封闭2 h。随后,将膜分别与一抗STING(1:3 000)、p-NF-κB p65(1:2 000)和NF-κB(1:3 000)4 ℃冰箱孵育过夜。TBST洗涤3次后,将膜与二抗(1:5 000)在室温下孵育2h。TBST洗涤3次后,使用超灵敏ECL化学发光试剂曝光,用Image J软件进行分析。
2.8 统计学方法计量资料均以均数±标准差(x±s)表示。使用GraphPad Prism 5进行统计分析。通过SPSS 11软件中的单因素方差分析(ANOVA)评估各组之间的差异。以P<0.05为差异具有统计学意义。
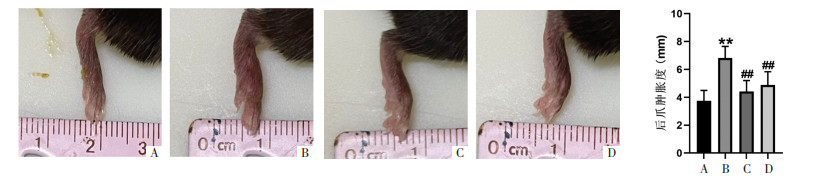
3 结果 3.1 蓟黄素对CIA小鼠后爪肿胀度的影响与Sham组比较,CIA组小鼠后爪肿胀度明显升高(P < 0.01),见图 1A和1B;与CIA组比较,MTX组和JHS组小鼠后爪肿胀度明显降低(P < 0.01),见图 1B、1C和1D。
|
| 注:A,Sham组;B,CIA组;C,MTX组;D,JHS组。与Sham组比较,**P < 0.01,与CIA组比较,##P < 0.01。 图 1 各组小鼠后爪肿胀水平(n=10,x±s) |
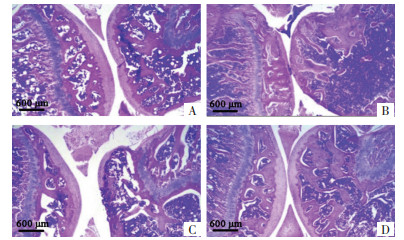
与Sham组相比,CIA组小鼠膝关节出现了明显的病理学变化,包括炎症细胞浸润增多、软骨组织损伤加重。给予甲氨蝶呤和蓟黄素干预后,炎症细胞浸润明显减少,软骨组织损伤减轻,见图 2。
|
| 注:A,Sham组;B,CIA组;C,MTX组;D,JHS组。 图 2 各组小鼠膝关节病理学变化(×10) |
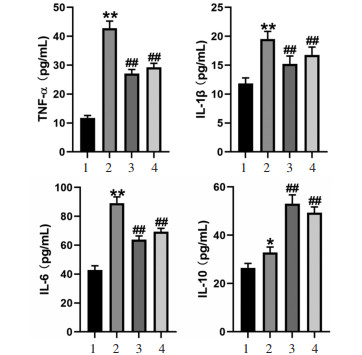
与Sham组比较,CIA组小鼠血清TNF-α、IL-1β、IL-6和IL-10水平明显升高(P < 0.05);与CIA组比较,MTX组和JHS组小鼠血清TNF-α、IL-1β和IL-6水平明显降低(P < 0.01),而IL-10水平明显升高(P < 0.01),见图 3。
|
| 注:A,各组小鼠血清TNF-α水平;B,各组小鼠血清IL-1β水平;C,各组小鼠血清IL-6水平;D,各组小鼠血清IL-10水平。1,Sham组;2,CIA组;3,MTX组;4,JHS组。与Sham组比较,*P < 0.05,**P < 0.01,与CIA组比较,##P < 0.01。 图 3 各组小鼠血清TNF-α、IL-1β、IL-6和IL-10水平(x±s) |
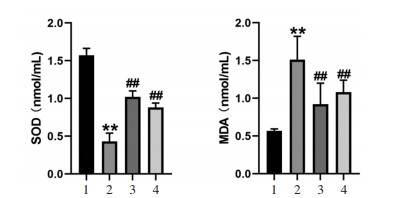
与Sham组比较,CIA组小鼠血清SOD活性明显降低,而MDA水平明显升高(P < 0.01);与CIA组比较,E2组和FL组小鼠血清SOD活性明显升高,而MDA水平明显降低(P < 0.01),见图 4。
|
| 注:A,各组小鼠血清SOD水平;B,各组小鼠血清MDA水平。1,Sham组;2,CIA组;3,MTX组;4,JHS组。与Sham组比较,**P < 0.01,与CIA组比较,##P < 0.01。 图 4 各组小鼠血清SOD和MDA水平(x±s) |
与Sham组比较,CIA组小鼠膝关节STING和NF-κB p65表达水平明显升高(P < 0.01);与CIA组比较,E2组和FL组小鼠膝关节STING和NF-κB p65表达水平明显降低(P < 0.01),见图 5。

|
| 注:A-D,STING免疫荧光图;E-H,NF-κB p65免疫荧光图;I-L,DAPI免疫荧光图;M-P分别为A-D与I-L的合并图;Q-T分别为E-H与I-L的合并图;A、E和I为Sham组;B、F和J为CIA组;C、G和K为MTX组;D、H和L为JHS组;×20。1,Sham组;2,CIA组;3,MTX组;4,JHS组。与Sham组比较,**P < 0.01,与CIA组比较,##P < 0.01。 图 5 各组小鼠膝关节STING和NF-κB p65表达水平(x±s) |
与Sham组比较,OVX组小鼠股骨STING和p-NF-κB p65/NF-κB蛋白表达水平明显升高(P < 0.01);与OVX组比较,E2组和FL组小鼠股骨STING和p-NF-κB p65/NF-κB蛋白表达水平明显降低(P < 0.01),见图 6。

|
| 注:1,Sham组;2,CIA组;3,MTX组;4,JHS组。与Sham组比较,**P < 0.01,与CIA组比较,#P < 0.05,##P < 0.01。 图 6 各组小鼠膝关节STING和NF-κB p65蛋白表达水平(x±s) |
RA属于病因不明的自身免疫性疾病,其发病率以及致残率相当高,对人类的健康和生活质量有严重影响。虽然其发病机制尚未不清楚,然而炎症、氧化应激损伤以及免疫与RA发病密切相关。胶原免疫法诱导的小鼠CIA模型具有造模快、易于操作、稳定和成本低等优点,广泛应用在RA研究的动物模型[9]。本实验中发现小鼠CIA造模后,后爪肿胀度明显升高,膝关节炎症细胞浸润增多、软骨组织损伤加重,血清TNF-α、IL-1β、IL-6、IL-10和MDA水平明显降低,而SOD活性明显增加,提示CIA小鼠模型建立成功。
蓟黄素是菊科蓟属草本植物中的一种黄酮类化合物。其药理活性多样,如抗炎、抗氧化、免疫调节、抗病毒、抗抗菌、肿瘤等,研究价值较高。然而,其对RA的作用目前尚不清楚。本研究发现蓟黄素可明显改善牛Ⅱ型胶原蛋白诱导CIA模型的病理症状,如降低后爪肿胀度,减少膝关节炎症细胞浸润以及减轻软骨组织损伤。此外,蓟黄素还可降低小鼠CIA模型血清炎症因子和氧化应激损伤相关指标水平,提示蓟黄素可通过抗炎抗氧化应激作用抑制RA的发生发展。STING是哺乳动物细胞质DNA传感通路的核心成分。STING通过激活下游因子NF-κB,促进下游炎症因子的表达,从而发挥促炎作用。提示STING/NF-κB信号通路可能在RA的发生发展中发挥重要作用。虽然NF-κB信号通路已被表明是影响RA发生发展的关键机制。然而STING/NF-κB信号通路对RA的作用知之甚少。我们研究发现牛Ⅱ型胶原蛋白可诱导小鼠膝关节STING和p-NF-κB p65/NF-κB蛋白表达水平明显升高,而给予蓟黄素干预后,STING和p-NF-κB p65/NF-κB蛋白表达水平明显降低,提示蓟黄素通过调控STING/NF-κB信号通路,减去炎症,从而改善RA。
综上所述,蓟黄素通过调控STING/NF-κB信号通路改善炎症和氧化应激损伤,从而改善RA。
| [1] |
ZUO Y H, XU H H, LI Y X, et al. Hsa_circ_0007707 participates in PDE3B-mediated apoptosis inhibition and inflammation promotion in fibroblast-like synoviocytes[J]. International Immunopharmacology, 2023, 119: 110157. DOI:10.1016/j.intimp.2023.110157 |
| [2] |
SMOLEN J S, ALETAHA D, MCINNES I B. Rheumatoid arthritis[J]. Lancet, 2016, 388(10055): 2023-2038. DOI:10.1016/S0140-6736(16)30173-8 |
| [3] |
RADU A F, BUNGAU S G. Management of rheumatoid arthritis: An overview[J]. Cells, 2021, 10(11): 2857. DOI:10.3390/cells10112857 |
| [4] |
LU Y Z, ZHOU J L, WANG Q M, et al. Glucocorticoid-loaded pH/ROS dual-responsive nanoparticles alleviate joint destruction by downregulating the NF-κB signaling pathway[J]. Acta Biomaterialia, 2023, 164: 458-473. DOI:10.1016/j.actbio.2023.04.012 |
| [5] |
STREHL C, VAN DER GOES M C, BIJLSMA J W J, et al. Glucocorticoid-targeted therapies for the treatment of rheumatoid arthritis[J]. Expert Opinion on Investigational Drugs, 2017, 26(2): 187-195. DOI:10.1080/13543784.2017.1276562 |
| [6] |
NAWAZ H, ALI A, REHMAN T, et al. Chronological effects of non-steroidal anti-inflammatory drug therapy on oxidative stress and antioxidant status in patients with rheumatoid arthritis[J]. Clinical Rheumatology, 2021, 40(5): 1767-1778. DOI:10.1007/s10067-020-05438-0 |
| [7] |
LANGBOUR C, RENE J, GOUPILLE P, et al. Efficacy of Janus kinase inhibitors in rheumatoid arthritis[J]. Inflammation Research, 2023, 72(5): 1121-1132. DOI:10.1007/s00011-023-01717-z |
| [8] |
张慧杰, 柴立民, 刘娟, 等. 基于JAK/STAT信号通路探讨红茴香注射液对类风湿关节炎小鼠的作用机制[J]. 北京中医药大学学报, 2022, 45(3): 267-274. |
| [9] |
乌日力嘎, 乌兰其其格, 呼日乐巴根, 等. 类风湿关节炎大小鼠动物模型研究进展[J]. 中国医药导报, 2023, 20(20): 69-72. |
 2024, Vol. 43
2024, Vol. 43




