文章信息
- 邱先哲, 黄晨瑶, 李彩霞, 张淑坤, 崔立华, 李雯雯, 刘国敬, 齐育麟, 张晗, 李琳, 李玉红
- QIU Xianzhe, HUANG Chenyao, LI Caixia, ZHANG Shukun, CUI Lihua, LI Wenwen, LIU Guojing, QI Yulin, ZHANG Han, LI Lin, LI Yuhong
- 宣肺败毒方调控TLR4/NLRP3/Caspase1信号通路抗小鼠急性肺损伤的作用机制研究
- Mechanism of Xuanfei Baidu Decoction to improve ALI mice by regulating TLR4/NLRP3/Caspase1 signaling pathway
- 天津中医药大学学报, 2024, 43(11): 992-999
- Journal of Tianjin University of Traditional Chinese Medicine, 2024, 43(11): 992-999
- http://dx.doi.org/10.11656/j.issn.1673-9043.2024.11.06
-
文章历史
收稿日期: 2024-05-03
2. 天津市南开医院, 天津 300193;
3. 天津中医药大学 组分中药国家重点实验室, 天津 301617
2. Tianjin Nankai Hospital, Tianjin 300193, China;
3. Tianjin University of Traditional Chinese Medicine, State Key Laboratory of Component-based Chinese Medicine, Tianjin 301617, China
急性肺损伤(ALI)/急性呼吸窘迫综合征(ARDS)是一种发病率和死亡率都很高的严重临床综合征[1-2]。研究表明其由直接或间接损伤引起肺部高炎症反应,破坏肺实质细胞并显著降低肺功能[3]。尽管目前的治疗可以改善ALI/ARDS症状,但仍伴有长期后遗症,比如认知障碍、心理疾病、肺功能不全等[2]。因此,亟须安全有效的ALI/ARDS治疗策略。
ALI/ARDS的临床病症表现为肺泡水肿、炎症细胞过度浸润和弥漫性肺间质[3]。因此,炎症在ALI中起关键作用[4]。细胞焦亡是一种新发现的程序性细胞死亡形式,与炎症反应密切相关,也被称为继发性坏死[5]。研究表明:细胞焦亡也是ALI/ARDS组织损伤的主要机制[6]。该过程主要涉及三个关键途径:典型的炎症小体诱导途径、非典型炎症小体诱导途径,以及与GSDM相关的诱导途径[5]。最近的研究表明天然药物可以通过抑制炎症小体活化诱导的焦亡从而缓解ALI[6-8]。综上所述,抑制细胞过度焦亡是改善ALI的一种有效方案。
宣肺败毒方(XFBD)是张伯礼院士和刘清泉教授根据抗疫一线用药经验,结合现代药理学研究拟定的中药方剂,多篇报道指出,XFBD在脂多糖(LPS)和IgG免疫复合物(IgG-IC)诱导的肺损伤中具有抗炎作用,可降低炎症因子的表达以及减少炎症细胞的浸润,进而改善ALI[4-5],但其抗炎机制是否与TLR4/NLRP3 /Caspase1信号通路有关尚未见报道。本研究采用IgG-IC构建小鼠ALI模型,基于TLR4/NLRP3/Caspase1信号通路探讨XFBD抗小鼠ALI的作用及机制。
1 材料与方法 1.1 实验动物北京维通利华实验动物技术有限公司提供的60只SPF级C57BL/6小鼠,6~8周龄,许可证号SCXK(京)2021-0006。
所有动物饲养于室温20~25 ℃、湿度40%~70%的环境中,分笼饲养,定期更换鼠笼垫料以保持清洁。每天光照采用12 h黑白交替循环,小鼠自由摄食与饮水,适应性饲养1周后开始实验。在实验操作过程中,所有动物均严格遵守天津中医药大学实验动物伦理委员会的准则(TCM-LAEC2023165)。
1.2 实验试剂XFBD由天津现代中医药创新中心提供;牛血清白蛋白(BSA)和兔抗BSA IgG抗体购自美国Sigma公司;乳酸脱氢酶(LDH)试剂盒购自苏州格锐思生物科技有限公司;白介素-1β(IL-1β)(ab9722)抗体购自英国Abcam公司和NOD样受体热蛋白结构域相关蛋白3(NLRP3)(NBP2-12446SS)抗体购自美国Novus Biologicals公司、凋亡相关斑点样蛋白(ASC)(A22046)和白介素-18(IL-18)(A20473)抗体购自武汉爱博泰克生物科技有限公司、半胱氨酸蛋白酶-1(Caspase1)(YP-Ab-00584)和消皮素D(GSDMD)(YP-Ab-12523)抗体购自深圳市优品生物科技有限公司;闭锁连接蛋白1(ZO-1)(61-7300)和闭合蛋白(Occludin)(71-1500)抗体抗体购自美国Invitrogen公司、β-actin抗体购自美国Santa Cruz Biotechnology公司。细胞/组织总RNA提取试剂盒(19221ES50)、逆转录试剂盒(11141ES60)、扩增试剂盒(11184ES08)和PAGE凝胶快速制备试剂盒(20325ES62)购自上海翌圣生物科技股份有限公司。
1.3 实验仪器酶标仪(Tecan公司);实时定量PCR系统和蛋白电泳系统(美国BIO-RAD公司);超敏多功能成像仪成像(美国General Electric公司)。
1.4 实验方法 1.4.1 动物分组、造模及给药将小鼠按体质量随机分为正常组、模型组、XFBD低剂量组(XFBD 4 g/kg组)和高剂量组(XFBD 8 g/kg组)。
IgG-IC诱导的ALI小鼠模型参考文献方法建立[9]。
气管滴注:用1.5%三溴乙醇腹腔注射麻醉小鼠,脱去小鼠前颈部毛发。将麻醉好的小鼠仰卧固定于手术板上,取颈部正中作约1 cm左右切口,钝性逐层分离,暴露气管。将手术板抬起形成45°倾斜角,小鼠头部在上尾部在下,同时在环状软骨上方将注射器插入气管,把预留的150 μL气体和生理盐水或兔抗BSA IgG抗体逐滴注入小鼠肺部;左右旋转手术板使液体向两肺扩散。
尾静脉注射:用酒精棉球擦拭小鼠尾静脉,直至尾静脉清晰显现出来,接着向静脉内注射生理盐水或50 mg/kg BSA。随后将小鼠侧躺放置于加热垫,直至清醒行动恢复。
待小鼠恢复正常活动后给药。XFBD的给药剂量参考人临床用量换算,即XFBD低剂量组给予4 g/kg,XFBD高剂量组给予8 g/kg,其余各组给予同等体积的净化水,单次给药。给药后禁食12 h,摘眼球取血于1.5 mL EP管中,离心,取上清-80 ℃保存,取肺组织,称重,拍照,将组织放于-80 ℃保存或4%多聚甲醛溶液中固定。
1.4.2 苏木素-伊红(HE)染色肺组织样本在4%多聚甲醛中浸泡48 h后,常规脱水、包埋、切片、HE染色,病理切片显微镜观察各组小鼠肺组织病理学变化。
1.4.3 免疫组织化学法(IHC)取包埋好的组织石蜡块,脱蜡至水,修复抗原,阻断内源性过氧化物酶,分别加入一抗TLR4(1∶200)、NLRP3(1∶200)和GSDMD(1∶200)抗体,加反应增强液,增强酶标聚合物,DAB显色,苏木素复染细胞核、脱水透明封片。
苏木素染细胞核为蓝色,DAB显出的阳性表达为棕黄色。
1.4.4 LDH测定按照试剂盒说明书提取组织,并进行检测,测定LDH释放量。
1.4.5 荧光定量PCR按照试剂盒说明书,提取肺组织中总RNA。测定RNA浓度后反转录为cDNA,按三步法设定扩增程序进行扩增,以GAPDH作为内参。实时荧光定量PCR扩增的结果用2-ΔΔCt表示。
1.4.6 Western blot提取小鼠肺组织总蛋白,并进行BCA蛋白定量,上样电泳后湿法转膜,PVDF膜用脱脂奶粉封闭2 h,洗膜后浸泡于一抗中孵育过夜。次日洗膜后,将PVDF膜用相应二抗室温孵育1.5 h。PVDF膜浸润在ECL液中,采用超敏多功能成像仪成像,并使用Image J与Gelpro32软件对蛋白条带进行分析计算蛋白的相对表达水平。
1.4.7 统计学分析采用GraphPad Prism 8.0.1软件进行统计学分析。实验数据以均数±标准差(x±s)表示。对数据进行正态性检验,若服从正态分布,两组间比较采用独立t检验(Student’s t test),多组间比较采用单因素方差分析(One-way ANOVA);若不符合正态性检验即采用非参数检验(Kruskal-Wallis秩和检验)。以P<0.05为差异有统计学意义。
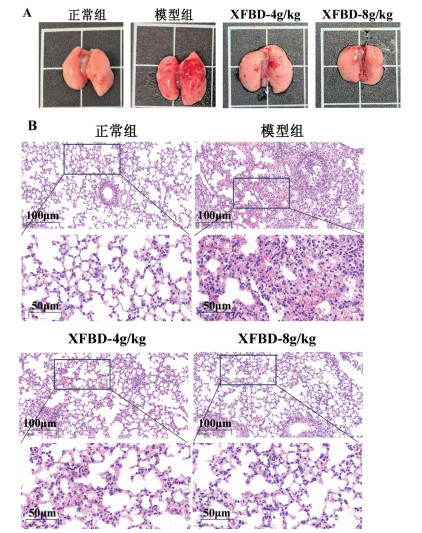
正常组小鼠肺组织形态正常,外表光滑,颜色淡红;与正常组小鼠相比,模型组小鼠肺组织体积较大,表面密布严重出血点;与模型组小鼠相比,XFBD 4 g/kg和8 g/kg组小鼠肺组织出血点减少,颜色浅红,见图 1A。与正常组相比,模型组小鼠肺组织炎症细胞浸润、肺泡出血以及肺泡间隔增厚;与模型组相比,XFBD 4 g/kg和8 g/kg组肺组织炎症细胞浸润减少以及肺泡出血减少,见图 1B。
|
| 注:A,各组小鼠肺组织外观图;B,各组小鼠肺组织病理学变化HE染色结果(200×、500×)。 图 1 XFBD对ALI小鼠肺组织病理形态的影响。 |
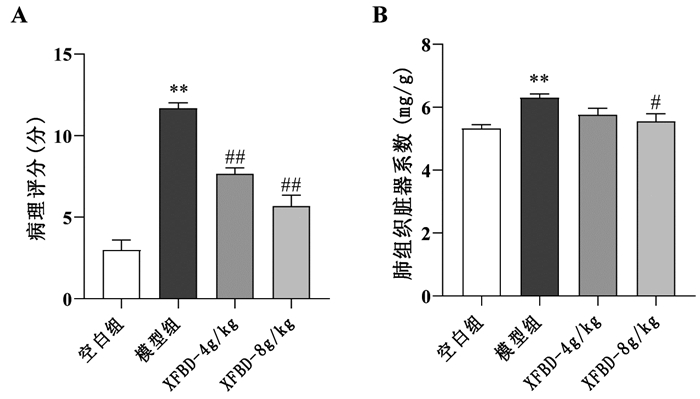
与正常组相比,模型组小鼠肺组织病理评分和脏器系数增加(P<0.01);与模型组相比,XFBD 4 g/kg和8 g/kg组显著逆转肺组织病理评分和脏器系数(P<0.05或P<0.01),见图 2。
|
| 注:A,肺组织病理评分;B,肺组织脏器系数。与正常组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01。 图 2 XFBD对ALI小鼠肺组织病理评分和脏器系数的影响(x±s,n≥3) |
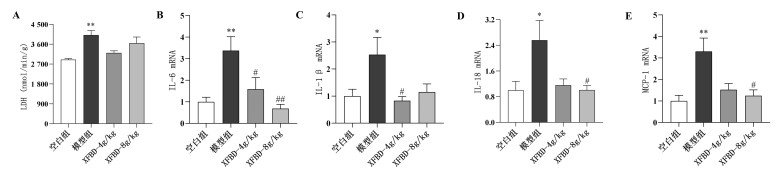
与正常组相比,模型组小鼠肺组织LDH含量显著增加(P<0.01),细胞因子如IL-6、IL-1β、IL-18及MCP-1基因mRNA表达升高(P<0.05或P<0.01);与模型组相比,XFBD 4 g/kg和8 g/kg可降低肺组织LDH含量,且IL-6、IL-1β、IL-18及MCP-1表达显著降低(P<0.05或P<0.01),见图 3。
|
| 注:A,肺组织LDH含量;B-E,肺组织细胞因子相对表达量。与正常组比较,*P<0.05,**P<0.01;与模型组比较,#P<0.05,##P<0.01。 图 3 XFBD对ALI小鼠肺组织中LDH、炎症因子的影响(x±s,n≥6) |
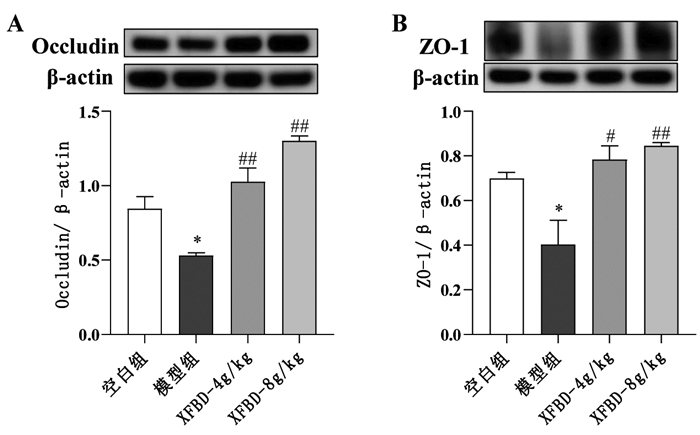
WB结果显示,与正常组相比,模型组小鼠肺组织Occludin和ZO-1蛋白表达下降,差异具有统计学意义(P<0.05);与模型组相比,XFBD 4 g/kg和8 g/kg显著升高Occludin和ZO-1蛋白表达水平(P<0.05或P<0.01),见图 4。
|
| 注:A,Occludin蛋白表达;B,ZO-1蛋白表达。与正常组比较,*P<0.05;与模型比较,#P<0.05,##P<0.01。 图 4 XFBD对ALI小鼠肺组织屏障保护的影响(x±s,n=3) |
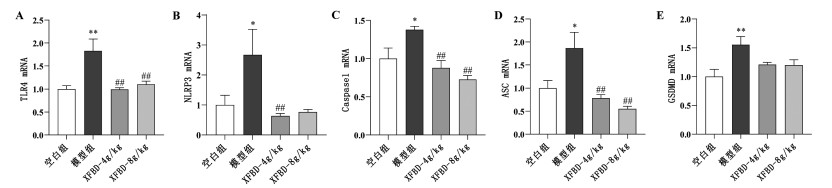
与正常组相比,模型组小鼠肺组织样本中TLR4、NLRP3、Caspase1、ASC和GSDMD mRNA表达显著增高(P<0.05或P<0.01);与模型组相比,XFBD 4 g/kg和8 g/kg组肺组织样本中TLR4、NLRP3、Caspase1和ASC mRNA表达显著下调(P<0.01),GSDMD表达降低,差异无统计学意义(P>0.05),见图 5。
|
| 注:与正常组比较,*P<0.05,**P<0.01;与模型组比较,##P<0.01。 图 5 XFBD对ALI小鼠肺组织TLR4/NLRP3/Caspase1信号通路相关基因表达的影响(x±s,n≥6) |
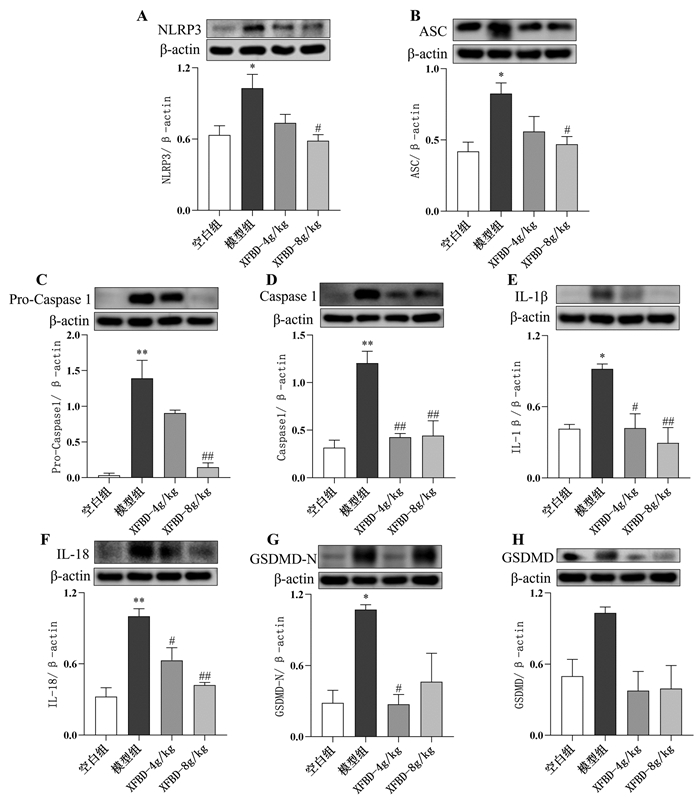
与正常组相比,模型处理后小鼠肺组织中NLRP3、ASC、Pro Caspase1、IL-18、Caspase1、IL-1β和GSDMD-N表达显著增加(P<0.05或P<0.01);与模型组相比,XFBD 4 g/kg和8 g/kg显著降低NLRP3、ASC、Pro-Caspase1、IL-18、Caspase1、IL-1β和GSDMD-N的蛋白表达水平(P<0.05或P<0.01),见图 6。
|
| 注:与正常组比较,*P<0.05,**P<0.01;与模型组比较,#P<0.05,##P<0.01。 图 6 各组小鼠WB指标分析(x±s,n≥3) |
免疫组化结果所示,与正常组相比,模型组小鼠肺组织TLR4、NLRP3和GSDMD表达显著增加(P<0.01);与模型组相比,XFBD 4 g/kg和8 g/kg显著下调TLR4、NLRP3和GSDMD蛋白表达(P<0.01),见图 7。

|
| 注:与正常组比较,**P<0.01;与模型组比较,##P<0.01。 图 7 各组小鼠免疫组化分析(x±s,n=3) |
ALI是由各种直接或间接的肺内外因素引起的一系列弥漫性肺损伤,具有高发病率和高病死率的特点[10]。据统计,ALI/ARDS在世界范围内的死亡率高达40%[11]。在啮齿动物中,IgG-IC模型已被广泛用于研究急性肺部炎症损伤的分子机制,该模型协调了多方面的介质级联反应,导致中性粒细胞向炎症部位动员,随后激活肺中的巨噬细胞,进而导致包括TNF-α在内的早期细胞因子形成。促炎细胞因子可诱导趋化因子和黏附分子在白细胞和内皮/上皮细胞上的表达,这些细胞共同诱导更加强烈的促炎级联反应,导致肺部急性损伤[12-13]。因此,本研究采用IgG-IC法建立小鼠ALI模型。
自古以来,中医药一直被用作大流行和地方病的常规治疗方案。多项临床前和临床试验已证实XFBD在治疗COVID-19中发挥了重要作用,逐渐获得广泛的关注和认同[14-15]。XFBD源自4种经典名方:麻杏石甘汤、麻杏薏甘汤、千金苇茎汤和葶苈大枣泻肺汤,由甘草、麻黄等13种中药组成[15]。药理学研究表明其具有抗炎、拮抗细胞因子风暴、抗氧化和调节机体免疫的作用[16-17]。本课题组前期研究表明,XFBD可以调节补体系统以改善肺部损伤,阻断C3a和C5a及其相应受体(C3aR和C5aR)的产生,同时通过抑制JAK2/STAT3/SOCS3和NF-κB信号通路,改善炎症反应[9]。近期研究报道,XFBD可减轻肺部成纤维细胞胶原沉积,抑制促炎细胞因子表达及促炎巨噬细胞极化,从而缓解肺部炎症[18-20]。本研究证实,XFBD可减少肺组织炎症细胞浸润及肺泡出血,明显减轻肺组织病理损伤评分和肺组织脏器系数,并显著降低了IL-6、IL-1β、IL-18和MCP-1的表达,减轻炎症反应。
上皮屏障功能障碍和肺泡毛细血管对蛋白质和液体的高渗透性是ALI的典型病理表现[21]。紧密连接是维持细胞完整性和通透性不可缺少的机械屏障,ZO-1与Occludin等在维持肺屏障完整性中起重要作用[22-23]。Li等研究发现,鸢尾素可上调ZO-1和Occludin的表达,降低上皮屏障通透性,从而改善脂多糖(LPS)诱导的ALI的肺上皮屏障功能损伤[24]。本研究表明,XFBD可上调肺组织ZO-1和Occludin的表达,改善ALI肺屏障功能障碍。
TLR4是一类模式识别受体,在天然免疫中发挥着重要作用,主要表现在细菌感染和引发炎症方面[25-26]。TLR4的激活可以导致炎症小体的形成和激活。炎症小体进一步促进促炎细胞因子IL-1β和IL-18的产生,加剧炎症反应,同时也会引发免疫细胞的活化和炎症相关细胞死亡。炎性小体是一种大的多聚体蛋白复合物,由ASC、细胞传感器NLR和Pro-Caspase1组成。炎症小体最初是作为先天免疫系统传感器发现的,可以识别各种刺激。在刺激下,传感器分子NLR、接头分子ASC和Pro-Caspase1形成复合物进而激活Caspase1。Caspase1可以激活pro-IL-1β和pro-IL-18,并裂解GSDMD在细胞膜上形成大孔,引起细胞焦亡[3, 6]。研究表明,细胞焦亡是ALI/ARDS组织损伤的主要机制[27]。Li等研究发现XFBD中主要活性成分可通过抑制NLRP3和CSF2的活化的来减少炎症反应和细胞凋亡,从而缓解COVID-19患者的临床症状[28]。Zhao等研究表明XFBD可以降低炎症小体相关蛋白的表达从而改善LPS诱导的小鼠急性肺炎与SiO2诱导的小鼠慢性肺炎[29]。此外,XFBD中马鞭草富含马鞭草素,可靶向C/EBP-δ/GSDMD/GSDME轴抑制肺泡巨噬细胞焦亡,减轻IgG-IC诱导的ALI小鼠炎症反应[27]。在本研究中XFBD显著抑制了TLR4的表达,阻断NLRP3炎症小体复合物的激活,同时减弱了GSDMD表达,提示XFBD可能通过抑制TLR4/NLRP3/Caspase1信号通路减轻ALI对小鼠肺部损伤。
4 结论本研究证明了XFBD可以抑制急性肺损伤小鼠肺组织炎症细胞浸润和肺泡出血,上调肺黏膜屏障ZO-1和Occludin水平,降低细胞因子IL-6、IL-1β、IL-18和MCP-1表达以及TLR4/NLRP3/Caspase1信号通路相关基因及蛋白表达水平。XFBD对ALI小鼠肺组织保护作用可能与抑制TLR4/NLRP3/Caspase1信号通路有关。
| [1] |
LU Q Y, YU S F, MENG X Y, et al. MicroRNAs: Important regulatory molecules in acute lung injury/acute respiratory distress syndrome[J]. International Journal of Molecular Sciences, 2022, 23(10): 5545. DOI:10.3390/ijms23105545 |
| [2] |
LIU C, XIAO K, XIE L X. Advances in the use of exosomes for the treatment of ALI/ARDS[J]. Frontiers in Immunology, 2022, 13: 971189. DOI:10.3389/fimmu.2022.971189 |
| [3] |
LI N, ZOU S S, WANG B, et al. Targeting immunometabolism against acute lung injury[J]. Clinical Immunology, 2023, 249: 109289. DOI:10.1016/j.clim.2023.109289 |
| [4] |
CHEN R, CAO C, LIU H M, et al. Macrophage Sprouty4 deficiency diminishes sepsis-induced acute lung injury in mice[J]. Redox Biology, 2022, 58: 102513. DOI:10.1016/j.redox.2022.102513 |
| [5] |
HSU S K, LI C Y, LIN I L, et al. Inflammation-related pyroptosis, a novel programmed cell death pathway, and its crosstalk with immune therapy in cancer treatment[J]. Theranostics, 2021, 11(18): 8813-8835. DOI:10.7150/thno.62521 |
| [6] |
LIANG Q, CAI W Y, ZHAO Y X, et al. Lycorine ameliorates bleomycin-induced pulmonary fibrosis via inhibiting NLRP3 inflammasome activation and pyroptosis[J]. Pharmacological Research, 2020, 158: 104884. DOI:10.1016/j.phrs.2020.104884 |
| [7] |
LIU B H, WANG Z, HE R Y, et al. Buformin alleviates sepsis-induced acute lung injury via inhibiting NLRP3-mediated pyroptosis through an AMPK-dependent pathway[J]. Clinical Science(London, England, 2022, 136(4): 273-289. DOI:10.1042/CS20211156 |
| [8] |
KANG J Y, XU M M, SUN Y, et al. Melatonin attenuates LPS-induced pyroptosis in acute lung injury by inhibiting NLRP3-GSDMD pathway via activating Nrf2/HO-1 signaling axis[J]. International Immunopharmacology, 2022, 109: 108782. DOI:10.1016/j.intimp.2022.108782 |
| [9] |
LI C X, LI Y H, ZHANG H, et al. Xuanfei Baidu Decoction suppresses complement overactivation and ameliorates IgG immune complex-induced acute lung injury by inhibiting JAK2/STAT3/SOCS3 and NF-κB signaling pathway[J]. Phytomedicine, 2023, 109: 154551. DOI:10.1016/j.phymed.2022.154551 |
| [10] |
陈采玉, 张文, 蒲玉婷, 等. 中药复方治疗脓毒症合并急性肺损伤作用机制的研究进展[J]. 中国中医急症, 2023, 32(12): 2241-2244. |
| [11] |
THOMPSON B T, CHAMBERS R C, LIU K D. Acute respiratory distress syndrome[J]. New England Journal of Medicine, 2017, 377(6): 562-572. DOI:10.1056/NEJMra1608077 |
| [12] |
ZHANG S J, YANG L, HU D S, et al. Syringaresinol alleviates IgG immune complex induced acute lung injury via activating PPARγ and suppressing pyroptosis[J]. International Immunopharmacology, 2023, 124(Pt B): 111071. |
| [13] |
TANG H F, YAN C G, CAO J, et al. An essential role for Stat3 in regulating IgG immune complex-induced pulmonary inflammation[J]. FASEB Journal, 2011, 25(12): 4292-4300. DOI:10.1096/fj.11-187955 |
| [14] |
ZHAO K, WANG C L, LIU Y, et al. Deficiency of microRNA-10b promotes DSS-induced inflammatory response via impairing intestinal barrier function[J]. Biochemical and Biophysical Research Communications, 2022, 636(Pt 2): 48-54. |
| [15] |
HUANG K, ZHANG P, ZHANG Z H, et al. Traditional Chinese medicine(TCM) in the treatment of COVID-19 and other viral infections: Efficacies and mechanisms[J]. Pharmacology & Therapeutics, 2021, 225: 107843. |
| [16] |
张敬升, 冀祖恩, 庞博, 等. 宣肺败毒方治疗新冠病毒感染的中医学理论探讨及现代药理研究进展[J]. 中国药物警戒, 2024, 21(1): 55-58. |
| [17] |
李玉丽, 谭周进, 袁振仪. 中医"三药三方"防治新型冠状病毒感染研究进展[J]. 时珍国医国药, 2021, 32(5): 1251-1253. |
| [18] |
LI Y J, LI B, WANG P, et al. Traditional Chinese medicine, Qingfei paidu decoction and Xuanfei Baidu Decoction, inhibited cytokine production via NF-κB signaling pathway in macrophages: Implications for coronavirus disease 2019(COVID-19) therapy[J]. Frontiers in Pharmacology, 2021, 12: 722126. DOI:10.3389/fphar.2021.722126 |
| [19] |
LI Z H, PAN H T, YANG J H, et al. Xuanfei Baidu formula alleviates impaired mitochondrial dynamics and activated NLRP3 inflammasome by repressing NF-κB and MAPK pathways in LPS-induced ALI and inflammation models[J]. Phytomedicine, 2023, 108: 154545. DOI:10.1016/j.phymed.2022.154545 |
| [20] |
WANG Y Y, SANG X Q, SHAO R, et al. Xuanfei Baidu Decoction protects against macrophages induced inflammation and pulmonary fibrosis via inhibiting IL-6/STAT3 signaling pathway[J]. Journal of Ethnopharmacology, 2022, 283: 114701. DOI:10.1016/j.jep.2021.114701 |
| [21] |
ENGLERT J A, MACIAS A A, AMADOR-MUNOZ D, et al. Isoflurane ameliorates acute lung injury by preserving epithelial tight junction integrity[J]. Anesthesiology, 2015, 123(2): 377-388. DOI:10.1097/ALN.0000000000000742 |
| [22] |
LI J, QI Z J, LI D X, et al. Alveolar epithelial glycocalyx shedding aggravates the epithelial barrier and disrupts epithelial tight junctions in acute respiratory distress syndrome[J]. Biomedecine & Pharmacotherapie, 2021, 133: 111026. |
| [23] |
ZHANG D, ZHOU J, YE L C, et al. Autophagy maintains the integrity of endothelial barrier in LPS-induced lung injury[J]. Journal of Cellular Physiology, 2018, 233(1): 688-698. DOI:10.1002/jcp.25928 |
| [24] |
LI X Y, JAMAL M, GUO P P, et al. Irisin alleviates pulmonary epithelial barrier dysfunction in sepsis-induced acute lung injury via activation of AMPK/SIRT1 pathways[J]. Biomedecine & Pharmacotherapie, 2019, 118: 109363. |
| [25] |
ZUSSO M, LUNARDI V, FRANCESCHINI D, et al. Cipro- floxacin and levofloxacin attenuate microglia inflammatory response via TLR4/NF-κB pathway[J]. Journal of Neuroinflammation, 2019, 16(1): 148. DOI:10.1186/s12974-019-1538-9 |
| [26] |
ZHANG C, WANG X R, WANG C G, et al. Qingwenzhike prescription alleviates acute lung injury induced by LPS via inhibiting TLR4/NF-κB pathway and NLRP3 inflammasome activation[J]. Frontiers in Pharmacology, 2021, 12: 790072. DOI:10.3389/fphar.2021.790072 |
| [27] |
YANG L, LIU T Y, ZHUO Y Z, et al. Verbenalin alleviates acute lung injury induced by sepsis and IgG immune complex through GPR18 receptor[J]. Cellular Signalling, 2023, 109: 110768. DOI:10.1016/j.cellsig.2023.110768 |
| [28] |
XIONG L, CAO J F, YANG X Y, et al. Exploring the mechanism of action of Xuanfei Baidu granule(XFBD) in the treatment of COVID-19 based on molecular docking and molecular dynamics[J]. Frontiers in Cellular and Infection Microbiology, 2022, 12: 965273. DOI:10.3389/fcimb.2022.965273 |
| [29] |
赵倩茹. 宣肺败毒方通过调节NLRP3炎症小体改善急、慢性肺炎的研究[D]. 天津: 天津中医药大学, 2023.
|
 2024, Vol. 43
2024, Vol. 43





