文章信息
- 夏鑫, 李艳芬, 黄宇虹, 黄伟, 程昱, 朱梦瑶
- XIA Xin, LI Yanfen, HUANG Yuhong, HUANG Wei, CHENG Yu, ZHU Mengyao
- 糖脂清提取物对淀粉水解中α-糖苷酶抑制作用研究
- Study on the inhibitory effect of Tangzhiqing extract on α-glucosidase in starch hydrolysis
- 天津中医药大学学报, 2024, 43(12): 1074-1081
- Journal of Tianjin University of Traditional Chinese Medicine, 2024, 43(12): 1074-1081
- http://dx.doi.org/10.11656/j.issn.1673-9043.2024.12.05
-
文章历史
收稿日期: 2024-09-20
2. 天津中医药大学第二附属医院 临床药理中心, 天津 300250;
3. 承德市中医院 肿瘤科, 承德 067000
2. Department of Clinical Pharmacology, The Second Affiliated Hospital of Tianjin University of Traditional Chinese Medicine, Tianjin 300250, China;
3. Oncology department, Chengde Traditional Chinese Medicine Hospital, Chengde 067000, China
人类进食的碳水化合物中,单糖,如葡萄糖,可以直接被人体吸收。双糖和多糖则需要一定的生物酶作用转化为单糖后才能被人体吸收利用。淀粉为食物常见碳水化合物,属于多糖,分直链淀粉和支链淀粉。淀粉进入人体后,被位于口腔的唾液淀粉酶和小肠上皮细胞刷状缘处α-葡萄糖苷酶(如胰淀粉酶、α-糊精酶、异麦芽糖酶、麦芽糖酶等)逐步水解,水解的终产物为葡萄糖[1]。α-糖苷酶抑制剂(AGI)通过抑制小肠中的α-糖苷酶的活性,使碳水化合物被糖苷酶水解的速度减慢,减少葡萄糖的生成和吸收,最终达到降低餐后血糖,从而降低各种糖尿病并发症发生风险及糖尿病病死率[2]。淀粉水解及α-糖苷酶抑制过程见图 1,淀粉水解的任何一个环节被阻断都将影响其体内水解过程。

|
| 图 1 淀粉水解及α-糖苷酶抑制过程 |
糖脂清提取物(TZQ)来自名老中医经验用方——三叶片汤剂。是由桑叶、荷叶、山楂叶、丹参、赤芍5味中药按一定比例配伍,经现代工艺提取制成的片剂,具有升清降浊、化瘀消痞的功效,用于痰浊内蕴,痞满不畅所致的脾瘅。TZQ中有效组分为桑叶总黄酮、桑叶总生物碱、桑叶总多糖、荷叶总黄酮、荷叶总生物碱、山楂叶总黄酮、丹参总酚酸、芍药总苷[3]。课题组前期研究结果显示,TZQ能够降低健康人餐后血糖水平且未升高C肽水平,与阿卡波糖有类似的作用特点[4]。另1项研究结果显示,TZQ 3、6、9片顿服可明显降低健康受试者服用淀粉后血糖AUC及升糖指数的水平,其中6片组与基线水平比较差异有统计学意义(P < 0.01)[5]。为明确TZQ通过何种途径干预淀粉水解过程而实现降低餐后血糖作用,研究在体外条件下运用TZQ分步干预淀粉水解为单糖全过程,考察TZQ对参与淀粉水解的糖苷酶(α-淀粉酶、α-糊精酶、异麦芽糖酶和麦芽糖酶)活性的抑制作用,明确TZQ干预淀粉水解的具体作用途径,为TZQ降糖作用机制研究提供数据支持。
1 材料与方法 1.1 实验材料 1.1.1 实验动物雄性SD大鼠,体质量(200±20)g,购自北京维通利华实验动物技术有限公司,实验动物许可证号:SCXK(京)2016-0006。
1.1.2 药物与试剂TZQ由山东步长神州制药有限公司提供并检验;批号:M18001。淀粉,购自美国sigma公司;糊精、麦芽糖,购自上海权旺生物科技有限公司;异麦芽糖,购自上海源叶生物科技有限公司;α-淀粉酶、α-糊精酶,购自美国Sigma公司;NaH2PO4·2H2O、Na2HPO4·12H2O、Na2CO3、DNS购自上海吉至生化有限公司;5%碘试剂,购自由北京索莱宝科技有限公司;葡萄糖试剂盒,购自由中生北控试剂生物科技股份有限公司。
1.1.3 主要仪器DNM-9602酶标仪(北京普朗科技有限公司);DHP9121B电热恒温培养箱(上海一恒科学仪器有限公司);BHS-2恒温水浴锅(JOANLAB);PR SERIES万分之一天平(上海奥豪斯仪器有限公司);MY-10匀浆器(上海净信);GTR16-2低温离心机(北京北利离心机有限公司)。
1.2 实验方法 1.2.1 大鼠小肠酶液的提取参考文献[6]取SPF级雄性大鼠,禁食不禁水12 h后,脱颈椎处死。处死后立即于冰板上取胃幽门以下小肠约15 cm,用预冷的生理盐水冲洗,翻转后再冲洗,将洗净的小肠置于冰板上剪开,用玻片刮取其内的表面黏膜后快速放入冰盒内的2 mL离心管中,将黏膜按1∶1的比例加入4 ℃ pH=6.80、浓度为0.1 mol/L的磷酸盐缓冲液(PBS),放入匀浆器内匀浆,再放入4 ℃低温离心机8 000 r/min,离心10 min,离心半径6.7 cm,取上清液放入无菌无酶的50 mL离心管内。沉淀物仍按1∶1的比例加入4 ℃ pH=6.8的PBS匀浆,重复第2次,合并两次上清液混匀后,分装在1.5 mL离心管内,置于-20 ℃冰箱内备用。在pH 6.8,37 ℃的条件下,小肠酶1 min催化浓度为0.896 mol/L的蔗糖溶液50 μL,生成1 μmol葡萄糖,定义为1个酶活力单位。
1.2.2 碳水化合物(底物)浓度过量的测定 1.2.2.1 底物淀粉过量浓度的测定1.5 mL Ep管中加入1.0 mg/mL淀粉酶10 μL,再分别加入淀粉溶液480 μL,用PBS缓冲液将反应体系补足至500 μL,反应体系中淀粉浓度为0.48、0.96、1.92、3.84、5.76、7.68、9.6、11.52 mg/mL,每个反应体系三孔平行加样,操作均在冰盒内完成,完成后放入37 ℃恒温箱反应30 min,置于沸水中煮沸15 min以终止反应,取出300 μL反应溶液加入400 μL DNS试剂与300 μL纯水于EP管中,煮沸5 min显色,取出150 μL溶液于96孔板中,于酶标仪560 nm波长下测定吸光度(OD值)。
1.2.2.2 底物糊精过量浓度的测定在1.5 mL Ep管中加入1.5 mg/mL糊精酶20 μL,再分别加入不同浓度糊精底物480 μL,反应体系中糊精浓度为2.4、4.8、9.6、19.2、28.8、38.4、48.0 mg/mL,三孔平行加样,完成后放入37 ℃恒温箱中反应30 min,煮沸15 min终止反应,冷却到室温后,取出45 μL反应溶液加入60 μL碘试剂与45 μL纯水于96孔板中,于酶标仪660 nm波长下测定OD值,pH=6.8 PBS缓冲液20 μL代替糊精酶为对照。
1.2.2.3 底物麦芽糖过量浓度的测定取96孔板,加入1.2.1中提取的小肠酶液50 μL,再分别加入不同浓度的麦芽糖底物50 μL,反应体系中麦芽糖浓度为4.38×10-4、8.75×10-4、1.75×10-3、3.5×10-3、7×10-3、1.4×10-2、2.8×10-2 mol/L,反应总体系为100 μL,三孔平行加样,操作在冰盒内完成,后置于37 ℃恒温箱中反应20 min,计时结束后取出立即放入冰水中5 min以降低反应速率。每孔加入100 μL Na2CO3溶液以终止反应,按葡萄糖测定试剂盒说明操作显色后,在酶标仪492 nm波长下测定OD值。
1.2.2.4 底物异麦芽糖过量浓度的测定小肠酶液量、底物异麦芽糖加入量及浓度梯度、操作方法同1.2.2.3。
1.2.3 最适酶量及反应时间的确定 1.2.3.1 淀粉酶动力学反应中最适酶量及反应时间取浓度分别为0.25、0.375、0.5、0.75、1、1.5 mg/mL的淀粉酶溶液10 μL,加入1.2.2.1中所得浓度的淀粉溶液480 μL,用PBS缓冲液将体系补足至500 μL,三孔平行加样,操作在冰盒内完成,完成后分别于37 ℃恒温箱中分别反应3、6、9、12、15、18、21、24、27 min,煮沸15 min终止反应,取出300 μL反应液加入400 μL DNS试剂与300 μL纯水于EP管中,煮沸5 min显色,显色结束后取出150 μL溶液于96孔板中,于560 nm波长下测定OD值。
1.2.3.2 糊精酶动力学反应中最适酶量及反应时间取浓度分别为0.1、0.25、0.5、0.75、1、1.25、1.5 mg/mL的糊精酶溶液20 μL加入Ep管中,再加入1.2.2.2中所得浓度的糊精溶液480 μL,三孔平行加样,在冰盒内完成,完成后放入37 ℃恒温箱中反应以下时间,即3、6、9、12、15、18、21、24、27 min,反应时间结束后置于沸水中煮沸15 min终止反应,冷却到室温后,取出45 μL反应溶液加入60 μL碘试剂与45 μL纯水于96孔板中,于酶标仪660 nm波长下测定OD值。用pH=6.8 PBS缓冲液20 μL代替糊精酶作为对照。
1.2.3.3 麦芽糖酶动力学反应中最适酶量及反应时间在96孔板中加入麦芽糖溶液20 μL(1.2.2.3测得浓度),分别加入体积为20、30、40、50、60、70、80 μL的小肠酶溶液,各孔用PBS缓冲液将反应体系补足至100 μL,三孔平行加样,操作在冰盒内完成,完成后放入37 ℃恒温箱中反应以下时间,即1、2、4、6、8、10、12、14、16 min,计时结束后取出立即放入冰水中5 min以降低反应速率。每孔加入100 μL Na2CO3溶液以终止反应,按葡萄糖测定试剂盒说明操作显色后,在酶标仪492 nm波长下测定OD值。
1.2.3.4 异麦芽糖酶动力学反应中最适酶量及反应时间在96孔板中加入异麦芽糖溶液20 μL(1.2.2.4测得浓度),加入小肠酶溶液的体积及梯度、反应时间及间隔、操作方法等同1.2.3.3。
1.2.4 酶反应动力学方程的建立按照前述方法所确定的最适反应时间和最适酶浓度为基本条件,分别测定在不同底物浓度下反应的初速率,每种浓度做3个平行,通过双倒数法求出米氏常数(Km)和最大反应速率(Vmax)。
1.2.5 TZQ对参与淀粉水解的α-糖苷酶活性影响的测定 1.2.5.1 TZQ对淀粉酶活性影响的测定取最适浓度的淀粉酶溶液10 μL加入Ep管中,再分别加入pH=6.8 PBS稀释配制的不同浓度的TZQ溶液10 μL(TZQ体系浓度为6.88×10-5、1.38×10-4、2.20×10-4、2.75×10-4、3.30×10-4、5.50×10-4 mg/mL),混匀后置于37 ℃恒温箱中反应10 min,计时结束后继续加入480 μL的最适淀粉溶液,每个反应体系3孔平行加样,37 ℃恒温箱反应,反应时间为1.2.3.1中得出的最适反应时间,完成后置于沸水中煮沸15 min以终止反应,取出300 μL反应溶液加入400 μL DNS试剂与300 μL纯水于EP管中,煮沸5 min显色,显色后取出150 μL溶液于96孔板中,用PBS 10 μL代替TZQ 10 μL作为阴性对照组,用PBS 20 μL代替淀粉酶10 μL及TZQ 10 μL作为空白组,分别于560 nm波长下测定OD值,计算抑制率,抑制率(%)=(无酶抑制剂组-酶抑制剂组)/无酶抑制剂组×100%。
1.2.5.2 TZQ对糊精酶活性影响的测定在1.5 mL Ep管中加入最适浓度的糊精酶液20 μL,再分别加入pH=6.8 PBS稀释配制的各浓度TZQ溶液10 μL(TZQ体系浓度为1.10×10-4、5.50×10-4、1.10×10-3、2.20×10-3、4.40×10-3、6.60×10-3 mg/mL),混匀后置于37 ℃恒温箱中使两者充分接触10 min,3管平行加样,计时结束后于每管加入糊精溶液470 μL(使反应体系中糊精浓度为1.2.2.2中所得最适浓度),37 ℃恒温箱中反应,反应时间为1.2.3.2中所得最适反应时间,反应时间结束后于沸水中煮沸15 min以终止反应,冷却到室温后,取出45 μL反应溶液加入60 μL碘试剂与45 μL纯水于96孔板中,于酶标仪660 nm波长下测定OD值。用PBS 10 μL代替TZQ 10 μL作为阴性对照组,用PBS 30 μL代替糊精酶20 μL及TZQ 10 μL作为对照组,其余操作同上。于660 nm波长下测定OD值,计算抑制率。
1.2.5.3 TZQ对麦芽糖酶活性影响的测定在96孔板中置pH=6.8 PBS稀释配制的各浓度TZQ溶液10 μL(TZQ体系浓度为5.50×10-4、2.75×10-3、3.30×10-3、3.85×10-3、4.40×10-3、5.50×10-3、8.25×10-3、1.10×10-2 mg/mL),再加入1.2.3.3中所得最适酶体积的小肠酶液,混匀后置于37 ℃恒温箱中10 min使两者充分接触,完成后于每孔加入麦芽糖溶液20 μL(浓度为1.2.2.3中所得的最适底物浓度),3孔平行加样,在冰盒内操作,37 ℃恒温箱中反应,反应时间为1.2.3.3中所得最适反应时间,计时结束后取出立即放入冰水中5 min以降低反应速率。每孔加入100 μL Na2CO3溶液以终止反应,按葡萄糖测定试剂盒说明操作显色后,在酶标仪492 nm波长下测定OD值。计算TZQ对麦芽糖酶的抑制率,拟合TZQ IC50值。
1.2.5.4 TZQ对异麦芽糖酶活性影响的测定在96孔板中加入各浓度梯度TZQ溶液10 μL(TZQ体系浓度为5.50×10-5、1.10×10-3、1.65×10-3、2.20×10-3、2.75×10-3、5.50×10-3、1.10×10-2 mg/mL),再加入最适体积的小肠酶液(即1.2.3.4中所得最适酶量),混匀后置于37 ℃恒温箱中10 min使两者充分接触,完成后于每孔加入异麦芽糖溶液20 μL(浓度为1.2.2.4中所得的最适底物浓度),用PBS缓冲液将反应体系补足至100 μL,每个反应体系三孔平行加样,操作均于冰盒内完成,37 ℃恒温箱中反应,反应时间为1.2.3.4中所得最适反应时间,其余操作同1.2.3.3。
1.3 统计学方法采用SPSS 20.0软件进行数据分析,数据采用统计描述方式均以均数±标准差(x±s)表示。采用斯皮尔曼秩相关系数解释TZQ浓度对各糖苷酶抑制率的影响,对存在有抑制关系的酶(P < 0.05)计算半数抑制率(IC50)。
2 结果 2.1 底物浓度过量的测定结果如图 2A所示,随着淀粉浓度的增加,反应速度先增加后趋于稳定,当淀粉浓度<3.84 mg/mL时,反应速率与淀粉浓度的一次方成正比例关系,表现为一级反应;当淀粉浓度在3.84~7.68 mg/mL之间时,反应速率不再呈现正比例升高,表现为混合级反应;当淀粉浓度>7.68 mg/mL,反应速率与淀粉浓度的零次方成正比例关系,反应速率不再增大,表现为零级反应;为保证整个酶反应过程中有足够的底物来饱和酶,淀粉过量浓度选择9.6 mg/mL。如图 2B、2C、2D所示,糊精过量浓度为38.4 mg/mL,麦芽糖过量浓度为0.014 mol/L,异麦芽糖过量浓度为0.028 mol/L。

|
| 图 2 确定底物过量浓度 |
如图 3A所示,当加入的淀粉酶浓度在1 mg/mL及以下时,反应速率在24 min内均保持近似线性增长,进一步比较,当酶浓度为1 mg/mL时,反应速率最大且在(0.03~0.25)/min,参考文献[7]该条件下处于零级反应,酶浓度适合建立科学的反应动力学方程,故选取淀粉酶浓度为1 mg/mL,反应时间为24 min作为本实验最适酶浓度与时间。
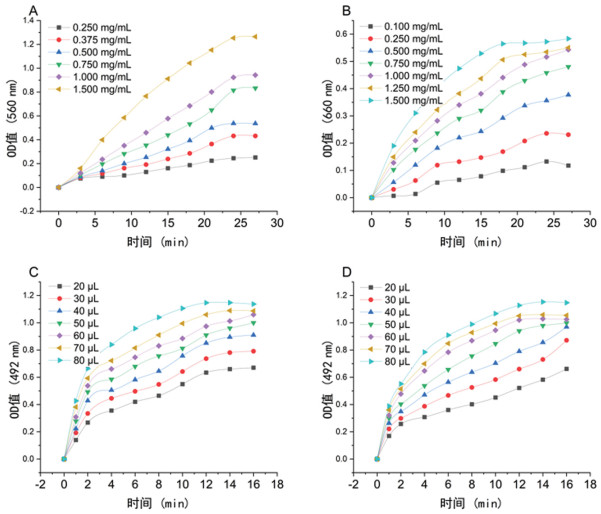
|
| 图 3 最适酶浓度与反应时间 |
如图 3B所示,随着加入糊精酶浓度的增大,反应速率也逐渐变大,当加入的糊精酶浓度在1.25 mg/mL及其以下时,反应速率在18 min内均保持近似线性增长,酶浓度为1.25 mg/mL时,反应速率最大且在(0.03~0.25)/min,故选取糊精酶浓度为1.25 mg/mL、18 min为本实验最适酶浓度与反应时间。
如图 3C所示,在底物麦芽糖过量的状态下,随着加入小肠酶体积的增大,反应速率也逐渐变大,使反应速率最大且在(0.03~0.25)/min,当加入的小肠酶量在70 μL及其以下时在12 min内均保持近似线性增长,故麦芽糖为底物的试验中选取加入小肠酶量为70 μL,反应时间为12 min作为最适条件。
如图 3D所示,反应条件同麦芽糖酶,当加入的小肠酶量在50 μL及以下时,反应速率在12 min内保持近似线性增长,取小肠酶50 μL,反应时间12 min为本实验最适酶浓度与时间。
2.3 米氏常数Km和最大反速率Vmax根据中间复合物假说,酶催化反应可表示为E+S←→E.S→P+E,米氏方程V=Vmax[S]/(Km+[S])即1/V=Km/Vmax×1/[S]+1/Vmax。以1/V为纵坐标以1/[S]为横坐标采用双倒数作图法作图。
在淀粉底物浓度分别为2.31、3.07、5.37、6.92 mg/mL的条件下建立酶动力学方程。见图 4A。从而得出Vmax=0.546 2,Km=14.635 4 mg/mL,R2=0.984 6,说明该酶催化反应与米氏方程高度吻合,可以运用该方程对催化反应进行机制分析和应用性评价。

|
| 图 4 酶的米氏方程曲线 |
在糊精底物浓度分别为2.3、4.61、9.22、18.43 mg/mL的条件下建立酶动力学方程。见图 4B。从而得出Vmax=1.154 5,Km=27.804 2 mg/mL,R2=0.997 9,说明该酶催化反应与米氏方程高度吻合,可以运用该方程对催化反应进行机理分析和应用性评价。
在麦芽糖底物浓度分别0.001 3、0.002 9、0.003 8、0.004 2 mol/L的条件下建立酶动力学方程。见图 4C。从而得出Vmax=2.992 2,Km=0.720 2×10-2 mol/L,R2=0.993 4,说明该酶催化反应与米氏方程高度吻合,可以运用该方程对催化反应进行机制分析和应用性评价。
在异麦芽糖底物浓度分别为0.004 2、0.008 4、0.009 8、0.012 6 mol/L的条件下建立酶动力学方程。见图 4D。从而得出Vmax=0.649 9,Km=0.273 0×10-2 mol/L,R2=0.993 2,说明该酶催化反应与米氏方程高度吻合,可以运用该方程对催化反应进行机制分析和应用性评价。
2.4 TZQ对α-糖苷酶活性抑制的测定结果用斯皮尔曼秩相关系数解释TZQ浓度对各糖苷酶抑制率的影响。
2.4.1 TZQ对淀粉酶活性抑制结果如表 1所示,随着TZQ浓度的增大,对淀粉酶的抑制率降低,差异具有统计学意义(P < 0.05)。在6.88×10-5~5.50×10-4 mg/mL浓度范围内,TZQ对淀粉酶活性的抑制作用未显示正向剂量依赖性。
如表 2所示,随着TZQ浓度的增大,对糊精酶活性的活性几乎无抑制作用,差异无统计学意义(P > 0.05),在1.10×10-4~6.60×10-3 mg/mL浓度范围内,TZQ对糊精酶活性没有明显的抑制作用。
如表 3所示,随着TZQ浓度的增大,对麦芽糖酶活性的抑制作用逐渐增强,差异具有统计学意义(P < 0.05)。
根据多元非线性拟合得到回归方程:Y=0.113 5X3-3.146 7X2+28.372X-9.307 7,R2=0.995 8。根据回归方程计算出TZQ对麦芽糖酶的IC50为2.96×10-3 mg/mL。
2.4.4 TZQ对异麦芽糖酶活性抑制结果如表 4所示,随着TZQ浓度的增大,对异麦芽糖酶活性的抑制作用逐渐增强,差异具有统计学意义(P < 0.05)。
根据多元非线性拟合得到回归方程:Y=0.441 2X3-9.005 2X2+55.254X-22.034,R2=0.999 7。根据回归方程计算出TZQ对异麦芽糖酶的半数抑制率IC50为1.77×10-3 mg/mL。
3 讨论糖尿病已成为威胁全球人类健康的严重慢病之一,其发病率呈逐年增长趋势,国际糖尿病联盟(IDF)[8]对110个国家相关数据分析,预计2035年全球糖尿病患者将达到5.92亿。其防治也已写入“健康中国2030”规划纲要[9]。餐后高血糖是糖尿病的重要临床特征之一,餐后血糖升高可引起胰岛素敏感性降低,从而加重糖尿病病情并导致严重并发症[10]。因此,餐后高血糖的控制成为糖尿病治疗的重点之一。
淀粉是人类食用的最常见的碳水化合物,尤其在中国,几乎每人每天都在进食淀粉及制品。正常情况下,进入人体的淀粉可以被位于口腔、小肠等处的消化酶消化被人体吸收利用,并不会引起血糖水平异常。当胰岛素抵抗(IR)和/或β细胞功能缺陷导致胰岛素分泌相对不足情况存在时,会导致血糖升高。糖尿病患者进食碳水化合物后,表现为餐后高血糖。研究者开发了α-糖苷酶抑制剂,如市售的阿卡波糖、伏格列波糖、米格列醇等,能作用于小肠绒毛刷状缘,竞争性抑制α-糖苷酶活性,从而有效延缓碳水化合物的吸收而降低餐后高血糖。中药作为中华民族的传统瑰宝,也被逐渐证实有较好的α-糖苷酶抑制作用[11-13]。
TZQ作为临床应用近30年的处方,在降糖调脂方面显示出了其独特的作用和优势[1]。前期研究结果表明,TZQ对2型糖尿病合并高三酰甘油血症患者具有较好治疗作用,动物实验显示TZQ可降低实验性2型糖尿病大鼠空腹血糖及糖化血红蛋白水平、降低血脂含量,可抑制小鼠小肠蔗糖酶、麦芽糖酶活性[14-16]。研究从淀粉水解过程入手,考察了TZQ对淀粉水解的各个环节的作用与特点,发现在实验考察浓度范围内,TZQ对淀粉酶活性具有抑制作用,但未显示与剂量正相关,对糊精酶活性没有明显抑制作用。对麦芽糖酶、异麦芽糖酶活性有较好抑制作用,半数抑制浓度IC50分别为2.96×10-3、1.77×10-3 mg/mL。TZQ对麦芽糖酶、异麦芽糖酶活性的抑制作用相似,对后者活性作用有微弱优势。因此,TZQ可能抑制了淀粉水解链中淀粉酶、麦芽糖酶、异麦芽糖酶活性,干预淀粉水解过程而降低血糖。TZQ对二糖酶麦芽糖酶、异麦芽糖酶的抑制作用结果与前期动物实验报道一致[16]。淀粉分为直链淀粉和支链淀粉两类[17]。直链淀粉具有非分支化或轻分支化结构,是葡萄糖残基通过α-1,4糖苷键连接的线性聚合物,支链淀粉具有高度支化结构,主要由α-1,4糖苷键首尾相连而成,还有由较多以α-1,6糖苷键连接的短分支。淀粉在淀粉酶作用下水解为麦芽糖、糊精和葡萄糖等,淀粉的最终产物是葡萄糖。麦芽糊精水解时,α-1,4糊精水解为麦芽糖和葡萄糖,α-1,4-α-1,6糊精水解为少量的麦芽糖、异麦芽糖、葡萄糖和α-极限糊精,α-极限糊精再由小肠中的α-糊精酶水解。淀粉下游水解产物麦芽糖是两个葡萄糖分子以α-1,4糖苷键连接起来的双糖,异麦芽糖则是以α-1,6糖苷键连接起来的双糖,二者水解时分别在麦芽糖酶、异麦芽糖酶的作用下生成葡萄糖,被人体吸收。结合实验结果,提示TZQ可能通过抑制淀粉酶、麦芽糖酶、异麦芽糖酶的活性,干扰相应的α-1,4糖苷键、α-1,6糖苷键的断裂,影响淀粉及下游产物麦芽糖和异麦芽糖的分解,延缓了葡萄糖入血的过程,从而降低了餐后高血糖。课题组关于TZQ对麦芽糖酶活性抑制的机制研究也证实了这一点,结果显示TZQ对麦芽糖酶活性的作用表现为可逆的竞争性抑制[17],该作用特点和阿卡波糖类似[19]。
实验中TZQ对淀粉酶活性抑制结果显示,随着加入TZQ浓度的增大,对淀粉酶的抑制作用呈现减小的趋势。分析此结果可能有以下影响因素,首先可能与DNS显色法本身的局限性有关,因其只能检测溶液中还原糖的量,并不能对淀粉生成的还原糖进行特异性检测,故不能排除反应体系中含有的其他还原性物质参与了DNS显色;也可能与加入的TZQ浓度相关,随着TZQ浓度的增加,更多的参与竞争淀粉酶结合部位,导致酶促反应不充分,从而抑制作用减弱;TZQ提取物中可能有的成分溶解度高,高浓度时会对结果有干扰。今后,可针对淀粉水解的第一个步骤,优化淀粉糊化过程及显色方法等其他实验条件,并可适当调整TZQ浓度与用量,考量提取物溶解度,进一步研究并深入分析。并从分子水平进一步阐释TZQ对不同碳水化合物中相同糖苷键的作用差异,探讨其深入的作用机制。
| [1] |
马庆一, 时国庆, 陈春涛, 等. 桑叶中α-葡萄糖苷酶活性调节成分的研究[J]. 食品科学, 2006, 27(2): 108-111. |
| [2] |
顾觉奋, 陈紫娟. α-葡萄糖苷酶抑制剂的研究及应用[J]. 药学进展, 2009, 33(2): 62-67. DOI:10.3969/j.issn.1001-5094.2009.02.003 |
| [3] |
WANG T, ZHANG D Q, LI Y H, et al. Regulation effects on abnormal glucose and lipid metabolism of TZQ-F, a new kind of Traditional Chinese Medicine[J]. Journal of Ethnopharmacology, 2010, 128(3): 575-582. DOI:10.1016/j.jep.2010.01.044 |
| [4] |
HUANG Y H, FU W X, LI Y F, et al. Comparison of the effects of acarbose and TZQ-F, a new kind of traditional Chinese medicine to treat diabetes, Chinese healthy volunteers[J]. Evidence-Based Complementray and Alternative Medicine, 2014, 2014: 308126. DOI:10.1155/2014/308126 |
| [5] |
LI Y F, LI Z Q, WANG R H, et al. Alleviating the hydrolysis of carbohydrates, Tangzhiqing(TZQ) decreased the postprandial glycemia in healthy volunteers: an eight-period crossover study[J]. Evidence-based Complementary and Alternative Medicine, 2020, 2020: 8138195. DOI:10.1155/2020/8138195 |
| [6] |
GUPTA S, MAHMOOD S, KHAN R H, et al. Inhibition of brush border sucrase by polyphenols in mouse intestine[J]. Bioscience Reports, 2010, 30(2): 111-117. DOI:10.1042/BSR20090012 |
| [7] |
张永军, 黄惠华. 茶多酚对胰α-淀粉酶的抑制动力学研究[J]. 食品工业, 2010, 31(1): 7-9. |
| [8] |
GUARIGUATA L, WHITING D, HAMBLETON I, et al. Global estimates of diabetes prevalence for 2013 and projections for 2035[J]. Diabetes Research and Clinical Practice, 2014, 103(2): 137-149. DOI:10.1016/j.diabres.2013.11.002 |
| [9] |
中国老年2型糖尿病防治临床指南(2022年版)[J]. 中国糖尿病杂志, 2022, 30(1): 2-51.
|
| [10] |
张燕, 李琳琳, 木合布力.阿布力孜, 等. 新疆昆仑雪菊5种提取物对α-葡萄糖苷酶活性的影响[J]. 中国实验方剂学杂志, 2011, 17(7): 166-169. DOI:10.3969/j.issn.1005-9903.2011.07.051 |
| [11] |
LI A N, CHEN J J, LI Q Q, et al. Alpha-glucosidase inhibitor 1-Deoxynojirimycin promotes beige remodeling of 3T3-L1 preadipocytes via activating AMPK[J]. Biochemical and Biophysical Research Communications, 2018, 509(4): 1001-1007. DOI:10.1016/j.bbrc.2019.01.023 |
| [12] |
QUAN Y S, ZHANG X Y, YIN X M, et al. Potential alpha-glucosidase inhibitor from Hylotelephium erythrostictum[J]. Bioorganic and Medicinal Chemistry Letters, 2020, 30(24): 127665. DOI:10.1016/j.bmcl.2020.127665 |
| [13] |
ZHANG X, LI G, WU D, et al. Emerging strategies for the activity assay and inhibitor screening of alpha-glucosidase[J]. Food & Function, 2020, 11(1): 66-82. |
| [14] |
李玉红, 张德芹, 王茜, 等. 糖脂清对实验性2型糖尿病大鼠糖脂代谢的影响[J]. 天津中医药大学学报, 2010, 29(2): 77-79. DOI:10.11656/j.issn.1673-9043.2010.02.09 |
| [15] |
LIU J, LI Z Q, LIU H, et al. Metabolomics-Based clinical efficacy and effect on the endogenous metabolites of Tangzhiqing tablet, a Chinese patent medicine for type 2 diabetes mellitus with hypertriglyceridemia[J]. Evidence Based Complementary and Alternative Medicine: ECAM, 2018, 2018: 5490491. |
| [16] |
王威, 张德芹, 高秀梅, 等. 复方中药糖脂清对KK-Ay小鼠糖脂代谢影响的机制探讨[J]. 天津中医药, 2008(3): 223-224. |
| [17] |
焦梦悦, 高涵, 王伟娜, 等. 四种测定直链淀粉和支链淀粉方法的比较[J]. 食品工业科技, 2019, 40(12): 259-263. |
| [18] |
LI Y, ZHANG X, WANG R, et al. Altering the inhibitory kinetics and molecular conformation of maltase by Tangzhiqing(TZQ), a natural α-glucosidase inhibitor[J]. BMC Complementary Medicine and Therapies, 2020, 20(1): 350. |
| [19] |
SURYA N MEENA, UJJWAL KUMAR, MAYURI M NAIK, et al. α-Glucosidase inhibition activity and in silico study of 2-(benzo[d][1, 3]dioxol-5-yl) -4Hchromen-4-one, a synthetic derivative of flavone[J]. Bioorganic & Medicinal Chemistry, 2019, 27(12): 2340-2344. |
 2024, Vol. 43
2024, Vol. 43








