文章信息
- 陈雪梅, 邵惠丽, 高燕, 郑真, 邓碧琦, 朱立俏, 盛华刚
- CHEN Xuemei, SHAO Huili, GAO Yan, ZHENG Zhen, DENG Biqi, ZHU Liqiao, SHENG Huagang
- 不同产地玄参多糖的单糖组成及分子量测定
- Analysis of monosaccharide composition and molecular mass of Scrophularia ningpoensis polysaccharides from different regions
- 天津中医药大学学报, 2024, 43(12): 1082-1089
- Journal of Tianjin University of Traditional Chinese Medicine, 2024, 43(12): 1082-1089
- http://dx.doi.org/10.11656/j.issn.1673-9043.2024.12.06
-
文章历史
收稿日期: 2024-08-17
2. 山东沃华医药科技股份有限公司, 潍坊 261021
2. Shandong Wohua Pharmaceutical Technology Co., Ltd, Weifang 261021, China
玄参为玄参科植物玄参(Scrophularia ningpoensis Hemsl.)的干燥根,广泛分布于湖南、湖北、山西、安徽、河北南部等地,具有清热凉血,滋阴降火,解毒散结的功效[1-2]。玄参主要含环烯醚萜类、苯丙素苷类、黄酮类、挥发油、甾体类、生物碱类、多糖等化学成分[3-4],其中多糖是玄参的主要有效成分之一,有调节免疫、降血糖、抗氧化、抗肿瘤和抗炎等多种作用[5-9],具有较高的开发利用价值。目前玄参多采用水提醇沉法制备玄参粗多糖[10-11],而粗多糖中还含有蛋白质以及单糖和低聚糖,可通过反复冻融法有效除去多糖中的蛋白质[12],凝胶层析法在除去蛋白后可进一步除去单糖和低聚糖制得纯化多糖[13]。
目前中药多糖常用的单糖组成分析方法有气质联用法、毛细管电泳法、离子交换色谱法、柱前衍生化高效液相色谱法等[14-17],其中柱前衍生化高效液相色谱法(HPLC)是最近几年定量研究多糖单糖组成[18],它有灵敏度高,重复性好等优点,可同时对中性单糖和酸性单糖进行分析测定,使多糖的定量测定更加准确[19-20]。马舒伟等[11]采用了1-苯基-3-甲基-5-吡唑啉酮(PMP)柱前衍生化HPLC法测定出玄参多糖由甘露糖、葡萄糖醛酸、半乳糖醛酸、葡萄糖、半乳糖、阿拉伯糖组成,各单糖的摩尔质量百分比为24.2∶6.4∶5.0∶33.0∶17.8∶13.8。
苯酚硫酸法和蒽酮硫酸法适用于多糖含量的测定[21],由于蒽酮硫酸法测定的是溶液中全部碳水化合物的总量,其测定值一般高于苯酚硫酸法,苯酚硫酸法更加精确[22]。传统的苯酚硫酸法是以单一的葡萄糖为对照品,但多糖一般是由多种单糖构成,而不同单糖与硫酸苯酚反应后生成的有色化合物的吸光度不同,所以采用单一的葡萄糖为对照品会显著影响多糖的含量测定结果[23-24]。邓施璐等[25]分别以单一葡萄糖及按决明子多糖中单糖组成比例配制的混合单糖为对照品,采用苯酚硫酸法测定决明子的多糖含量,发现混合单糖比单一葡萄糖测得结果更加准确。
高效凝胶渗透色谱法(HPGPC)是测相对分子量普遍应用方法之一,它具有用量少、灵敏度高、重现性好且操作简便等优点[26]。在测定多糖分子量时,为防止因糖链过度伸展而造成的多糖分子量检测值过大,常用盐溶液为流动相[27],如硫酸钠溶液[28-29]、硝酸钠溶液[30]等。
文章采用柱前衍生化HPLC测定10批不同产地玄参多糖的单糖组成,并基于玄参多糖的单糖组成配制混合单糖对照品,采用苯酚硫酸法测定玄参多糖的含量;以硫酸钠为流动相采用HPGPC测定玄参多糖的相对分子量,分析不同地区玄参所含玄参多糖的差异性,可为玄参多糖的进一步研究提供依据。
1 实验材料 1.1 仪器与设备MS105DU型十万分之一电子天平:瑞士Mettler Toledo公司;X-5型紫外可见分光光度计:上海元析仪器有限公司;SCIENTZ-10N/A型冷冻干燥机:宁波新芝生物科技股份有限公司;Agilent1200型高效液相色谱仪:美国Agilent公司。
1.2 试剂与材料Sephadex G-50、再生纤维素透析袋(3500 Da):上海源叶生物科技有限公司;葡萄糖(批号:Y19F11J1087781)、半乳糖(批号:Z22J9H64187)、鼠李糖(批号:O12A10K95105)、甘露糖(批号:C11M10H82342)、半乳糖醛酸(批号:K07J1B133073)、阿拉伯糖(批号:J24M10R89091):上海源叶生物有限公司;葡聚糖5000(批号:BCCK2280)、葡聚糖12000(批号:BCCC1294)、葡聚糖25000(批号:BCCC0377)、葡聚糖50000(批号:BCCB5075)、葡聚糖410000(批号:BCCC2882):美国Sigma-Aldrich公司。无水乙醇、硫酸、盐酸、三氯甲烷、苯酚、三氟乙酸、PMP、无水硫酸钠、氢氧化钠、磷酸二氢钾、溴化钾为分析纯。
玄参饮片(批号:山东200101、安徽200301、湖北201101、重庆200801、浙江200901、河南210201、安徽210601、湖北200501、江苏210301、浙江201001):济南众和中药饮片有限公司。
2 实验方法 2.1 不同产地玄参粗多糖的制备玄参饮片粉碎成粗粉,称取粉末150 g,加入90%乙醇浸泡24 h脱脂,抽滤,烘干,加入13倍量水煎煮3次,每次1.75 h,合并滤液,浓缩至150 mL。浓缩液加入95%乙醇使醇沉浓度为50%,静置12 h,离心机离心半径70 mm,4 000 r/min离心15 min后,沉淀经无水乙醇、丙酮、乙醚依次洗涤,烘干,得到10批玄参粗多糖。
2.2 不同产地玄参多糖的分离纯化 2.2.1 玄参多糖冻融前后多糖含量比较 2.2.1.1 标准曲线的绘制精密称取经105 ℃干燥至恒重的无水葡萄糖对照品50 mg于100 mL量瓶中,加水定容至刻度,振摇混匀。分别精密量取0.2、0.4、0.6、0.8、1.0、1.2、1.4 mL至10 mL量瓶中,定容并混匀,即得浓度为0.01、0.02、0.03、0.04、0.05、0.06、0.07 mg/mL对照品溶液,采用苯酚硫酸法于490 nm波长下绘制标准曲线。
2.2.1.2 玄参多糖冻融除蛋白精密称取玄参粗多糖(重庆,200801)8.00 mg,加水溶解定容至10 mL,精密吸取2 mL转移至50 mL量瓶中,加水稀释至刻度,摇匀,即得供试品溶液。供试品溶液用苯酚硫酸法测定多糖含量。另将玄参多糖溶于水中,置-20 ℃冷冻,在室温下取出放至融化后,离心机离心半径70 mm,4 000 r/min离心15 min,弃去沉淀,反复冻融离心4次至无沉淀出现,取适量溶液用苯酚硫酸法测定多糖含量。比较冻融前后玄参多糖含量变化。
2.2.2 玄参多糖透析前后洗脱曲线对比将冻融后的玄参多糖分为两部分,一部分多糖溶液经截留分子量为3500 Da的透析袋加水透析48 h,截留液冷冻干燥后再加水溶解;另一部分多糖溶液不透析经冷冻干燥后再加水溶解。两份多糖溶液分别经0.22 μm微孔滤膜过滤后用Sephadex G-50层析柱(2.6 cm×60 cm)进行纯化,收集洗脱液,流速为1 mL/min,每管收集5 mL,各收集30管,采用苯酚硫酸法测定每管洗脱液的吸光度值,根据吸光度值的变化绘制洗脱曲线。
2.2.3 玄参多糖的制备根据“2.2.2玄参多糖透析前后洗脱曲线对比”中洗脱曲线确定的方法收集相应管中洗脱液,冷冻干燥即得纯化玄参多糖。
2.2.4 紫外吸收光谱适量称取纯化玄参多糖加水溶解,在190~900 nm波长范围内进行扫描,确定多糖是否存在蛋白、核酸等杂质。
2.3 玄参多糖单糖组成 2.3.1 玄参多糖的水解按“2.2.3玄参多糖的制备”中的方法制备不同产地玄参多糖,精密称取各产地玄参多糖10 mg于试管中,加入2 mol/L三氟乙酸溶液2 mL,混匀,充氮气封口,于110 ℃加热水解4 h。取出后将水解液旋蒸蒸干,加甲醇1 mL溶解,旋蒸蒸干,重复3次,挥去三氟乙酸,加入3 mL纯水溶解,转移至10 mL量瓶中并加水定容,备用。
2.3.2 单糖的衍生化量取水解后的玄参多糖样品500 μL,加入500 μL 0.3 mol/L NaOH溶液和500 μL 0.5 mol/L PMP甲醇溶液,70 ℃水浴加热100 min,静置冷却10 min,加入0.3 mol/L盐酸溶液500 μL中和,加入1 mL三氯甲烷萃取,涡旋1 min后,在离心半径为70 mm的离心机中,5 000 r/min离心5 min,弃下层有机相,重复萃取操作3次,过0.22 μm滤膜,进行HPLC分析。分别精密称取鼠李糖、甘露糖、葡萄糖、半乳糖、阿拉伯糖、半乳糖醛酸对照品5 mg于5 mL量瓶中,加水定容。分别量取各单糖对照品和混合单糖对照品500 μL,以及纯水500 μL作为空白对照,进行衍生化操作,过0.22 μm滤膜,进行HPLC分析。
2.3.3 HPLC色谱检测条件以Inertsil ODS-3 C18柱(4.6 mm×250 mm,5 μm)为色谱柱,以乙腈-磷酸二氢钾缓冲溶液(pH 6.8)(17∶83,V/V)为流动相,柱温为30 ℃,检测波长为250 nm,流速为1.0 mL/min,进样量为10 μL。
2.4 多糖含量的测定 2.4.1 标准曲线的绘制精密称取鼠李糖、甘露糖、葡萄糖、半乳糖、阿拉伯糖、半乳糖醛酸各10 mg,加水定容至100 mL,混匀,制得0.10 mg/mL各单糖对照品溶液。混合单糖对照品溶液按照“2.3.2单糖的衍生化”项下测定的不同产地玄参多糖中所含的单糖组成比例配制成浓度为0.10 mg/mL的混合对照品溶液。分别取1、2、3、4、5 mL混合单糖对照品溶液于5 mL量瓶中,加水定容,即得浓度为0.02、0.04、0.06、0.08、0.10 mg/mL混合单糖对照品溶液,采用苯酚硫酸法测定,绘制标准曲线,供不同批次玄参多糖含量测定。
2.4.2 方法学验证 2.4.2.1 精密度试验取“2.4.1标准曲线的绘制”中配制的0.1 mg/mL混合对照品溶液,采用苯酚硫酸法连续测定6次,求RSD值。
2.4.2.2 稳定性试验精密量取1 mL的玄参多糖溶液,采用苯酚硫酸法分别在0、10、20、30、40、50、60 min后测定吸光度,求RSD值。
2.4.2.3 重复性试验精密称取同一批次玄参多糖1.0 mg,加水定容至25 mL,采用苯酚硫酸法连续测定6次,求RSD值。
2.4.2.4 加样回收率试验精密量取9份已知多糖含量的玄参多糖30.60 μg,分别加入质量为其含量80%、100%和120%的混合单糖对照品。采用苯酚硫酸法测定,计算加样回收率和RSD值。
2.5 多糖分子量测定 2.5.1 HPGPC色谱条件PL aquagel-OH MTXED-M色谱柱(300 mm×7.5 mm,8 μm),分离范围500~500 000 Da,流动相为0.05 mol/L硫酸钠溶液,流速1 mL/min,柱温35 ℃,检测器为示差折光检测器,进样量30 μL。
2.5.2 标准曲线的绘制精密称取Dextran-T系列葡聚糖对照品(5 000、12 000、25 000、50 000、410 000 Da)溶于0.05 mol/L硫酸钠溶液配制成1 mg/mL对照品溶液,0.22 μm微孔滤膜过滤后经HPLC分析,以分子量对数为纵坐标、保留时间为横坐标绘制标准曲线。
2.5.3 多糖分子量的测定精密称取玄参多糖样品5.0 mg,用0.05 mol/L硫酸钠溶液配制成1 mg/mL多糖溶液,0.22 μm微孔滤膜过滤后经HPLC分析,根据GPC软件所给数据,分别以保留时间为横坐标和信号强度为纵坐标绘制各样品的示差色谱图,再根据保留时间和标准曲线,计算出各洗脱峰对应的分子量。
3 结果 3.1 冻融前后玄参多糖的多糖含量葡萄糖标准曲线是Y=10.551X+0.012 6,R2=0.999 8,在0.01~0.07 mg/mL范围内线性关系良好。冻融前,重庆200801批次玄参粗多糖含量为7.53%;冻融后,玄参多糖含量为8.4%。
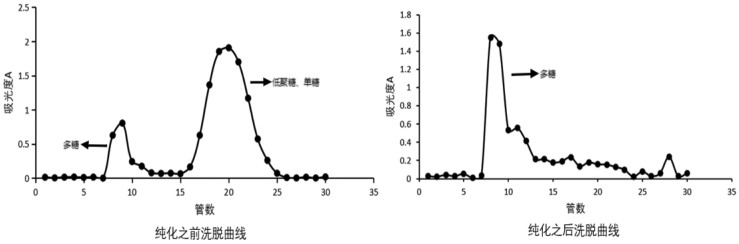
3.2 不同产地玄参多糖的分离纯化玄参多糖透析前后经过Sephadex G-50层析柱洗脱曲线对比见图 1。
|
| 图 1 玄参多糖透析前后洗脱曲线对比 |
由图 1可知,分子量大的多糖先被洗脱下来,分子量小的低聚糖和单糖后被洗脱下来,经过透析之后玄参多糖中的大部分低聚糖和单糖被除去。根据Sephadex G-50层析柱洗脱曲线收集的洗脱液,不同产地玄参多糖纯化后的得率见表 1。其中安徽200301批次纯化后玄参多糖的得率最高为11.57%,江苏210301批次得率最低为8.67%。
玄参多糖的紫外吸收光谱图见图 2。不同产地玄参多糖均在200 nm波长附近有强吸收峰,符合多糖的紫外吸收特征。260和280 nm处无明显吸收,说明多糖的纯化效果较好,几乎不存在蛋白、核酸等杂质。

|
| 图 2 不同产地玄参多糖紫外吸收光谱 |
通过对比多个单糖对照品的保留时间,可以确定玄参多糖由甘露糖、鼠李糖、半乳糖醛酸、葡萄糖、半乳糖以及阿拉伯糖组成,其中含量最多的为半乳糖醛酸,其次为半乳糖,不同产地玄参多糖的单糖组成存在差异。混合单糖对照品的色谱峰结果见图 3,各单糖对照品的保留时间及线性回归方程见表 1。不同产地玄参多糖HPLC图见图 4,玄参多糖中各种单糖组成的百分比见表 2。

|
| 注:1,甘露糖;2,鼠李糖;3,半乳糖醛酸;4,葡萄糖;5,半乳糖;6,阿拉伯糖。 图 3 混合标准单糖HPLC图 |

|
| 注:1,甘露糖;2,鼠李糖;3,半乳糖醛酸;4,葡萄糖;5,半乳糖;6,阿拉伯糖。 图 4 不同产地玄参多糖单糖组成HPLC图 |
根据不同产地玄参多糖的单糖组成的比例,配制混合单糖对照品,绘制混合单糖标准曲线,不同产地玄参多糖的混合单糖标准曲线见表 3。
对同一份玄参多糖溶液连续测定6次,计算RSD值为0.04%,说明仪器精密度良好。
3.5.3 稳定性实验在60 min内多次测定同一玄参多糖溶液的吸光度,计算RSD值为1.69%,说明玄参多糖溶液显色后在60 min内稳定。
3.5.4 重复性实验测定6份同一玄参多糖溶液,计算RSD值为1.81%,说明该方法重复性良好。
3.5.5 加样回收率实验以混合标准单糖为对照,测定玄参多糖的含量。取玄参多糖溶液适量与混合标准单糖混合测定含量,结果见表 4,计算平均回收率为101.57%,RSD值为2.61%,说明该法可行,可用于玄参多糖含量测定。
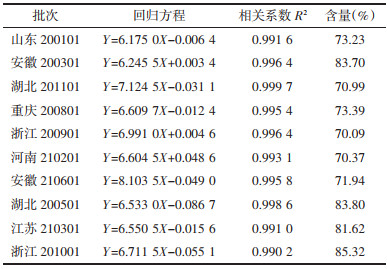
计算各批次玄参多糖的含量,结果见表 4。其中,浙江产201001批次玄参多糖含量最高为85.32%,浙江产200901批次玄参多糖含量最低为70.09%。不同产地玄参多糖的含量存在一定差异。
3.6 玄参多糖相对分子量测定 3.6.1 标准曲线绘制葡聚糖对照品保留时间与分子量对数标准曲线回归方程为Y=-0.865 5X+10.97 6,R2=0.998 6。
3.6.2 多糖分子量测定HPGPC使用的凝胶色谱柱采集时间12 min。不同产地玄参多糖经HPGPC测定,绘制示差色谱图见图 5,数据经分析得到各批次玄参多糖保留时间和相对分子量,结果见表 5。

|
| 图 5 10批玄参多糖的示差色谱图 |
研究采用了水提醇沉法制备玄参粗多糖,但研究发现高浓度乙醇除了沉淀玄参多糖外也使玄参中的部分单糖和低聚糖也沉淀析出,从而使得测得的多糖含量不准确。因此选用了反复冻融法除蛋白并用截留分子量为3 500 Da的透析膜除去单糖和低聚糖。在预实验中分别采用了Sephadex G-150和Sephadex G-150层析柱纯化玄参多糖,对比二者的洗脱曲线发现Sephadex G-150不如Sephadex G-50理想,故文章采用Sephadex G-50层析柱纯化玄参多糖。
研究采用了PMP柱前衍生化HPLC法确定10批不同产地玄参多糖由半乳糖醛酸、半乳糖、阿拉伯糖、甘露糖、鼠李糖、葡萄糖组成,结果表明不同产地玄参的单糖组成和比例均有一定的差异,其中半乳糖醛酸含量最高,可达39.75%~51.83%,半乳糖含量位于第二,约为20.54%~33.86%,阿拉伯糖含量位于第三,约为12.57%~21.45%。采用苯酚硫酸法分析出玄参多糖含量范围在70.09%~83.70%。研究表明玄参多糖的单糖组成和单糖含量与相关文献[10, 21]研究结果存在一定差异。张婷等[10]研究表明玄参多糖由甘露糖、鼠李糖、半乳糖醛酸、葡萄糖、半乳糖、阿拉伯糖组成,各单糖的平均质量比为0.48:1.40:1.00:69.80:93.00:2.20,其中其中半乳糖含量最高,占比约为52.37%~59.18%:马舒伟等[11]研究发现玄参多糖由甘露糖、葡萄糖醛酸、半乳糖醛酸、葡萄糖、半乳糖、阿拉伯糖组成,其中含量最高的是葡萄糖,占比约为32.6%~41.45%,而本研究表明玄参多糖中含量最高的单糖是半乳糖醛酸,其次为半乳糖,且单糖组成中不含葡糖糖醛酸。可能原因一是张婷等[10]的研究对象是水提醇沉法制备的玄参粗多糖,没有对玄参多糖进行进一步纯化处理,导致单糖组成存在差异;二是马舒伟等[21]通过水提醇沉法制得玄参粗多糖后,采用了大孔树脂法除色素和Sevag法除蛋白,纯化方法不同可能导致单糖组成成分存在差异。此外,中药材质量易受环境、气候、产地、加工等各种多方面因素影响,文章采用HPGPC测定玄参多糖的相对分子量,其中重庆200801批次玄参多糖相对分子量最高为122 744 Da,湖北200501批次玄参多糖相对分子量最低为89 536 Da,产地不同也是玄参多糖分子量之间存在差异的主要原因。
综上所述,研究选取了不同地区的玄参多糖,确保了样本的多样性和代表性,并采用水提醇沉法、反复冻融法和Sephadex G-50层析柱法进行提取纯化,制备出了纯度较高的玄参多糖。通过使用PMP柱前衍生化HPLC法测定了不同产地玄参多糖的单糖组成及其平均质量比、苯酚硫酸法测定多糖含量以及HPGPC法测定玄参多糖的相对分子量,对玄参多糖进行了定性分析和定量分析,并经方法学验证,确保了分析结果的准确性和可靠性,实验方法的高稳定性和重现性。实验研究成果可为玄参多糖的基础研究提供参考数据,并为玄参的质量标准提供科学依据,同时有助于进一步开发和利用玄参多糖在药物开发、食品添加剂等领域的应用前景。在文献查阅过程中,发现玄参多糖具有抗氧化和抗肿瘤能力,可以有效清除1,1-二苯基-2-三硝基苯肼自由基(DPPH自由基)和超氧阴离子自由基[7,11],对荷瘤小鼠也有较好的抑制肿瘤生长、延长小鼠生命的效果[8]。因此,在后续实验中,将进一步研究探索玄参多糖的药理作用。
| [1] |
国家药典委员会. 中华人民共和国药典: 一部[M]. 北京: 中国医药科技出版社, 2020: 121.
|
| [2] |
陈丽新, 梁伟. 玄参化学成分及药理作用的研究进展[J]. 特产研究, 2023, 45(1): 147-151. |
| [3] |
李翎熙, 陈迪路, 周小江. 玄参化学成分、药理活性研究进展及其质量标志物分析预测[J]. 中成药, 2020, 42(9): 2417-2426. |
| [4] |
刘依茹, 刘考铧, 秦路平, 等. 中药玄参的化学成分、药理活性、炮制及临床应用的研究进展[J]. 中国中药杂志, 2023, 48(16): 4302-4319. |
| [5] |
李自辉, 张宁, 董婉茹, 等. 玄参多糖对正常生理小鼠和免疫低下状态小鼠免疫功能的影响[J]. 中国药房, 2017, 28(10): 1316-1319. |
| [6] |
郑园园, 王健, 蒋剑平, 等. 玄参多糖对2型糖尿病大鼠糖脂代谢及肝胰岛素信号通路的影响[J]. 中草药, 2020, 51(6): 1586-1592. |
| [7] |
陈莉华, 廖微, 肖斌, 等. 玄参多糖体外清除自由基和抗氧化作用的研究[J]. 食品工业科技, 2013, 34(7): 86-89. |
| [8] |
邹霞, 易萍, 曹江. 玄参多糖抗肿瘤作用的实验研究[J]. 中国医药指南, 2015, 13(10): 69-70. |
| [9] |
高丽娜, 周利润, 李曼曼, 等. 硫酸化修饰对玄参多糖抗炎活性的影响[J]. 中国现代应用药学, 2021, 38(12): 1431-1435. |
| [10] |
张婷, 孙红梅, 李振, 等. 响应面法优化水提醇沉玄参多糖工艺及其含量分析[J]. 中国现代中药, 2021, 23(4): 679-684, 697. |
| [11] |
马舒伟, 刘兴艳, 贾占东, 等. 不同提取方法对玄参多糖单糖组分和抗氧化活性的影响[J]. 中华中医药学刊, 2020, 38(1): 220-224, 285. |
| [12] |
任洪飞, 逄梦玉, 隋昕怡, 等. 反复冻融法制备灵芝多糖工艺优化、结构表征及抗氧化活性分析[J]. 食品工业科技, 2024, 45(8): 11-20. |
| [13] |
米圣成, 徐晓杰, 魏菱鸽, 等. 元宝枫种仁多糖提取纯化、结构表征以及降糖活性研究[J]. 食品工业科技, 2024, 45(8): 29-38. |
| [14] |
刘玉红, 张岱州, 任文静, 等. GC和HPLC分析北豆根多糖的单糖组成的方法比较[J]. 化学研究与应用, 2020, 32(8): 1514-1518. |
| [15] |
林晓燕, 贺阳洁, 胡筱, 等. 柱前衍生-高效毛细管电泳法分析太子参多糖中的单糖组成[J]. 福建中医药, 2021, 52(11): 26-29. |
| [16] |
王梓轩, 李娅琦, 柳国霞, 等. 高效阴离子交换色谱-脉冲安培检测法测定枸杞多糖的单糖及糖醛酸组成[J]. 中华中医药杂志, 2021, 36(10): 6082-6085. |
| [17] |
张璐, 杨莹莹. 高效液相色谱法测定党参多糖的单糖组成及含量[J]. 中国食品添加剂, 2021, 32(12): 163-169. |
| [18] |
郭志烨, 韩丽, 杨明, 等. 中药多糖定量测定方法的探讨[J]. 中成药, 2014, 36(10): 2172-2176. |
| [19] |
王淑娜, 杨丽雅, 余登香, 等. 山豆根多糖的制备、单糖组成及体外抗肿瘤作用[J]. 中国新药杂志, 2023, 32(11): 1155-1162. |
| [20] |
徐洲, 达小梅. PMP柱前衍生HPLC法测定松乳菇多糖的单糖组成[J]. 西昌学院学报(自然科学版), 2023, 37(3): 1-6. |
| [21] |
万晓莹, 刘振丽, 宋志前, 等. 中药多糖含量测定方法研究[J]. 中国中医基础医学杂志, 2021, 27(7): 1175-1178. |
| [22] |
夏文, 杜洪志, 董立莎, 等. 蒽酮-硫酸法与苯酚-硫酸法测定切面红色与切面白色土茯苓药材中多糖含量的比较[J]. 时珍国医国药, 2015, 26(11): 2572-2574. |
| [23] |
钟方晓, 任海华, 李岩. 多糖含量测定方法比较[J]. 时珍国医国药, 2007, 18(8): 1916-1917. |
| [24] |
白瑞斌, 马玉玲, 张培, 等. 苯酚-硫酸法结合校正因子法测定含半乳糖醛酸的多糖中的糖含量[J]. 中国药房, 2017, 28(21): 2974-2978. |
| [25] |
邓施璐, 龙远春, 张兵, 等. 决明子多糖含量测定方法[J]. 南昌大学学报(理科版), 2019, 43(3): 241-245. |
| [26] |
闫光玲, 张锋, 金娟, 等. 金银花多糖分子量及单糖组成研究[J]. 中国中医药信息杂志, 2019, 26(2): 97-101. |
| [27] |
侯重文, 朱梓昂, 张金华, 等. 高效凝胶色谱法测定贻贝多糖含量及分子量[J]. 中国生化药物杂志, 2016, 36(11): 9-12. |
| [28] |
徐蕾, 王瑾, 陈涛, 等. 对照品及流动相对海藻酸钠分子量测定的影响[J]. 青岛大学学报(自然科学版), 2022, 35(2): 19-22, 28. |
| [29] |
王莹, 许玮仪, 李丽潇, 等. 注射用黄芪多糖相对分子质量测定方法的比较及研究[J]. 药学学报, 2019, 54(2): 348-353. |
| [30] |
杨培, 董文亮, 董梅月, 等. 北豆根多糖的单糖组成分析及分子量研究[J]. 山东中医杂志, 2019, 38(5): 482-486. |
 2024, Vol. 43
2024, Vol. 43