文章信息
- 李焕敏, 李艳娇, 彭莹莹, 孙婷, 孙丹, 韩耀巍, 马莉婷, 李新民
- LI Huanmin, LI Yanjiao, PENG Yingying, SUN Ting, SUN Dan, HAN Yaowei, MA Liting, LI Xinmin
- 清宣通络方通过外泌体miRNA-146a靶向TRAF6基因抑制肺炎支原体感染诱导肺泡上皮细胞炎性损伤的研究
- Qingxuan Tongluo Formula regulates TRAF6 gene through exosomal miRNA-146a regulating inflammatory injury induced by mycoplasma pneumoniae infection in alveolar epithelial cells
- 天津中医药大学学报, 2024, 43(12): 1107-1115
- Journal of Tianjin University of Traditional Chinese Medicine, 2024, 43(12): 1107-1115
- http://dx.doi.org/10.11656/j.issn.1673-9043.2024.12.09
-
文章历史
收稿日期: 2024-07-15
2. 天津中医药大学, 天津 301617
2. Tianjin University of Traditional Chinese Medicine, Tianjin 301617, China
肺炎支原体(MP)是引起儿童社区获得性肺炎的常见病原。肺炎支原体肺炎(MPP)发病率约占社区获得性肺炎的10%~40%[1]。MPP多见于学龄期儿童和青少年,临床以发热、咳嗽为主要表现,部分患儿可合并肺部或肺外多系统并发症。由于喹诺酮类和四环素类抗生素对儿童生长发育的影响,目前针对儿童MPP的治疗首选阿奇霉素等大环内酯类抗生素,但随着大环内酯类抗生素耐药率的增加,重症及难治性MPP发病率亦逐渐上升,MPP的治疗仍然面临着严峻的挑战[2-3]。
MP感染后引起的免疫炎性损伤是导致疾病难治、病情进展至重症及出现多系统肺外并发症的重要原因[4]。前期临床研究[5-6]和动物实验结果证实清宣通络方临床疗效确切,且具有上调机体能量代谢、缓解氧化应激、激活纤溶系统、减轻MPP小鼠免疫炎性损伤等多重作用[7]。外泌体广泛存在于血液、唾液等体液中,含有蛋白质、脂质类和核酸等生物活性物质,参与细胞间物质交换及信息交流,在各种生理和病理过程中发挥重要作用[8-9]。microRNA(miRNA)是外泌体核酸的主要组成部分,能够被靶细胞摄取,进而如同内源性的miRNA一样,通过沉默靶基因而发挥作用[10]。研究表明,miRNA-146a可以通过靶向调控肿瘤坏死因子受体相关因子6(TRAF6)基因,作用于白介素(IL)-17/细胞间黏附分子(ICAM)和核因子-κB(NF-κB)通路,调节免疫和炎症反应[11-12]。然而miRNA-146a是否可以通过靶向调控TRAF6基因调节MP感染诱导的炎性损伤及清宣通络方是否可以通过外泌体减轻炎性损伤尚不明确,研究主要就以上问题进行探讨。
1 材料 1.1 菌株MP标准株(M129-B7)购自于美国ATCC公司。将MP标准菌株在37 ℃、5%二氧化碳(CO2)的恒温恒湿培养箱中静置培养,待培养基由红色变为黄色时表明有MP的繁殖,并重复此步骤2次,取第3次测定MP浓度。以菌液发生颜色改变的最高稀释度为颜色改变单位,采用CCU法测定MP菌株浓度,留取1×107 CCU/mL菌液备用。
1.2 动物SPF级别BALB/C雄性小鼠26只,周龄为4~6周,体质量15~20 g,购自于斯贝福(北京)生物技术有限公司,在P2实验室喂养,环境温度21~26 ℃,湿度50%~60%。(伦理审查批号:MDL20210520-01;实验动物许可证号:SYXK(津滨)2022-004)。动物实验遵循减少、优化和替代的3R原则。
1.3 药物清宣通络方组成:麻黄6 g,苦杏仁6 g,生石膏25 g,连翘10 g,金银花10 g,郁金10 g,僵蚕10 g,柴胡10 g,葛根10 g和甘草6 g(专利号:ZL201810211552.5,由天津中医药大学第一附属医院药剂科提供),阿奇霉素干混悬剂(国药准字10960112 0.1g辉瑞制药有限公司)。
1.4 主要试剂及仪器DNA提取试剂盒(DN07,aidlab),外泌体提取试剂盒(吉赛生物,E5002),蛋白酶抑制剂(MDL,MD912893),中等蛋白分子量marker(Thermo,26617),Anti-actin(MDL,MD6553),CD63 abcam,Ab217345),CD81(abcam,Ab109201)。YCP系列气套二氧化碳培养箱(YILIANG),荧光定量聚合酶链式反应(PCR)仪(Applied biosystems(USA),StepOne Software),电泳仪(biorad,EPS 300),凝胶成像仪(biorad,2500)。
2 方法 2.1 小鼠模型建立及分组24只SPF级别BALB/C雄性小鼠在P2实验室适应性喂养3 d后随机分为4组(空白组、MPP组、阿奇霉素组、清宣通络方组),每组6只。动物模型构建根据参考文献[7]用蘸有乙醚的手帕使小鼠吸入麻醉,取100 μL 1×107 CCU/mL的MP菌液缓慢滴入小鼠的鼻腔,利用小鼠自然呼吸使其将菌液全部吸入肺内,并保持直立体式15 s左右。于模型构建开始的1、3、5 d隔日滴鼻3次,空白组以相同剂量的不含菌液的MP液体培养基滴鼻。各组在滴鼻结束后第2天开始进行干预治疗,每天上午进行灌胃给药1次,共给药5 d。空白组、MPP组予生理盐水按每次0.4 mL/10 g;阿奇霉素组予阿奇霉素按10 mg/kg给药浓度,配制成溶液每次0.4 mL/10 g;清宣通络方组予清宣通络方按生药含量2.4 g/mL配制成溶液每次0.4 mL/10 g。模型建立后每日对小鼠进行行为学数据采集,并于药物干预完成后第2天进行宰杀,取小鼠肺组织进行肺炎支原体PCR鉴定、苏木精-伊红(HE)染色和肺组织病理学评分以评价MPP动物模型构建成功。
2.2 miRNA-146a核酸构建、细胞转染及分组 2.2.1 miRNA-146a核酸构建miRNA-146a模拟物为miRNA-146a mimic,双链;miRNA-146a抑制剂为miRNA-146a inhibitor,单链;miRNA-146a模拟物阴性对照为miRNA-NC。miRNA-146 mimic和miRNA-146 inhibitor为miRNA的成熟序列(UGAGAACUGAAUUCCAUGGGUU)及miRNA base accessition(MIMAT0000158)合成。miRNA-146a mimic阴性对照序列为UCACAACCUCCUAGAAAGAGUAGA。细胞转染所用片段均由上海生工公司合成。
2.2.2 细胞转染取2只空白组小鼠分离肺组织Ⅱ型肺泡上皮细胞,培养传代至对数生长期,调整细胞密度至1×105/mL,以每组2孔、每孔2 mL细胞悬液接入6孔板,37 ℃培养过夜。转染前2 h,将细胞培养基换成无血清培养基,按miRNA-146a核酸(20 μmol/L)与转染试剂Lipofecta mine 2000在Opti-MEM培养液中以1∶1比例混合,室温孵育20 min,制备转染预混液。弃去细胞原培养液,加入含有5%胎牛血清Opti-MEM培养液,将转染预混液逐滴加入融合至60%~70%的肺泡上皮细胞中,置于37 ℃,5% CO2培养箱中孵育72 h。
2.2.3 细胞分组肺泡上皮细胞铺展面积占培养瓶面积60%~70%时,将其分为正常对照组、MP感染组、miRNA-146a过表达组、miRNA-146a抑制剂组和miRNA-NC阴性对照组。正常对照组细胞全程正常培养;MP感染组细胞予以PBS重悬的107/mL的1ml MP菌株(大约1×107 CFU/106 cells)感染细胞;miRNA-146a过表达组、miRNA-146a抑制剂组和miRNA-NC阴性对照组细胞分别转染miRNA-146a模拟物、miRNA-146a inhibitor、阴性对照miRNA-NC,并于转染72 h后用MP菌株进行感染。
2.3 外泌体提取及鉴定收集各组细胞培养液上清,应用差速离心法配合试剂盒法提取外泌体,-80 ℃保存。取部分外泌体冰上解冻,用预冷的1×PBS重悬,移液枪轻轻吹匀后滴加在铜网上,30%磷钨酸负染,室温干燥后将铜网置于透射电镜下观察和拍照记录,观察外泌体形态。用BCA法对提取的外泌体进行蛋白定量,应用蛋白免疫印迹法(Western blot)对检测外泌体表面标志蛋白CD63和CD81表达情况。
2.4 肺泡灌洗液来源外泌体干预肺泡上皮细胞收集清宣通络方组小鼠肺泡灌洗液并提取外泌体,MP感染肺泡上皮细胞12 h后,miRNA-146a抑制剂组肺泡上皮细胞传代培养后,用肺泡灌洗液来源外泌体干预72 h,收集细胞培养液上清进行分析。
2.5 实验指标的检测 2.5.1 行为学数据采集模型建立成功后,于每日药物干预前,在同一时间对小鼠进行称质量,测量小鼠肛温,测量小鼠咳嗽次数及咳嗽潜伏期。方法:将15%的氨水溶液,使用雾化器雾化后将雾化气加入烧杯中60 s后,关闭雾化器风口烧;记录小鼠咳嗽潜伏期及3 min内咳嗽次数;咳嗽表型可表现为腹肌收缩的同时张口,有时可伴有咳声。计算剩余食量,记录气促竖毛和倦怠的情况,连续观察5 d。
2.5.2 肺组织MP PCR鉴定各组小鼠干预治疗结束后隔日在无菌条件下进行宰杀,取右肺中叶放于-196 ℃液氮中速冻。将解冻的肺组织在液氮中研磨成细粉后取20~50 mg,加入细胞裂解液,随后根据DNA提取试剂盒说明书提取肺组织DNA,PCR检测肺组织MP-DNA载量。
引物设计:MP Forward:5’-GAAGCTTATGGTAGTACAGGTTGG-3’;MP Reverse:5’-ATTACCATCCTTGTTGTAAGG-3’。
2.5.3 肺组织HE染色取左侧肺组织于10%福尔马林中固定24 h,石蜡包埋并切片,组织切片于60 ℃温度下烤片4~6 h。切片常规脱蜡至水,随后用配置好的Weigert铁苏木素染色5~10 min,酸性乙醇分化液分化水洗,Masson蓝化液返蓝水洗1 min,蒸馏水洗1 min,丽春红品红染色液染色5~10 min,弱酸工作液洗1 min,磷钼酸溶液洗1~2 min,弱酸工作液洗1 min,直接入苯胺蓝染色液中染色1~2 min,弱酸工作液洗1 min,95%乙醇快速脱水,无水乙醇脱水3次,二甲苯透明3次。中性树胶封固,光镜下观察肺组织结构变化。
2.5.4 肺组织病理评分根据病理特征对肺组织进行打分,具体分类如下。A:细支气管周围/支气管浸润部位的百分率:0=无,1=少许(<25%),2=许多(25%~75%);3=所有(> 75%);B:细支气管/支气管周围浸润的定性:0=无,偶见轻微浸润或支气管周围淋巴样细胞团块见于正常动物;1=轻,不正常,常常伴有间断的环;2=中度,完整的环或新月形的环,伴有 < 5个细胞的厚度;3=严重,完全的环,伴有 > 5~10个细胞厚度;C:细支气管/支气管腔渗出:0=无;1=轻度,< 25%腔闭合;2=重度,> 25%腔,闭合;D:血管周围浸润(部位的百分率):0=无;1=少(< 10%);2=许多(10%~50%);3=大多数(> 50%);E:实质性肺炎:0=无;1=轻度,斑状实质性浸润;2=重度,斑状融合的实质性浸润。最后,将A至E 5项的打分加和作为最终的病理评分。
2.5.5 实时荧光定量聚合酶链式反应(RT-qPCR)法检测肺组织、外泌体miRNA-146a及肺泡上皮细胞TRAF6 mRNA表达水平各组小鼠干预治疗结束后第2天进行宰杀收集肺组织,MP菌株感染各组肺泡上皮细胞12 h后收集肺泡上皮细胞,Trizol法提取样本总RNA,使用核酸浓度测定仪测定RNA浓度和纯度。逆转录使用invitrogen的逆转录试剂盒superscriptⅢ,反应结束后将产物置于-20 ℃待用,根据说明书步骤构建反应体系并进行后续检测。
miRNA-146a反转录引物:5’-GTCGTATCCAGTGCAGGGTCCGAGGTATTCGC-3’,Forward:5’-ACTGGATACGACAACCCA-3’,Reverse:5’-GAGAACTGAATTCCATGGG-3’;U6 Forward:5’-CTCGCTTCGGCAGCACA-3’,Reverse:5’-AACGCTTCACGAATTTGCGT-3’;traf6 Forward:5’-CGCTGCAGTGAAAGATGACA-3’,Reverse:5’-CACATCGTAGCCCTGGATCT-3’,actin Forward:5’-CTCCTGAGCGCAAGTACTCT-3’,Reverse:5’-TACTCCTGCTTGCTGATCCAC-3’。
2.5.6 酶联免疫吸附试验(ELISA)法检测细胞培养液中IL-17、IL-6及TNF-α含量MP菌株感染各组肺泡上皮细胞12 h后,收集细胞培养液上清。用清宣通络方组小鼠肺泡灌洗液来源外泌体干预miRNA-146a抑制剂组肺泡上皮细胞后收集培养液上清。用ELISA试剂盒检测各组细胞培养上清中IL-17、IL-6及TNF-α表达水平。
2.6 统计学方法实验数据使用SPSS 25.0进行统计分析,计量资料用均数±标准差(x±s)表示,符合正态分布,方差齐,使用独立样本t检验;若不符合正态分布,用非参数检验;重复测量的计量资料,使用重复测量方差分析,P>0.05为无统计学意义,P < 0.05为有统计学意义。
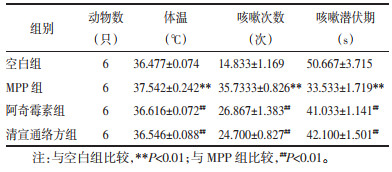
3 结果 3.1 小鼠体温及咳嗽情况MPP小鼠较空白组出现程度不同的气促、精神倦怠、毛发不光泽和竖毛现象,及体温明显升高,咳嗽次数增加和咳嗽潜伏期缩短,差异具有统计学意义(P<0.01)。清宣通络方组、阿奇霉素组较MPP组小鼠出现体温下降,咳嗽次数减少及咳嗽潜伏期延长,差异具有统计学意义(P<0.01)。见表 1。
MPP组在144bp处出现特异性条带变亮,表明MP载量增加。阿奇霉素组和清宣通络方组MP特异性条带亮度较MPP组变弱。见图 1。

|
| 图 1 肺组织肺炎支原体PCR鉴定 |
肺组织HE染色结果显示,空白组小鼠肺组织肺泡充盈适中,肺泡隔腔正常,肺泡腔内未见明显炎细胞渗出及浸润;MPP组小鼠肺组织出现肺泡间隔变宽,肺泡腔受到挤压甚至肺泡腔消失,并可见核深染且呈现多核叶的中性粒细胞浸润。HE病理评分结果显示,MPP组小鼠肺组织的炎性程度较空白组著性增加,差异具有统计学意义(P < 0.01),阿奇霉素组和清宣通络方组小鼠肺组织炎性程度较MPP组明显减弱,差异具有统计学意义(P < 0.01),见图 2。
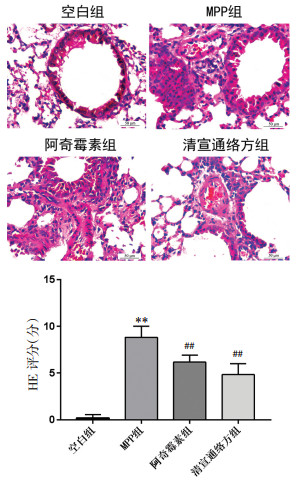
|
| 注:n=6。与空白组比较,**P<0.01;与MPP组比较,##P<0.01。 图 2 肺组织HE染色和病理评分(×400) |
从肺泡上皮细胞培养液上清中提取外泌体后,在透射电子显微镜下观察其形态大小,为脂质膜包裹的小囊泡,直径约为100 nm,大小不一,形态类圆形或椭圆形类似茶托。见图 3。
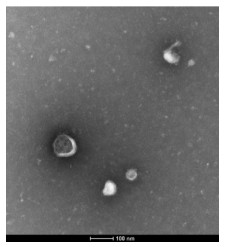
|
| 图 3 外泌体形态学特征鉴定 |
Western blot法检测各组肺泡上皮细胞培养液上清来源外泌体表面标志蛋白表达情况,各组均有外泌体表面特征蛋白CD63和CD81的表达。结合透射电子显微镜对外泌体形态学特征观察,实验结果与相关文献对外泌体的特征描述一致,证实提取物为外泌体。见图 4。
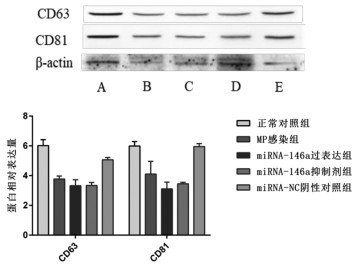
|
| 注:A,正常对照组;B,MP感染组;C,miRNA-146a过表达组;D,miRNA-146a抑制剂组;E,miRNA-NC阴性对照组。 图 4 外泌体表面标志蛋白CD63和CD81表达水平 |
与正常对照组相比,肺泡上皮细胞培养液上清来源外泌体miRNA-146a表达水平在MP感染组和miRNA-146a抑制剂组降低,差异具有统计学意义(P < 0.01),且miRNA-146a抑制剂组降低更加显著(P < 0.01);在miRNA-146a过表达组升高,差异具有统计学意义(P < 0.01)。与正常对照组相比,MP感染组和miRNA-146a抑制组TRAF6 mRNA表达水平升高(P < 0.01);与MP感染组相比,miRNA-146a过表达组TRAF6 mRNA水平降低(P < 0.01),而miRNA-146a抑制组显著升高(P < 0.01),差异均具有统计学意义。见表 2和图 5。

|
| 注:与正常对照组比较,*P<0.05,**P<0.01;与MP感染组比较,##P<0.01;与miRNA-146a过表达组比较,▲▲P<0.01。 图 5 外泌体miRNA-146a和肺泡上皮细胞TRAF6 mRNA相对表达量(x±s,n=3) |
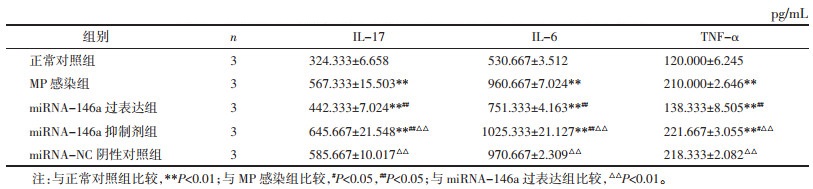
IL-17、IL-6和TNF-α表达水平在MP感染组、miRNA-146a过表达、miRNA-146a抑制剂组较正常对照组均升高(P < 0.01);在miRNA-146a抑制剂组较MP感染组表达水平升高(P < 0.05);在miRNA-146a过表达组较MP感染组、miRNA-146a抑制剂组表达水平降低(P < 0.01),见表 3。
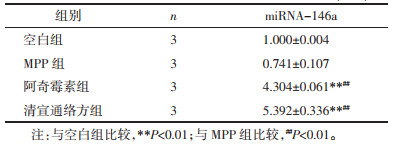
miRNA-146a表达水平在MPP模型组中较正常对照组呈降低趋势,在清宣通络方组和阿奇霉素组较MPP组升高,差异具有统计学意义(P < 0.01)。见表 4。
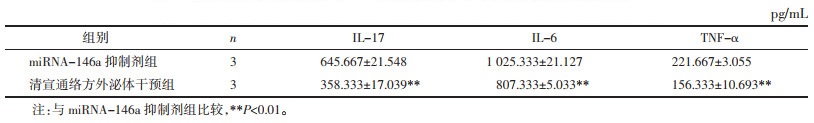
来源于清宣通络方组MPP小鼠肺泡灌洗液外泌体与miRNA-146a抑制剂组肺泡上皮细胞共培养后,细胞培养液上清中IL-17、IL-6和TNF-α炎性因子表达水平降低,差异具有统计学意义(P < 0.01)。见表 5。
目前MP的致病机制主要包括直接黏附、营养消耗、细胞毒效应等因素造成的直接损害机制和细胞免疫、体液免疫、炎性浸润等造成的免疫损伤机制[4]。其中免疫介导的肺部炎性损伤是MPP发病过程中的重要环节,MP诱发的免疫过程涉及固有免疫、细胞免疫、体液免疫等多个方面,这些免疫反应的过度激活既是预防或控制感染的有效途径,也是导致疾病进展至重症和难治的重要原因[13]。
儿童MPP与其他病原体引起的肺炎相比,具有发热程度重,持续时间长,咳嗽以刺激性干咳为主,病程缠绵难愈,肺部常见大叶性和间质性病理改变,易见高凝状态或凝血功能异常的特点[14-15]。早期诊断并及时应用大环内酯类药物治疗仍能缩短大环内酯类耐药患儿的病程和发热时间[16]。基于MPP的以上特点,针对儿童MPP早期风热闭肺证,李新民教授提出“病初肺闭尤应重视,化瘀通络贯彻始终”的观点,并在此基础上创立了清宣通络方。清宣通络方是在麻杏石甘汤基础上增加透散外邪之金银花、连翘,清热解肌之柴胡、葛根,活血通络之郁金、僵蚕。课题组在此治疗法则的基础上,前期对513例MPP风热闭肺证患儿采用回顾性队列研究的结果显示,初步提示清宣通络方能有效提高MPP患儿退热时间、临床痊愈时间,缩短住院病程,提高临床治愈率[5]。课题组进一步临床研究显示,清宣通络方联合阿奇霉素治疗MPP患儿在提高早期退热时间、临床痊愈时间上均明显优于单纯应用阿奇霉素治疗[6],表明清宣通络方在提高早期退热疗效的同时,可显著缩短病程。同时,课题组通过前期探索性实验建立了一套稳定可靠的MP感染急性期小鼠模型,实验结果显示,清宣通络方可明显改善MPP模型小鼠发热情况,减轻肺部炎性浸润,调节MPP中存在的免疫损伤[7]。
TRAF6是一种衔接蛋白,能够介导广泛的蛋白质-蛋白质相互作用[17],对IL-17介导的免疫炎症发展至关重要[18]。miRNA可通过与目标mRNA的3’UTRs不完全互补结合在翻译水平抑制蛋白合成,或近乎完全互补结合在转录后水平使其降解[19]。miRNA-146a是miRNA-146 miRNA家族的成员,是近年来研究较前言和较广泛的miRNA之一,在炎症、免疫和肿瘤等多种生物体的生理、病理过程中发挥重要作用[20]。Taganov等[21]对miRNA-146a的基因表达进行分析,发现miRNA-146a是NF-κB依赖性的,能对多种微生物成分和促炎细胞因子作出响应,可通过结合TRAF6 3’UTR中的多个位点直接靶向TRAF6转录来调节免疫功能。目前,miRNA-146a对TRAF6表现出的负向调控作用已经在多种免疫炎性疾病中发现,但笔者在MPP中尚未见到相关报道。外泌体是从细胞中释放出的最小的细胞囊泡之一,已显示出携带miRNA等不同的核酸物质在细胞之间进行信息通讯,miRNA通过转录后抑制基因表达的形式来显著调节细胞生长和代谢[22]。外泌体具备完善的信息传输任务,可以调节各种生理和病理活动,它们通过将信息传递到邻近或远处的受体细胞并对其功能进行重新编程来实现[23]。
本研究通过体外构建MP感染的miRNA-146a过表达、抑制的肺泡上皮细胞模型,发现MP感染能够诱导肺泡上皮细胞中TRAF6 mRNA和IL-17、IL-6和TNF-α等炎性因子水平升高,miRNA-146a抑制后两者含量进一步上调,而miRNA-146a过表达后两者水平均显著下降。说明IL-17、IL-6和TNF-α等炎性因子水平随着TRAF6基因的上调而高表达,而miRNA-146a可以通过调控TRAF6基因,减轻MP感染引起的炎性损伤。由此表明,在MP感染的体外细胞模型中,miRNA-146a可能以外泌体为载体,通过对肺泡上皮细胞中TRAF6 mRNA的表达抑制,进而负向调节MP感染引起的炎性因子升高。随后,为了进一步明确外泌体作为一种介质可以传递信息,收集清宣通络方干预治疗的MPP小鼠肺泡灌洗液,并提取外泌体,随后与miRNA-146a抑制剂组肺泡上皮细胞共培养,结果发现miRNA-146a抑制组肺泡上皮细胞培养液上清中IL-17、IL-6和TNF-α炎性因子水平显著降低。同时,对清宣通络方组小鼠肺组织中miRNA-146a水平进行检测,发现清宣通络方能显著上调MPP小鼠肺组织中miRNA-146a的表达。由此推测,清宣通络方可能通过外泌体参与抑制MPP的炎性损伤,而miRNA-146a是其发挥免疫调节功能的主要物质。
近年来,miRNA-146a在调节免疫和炎症反应中的功能被广泛研究,是先天免疫应答的主要负反馈调节因子。亦有学者报道[24],血清microRNA-146a在MPP患儿中下调,与促炎细胞因子IL-6、TNF-α、IL-8呈负相关。在机制上,miRNA-146a靶向myd88依赖性信号通路的关键组分,如IRAK1和TRAF6,导致各种炎症介质合成的协同减少[25]。TRAF6能介导多种炎症反应和天然免疫信号通路,在触发和传播IL-17介导的炎症反应中起重要作用[26]。IL-17家族可以诱导包括NF-κB和MAPK等在内的常见信号传导途径,而TRAF6是IL-17诱导NF-κB活化和产生促炎蛋白基因所必需的[27]。当MP进入下呼吸道后,其脂蛋白被Toll样受体识别,可通过TIR结构域或IL-17R与TRAF6连接,TRAF6作为关键信号转导蛋白激活NF-κB炎性通路,促进TNF-α、IL-6、IL-8、前列腺素、粒-单核细胞集落刺激因子等炎性因子高表达引起机体过强炎症反应,造成机体组织损伤。
综上所述,可以推测清宣通络方可通过上调miRNA-146a表达,以外泌体为载体携带miRNA-146a靶向调控TRAF6基因的表达,从而抑制IL-17、IL-6和TNF-α等炎性因子释放,进而减轻MP感染诱导的炎性损伤。但本研究尚未对外泌体在体内的具体来源和作用靶细胞进行验证,其深层次的作用机制将在课题组的后续实验中进一步阐释。
| [1] |
WALLER J L, DIAZ M H, PETRONE B L, et al. Detection and characterization of mycoplasma pneumoniae during an outbreak of respiratory illness at a university[J]. Journal of Clinical Microbiology, 2014, 52(3): 849-853. DOI:10.1128/JCM.02810-13 |
| [2] |
ZHANG W Z, ZHANG S J, WANG Q Y, et al. Outbreak of macrolide-resistant mycoplasma pneumoniae in a primary school in Beijing, China in 2018[J]. Bmc Infectious Diseases, 2019, 19(1): 871. DOI:10.1186/s12879-019-4473-6 |
| [3] |
HONG K B, CHOI E H, LEE H J, et al. Macrolide resistance of mycoplasma pneumoniae, South Korea, 2000-2011[J]. Emerg Infect Dis, 2013, 19(8): 1281-1284. DOI:10.3201/eid1908.121455 |
| [4] |
PODDIGHE D. Extra-pulmonary diseases related to mycoplasma pneumoniae in children: recent insights into the pathogenesis[J]. Curr Opin Rheumatol, 2018, 30(4): 380-387. DOI:10.1097/BOR.0000000000000494 |
| [5] |
韩耀巍, 李新民, 杜洪喆, 等. "宣肺清热, 化瘀通络"法治疗小儿肺炎支原体肺炎风热闭肺证患者266例疗效分析[J]. 天津中医药, 2019, 36(9): 869-872. |
| [6] |
肖莹. 清宣通络方联合阿奇霉素治疗小儿肺炎支原体肺炎的临床研究[D]. 天津: 天津中医药大学, 2019.
|
| [7] |
WEI L N, ZHONG W L, SUN T, et al. Proteomic and mechanistic study of Qingxuan Tongluo formula and curcumin in the treatment of mycoplasma pneumoniae pneumonia[J]. Biomed Pharmacother, 2021, 133: 110998. DOI:10.1016/j.biopha.2020.110998 |
| [8] |
NAVAJAS R, CORRALES F J, PARADRLA A. Serum exosome isolation by size-exclusion chromatography for the discovery and validation of preeclampsia-associated biomarkers[J]. Methods Mol Biol, 2019, 1959: 39-50. |
| [9] |
陈文生, 赵颖海. 外泌体提取方法及其在人类疾病中的研究进展[J]. 海南医学, 2019, 30(22): 2977-2980. DOI:10.3969/j.issn.1003-6350.2019.22.037 |
| [10] |
ZAHARIE F, MURESAN M S, PETRUSHEV B, et al. Exosome-carried microRNA-375 inhibits cell progression and dissemination via Bcl-2 blocking in colon cancer[J]. Journal of Gastrointestinal And Liver Diseases, 2015, 24(4): 435-443. DOI:10.15403/jgld.2014.1121.244.375 |
| [11] |
YIN Y Q, LI F, SHI J, et al. MiR-146a regulates inflammatory infiltration by macrophages in polymyositis/dermatomyositis by targeting TRAF6 and affecting IL-17/ICAM-1 pathway[J]. Cell Physiol Biochem, 2016, 40(3-4): 486-498. DOI:10.1159/000452563 |
| [12] |
BHAUMIK D, SCOTT G K, SCHOKRPUR S, et al. Expression of microRNA-146 suppresses NF-kappaB activity with reduction of metastatic potential in breast cancer cells[J]. Oncogene, 2008, 27(42): 5643-5647. DOI:10.1038/onc.2008.171 |
| [13] |
张海邻, 陈志敏, 刘瀚旻, 等. 肺炎支原体感染的致病机制[J]. 中华儿科杂志, 2016(2): 243-245. |
| [14] |
蒋星华, 周良芳, 邓剑, 等. 儿童肺炎支原体感染920例临床分析[J]. 中南医学科学杂志, 2019, 47(2): 195-197. |
| [15] |
魏娜. 儿童肺炎支原体肺炎凝血功能和免疫功能相关指标水平变化及其临床意义[J]. 中国医药导报, 2016, 13(32): 94-97. |
| [16] |
冯雪莉, 李勤静, 孙琳, 等. 大环内酯类耐药和敏感的肺炎支原体肺炎临床特点病例对照研究[J]. 中国循证儿科杂志, 2016, 11(5): 357-360. |
| [17] |
ISHIDA T, MIZUCHIMA S I, AZUMA S, et al. Identification of TRAF6, a novel tumor necrosis factor receptor-associated factor protein that mediates signaling from an amino-terminal domain of the CD40 cytoplasmic region[J]. J Biol Chem, 1996, 271(46): 28745-28748. DOI:10.1074/jbc.271.46.28745 |
| [18] |
MATSUMOTO R, DAINICHI T, TSUCHIYA S, et al. Epithelial TRAF6 drives IL-17-mediated psoriatic inflammation[J]. JCI Insight, 2018, 3(15): e121175. DOI:10.1172/jci.insight.121175 |
| [19] |
LLAVE C, XIE Z X, KASSCHAU K D, et al. Cleavage of Scarecrow-like mRNA targets directed by a class of arabidopsis miRNA[J]. Science, 2002, 297(5589): 2053-2056. DOI:10.1126/science.1076311 |
| [20] |
WILLIAMS A E, PERRY M M, MOSCHOS S A, et al. Role of miRNA-146a in the regulation of the innate immune response and cancer[J]. Biochemical Society Transactions, 2008, 36(Pt6): 1211-1215. |
| [21] |
TAGANOV K D, BOLDIN M P, CHANG K J, et al. NF-kappaB-dependent induction of microRNA miR-146, an inhibitor targeted to signaling proteins of innate immune responses[J]. Proceedings of The National Academy of Sciences of The United States of America, 2006, 103(33): 12481-12486. |
| [22] |
YU X J, ODENTHAL M, FRIES J W U. Exosomes as miRNA carriers: formation-function-future[J]. International Journal of Molecular Sciences, 2016, 17(12): 2028. DOI:10.3390/ijms17122028 |
| [23] |
GREENING D W, GOPAL S K, XU R, et al. Exosomes and their roles in immune regulation and cancer[J]. Seminars in Cell & Developmental Biology, 2015, 40: 72-81. |
| [24] |
WANG Z, CHU C, DING Y, et al. Clinical significance of serum microRNA-146a and inflammatory factors in children with mycoplasma pneumoniae pneumonia after azithromycin treatment[J]. Jornal de Pediatria, 2024, 100(1): 108-115. DOI:10.1016/j.jped.2023.06.004 |
| [25] |
GILYAZOVA I, ASADULLINA D, KAGIROVA E, et al. MiRNA-146a-a key player in immunity and diseases[J]. Int J Mol Sci, 2023, 24(16): 12767. DOI:10.3390/ijms241612767 |
| [26] |
DU S Y, LI Z L, XIE X, et al. IL-17 stimulates the expression of CCL2 in cardiac myocytes via Act1/TRAF6/p38MAPK-dependent AP-1 activation[J]. Scandinavian Journal of Immunology, 2020, 91(1): e12840. DOI:10.1111/sji.12840 |
| [27] |
QU F F, GAO H C, ZHU S, et al. TRAF6-dependent Act1 phosphorylation by the IκB kinase-related kinases suppresses interleukin-17-induced NF-κB activation[J]. Molecular And Cellular Biology, 2012, 32(19): 3925-3937. |
 2024, Vol. 43
2024, Vol. 43