文章信息
- 李田甜, 吴美蓉, 李霖, 张晗
- LI Tiantian, WU Meirong, LI Lin, ZHANG Han
- 芳香开窍药调节脑卒中血脑屏障的作用机制
- Mechanism of aromatic resuscitation herbs on blood brain barrier regulation in stroke
- 天津中医药大学学报, 2024, 43(12): 1123-1130
- Journal of Tianjin University of Traditional Chinese Medicine, 2024, 43(12): 1123-1130
- http://dx.doi.org/10.11656/j.issn.1673-9043.2024.12.11
-
文章历史
收稿日期: 2024-08-29
2. 天津中医药大学, 现代中药创制全国重点实验室, 天津 301617
2. National Key Laboratory of Chinese Medicine Modernization, Tianjin University of Traditional Chinese Medicine, Tianjin 301617, China
血脑屏障(BBB)作为中枢神经系统(CNS)和体循环的屏障,能够保护脑组织免受毒素和病原体的侵害,保护中枢神经系统微环境的发育[1],然而,BBB也限制了大部分药物进入脑组织[2]。BBB是1个复杂的动态界面,可以响应生理变化以适应CNS的需要,但也容易受到疾病的影响促进疾病的发生[3]。据报道,BBB抑制了98%的小分子和几乎所有的大分子治疗药物进入大脑,极大地影响了CNS疾病的治疗效果。
卒中是1种急性神经系统疾病,分为出血性脑卒中(ICH)和缺血性脑卒中(IS)两类。ICH、IS以及缺血后再灌注损伤引起的神经炎症浸润会导致BBB的破坏,并且进一步出现出血性转化(HT)、血肿扩大、脑疝等症状。因此,BBB在卒中治疗过程中的作用十分关键。芳香开窍药具有开窍醒神的作用,这些药物含有大量的挥发性成分以及高脂溶性成分,可以通过被动扩散等方式快速进入BBB,同时也能够通过增加BBB通透性的方法,使其他治疗性药物更容易通过血脑屏障。
因此,文章通过检索国家知识基础设施数据库(CNKI)、Pubmed数据库以探究芳香开窍药对卒中后BBB的影响。设定检索时限为2000—2024年,检索词包括:芳香开窍药、血脑屏障、卒中、缺血性卒中、出血性卒中、冰片、石菖蒲、麝香、苏合香、安息香。发现芳香开窍药对BBB具有双向调节作用,一方面能够在生理状态下透过BBB使BBB开放从而增加其他药物在脑组织内的浓度,另一方面芳香开窍药能够降低卒中后BBB的通透性,稳定基膜从而减轻由BBB过度开放导致的脑水肿、炎症反应等。见图 1。
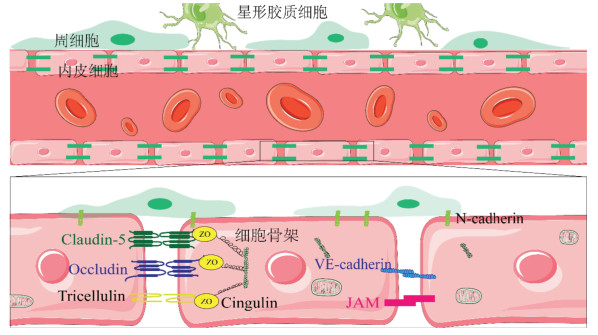
|
| 图 1 生理状态下BBB的结构 |
BBB由血管内皮细胞及其周围的周细胞和星形胶质细胞组成,其中周细胞和星形胶质细胞组成了内皮细胞与神经元之间的分界线[4]。内皮细胞极低的囊泡转运率限制囊泡介导的跨细胞转运,如吸附介导的转胞吞作用[5]。此外,内皮细胞之间存在特殊的紧密连接蛋白(TJs)和黏附连接蛋白(AJs)维持BBB的通透性[6]。TJs的发展依赖于AJs的产生,AJs是由钙黏蛋白之间的同源连接产生的[7]。跨膜TJ蛋白包括Occludin、Claudin、tricellins和连接黏附分子(JAM),胞质TJ蛋白包括ZOs和cingulin[8]。Claudin-5被认为是毛细血管内皮细胞通透性的关键调节因子[9],限制分子量大于400 d的分子通过BBB[10]。ZO蛋白是1种参与信号转导的支架蛋白,能够辅助Occludin、Claudin的形成[11]。JAM通过Occludin参与TJ的形成,并可特异性调节细胞旁通透性[12]。Tricellulins主要用于连接2个或3个细胞之间的连接,通常与Claudin-5共定位[13]。
2 卒中后BBB的病理变化卒中是1种急性脑血管病,其特点为起病急、症状多、变化快,具有高发病率、死亡率、致残率和复发率。出血性卒中和缺血性卒中是卒中的两大类。其中缺血性卒中是卒中的主要形式,脑出血在亚洲占20%~30%,但脑出血的发病率和死亡率高于缺血性卒中[14-15]。卒中的重要病理生理学特征为BBB功能障碍,可能的原因为神经炎症,紧密连接蛋白的降解转运功能失调。因此,血源性细胞、大分子和液体不受控制地涌入,导致细胞毒性、血管源性水肿以及HT。目前对于卒中的治疗仍有诸多限制,且针对BBB损伤这一环节无有效的治疗方法。
2.1 ICHICH也被称为脑出血。在ICH后数小时内由于脑部出血、血肿扩大以及邻近的脑血管系统受到机械损伤和压迫引发原发性脑损伤。破裂血管渗出的血液成分和血细胞降解产物可引起严重的后续脑损伤,导致BBB破坏、神经行为失常和脑细胞死亡[16]。
2.1.1 炎症因子引起BBB通透性增加胶原酶注射诱导的ICH小鼠显示白细胞介素-1β(IL-1β)、白细胞介素-6(IL-6)、p-核因子-κB亚基(p-NF-κB)、肿瘤坏死因子-α(TNF-α)、基质金属蛋白酶-9(MMP-9)等细胞因子和趋化因子水平升高,中性粒细胞聚集[17]。局灶性炎症进一步导致BBB的恶化和脑水肿的升级[18]。ICH后氧化因子如活性氧(ROS)、超氧阴离子(O2-)和一氧化氮(NO)水平升高,O2-和NO进一步形成过氧亚硝酸盐(ONOO-)。ONOO-能激活MMP-9[19]。MMP-9进行性破坏基底层的组成部分,使Occludin、ZO-1和Claudin-5水平降低导致BBB破坏[20]。
2.1.2 血液成分引起BBB通透性增加凝血酶、铁、血红蛋白(Hb)等血液成分也会导致BBB通透性增加。凝血酶的许多作用是由蛋白酶激活受体(PAR)介导的。PAR-1能够导致ZO-1以及VE-钙黏蛋白表达降低并增加内皮细胞内的钙离子含量使紧密连接因肌动蛋白应力纤维的形成受到破坏[21]。Hb在溶血过程中能够从红细胞中释放并转化为铁。Hb注射后,Claudin-5、ZO-1和JAM-1的表达均明显下调,产生氧化产物一氧化氮合酶(NOS)和NO[22]。铁可以通过促进自由基的生成来破坏BBB[23]。
2.1.3 自由基引起BBB通透性增加氧、氮自由基可损伤内皮细胞,加速脂质过氧化,增加BBB的通透性[24]。RhoA/rho相关蛋白激酶(ROCK)信号通路可以调控AJ表达引起内皮细胞收缩[25],磷脂酰肌醇3激酶(PI3K/ATK)信号通路促进血管内皮生长因子(VEGF)和血管生成素-1(Ang-1)的表达以维持AJ、TJ的稳定[26]。
综上,ICH患者会出现脑水肿、神经炎症、氧化应激、血管破裂等反应。这些反应的产物会在一定程度上破坏BBB的结构,使TJs被破坏。血肿周围BBB的破坏会使白细胞和血液中的神经毒性物质进入大脑,从而引起继发脑损伤和神经功能障碍。
2.2 ISIS是指颈动脉和椎动脉收缩或闭塞,脑部供血不足而引起的脑组织坏死。
2.2.1 炎症因子引起BBB通透性增加炎症因子的浸润通过影响TJ的表达导致BBB损伤,小胶质细胞、周细胞[27]和星形胶质细胞在IS后会促进MMP-9的生成,促进脑组织炎性浸润以及TJ分解[28-29]。MMP-9也会被NO、O2-等氧化物通过破坏半胱氨酸开关直接激活[30]。趋化因子单核细胞趋化蛋白-1(MCP-1/CCL2)的升高导致Claudin-5、ZO-1和ZO-2表达减少[31]。
2.2.2 转运蛋白介导BBB变化钠转运蛋白在IS刺激后引起细胞内钠离子和水的蓄积[32],进一步引发血管源性水肿导致BBB损伤[33]。
2.2.3 生长因子引起BBB通透性增加星形胶质细胞产生的VEGF刺激血管内皮生长因子受体-2(VEGFR-2)介导紧密连接蛋白的表达[34]。组织型纤溶酶原激活剂(tPA)是目前治疗IS的首选药物,但其会作用于神经血管单元(NVU)实质侧激活潜伏性血小板源性生长因子-cc(PDGF-cc)和PDGF受体-α(PDGFRα)的信号转导增加BBB的通透性[35]。
综上所述,卒中后BBB的破坏将导致TJs的结构破坏、降解和易位,从而导致脑水肿、出血性转化、神经炎症和氧化应激等。这些病理改变又会在一定程度上加重BBB的渗漏。见图 2。
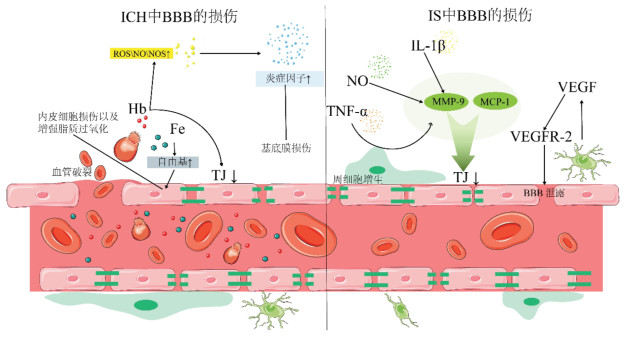
|
| 图 2 ICH和IS中BBB的损伤 |
卒中,中医归为“中风”“厥证”一类,其病位在脑,治法主要以醒脑开窍为主,多使用龙脑、麝香等芳香开窍、豁痰醒脑之品。以芳香轻灵之性,奏宣畅清透之功。中风病机复杂,但归纳其根本为气血逆乱、脑窍闭阻,因此醒脑开窍是治疗中风的关键[36]。尽早的使用开窍药治疗能够有效的阻止风火、痰湿、淤血等对脑窍的损害,防止机体气血逆乱的进一步发展,减少中风的病死率和致残率。中医研究表明,芳香开窍药麝香、冰片等具有明显的脑保护作用,减轻脑水肿以及缺血性、缺氧所致的损伤。
芳香开窍药在治疗脑部疾病过程中主要涉及两方面作用。一方面芳香开窍药能够恢复受损后的BBB通透性,其可能涉及的机制为增强TJ的表达、降低其降解速率和减少炎性因子对基底膜的损伤。另一方面芳香开窍药也能够增加BBB的通透性以促进药物进入BBB,可能涉及的机制为抑制转运蛋白的表达、跨细胞转运、减少TJ的表达以及调控神经递质的表达。见图 3。
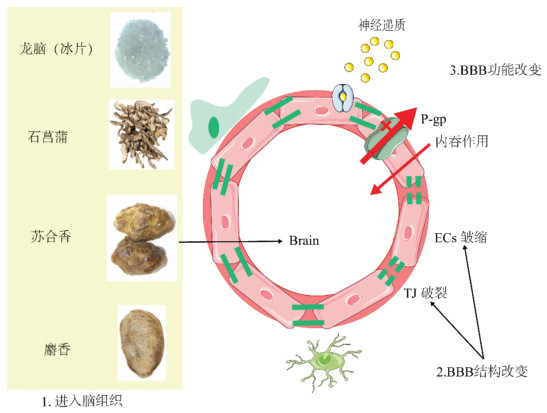
|
| 图 3 芳香开窍药对BBB的作用机制 |
龙脑(冰片)可分为天然龙脑和合成龙脑。天然龙脑来源于樟科植物香樟(Linn)新鲜枝叶。龙脑的化学式为C10H18O,分子量仅为154.25,是一种高度脂溶性双环单体。龙脑的低分子量和高脂溶性是其快速通过BBB的重要条件[37]。口服给药时,5 min内即能在脑内检测到与血液浓度相同的龙脑,其中皮质中浓度最高[38]。构建含有龙脑的血清将其注入到体外BBB中,观察到TJs的降解以及胞饮形成的囊泡数量增加。去除龙脑后可恢复正常,说明龙脑对BBB通透性的调节是可逆的、短暂的[37]。
3.1.1 调节炎症因子以及生长因子的表达龙脑能够恢复IS后BBB的损伤可能是通过抑制iNOS、MMP-9等物质的表达,增加Claudin-5、Occludin的表达,恢复BBB的通透性[39]。川芎与龙脑联用治疗IS时,龙脑在其中起到促进BMECs的增值以及血管生成,抑制IS后体内TJ的降解[40]。
3.1.2 抑制外排蛋白功能龙脑可以增加BBB的通透性,增加其他药物在脑内的分布,可能涉及以下机制:首先,龙脑可以抑制外排蛋白的功能[41]。龙脑可能通过介导NF-κb信号通路抑制内皮细胞中P-gp的表达减少药物的排出[42]。基于此构建了1种新型龙脑修饰的丹参酮Ⅱa(TSA)负载纳米粒(Bo-TSA-NP),该纳米粒可抑制P-gp表达,降低丙二醛(MDA)水平,减缓药物释放,从而辅助治疗IS[43]。
3.1.3 调控神经递质的表达组胺、5-羟色胺(5-HT)等神经递质可激活星形胶质细胞或内皮细胞上的受体,引起脑血管扩张[44]。如龙脑可以增加脑微血管中5-HT的含量,增加与内皮细胞上5-HT受体结合率引起内皮细胞的强收缩,促进内皮细胞间TJs的开放[37]。
3.1.4 增强内吞作用龙脑与川芎合用治疗脑卒中时内皮细胞内吞作用增强,便于川芎进入脑内[45]。但龙脑对BBB通透性的调节也受剂量的影响。当大鼠灌胃剂量超过4.0 g/kg时,龙脑对BBB通透性作用减弱。
3.2 麝香麝香是成熟雄性鹿科动物林麝、马麝和原麝香囊分泌的干燥物。麝香既可以增加BBB通透性促进其他药物进入脑组织发挥药物作用,又可降低BBB通透性发挥脑保护作用。麝香酮是麝香的主要生理活性物质,是麝香发挥BBB屏障功能的主要物质。麝香酮尾静脉注射后5 min即可到达脑组织并达到最大浓度,且在脑内长时间蓄积。
3.2.1 降低炎症因子以及减少自由基损伤醒脑静注射液(XNJ)可减少脑缺血再灌注大鼠脑组织伊文思蓝的渗漏,表明麝香对BBB结构的完整性具有保护作用[46]。麝香酮能够抑制伊文思蓝进入IS大鼠脑组织,降低BBB的通透性[47]。麝香酮发挥降低BBB通透性的机制可能为:1)麝香酮可降低缺血再灌注大鼠脑组织中炎性因子MMP-9的表达,减少脑组织BBB基底膜细胞外基质的降解[48-49]。2)麝香酮可减轻自由基引起的细胞损伤,减少自由基引起的BBB通透性增加[50]。
3.2.2 抑制TJ表达麝香能够降低Claudin基因表达,导致TJs结构松动,同时引起基底膜结构损伤和内皮细胞萎缩,从而削弱BBB的屏障功能[51]。
3.2.3 调节外排蛋白功能麝香酮与京尼平苷联用时,麝香酮能够降低TJ的表达,增加京尼平苷的细胞旁转运和跨细胞转运[52]。麝香黄芪复方滴丸中麝香可以抑制BBB上p-gp的表达,降低BBB外排系统将药物泵回血液的效能,从而使黄芪快速降低脑梗死患者梗死侧IL-1β、NF-κB等炎性因子水平,提高脑梗死患者的疗效。同时抑制AQP4的表达,抑制脑水肿的发展[53]。
3.3 苏合香苏合香是从金缕梅科植物东方枫香树的树干中渗出的芳香树脂中提炼。在生理状态下,苏合香可以引起BBB的开放,使其他药物更容易在皮层、海马和下丘脑等组织中分布。海马区的开放效应与抑制P-gp活性有关[54]。在病理条件下,苏合香可促进BBB溶血脂质转运蛋白A(Mfsd2a)的表达,进而抑制IS大鼠小窝蛋白-1(cav-1)的表达,降低胞浆转运率,维持BBB的跨细胞稳定性[55]。此外,苏合香还可抑制MMP-9水平,最大限度地减少脑缺血造成的BBB损伤。
3.4 安息香安息香是安息香科植物白花树的干燥树脂,具有刺激性香气。其能够增加正常小鼠BBB的通透性,促进EB进入脑组织,可能发挥作用的是其脂溶性成分[56],同时能够显著增加EB在皮层、下丘脑和纹状体区域的分布[54]。
3.5 石菖蒲石菖蒲是天南星科植物石菖蒲的干根茎。石菖蒲中的挥发油是其药用特性的成分之一。目前已鉴定出60多种成分,包括α-细辛醚、β-细辛醚、甲基丁香酚、榄香烯、樟脑、α-蒎烯、β-榄香烯、大肠杆菌酮等[57]。其中,α-细辛醚、β-细辛醚、榄香烯和α-蒎烯可透过BBB发挥作用。
3.5.1 调节神经递质表达石菖蒲可改变大鼠BBB的超微结构,使内皮细胞壁变薄,局部缺损,外基底膜及星形胶质细胞底部水肿。内皮细胞和星形胶质细胞的变化会影响TJ的含量,进一步增加BBB的通透性,这可能与5-HT含量增加有关[58]。
3.5.2 抑制外排蛋白功能β-细辛醚对P-gp在Hela细胞膜上的药物外排有较强的抑制作用,减少药物从脑内的排出[59]。榄香烯-卡巴他赛(CTX)与转铁蛋白偶联构建的靶向仿生脂质体可提高CTX的治疗效果。其中榄香烯对BBB具有较强的通透性,可通过抑制P-gp提高BBB通透性,使CTX更容易进入脑内[60]。
3.5.3 影响TJ表达α-细辛醚可显著降低ZO-1、Claudin-5和Occludin的表达,增加BBB的通透性[61]。葛根素和川芎嗪均是治疗脑梗死的有效药物,但其BBB通透性低,限制了其在脑内的利用,使其临床治疗受到限制。当与α-细辛醚结合时,发现α-细辛醚可以作用于腺苷受体,降低ZO-1的表达,导致细胞骨架的改变,从而增加两种药物的脑分布[62]。
4 讨论卒中作为现代医疗护理的一大难题,迫切需要找到有效的治疗药物。卒中后BBB失去部分屏障功能,使脑内环境恶化[63]。BBB是由内皮细胞、星形胶质细胞、周细胞组成的致密屏障,是保护大脑的重要屏障。然而,BBB使药物难以进入大脑并抑制其功能[64]。如脑肿瘤血管系统受损、渗漏时,通常表现为内皮细胞损伤、紧密连接蛋白丢失,但仍具有选择性药物渗透的特点,使治疗性药物难以进入并发挥作用。可通过BBB的药物很少且由于BBB的结构和药物的理化特性,使生物利用度大大降低。寻找治疗脑卒中的药物,要求药物不仅要能穿透BBB,还要能恢复BBB的结构和功能。
芳香开窍药治疗脑卒中已有数千年的历史。芳香开窍药成分由于其高脂溶性和低分子量使其容易透过BBB。芳香开窍药可以通过影响BBB的结构和功能来调节药物进入脑组织的量。结构上,芳香开窍药可损伤基底膜,使内皮细胞萎缩,增加通过细胞旁路途径进入脑内的药物量。同时还可影响内皮细胞之间的骨架结构,降低TJ的表达。Occludin/ZO-1张力的改变也引起膜流动性的上调,从而促进非选择性药物内流[65]。从功能上讲,芳香开窍药可以增加胞饮作用形成的囊泡数量,从而将更多的药物运输到大脑。抑制P-gp和其他外排蛋白的功能以减少药物被排除出脑。调节神经递质含量,使其与内皮细胞上的受体结合,导致内皮细胞功能的变化。此外,芳香开窍药还可部分减少炎性因子和自由基的产生,恢复部分BBB功能。
然而,目前的研究仍存在一定的局限性。TJ仍然是大多数药理学研究的重点,而其他BBB成分如内皮细胞、星形胶质细胞和周细胞等没有得到足够的重视。此外,尽管一些西药对IS有良好的治疗效果,但它们进入大脑时的低浓度使其无法高效发挥作用。因此,可以通过现代技术手段将芳香开窍药与现代药物或靶向药物结合共同发挥作用以达到治疗IS的目的。
| [1] |
LANGEN U H, AYLOO S, GU C H. Development and cell biology of the blood-brain barrier[J]. Annu Rev Cell Dev Biol, 2019, 35: 591-613. DOI:10.1146/annurev-cellbio-100617-062608 |
| [2] |
UMLAUF B J, SHUSTA E V. Exploiting BBB disruption for the delivery of nanocarriers to the diseased CNS[J]. Curr Opin Biotechnol, 2019, 60: 146-152. DOI:10.1016/j.copbio.2019.01.013 |
| [3] |
BANKS W A. From blood-brain barrier to blood-brain interface: new opportunities for CNS drug delivery[J]. Nat Rev Drug Discov, 2016, 15(4): 275-292. DOI:10.1038/nrd.2015.21 |
| [4] |
LIEBNER S, DIJKHUIZEN R M, REISS Y, et al. Functional morphology of the blood-brain barrier in health and disease[J]. Acta Neuropathologica, 2018, 135(3): 311-336. DOI:10.1007/s00401-018-1815-1 |
| [5] |
CHEN H S, CAO Z J, GU Y, et al. Editorial: blood-brain barrier dysregulation and recovery following brain ischemia: cellular constituents, molecular mechanisms, and therapeutic strategies enabling successful brain remodeling[J]. Frontiers in Cellular Neuroscience, 2022, 16: 968425. DOI:10.3389/fncel.2022.968425 |
| [6] |
CHOW B W, GU C H. The molecular constituents of the blood-brain barrier[J]. Trends in Neurosciences, 2015, 38(10): 598-608. DOI:10.1016/j.tins.2015.08.003 |
| [7] |
ANDREONE B J, CHOW B W, TATA A, et al. Blood-brain barrier permeability is regulated by lipid transport-dependent suppression of caveolae-mediated transcytosis[J]. Neuron, 2017, 94(3): 581-594. DOI:10.1016/j.neuron.2017.03.043 |
| [8] |
CONG X, KONG W. Endothelial tight junctions and their regulatory signaling pathways in vascular homeostasis and disease[J]. Cellular Signalling, 2020, 66: 109485. DOI:10.1016/j.cellsig.2019.109485 |
| [9] |
WEI Z L, LIU H S, LIN Z X, et al. Non-contrast assessment of blood-brain barrier permeability to water in mice: An arterial spin labeling study at cerebral veins[J]. Neuroimage, 2023, 268: 119870. DOI:10.1016/j.neuroimage.2023.119870 |
| [10] |
TERAIYA M, PERREAULT H, CHEN V C. An overview of glioblastoma multiforme and temozolomide resistance: Can LC-MS-based proteomics reveal the fundamental mechanism of temozolomide resistance?[J]. Frontiers in Oncology, 2023, 13: 1166207. DOI:10.3389/fonc.2023.1166207 |
| [11] |
WIBBE N, EBNET K. Cell adhesion at the tight junctions: New aspects and new functions[J]. Cells, 2023, 12(23): 2701. DOI:10.3390/cells12232701 |
| [12] |
AURRAND-LIONS M, JOHNSON-LEGER C, WONG C, et al. Heterogeneity of endothelial junctions is reflected by differential expression and specific subcellular localization of the three JAM family members[J]. Blood, 2001, 98(13): 3699-3707. DOI:10.1182/blood.V98.13.3699 |
| [13] |
MARIANO C, PALMELA I, PEREIRA P, et al. Tricellulin expression in brain endothelial and neural cells[J]. Cell and Tissue Research, 2013, 351(3): 397-407. DOI:10.1007/s00441-012-1529-y |
| [14] |
KEEP R F, ZHOU N N, XIANG J M, et al. Vascular disruption and blood-brain barrier dysfunction in intracerebral hemorrhage[J]. Fluids and Barriers of the CNS, 2014, 11: 18. DOI:10.1186/2045-8118-11-18 |
| [15] |
HUANG B, LI X H. The role of Mfsd2a in nervous system diseases[J]. Frontiers in Neuroscience, 2021, 15: 730534. DOI:10.3389/fnins.2021.730534 |
| [16] |
KEEP R F, HUA Y, XI G H. Intracerebral haemorrhage: mechanisms of injury and therapeutic targets[J]. The Lancet Neurology, 2012, 11(8): 720-731. DOI:10.1016/S1474-4422(12)70104-7 |
| [17] |
WU X, FU S M, LIU Y, et al. NDP-MSH binding melanocortin-1 receptor ameliorates neuroinflammation and BBB disruption through CREB/Nr4a1/NF-κB pathway after intracerebral hemorrhage in mice[J]. Journal of Neuroinflammation, 2019, 16(1): 192. DOI:10.1186/s12974-019-1591-4 |
| [18] |
LI Z G, LI M S, SHI S X, et al. Brain transforms natural killer cells that exacerbate brain edema after intracerebral hemorrhage[J]. Journal of Experimental Medicine, 2020, 217(12): e20200213. DOI:10.1084/jem.20200213 |
| [19] |
YAO Z J, BAI Q Q, WANG G Q. Mechanisms of oxidative stress and therapeutic targets following intracerebral hemorrhage[J]. Oxidative Medicine and Cellular Longevity, 2021, 2021: 8815441. DOI:10.1155/2021/8815441 |
| [20] |
ZHAO W, ZHAO L H, GUO Z Y, et al. Valproate sodium protects blood brain barrier integrity in intracerebral hemorrhage mice[J]. Oxidative Medicine and Cellular Longevity, 2020, 8884320. |
| [21] |
LIU D Z, ANDER B P, XU H C, et al. Blood-brain barrier breakdown and repair by Src after thrombin-induced injury[J]. Annals of Neurology, 2010, 67(4): 526-533. DOI:10.1002/ana.21924 |
| [22] |
YANG S, CHEN Y Z, DENG X Q, et al. Hemoglobin-induced nitric oxide synthase overexpression and nitric oxide production contribute to blood-brain barrier disruption in the rat[J]. Journal of Molecular Neuroscience, 2013, 51(2): 352-363. DOI:10.1007/s12031-013-9990-y |
| [23] |
IMAI T, IWATA S, HIRAYAMA T, et al. Intracellular Fe2+ accumulation in endothelial cells and pericytes induces blood-brain barrier dysfunction in secondary brain injury after brain hemorrhage[J]. Scientific Reports, 2019, 9(1): 6228. DOI:10.1038/s41598-019-42370-z |
| [24] |
DUAN X C, WEN Z J, SHEN H T, et al. Intracerebral hemorrhage, oxidative stress, and antioxidant therapy[J]. Oxidative Medicine and Cellular Longevity, 2016, 2016: 1203285. DOI:10.1155/2016/1203285 |
| [25] |
ZHOU Z Y, HUANG B, LI S, et al. Sodium tanshinone IIA sulfonate promotes endothelial integrity via regulating VE-cadherin dynamics and RhoA/ROCK-mediated cellular contractility and prevents atorvastatin-induced intracerebral hemorrhage in zebrafish[J]. Toxicology and Applied Pharmacology, 2018, 350: 32-42. DOI:10.1016/j.taap.2018.04.037 |
| [26] |
XI T Y, JIN F, ZHU Y, et al. MicroRNA-126-3p attenuates blood-brain barrier disruption, cerebral edema and neuronal injury following intracerebral hemorrhage by regulating PIK3R2 and Akt[J]. Biochemical and Biophysical Research Communications, 2017, 494(1/2): 144-151. |
| [27] |
TAKATA F, DOHGU S, MATSUMOTO J, et al. Brain pericytes among cells constituting the blood-brain barrier are highly sensitive to tumor necrosis factor-α, releasing matrix metalloproteinase-9 and migrating in vitro[J]. Journal of Neuroinflammation, 2011, 8: 106. DOI:10.1186/1742-2094-8-106 |
| [28] |
YANG C J, HAWKINS K E, DORÉ S, et al. Neuroinflammatory mechanisms of blood-brain barrier damage in ischemic stroke[J]. American Journal of Physiology Cell Phy- siology, 2019, 316(2): C135-C153. DOI:10.1152/ajpcell.00136.2018 |
| [29] |
SMYTH L C D, RUSTENHOVEN J, PARK T I, et al. Unique and shared inflammatory profiles of human brain endothelia and pericytes[J]. Journal of Neuroinflammation, 2018, 15(1): 138. DOI:10.1186/s12974-018-1167-8 |
| [30] |
YANG C J, LIU L, LAVAYEN B P, et al. Therapeutic benefits of adropin in aged mice after transient ischemic stroke via reduction of blood-brain barrier damage[J]. Stroke, 2023, 54(1): 234-244. DOI:10.1161/STROKEAHA.122.039628 |
| [31] |
PILLAI D R, DITTMAR M S, BALDARANOV D, et al. Cerebral ischemia-reperfusion injury in rats: A 3 T MRI study on biphasic blood-brain barrier opening and the dynamics of edema formation[J]. Journal of Cerebral Blood Flow and Metabolism, 2009, 29(11): 1846-1855. DOI:10.1038/jcbfm.2009.106 |
| [32] |
YAO Y, LIU F, GU Z W, et al. Emerging diagnostic markers and therapeutic targets in post-stroke hemorrhagic transformation and brain edema[J]. Frontiers in Molecular Neuroscience, 2023, 16: 1286351. DOI:10.3389/fnmol.2023.1286351 |
| [33] |
DHARMASAROJA P A. Fluid intake related to brain edema in acute middle cerebral artery infarction[J]. Translational Stroke Research, 2016, 7(1): 49-53. DOI:10.1007/s12975-015-0439-1 |
| [34] |
KIM Y, LEE S, ZHANG H Y, et al. CLEC14A deficiency exacerbates neuronal loss by increasing blood-brain barrier permeability and inflammation[J]. Journal of Neuroinflammation, 2020, 17(1): 48. DOI:10.1186/s12974-020-1727-6 |
| [35] |
SU E J, CAO C Z, FREDRIKSSON L, et al. Microglial-mediated PDGF-CC activation increases cerebrovascular permeability during ischemic stroke[J]. Acta Neuropathologica, 2017, 134(4): 585-604. DOI:10.1007/s00401-017-1749-z |
| [36] |
刘亚敏. 芳香开窍法对急性缺血性中风的脑保护作用研究[D]. 广州: 广州中医药大学, 2002.
|
| [37] |
ZHANG Q L, FU B M, ZHANG Z J. Borneol, a novel agent that improves central nervous system drug delivery by enhancing blood-brain barrier permeability[J]. Drug Delivery, 2017, 24(1): 1037-1044. DOI:10.1080/10717544.2017.1346002 |
| [38] |
YU B, RUAN M, CUI X B, et al. Effects of borneol on the pharmacokinetics of geniposide in cortex, hippocampus, hypothalamus and striatum of conscious rat by simultaneous brain microdialysis coupled with UPLC-MS[J]. Journal of Pharmaceutical and Biomedical Analysis, 2013, 77: 128-132. DOI:10.1016/j.jpba.2013.01.017 |
| [39] |
TAN X H, ZHANG K, SHI W Y, et al. Research progress on the regulation and mechanism of borneol on the blood-brain barrier in pathological states: A narrative review focused on ischemic stroke and cerebral glioma[J]. Translational Cancer Research, 2023, 12(11): 3198-3209. DOI:10.21037/tcr-23-1487 |
| [40] |
SONG X X, XING W Q, ZHANG X F, et al. Exploring the synergic mechanism of Ligusticum striatum DC. and borneol in attenuating BMECs injury and maintaining tight junctions against cerebral ischaemia based on the HIF-1α/VEGF signalling pathway[J]. Journal of Ethnopharmacology, 2023, 301: 115764. DOI:10.1016/j.jep.2022.115764 |
| [41] |
WU T, ZHANG A Q, LU H Y, et al. The role and mechanism of borneol to open the blood-brain barrier[J]. Integrative Cancer Therapies, 2018, 17(3): 806-812. DOI:10.1177/1534735418767553 |
| [42] |
FAN X, CHAI L J, ZHANG H, et al. Borneol depresses P-glycoprotein function by a NF-κB signaling mediated mechanism in a blood brain barrier in vitro model[J]. International Journal of Molecular Sciences, 2015, 16(11): 27576-27588. DOI:10.3390/ijms161126051 |
| [43] |
WANG L T, XU L, DU J F, et al. Nose-to-brain delivery of borneol modified tanshinone IIA nanoparticles in prevention of cerebral ischemia/reperfusion injury[J]. Drug Delivery, 2021, 28(1): 1363-1375. DOI:10.1080/10717544.2021.1943058 |
| [44] |
NEUHAUS W, FREIDL M, SZKOKAN P, et al. Effects of NMDA receptor modulators on a blood-brain barrier in vitro model[J]. Brain Research, 2011, 1394: 49-61. DOI:10.1016/j.brainres.2011.04.003 |
| [45] |
YU B, YAO Y, ZHANG X F, et al. Synergic neuroprotection between Ligusticum chuanxiong hort and borneol against ischemic stroke by neurogenesis via modulating reactive astrogliosis and maintaining the blood-brain barrier[J]. Frontiers in Pharmacology, 2021, 12: 666790. DOI:10.3389/fphar.2021.666790 |
| [46] |
QU X Y, ZHANG Y M, TAO L N, et al. XingNaoJing injections protect against cerebral ischemia/reperfusion injury and alleviate blood-brain barrier disruption in rats, through an underlying mechanism of NLRP3 inflammasomes suppression[J]. Chinese Journal of Natural Medicines, 2019, 17(7): 498-505. DOI:10.1016/S1875-5364(19)30071-8 |
| [47] |
WANG J, XING H, QIN X M, et al. Pharmacological effects and mechanisms of muscone[J]. Journal of Ethnopharmacology, 2020, 262: 113120. DOI:10.1016/j.jep.2020.113120 |
| [48] |
徐秋英, 刘亚敏, 沈强, 等. 人工麝香对大鼠局灶性脑缺血再灌注后大脑MMP-9 mRNA及其蛋白表达的影响[J]. 热带医学杂志, 2011, 11(8): 875-878, 997. |
| [49] |
WANG G Y, WANG N, LIAO H N. Effects of muscone on the expression of P-gp, MMP-9 on blood-brain barrier model in vitro[J]. Cellular and Molecular Neurobiology, 2015, 35(8): 1105-1115. DOI:10.1007/s10571-015-0204-8 |
| [50] |
逯锐锐, 龚圆渊, 张力华. 中医药对血脑屏障通透性影响的研究进展[J]. 湖南中医杂志, 2016, 32(7): 187-189. |
| [51] |
陈怡君, 桑洁, 赵宝全, 等. 麝香酮对斑马鱼血脑屏障超微结构及Claudins基因表达的影响[J]. 国际药学研究杂志, 2020, 47(12): 1121-1128. |
| [52] |
CHEN Z Z, LU Y, DU S Y, et al. Influence of borneol and muscone on geniposide transport through MDCK and MDCK-MDR1 cells as blood-brain barrier in vitro model[J]. International Journal of Pharmaceutics, 2013, 456(1): 73-79. DOI:10.1016/j.ijpharm.2013.08.017 |
| [53] |
樊飞燕, 陈娜, 行文娟, 等. 麝香黄芪复方治疗急性脑梗死的疗效及对血脑屏障转运蛋白、炎性因子的影响[J]. 时珍国医国药, 2023, 34(8): 1901-1904. DOI:10.3969/j.issn.1008-0805.2023.08.26 |
| [54] |
丁洁, 张莹, 巫悦, 等. 麝香、安息香和苏合香对血脑屏障脑区特异性开放作用及其机制[J]. 中国医院药学杂志, 2015, 35(4): 279-282. |
| [55] |
李东娜. 苏合香对脑缺血损伤大鼠跨细胞血脑屏障通透性的影响及机制研究[D]. 天津: 天津中医药大学, 2021.
|
| [56] |
倪彩霞, 曾南, 汤奇, 等. 芳香开窍药对正常小鼠血脑屏障通透性的影响[J]. 江苏中医药, 2011, 43(2): 88-89. DOI:10.3969/j.issn.1672-397X.2011.02.058 |
| [57] |
ZANG Z Z, CHEN L M, LIU Y, et al. Uncovering the protective mechanism of the volatile oil of Acorus tatarinowii against acute myocardial ischemia injury using network pharmacology and experimental validation[J]. Evidence-Based Complementary and Alternative Medicine, 2021, 2021: 6630795. |
| [58] |
胡园, 袁默, 刘屏, 等. 石菖蒲对血脑屏障超微结构及通透性的影响[J]. 中国中药杂志, 2009, 34(3): 349-351. DOI:10.3321/j.issn:1001-5302.2009.03.026 |
| [59] |
WANG N B, ZHANG Q X, NING B L, et al. β-Asarone promotes Temozolomide's entry into glioma cells and decreases the expression of P-glycoprotein and MDR1[J]. Biomedecine & Pharmacotherapie, 2017, 90: 368-374. |
| [60] |
LI J, ZENG H M, YOU Y, et al. Active targeting of orthotopic glioma using biomimetic liposomes co-loaded elemene and cabazitaxel modified by transferritin[J]. Journal of Nanobiotechnology, 2021, 19(1): 289. DOI:10.1186/s12951-021-01048-3 |
| [61] |
黄丽平, 宁百乐, 王南卜, 等. 石菖蒲挥发油有效成分β-细辛醚联合左旋多巴对6-OHDA诱导帕金森模型大鼠的分子伴侣介导自噬的影响[J]. 中药材, 2020, 43(7): 1716-1720. |
| [62] |
WU J Y, LI Y J, YANG L, et al. Borneol and Α-asarone as adjuvant agents for improving blood-brain barrier permeability of puerarin and tetramethylpyrazine by activating adenosine receptors[J]. Drug Delivery, 2018, 25(1): 1858-1864. DOI:10.1080/10717544.2018.1516005 |
| [63] |
KANG Y J, CUTLER E G, CHO H. Therapeutic nanoplatforms and delivery strategies for neurological disorders[J]. Nano Convergence, 2018, 5(1): 35. DOI:10.1186/s40580-018-0168-8 |
| [64] |
WU D, CHEN Q, CHEN X J, et al. The blood-brain barrier: Structure, regulation, and drug delivery[J]. Signal Transduction and Targeted Therapy, 2023, 8(1): 217. DOI:10.1038/s41392-023-01481-w |
| [65] |
LI C, CHEN L L, WANG Y Y, et al. Protein nanoparticle-related osmotic pressure modifies nonselective permeability of the blood-brain barrier by increasing membrane fluidity[J]. International Journal of Nanomedicine, 2021, 16: 1663-1680. DOI:10.2147/IJN.S291286 |
 2024, Vol. 43
2024, Vol. 43




