文章信息
- 贾梦杰, 刘怡曼, 刘佳, 孟鋆钰, 杨剑
- JIA Mengjie, LIU Yiman, LIU Jia, MENG Junyu, YANG Jian
- 特发性肺纤维化中肺屏障损伤及中药防治研究进展
- Research progress on lung barrier injury and traditional Chinese medicine prevention and treatment in idiopathic pulmonary fibrosis
- 天津中医药大学学报, 2024, 43(12): 1131-1139
- Journal of Tianjin University of Traditional Chinese Medicine, 2024, 43(12): 1131-1139
- http://dx.doi.org/10.11656/j.issn.1673-9043.2024.12.12
-
文章历史
收稿日期: 2024-09-16
2. 天津中医药大学中医药研究院, 天津 301617;
3. 现代中医药海河实验室, 天津 301617
2. Institue of Chinese Medicine of Tianjin University of Traditional Chinese Medicine, Tianjin 301617, China;
3. Haihe Laboratory of Modern Chinese Medicine, Tianjin 301617, China
特发性肺纤维化(IPF)是一种病因和发病机制不明确的慢性进行性的纤维化间质性肺炎。在中医理论中,IPF并没用统一的病名,依据证治表现进行分类有“咳嗽”“肺胀”“喘证”“肺痹”“肺痿”等,但根据IPF的现代临床表现与肺部组织病理学特征,多数学者更倾向于将IPF归纳于“肺痿”的范畴[1]。肺司呼吸,主气,朝百脉,调节一身之气血,而机体气血、津液等物质在体内的正常输布、渗灌、转化依赖微观玄府的开阖功能。气血屏障是肺脏进行气体交换的重要界面,因此,玄府正常开阖,气体可通过气血屏障完成互换以为机体供氧并带出毛细血管中的代谢废物,而且正常的玄府开阖还能阻挡有害物质进入体液循环,阻止毛细血管内液体透过气血屏障进入肺泡而发生病变[2]。宋代陈无择《三因极一病证方论·肺痿肺痈》言:“肺为五脏华盖,百脉取气,运动血脉,卫养脏腑,灌注皮毛,将理失宜,气与血乱,则成肺痿肺痈矣。”提示气血关系失调可导致肺痿的发生[3]。
临床研究表明,肺泡上皮细胞表型的改变是IPF的一个关键特征。肺泡上皮Ⅱ型细胞(ATⅡs)在分泌表面活性剂和执行重要的代谢和免疫功能方面发挥着重要作用。此外,它们还充当肺泡上皮Ⅰ型细胞(ATIs)的祖细胞。然而,在IPF患者中,ATⅡs的基因组不稳定、端粒缩短、表观遗传修饰、蛋白稳定破坏、营养感知失调、线粒体功能障碍、细胞衰老和细胞间通讯改变。因此,有报道提出了一个新的概念,通过重复性微损伤导致的ATⅡs耗竭可能是肺纤维化的根本原因[4]。
有研究证明内皮细胞(EC)也是纤维化过程中异常激活的肌成纤维细胞的主要来源之一,并且EC与肌成纤维细胞之间异常串扰导致IPF中的肺血管重构[5-6]。肺纤维化刺激诱导正常的肺EC重新编程为纤维化相关的肺内皮细胞。正常EC是静止的并为维持肺部微环境稳态提供紧密的内皮屏障,而纤维化相关EC具有高渗透性,导致肺内皮屏障的渗漏从而引起局灶性水肿,并导致纤维化相关的上皮损伤和炎症。除了内皮细胞变化,纤维化相关肺血管的灌注减少会导致纤维化病变并加剧局部缺氧,进一步造成肺上皮损伤和炎症[7]。因此,进一步了解内皮屏障完整性维持的机制对特发性肺纤维化的防治意义重大。
西医对IPF发病机制的研究主要集中在持续的慢性炎症、氧化应激紊乱和自噬抑制等方面,但目前在IPF过程中的肺部屏障的损伤和修复过程以及肺部屏障损伤后肺部微环境的扰动缺乏系统的归纳与整理,基于此,文章就肺部屏障(图 1)作为肺部抵抗外部侵袭的第一道防线、IPF的驱动者对调节肺部屏障的相关信号通路和生理过程,如表面活性蛋白影响上皮祖细胞的再生能力、Fyn激酶和Caveolin-1调控肺泡上皮细胞间的黏附分子连接、Wnt信号通路和EGFR-RAS-ZEB1信号传导等调控肺泡上皮-间充质之间的转化、P53细胞周期信号通路和Hippo Yap/Taz信号通路调控肺泡上皮细胞的衰老与再生、以及FOXF1/R-Ras信号调控肺内皮细胞对抗特发性肺纤维化等(图 2),以及屏障受损后IPF中肺部微环境的扰动和相关促纤维化因子的分泌进行了系统总结,并对通过调控肺部屏障的中药及天然产物的研究进行统一归纳,为中药防治特发性肺纤维化保护肺屏障提供新的数据支撑。

|
| 图 1 特发性肺纤维化进展中屏障破坏的关键过程 |

|
| 图 2 IPF中调控肺屏障的相关机制图 |
在多个IPF的患病家族中,已发现表面活性剂蛋白A2(SP-A2)和C(SFTPC)的变异[8]。影响SFTPC的杂合性与所有年龄段的纤维化发生有关,包括儿童形式的间质性肺病(pILD)[9-10]。Kortekaas等[11]的实验利用小鼠肺类器官和人肺组织精准切片验证了IL-11降低了类器官数量,并降低了促表面活性蛋白C阳性的类器官的比例,表明上皮祖细胞启动的再生功能失调。
Cav-1是小窝的支架蛋白,小窝是质膜的特殊脂筏,其大量存在于Ⅰ型AECs中[12]。它参与连接蛋白(如连接蛋白、E-钙黏蛋白、β-连环蛋白、Occludin、JAM-A、Claudin-1和-4以及ZO-1)的内化过程[13]。Cav-1的丧失导致肺泡屏障功能降低和肺实质的纤维化样改变[14]。Menzel等[15]的研究证明了肺泡上皮连接黏附复合体中的Fyn激酶和Caveolin-1与肺纤维化的早期阶段有关。
1.2 Wnt信号通路、EGFR-RAS-ZEB1信号传导和SNAI的表达调控肺泡上皮-间充质之间的转化上皮-间质转移(EMT)是1种动态可逆的生物学过程,通过该过程,上皮细胞失去细胞极性并下调E-Cadherin介导的细胞-细胞黏附以获得迁移特性,参与胚胎发育、伤口愈合、纤维化和癌症转移[16]。其中Wnt信号通路、EGFR-RAS-ZEB1信号传导和SNAI的表达被证明与IPF中的EMT过程中肺泡上皮细胞密切相关,SNAI表达升高并定位于增生的ATⅡ细胞[17]。
Wnt信号通路:在IPF中,异常上皮的再形成一部分可归因于肺损伤后Wnt信号通路的异常刺激。Wnt蛋白阻止β-连环蛋白被糖原合成酶激酶3b(GSK3b)磷酸化,阻止其移动到细胞核并激活被称为淋巴增强因子/T-细胞因子(LEF/TCF)的转录因子;这被认为可以促进Ⅱ型细胞增殖,同时抑制分化,进而导致支气管肺泡连接处的分化上皮再生,并可能最终导致上皮-间质转化[18]。
EGFR-RAS-ZEB1信号传导:Yao等[19]的实验结果表明,表皮生长因子受体(EGFR)-RAS细胞外信号调节激酶(ERK)信号传导诱导转录因子ZEB1,它不仅控制EMT,还调节局部作用介质的产生。肺泡上皮Ⅱ型细胞的ZEB1依赖性EMT通过上皮-成纤维细胞串扰导致纤维化。此外,后续工作结果表明IPF中异常的上皮-间充质串扰是双向的,共同驱动了维持伤口愈合表型的慢性反馈回路[20]。
SNAI的表达:TGFβ1处理增加了SNAI1和SNAI2的表达和核积累,与ATⅡ细胞中EMT的诱导一致。SNAI过表达足以诱导EMT,小干扰RNA(siRNA)介导的SNAI耗竭减弱了TGFβ1诱导的ATⅡ细胞迁移和EMT[17]。
1.3 p53细胞周期信号通路和Hippo Yap/Taz信号通路调控肺泡上皮细胞的衰老与再生肺上皮细胞损伤后,可通过凋亡或表型分化为成纤维细胞导致的胱天蛋白酶依赖性死亡[21]。ATⅡ细胞衰老在纤维化肺部疾病中很明显,包括IPF患者[22-23]和实验性纤维化模型[24-25]。有研究报道,IPF患者肺组织Ⅱ型AEC中p16和p21浓度的增加可能与更高的疾病严重程度有关[26]。
P53细胞周期信号通路:p53是细胞周期的主要调节因子,也是细胞衰老的普遍诱导因子。事实上,p53途径是在IPF肺中发现的最失调的途径之一[25, 27]。Rana等[28]的结果表明,由于PAI-1在IPF肺和实验性肺纤维化模型中的表达增加,PAI-1的增加可能是IPF肺中p53和ATⅡ细胞衰老失调的基础。
Hippo Yap/Taz信号通路:在气道上皮中,有证据表明,维持肺部微环境的平衡需要Yap活性的调节。Yap的持续激活导致基底细胞化生,而Yap缺失加速基底细胞的末端分化并损害基底细胞祖细胞功能,表明在气道发育和修复过程中Yap活性受到严格调节[29-30]。该通路的失调是特发性肺纤维化远端肺上皮的一个显著特征[31]。Digiovanni等[32]的工作发现,在博来霉素和LPS损伤模型中,Yap/Taz缺失导致持续的肺泡炎症,并导致成纤维细胞过度活化和肺纤维化。这些发现表明,ATⅡ细胞特异性Yap/Taz激活对肺泡修复的启动至关重要,如果没有Yap/Taz激活,则无法再生功能性肺泡所需的ATI细胞。
1.4 FOXF1/R-Ras信号调控肺内皮细胞对抗特发性肺纤维化FOXF1是通过激活VEGF、BMP9和TIE-2信号通路[33-34]实现肺血管系统胚胎发育所必需的。FOXF1通过调节对细胞外基质重塑、炎症和内皮屏障功能至关重要的基因来刺激肺修复和再生[35-36]。有研究将血管恢复正常化的关键靶点聚焦于FOXF1,在人类IPF和博来霉素诱导的小鼠IPF模型的肺中,转录因子下调最多的1种是FOXF1,且在肺内皮细胞中高度富集[37-38]。小鼠内皮特异性Foxf1抑制增加了胶原沉积,促进了肺部炎症,并损害了R-Ras信号传导,肺内皮细胞通过FOXF1/R-Ras信号调节肺纤维化[39]。
1.5 肺屏障破坏对特发性肺纤维化中肺部微环境的影响在IPF中,肺部屏障损伤后会进一步影响肺部稳态,而肺部微环境稳态亦可以作为IPF的1个潜在作用位点。在IPF患者的肺部由于活性氧的增加,导致肺泡屏障的破坏,从而诱导细胞凋亡和细胞衰老。此外,特发性肺纤维化导致肺结构发生不可逆转的变化,如气道和肺泡黏膜、血流和氧张力发生局部改变,宿主免疫紊乱。该疾病的所有这些解剖、生理和免疫特征都可能对下呼吸道的细菌群落施加偏向性压力,从而产生微生态失调[40],见图 3。受损的宿主防御和先天免疫信号是导致IPF疾病严重程度和病程的因素[41]。
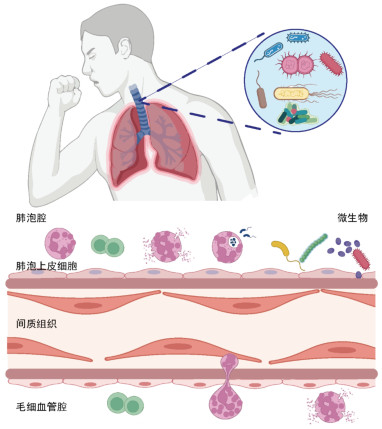
|
| 图 3 特发性肺纤维化进展过程中肺部微生态受到影响 |
受损的肺泡上皮释放调节成纤维细胞增殖的介质,如转化生长因子β(TGF-β)、结缔组织生长因子(CTGF)、声波刺猬蛋白(Shh)和前列腺素E2(PGE2)。总体而言,这些介质诱导Ⅱ型上皮向间充质转化的激活。这一过程是肌成纤维细胞的来源,因为在生物化学刺激下,上皮细胞通过失去其特性(如顶端-基底极性和细胞-细胞黏附)而去分化并获得成纤维细胞表型。另一方面,活化的成纤维细胞通过产生血管紧张素Ⅱ和活性氧(ROS)损伤肺泡肺细胞,加剧肺纤维化发展[42-43]。
2 中药通过调控肺屏障防治特发性肺纤维化的研究进展气行于无形之肺络,血之承载使气不致耗散,血之濡养使气充盛畅达,故气得血则盛;血行于有形之肺络,气之推动使血循行有序,气之固摄使血不致丢失,故血得气则养。肺脏既存在运行经气的无形之肺络也存在运行血液的有形之肺络,范锐等学者认为,有形之肺络与无形之肺络之间即是气、血相互作用之所,亦即气血屏障之所在[44]。根据上述调控肺部屏障防治IPF发生发展的主要生物途径,包括保护肺部屏障的完整性、影响肺泡上皮细胞的修复再生能力、调节细胞衰老、调节上皮-间充质转化和维持肺部微环境稳态等,笔者对中药复方和中成药的代表方药和中药及其活性成分的相关研究进行了梳理归纳[45-57],见表 1。
甘草干姜汤是一种治疗伤寒误汗、咽嗽、遗尿、血症等病症的中药方剂,主要成分有甘草、干姜、蜀椒等。且在《金匮要略》中提及可用于治疗虚寒肺痿。Wang等[52]对甘草干姜汤治疗IPF的作用机制进行研究,结果表明甘草干姜汤能显著改善小鼠肺组织炎症,减轻IPF,降低肺组织中PD-1的含量以及外周血中CD4+T细胞中PD-1表达,降低p-STAT3、IL-17A和TGF-β1的含量。此外甘草干姜汤可通过增加E-钙黏蛋白的表达、减少波形蛋白和α-平滑肌肌动蛋白(α-SMA)来抑制EMT,从而减少细胞外基质(ECM)的沉积。
2.1.2 玉屏风散玉屏风散是具有益气固表止汗功效的补益剂,由黄芪、白术和防风3味中药配伍而成,在临床实践中已被广泛应用与治疗肺部疾病与免疫系统疾病。在Chen等[45]的研究中,网络药理学的结果发现Cav-1可能是玉屏风散治疗IPF的有效靶点,Cav-1是小窝的支架蛋白,在控制细胞传导和内吞作用中发挥重要作用。实验结果表明玉屏风散可以通过调节TGF-β1/Smad2信号通路上调Cav-1的表达,减少肺部炎症与胶原沉积,从而治疗IPF。
2.1.3 益气化瘀化痰方益气化瘀化痰方是曹文富教授基于肺纤维化基本病机“气虚-痰瘀互结-阻滞肺络”的基本病机治疗肺纤维化的基础方,有益气健脾、化瘀消痰散结的功效。田晟等[53]在博来霉素诱导的肺纤维化大鼠模型中探讨了益气化瘀化痰方的作用机制,实验结果表明,益气化瘀化痰方能够通过调节TGF-β/Snail信号通路上调E-钙黏蛋白下调纤连蛋白以逆转EMT,改善肺组织的纤维化程度。
2.2 中成药 2.2.1 痰热清注射液痰热清注射液是具有清热止咳化痰的中成药,在临床上经常用于治疗风温肺热所致的呼吸道疾病,在Deng等[47]的实验结果中,结果表明痰热清注射液可以通过抑制STING信号通路介导的内质网应激改善肺部炎症,减少胶原沉积并恢复肺部通透性改善肺部通气功能。
2.2.2 补肺活血胶囊中医认为在IPF发展过程中,气虚与血瘀均为肺纤维化的病机,瘀血凝滞,阻碍肺气运行,引起肺脏损伤。充盛的肺气可以发挥肺脏“相傅”之能,治节之本,固摄血液在肺络中,使肺络条达,血流通畅;肺气虚时行血、摄血功能减弱,难以化结开瘀,瘀血不去,新血不生,浊邪害清,肺本清虚之体,异物不容,肺体僵化,肺络枯萎,发为肺纤维化。鉴于IPF气虚血瘀的病机特点,中医临床常用补气活血法为治疗大法[58]。补肺活血胶囊是由中药黄芪、赤芍和补骨脂配伍而成的药中成药,用于新型冠状病毒肺炎和肺通气治疗并表现出许多生物学特性,包括增强免疫系统、改善肺部通气功能和心脏功能,促进身体新陈代谢,以及抑制病毒和细菌活性。Li等[49]的研究表明,补肺活血胶囊可以抑制博来霉素诱导的特发性肺纤维化大鼠中E-钙黏蛋白的下调和α-SMA、波形蛋白和Ⅰ型胶原蛋白的上调以逆转EMT,从机制上讲,补肺活血胶囊可以调节TGF-β1/Smad2/3信号通路来治疗特发性肺纤维化。
2.3 中药及有效成分 2.3.1 黄芪甲苷Ⅳ(ASV)ASV是中药黄芪的主要活性成分之一。最近,对ASV药理作用的研究已经证明了其抗氧化、抗炎、抗糖尿病、抗高血压、抗哮喘和抗纤维化的特性,Qian等[48]的实验中,研究结果表明黄芪甲苷(ASV)在纤维化进程中能够通过抑制TGF-β1/PI3K/Akt诱导的FOXO3a过度磷酸化和下调以逆转EMT在肺上皮细胞中E-钙黏蛋白减少和α-平滑肌肌动蛋白(α-SMA)间充质细胞增加,从而减轻博来霉素诱导的特发性肺纤维化。
2.3.2 黄芩素黄芩素(5,6,7-三羟基黄酮)是从黄芩根中提取的1种主要酚类黄酮类化合物,因其抗炎作用,广泛用于治疗多种疾病。Yuan等[55]的研究采用BLM诱导的IPF小鼠模型,结果表明黄芩素可通过抑制TGF-β1/Smad信号通路抑制BLM诱导的肺成纤维细胞衰老和肺纤维化并显著增加了BLM处理小鼠肺组织中Sirtuin 3的表达。
2.3.3 丹酚酸B(SAB)SAB具有抗氧化、抗炎和抗纤维化的生物活性,被认为是一种很有前途的肺部疾病治疗药物。Li等[56]的研究发现SAB显著预防了小鼠的肺纤维化和细胞衰老,并逆转了衰老趋势和肺巨噬细胞和ATⅡ上皮细胞释放的典型衰老相关分泌表型(SASP)因子,从而进一步减少了肺成纤维细胞的活化。
2.3.4 柚皮苷Wei等[57]对柚皮苷的研究结果表明,柚皮苷能够抑制内质网应激和线粒体自噬相关基因以及ERS下游蛋白的表达,从而激活转录因子(ATF)3并抑制PTEN诱导的激酶1(PINK1)的转录维持肺部微环境的稳态来治疗IPF。
2.3.5 薯蓣皂苷元薯蓣皂苷元是1种生物活性甾体三萜皂苷元,存在于胡芦巴和绒毛薯蓣中,是黄体酮合成的主要前体。在胡芦巴的种子和叶子中观察到抗炎、雄激素和避孕等药理学特征[59]。Dinesh等[46]证明了薯蓣皂苷元通过调节EMT在实验性肺纤维化中的纤维保护作用。
2.3.6 肉桂醛(CA)CA是从肉桂中提取的1种单体,具有许多生物学特性,包括抗氧化和抗炎特性[60-61]。CA的抗氧化作用得到了广泛认可,甚至最近还被用作癌症特异性氧化应激放大纳米药物[62]。线粒体功能障碍削弱了MSCs修复远端肺上皮的能力,这是IPF发病机制的关键因素之一[63]。Ke等[54]的研究发现CA可以控制线粒体质量并避免LMSC的凋亡,这可能与PINK1/Parkin信号通路的调节有关。
2.3.7 地黄梓醇(CAT)CAT是从地黄中提取的1种化合物,地黄是传统的中草药,数千年来一直被广泛用于治疗循环系统疾病。Yang等[50]建立了大鼠IPF模型,以验证CAT对IPF的疗效并探讨其作用机制。结果表明,CAT可以通过下调纤维化生物标志物和促进上皮钙黏蛋白的表达来抑制EMT过程和胶原重塑。此外,CAT通过氢键、范德华键和其他相互作用与TGF-βR1、Smad3、Wnt3a和GSK-3β结合,下调Smad3,Wnt3a、GSK-3α和β-连环蛋白的表达和磷酸化,抑制细胞因子的表达,降低肺组织中的氧化应激程度。
2.3.8 华蟾素(CBG)CBG已被广泛用于长期止痛、心脏刺激、抗炎和局部麻醉治疗,在Li等[51]的研究表明华蟾素以剂量依赖的方式抑制TGF-β1/Smad3信号传导,减弱肺成纤维细胞的活化和分化,并抑制TGF-α诱导的肺泡上皮细胞EMT。
3 结语与展望中医药在临床治疗IPF上未见明显不良反应,并且随着进一步的研究,中药复方、中成药以及中药活性成分对防治IPF的药理作用探究和临床实践均取得了一定进展。文章主要从调控肺屏障防控IPF的角度对中药复方、中成药代表方药以及代表性中药活性成分进行了梳理总结。鉴于IPF发病机制复杂、早期隐匿性的特点,中药复方以及中成药能够发挥多种通路多种机制间的串联作用,发挥中药多途径,多重机制的效应,并较西药对改善咳嗽和呼吸困难的症状以及能够调节免疫功能,减轻抗纤维化作用的毒副作用,发挥“增效减毒”的作用。在IPF病理发展过程中,笔者认为肺部屏障主要涉及4个主要环节:屏障完整性、上皮-间充质转化过程、上皮细胞的衰老与再生能力和内皮细胞类型的转化。
总的来说,从肺泡上皮屏障开始,基底膜和上皮细胞的损伤会导致细胞和细胞因子之间复杂的相互作用,从而将纤维化过程传播到肺泡壁、肺泡腔,最后传播到附近的肺实质。笔者对调控肺屏障的相关机制的进行了梳理,然而由于笔者对IPF的作用机制和发病机制并未完全阐释,对通路的延展性和屏障相关细胞与IPF发生发展之间可能会有进一步的发现。此外,笔者发现多数研究的核心指标还是围绕自噬、炎症、氧化应激等,但在IPF发展过程中间EMT、不同细胞之间复杂的相互作用会决定IPF的疾病严重程度。因此,笔者认为,通过肺泡物理构成角度对肺部屏障的在不同时空之间的作用与功能进行划分,有助于在疾病不同阶段的细化防治需求,以达到对IPF更精确的预防与治疗。
| [1] |
王春娥, 王辛秋. 晁恩祥治疗肺间质纤维化经验小结[J]. 福建中医药, 2018, 49(4): 2. |
| [2] |
陆鹏, 任凤艳, 潘 迪., 等. 肺玄府络脉与气血屏障论[J]. 中医杂志, 2016, 57(16): 1433-1435. |
| [3] |
安丽萍, 杜全宇, 杨 晗., 等. 益气活血法治疗特发性肺纤维化的机制研究进展[J]. 世界科学技术-中医药现代化, 2023, 25(6): 2122-2131. |
| [4] |
PARIMON T, YAO C F, STRIPP B R, et al. Alveolar epithelial type Ⅱ cells as drivers of lung fibrosis in idiopathic pulmonary fibrosis[J]. International Journal of Molecular Sciences, 2020, 21(7): 2269. DOI:10.3390/ijms21072269 |
| [5] |
YANAGIHARA T, TSUBOUCHI K, ZHOU Q, et al. Vascular-parenchymal cross-talk promotes lung fibrosis through BMPR2 signaling[J]. American Journal of Respiratory And Critical Care Medicine, 2023, 207(11): 1498-1514. DOI:10.1164/rccm.202109-2174OC |
| [6] |
YANAGIHARA T, GUIGNABERT C, KOLB M R J. Endothelial cells in pulmonary fibrosis: more than a bystander[J]. The European respiratory journal, 2023, 61(6): 2300407. DOI:10.1183/13993003.00407-2023 |
| [7] |
PLANTIER L, CAZES A, DINH-XUAN A T, et al. Physiology of the lung in idiopathic pulmonary fibrosis[J]. European respiratory review: an official journal of the European Respiratory Society, 2018, 27(147): 170062. DOI:10.1183/16000617.0062-2017 |
| [8] |
WANG Y, KUAN P J, XING C, et al. Genetic defects in surfactant protein A2 are associated with pulmonary fibrosis and lung cancer[J]. American Journal of Human Genetics, 2009, 84(1): 52-59. DOI:10.1016/j.ajhg.2008.11.010 |
| [9] |
VAN MOORSEL C H, VAN OOSTERHOUT M F, BARLO N P, et al. Surfactant protein C mutations are the basis of a significant portion of adult familial pulmonary fibrosis in a dutch cohort[J]. American Journal of Respiratory And Critical Care Medicine, 2010, 182(11): 1419-1425. DOI:10.1164/rccm.200906-0953OC |
| [10] |
CROSSNO P F, POLOSUKHIN V V, BLACKWELL T S, et al. Identification of early interstitial lung disease in an individual with genetic variations in ABCA3 and SFTPC[J]. Chest, 2010, 137(4): 969-973. DOI:10.1378/chest.09-0790 |
| [11] |
KORTEKAAS R K, GEILLINGER-KÄSTLE K E, BORGHUIS T, et al. Interleukin-11 disrupts alveolar epithelial progenitor function[J]. Erj Open Research, 2023, 9(3): 00679-02022. |
| [12] |
FUCHS S, HOLLINS A J, LAUE M, et al. Differentiation of human alveolar epithelial cells in primary culture: morphological characterization and synthesis of caveolin-1 and surfactant protein-C[J]. Cell and tissue research, 2003, 311(1): 31-45. DOI:10.1007/s00441-002-0653-5 |
| [13] |
XU S Y, XUE X D, YOU K, et al. Caveolin-1 regulates the expression of tight junction proteins during hyperoxia-induced pulmonary epithelial barrier breakdown[J]. Respiratory Research, 2016, 17(1): 50. DOI:10.1186/s12931-016-0364-1 |
| [14] |
KASPER M, REIMANN T, HEMPEL U, et al. Loss of caveolin expression in type Ⅰ pneumocytes as an indicator of subcellular alterations during lung fibrogenesis[J]. Histochemistry and cell biology, 1998, 109(1): 41-48. |
| [15] |
MENZAEL V, ZIEGLER M, HANTE N, et al. Fyn-kinase and caveolin-1 in the alveolar epithelial junctional adherence complex contribute to the early stages of pulmonary fibrosis[J]. European journal of pharmaceutical sciences: official journal of the European Federation for Pharmaceutical Sciences, 2022, 175: 106236. DOI:10.1016/j.ejps.2022.106236 |
| [16] |
NIETO M A, HUANG R Y J, JACKSON R A, et al. EMT: 2016[J]. Cell, 2016, 166(1): 21-45. DOI:10.1016/j.cell.2016.06.028 |
| [17] |
JAYACHANDRAN A, KONIGSHOFF M, YU H, et al. SNAI transcription factors mediate epithelial-mesenchymal transition in lung fibrosis[J]. Thorax, 2009, 64(12): 1053-1061. DOI:10.1136/thx.2009.121798 |
| [18] |
CHILOSI M, POLETTI V, ZAMO A, et al. Aberrant Wnt/beta-catenin pathway activation in idiopathic pulmonary fibrosis[J]. Am J Pathol, 2003, 162(5): 1495-1502. DOI:10.1016/S0002-9440(10)64282-4 |
| [19] |
YAO L D, CONFORTI F, HILL C, et al. Paracrine signalling during ZEB1-mediated epithelial-mesenchymal transition augments local myofibroblast differentiation in lung fibrosis[J]. Cell Death Differ, 2019, 26(5): 943-957. DOI:10.1038/s41418-018-0175-7 |
| [20] |
YAO L D, ZHOU Y L, LI J J, et al. Bidirectional epithelial-mesenchymal crosstalk provides self-sustaining profibrotic signals in pulmonary fibrosis[J]. The Journal of Biological Chemistry, 2021, 297(3): 101096. DOI:10.1016/j.jbc.2021.101096 |
| [21] |
HOO Z H, WHYTE M K B. Idiopathic pulmonary fibrosis[J]. Thorax, 2012, 67(8): 742-746. DOI:10.1136/thoraxjnl-2011-200515 |
| [22] |
DISAYABUTR S, KIM E K, CHA S I, et al. MiR-34 miRNAs regulate cellular senescence in type Ⅱ alveolar epithelial cells of patients with idiopathic pulmonary fibrosis[J]. PloS one, 2016, 11(6): e0158367. DOI:10.1371/journal.pone.0158367 |
| [23] |
SCHAFER M J, WHITE T A, IIJIMA K, et al. Cellular senescence mediates fibrotic pulmonary disease[J]. Nature communications, 2017, 8: 14532. DOI:10.1038/ncomms14532 |
| [24] |
CITRIN D E, SHANKAVARAM U, HORTON J A, et al. Role of typeⅡpneumocyte senescence in radiation-induced lung fibrosis[J]. Journal of the National Cancer Institute, 2013, 105(19): 1474-1484. DOI:10.1093/jnci/djt212 |
| [25] |
JIANG C S, LIU G, LUCKHARDT T, et al. Serpine 1 induces alveolar type Ⅱ cell senescence through activating p53-p21-Rb pathway in fibrotic lung disease[J]. Aging cell, 2017, 16(5): 1114-1124. DOI:10.1111/acel.12643 |
| [26] |
LEHMANN M, KORFEI M, MUTZE K, et al. Senolytic drugs target alveolar epithelial cell function and attenuate experimental lung fibrosis ex vivo[J]. The European Respiratory Journal, 2017, 50(2): 1602367. DOI:10.1183/13993003.02367-2016 |
| [27] |
ÁLVAREZ D, CÁRDENES N, SELLARÉS J, et al. IPF lung fibroblasts have a senescent phenotype[J]. American Journal of Physiology Lung Cellular and Molecular Physiology, 2017, 313(6): L1164-1l73. DOI:10.1152/ajplung.00220.2017 |
| [28] |
RANA T, JIANG C S, BANERJEE S, et al. PAI-1 regulation of p53 expression and senescence in typeⅡalveolar epithelial cells[J]. Cells, 2023, 12(15): 2008. DOI:10.3390/cells12152008 |
| [29] |
VAN SOLDT B J, QIAN J, LI J, et al. Yap and its subcellular localization have distinct compartment-specific roles in the developing lung[J]. Development, 2019, 146(9): dev175810. DOI:10.1242/dev.175810 |
| [30] |
LANGE A W, SRIDHARAN A, XU Y, et al. Hippo/Yap signaling controls epithelial progenitor cell proliferation and differentiation in the embryonic and adult lung[J]. Journal of Molecular Cell Biology, 2015, 7(1): 35-47. DOI:10.1093/jmcb/mju046 |
| [31] |
GOKEY J J, SRIDHARAN A, XU Y, et al. Active epithelial Hippo signaling in idiopathic pulmonary fibrosis[J]. JCI Insight, 2018, 3(6): e98738. DOI:10.1172/jci.insight.98738 |
| [32] |
DIGIOVANNI G T, HAN W, SHERRILL T P, et al. Epithelial Yap/Taz are required for functional alveolar regeneration following acute lung injury[J]. JCI Insight, 2023, 8(19): e173374. DOI:10.1172/jci.insight.173374 |
| [33] |
WANG G L, WEN B Q, DENG Z C, et al. Endothelial progenitor cells stimulate neonatal lung angiogenesis through FOXF1-mediated activation of BMP9/ACVRL1 signaling[J]. Nature Communications, 2022, 13(1): 2080. DOI:10.1038/s41467-022-29746-y |
| [34] |
REN X M, USTIYAN V, PRADHAN A, et al. FOXF1 transcription factor is required for formation of embryonic vasculature by regulating VEGF signaling in endothelial cells[J]. Circulation Research, 2014, 115(8): 709-720. DOI:10.1161/CIRCRESAHA.115.304382 |
| [35] |
REN X M, USTIYAN V, GUO M Z, et al. Postnatal alveologenesis depends on FOXF1 signaling in c-KIT+ endothelial progenitor cells[J]. American Journal of Respiratory and Critical Care Medicine, 2019, 200(9): 1164-1176. DOI:10.1164/rccm.201812-2312OC |
| [36] |
PRADHAN A, DUNN A, USTIYAN V, et al. The S52F FOXF1 mutation inhibits STAT3 signaling and causes alveolar capillary dysplasia[J]. American Journal of Respiratory and Critical Care Medicine, 2019, 200(8): 1045-1056. DOI:10.1164/rccm.201810-1897OC |
| [37] |
KALUCKA J, DE ROOIJ L P M H, GOVEIA J, et al. Single-cell transcriptome atlas of murine endothelial cells[J]. Cell, 2020, 180(4): 764-779. DOI:10.1016/j.cell.2020.01.015 |
| [38] |
PAIK D T, TIAN L, WILLIAMS I M, et al. Single-cell RNA sequencing unveils unique transcriptomic signatures of organ-specific endothelial cells[J]. Circulation, 2020, 142(19): 1848-1862. DOI:10.1161/CIRCULATIONAHA.119.041433 |
| [39] |
BIAN F H, LAN Y W, ZHAO S Y, et al. Lung endothelial cells regulate pulmonary fibrosis through FOXF1/R-Ras signaling[J]. Nature Communications, 2023, 14(1): 2560. DOI:10.1038/s41467-023-38177-2 |
| [40] |
O'DWYER D N, ASHLEY S L, GURCZYNSKI S J, et al. Lung microbiota contribute to pulmonary inflammation and disease progression in pulmonary fibrosis[J]. American Journal of Respiratory and Critical Care Medicine, 2019, 199(9): 1127-1138. DOI:10.1164/rccm.201809-1650OC |
| [41] |
O'DWYER D N, NORMAN K C, XIA M, et al. The peripheral blood proteome signature of idiopathic pulmonary fibrosis is distinct from normal and is associated with novel immunological processes[J]. Scientific Reports, 2017, 7: 46560. DOI:10.1038/srep46560 |
| [42] |
HASAN N A H M, HARITH H H, ISRAF D A, et al. The differential effects of commercial specialized media on cell growth and transforming growth factor beta 1-induced epithelial-mesenchymal transition in bronchial epithelial cells[J]. Molecular Biology Reports, 2020, 47(5): 3511-3519. DOI:10.1007/s11033-020-05439-x |
| [43] |
LETTIERI S, BERTUCCIO F R, DEL FRATE L, et al. The plastic interplay between lung regeneration phenomena and fibrotic evolution: Current challenges and novel therapeutic perspectives[J]. International Journal of Molecular Sciences, 2023, 25(1): 547. DOI:10.3390/ijms25010547 |
| [44] |
范锐, 张伟. 从气血关系探讨特发性肺纤维化之弥散功能障碍[J]. 时珍国医国药, 2020, 31(7): 1670-1671. DOI:10.3969/j.issn.1008-0805.2020.07.041 |
| [45] |
CHEN X, WEI M, LI G D, et al. YuPingFeng(YPF) upregulates caveolin-1(CAV1) to alleviate pulmonary fibrosis through the TGF-β1/Smad2 pathway[J]. Journal of Ethnophar- macology, 2024, 319(Pt 3): 117357. |
| [46] |
DINESH BABU V, SURESH KUMAR A, SUDHANDIRAN G. Diosgenin inhibits TGF-β1/Smad signaling and regulates epithelial mesenchymal transition in experimental pulmonary fibrosis[J]. Drug and Chemical Toxicology, 2022, 45(3): 1264-1275. DOI:10.1080/01480545.2020.1814803 |
| [47] |
DENG J L, HE Y Q, SUN G C, et al. Tanreqing injection protects against bleomycin-induced pulmonary fibrosis via inhibiting STING-mediated endoplasmic reticulum stress signaling pathway[J]. Journal of Ethnopharmacology, 2023, 305: 116071. DOI:10.1016/j.jep.2022.116071 |
| [48] |
QIAN W B, CAI X R, QIAN Q H, et al. Astragaloside Ⅳ modulates TGF-β1-dependent epithelial-mesenchymal transition in bleomycin-induced pulmonary fibrosis[J]. Journal of Cellular and Molecular Medicine, 2018, 22(9): 4354-4365. DOI:10.1111/jcmm.13725 |
| [49] |
LI Y Y, QIN W G, LIANG Q L, et al. Bufei Huoxue capsule alleviates bleomycin-induced pulmonary fibrosis in mice via TGF-β1/Smad2/3 signaling[J]. Journal of Ethnopharmacology, 2023, 316: 116733. DOI:10.1016/j.jep.2023.116733 |
| [50] |
YANG F, HOU Z F, ZHU H Y, et al. Catalpol protects against pulmonary fibrosis through inhibiting TGF-β1/Smad3 and Wnt/β-catenin signaling pathways[J]. Frontiers in Pharmacology, 2021, 11: 594139. DOI:10.3389/fphar.2020.594139 |
| [51] |
LI X H, BI Z, LIU S S, et al. Antifibrotic mechanism of cinobufagin in bleomycin-induced pulmonary fibrosis in mice[J]. Frontiers in Pharmacology, 2019, 10: 1021. DOI:10.3389/fphar.2019.01021 |
| [52] |
WANG D, GONG L L, LI Z F, et al. Antifibrotic effect of Gancao Ganjiang decoction is mediated by PD-1/TGF-β1/IL-17A pathway in bleomycin-induced idiopathic pulmonary fibrosis[J]. Journal of Ethnopharmacology, 2021, 281: 114522. DOI:10.1016/j.jep.2021.114522 |
| [53] |
田晟, 曹文富, 张永越, 等. 益气化瘀化痰方对肺纤维化大鼠的干预作用及其机制[J]. 中国应用生理学杂志, 2019, 35(2): 101-106, 144. |
| [54] |
KE S W, ZHU W, LAN Z H, et al. Cinnamaldehyde regulates mitochondrial quality against hydrogen peroxide induced apoptosis in mouse lung mesenchymal stem cells via the PINK1/Parkin signaling pathway[J]. PeerJ, 2022, 10: e14045. DOI:10.7717/peerj.14045 |
| [55] |
YUAN J H, MA Y, YUAN L H, et al. Baicalein attenuates bleomycin-induced lung fibroblast senescence and lung fibrosis through restoration of Sirt3 expression[J]. Pharmaceutical Biology, 2023, 61(1): 288-297. DOI:10.1080/13880209.2022.2160767 |
| [56] |
LI Y J, CHEN R Y, WU J Z, et al. Salvianolic acid B protects against pulmonary fibrosis by attenuating stimulating protein 1-mediated macrophage and alveolar type 2 cell senescence[J]. Phytotherapy Research, 2024, 38(2): 620-635. DOI:10.1002/ptr.8070 |
| [57] |
WEI Y, SUN L, LIU C, et al. Naringin regulates endoplasmic reticulum stress and mitophagy through the ATF3/PINK1 signaling axis to alleviate pulmonary fibrosis[J]. Naunyn-Schmiedeberg's Archives of Pharmacology, 2023, 396(6): 1155-1169. DOI:10.1007/s00210-023-02390-z |
| [58] |
王怡然, 张伟. 从气虚血瘀与血管新生相关性论治特发性肺纤维化[J]. 山东中医杂志, 2024, 43(4): 353-356. |
| [59] |
KHATOON F, AZAHAR M, UDDIN Q, et al. A comprehensive review on Trigonella foenum-graecum L. with special reference to unani medicine[J]. Combinatorial Chemistry & High Throughput Screening, 2024, 27(2): 187-202. |
| [60] |
DOYLE A A, STEPHENS J C. A review of cinnamaldehyde and its derivatives as antibacterial agents[J]. Fitoterapia, 2019, 139: 104405. DOI:10.1016/j.fitote.2019.104405 |
| [61] |
ISMAIL B S, MAHMOUD B, ABDEL-REHEIM E S, et al. Cinnamaldehyde mitigates atherosclerosis induced by high-fat diet via modulation of hyperlipidemia, oxidative stress, and inflammation[J]. Oxidative Medicine and Cellular Lon- gevity, 2022, 2022: 4464180. |
| [62] |
WANG Q H, JIA X L, LI X L, et al. One-pot fabrication of a polydopamine-based nanoplatform for GSH triggered trimodal ROS-amplification for cancer therapy[J]. Biomaterials Science, 2022, 10(15): 4208-4217. DOI:10.1039/D2BM00421F |
| [63] |
FERGIE N, TODD N, MCCLEMENTS L, et al. Hypercapnic acidosis induces mitochondrial dysfunction and impairs the ability of mesenchymal stem cells to promote distal lung epithelial repair[J]. FASEB Journal, 2019, 33(4): 5585-5598. DOI:10.1096/fj.201802056R |
 2024, Vol. 43
2024, Vol. 43





