文章信息
- 邱建永, 张建军, 洪笃云, 李文兵, 冯穗芬, 程良凯
- QIU Jianyong, ZHANG Jianjun, HONG Duyun, LI Wenbing, FENG Suifen, CHENG Liangkai
- 基于Nrf2/ARE信号通路探讨中药治疗慢性阻塞性肺疾病的研究进展
- Research progress on traditional Chinese medicine treatment of chronic obstructive pulmonary disease based on the Nrf2/ARE signaling pathway
- 天津中医药大学学报, 2024, 43(12): 1140-1147
- Journal of Tianjin University of Traditional Chinese Medicine, 2024, 43(12): 1140-1147
- http://dx.doi.org/10.11656/j.issn.1673-9043.2024.12.13
-
文章历史
收稿日期: 2024-08-20
2. 广东省中医药研究开发重点实验室, 广州 510095
2. Guangdong Provincical Key Laboratory of Research and Development in Traditional Chinese Medicine, Guangzhou 510095, China
慢性阻塞性肺疾病(COPD)是一种常见的慢性呼吸系统疾病,其特点是持续的气流阻塞伴随呼吸系统症状,患者气道的炎症和氧化应激是其反复发病的重要原因。COPD是全球第三大死亡原因,是1个危害人类健康的严重公共卫生问题,具有复发率高的特点[1]。目前COPD的西医治疗方式主要是抗炎和舒张支气管,同时采用止咳、祛痰、吸氧等对症治疗[2],但是存在肺损伤严重、疾病易反复等问题,因此降低肺部损伤,减少疾病的复发是COPD的重要治疗思路。中医COPD属于“咳嗽”“肺胀”“喘证”,而在证型上多属本虚标实,虚为脾、肺、肾等脏器之虚,实为痰和瘀等病理产物之实,外邪引动痰饮、肺气壅塞导致肺胀是COPD急性加重的原因[3-5],因此COPD的中药治疗多数扶正与祛邪兼用,在祛痰、瘀等实证的基础上,同时根据辨证进行温补肺肾,做到标本兼治。而中药治疗慢阻肺,因其多靶点、多途径的治疗效果和较高的安全性,已经成为COPD治疗的重要方式[6-7]。NF-E2相关因子2(Nrf2)/抗氧化反应原件(ARE)信号通路能够调控机体的氧化还原平衡,是影响COPD的疾病进展的重要因子[8]。目前较多学者研究将Nrf2作为COPD治疗的药理学靶点,通过干预Nrf2/ARE信号通路,改善慢阻肺患者的氧化应激反应,延缓COPD的疾病进展[9]。另一方面,较多研究表明中药及其相关有效成分可以通过调控关键因子Nrf2在COPD的防治上发挥关键作用[10-11],故文章对Nrf2/ARE信号通路与相关的COPD中药治疗机制做一综述,以期为中药治疗COPD的研究提供一些思路和依据。
1 Nrf2/ARE信号通路的概况Nrf2/ARE是人体重要的抗氧化信号通路之一,可以调控一系列细胞保护基因的表达,而Kelch样ECH关联蛋白1(Keap1)是Nrf2/ARE信号通路的主要调节蛋白,可以通过负调控Nrf2的降解,调控细胞的氧化还原平衡。此外,Nrf2除了通过Keap1调控的经典途径激活外,也受到激酶等其他蛋白的调控,而产生抗氧化、抗炎等细胞保护作用,目前也已经发现有较多中药通过非经典途径激活Nrf2来治疗COPD。
1.1 Nrf2与Keap1Nrf2是由605个氨基酸组成的转录因子,属于cap-n-collar转录因子家族[12]。其包含有7个高度保守的结构域,分别为Nrf2-ECH同源结构域(Neh)1-Neh7。Neh1结构域负责与小肌肉腱膜纤维肉瘤(sMAF)形成异二聚体[13];Neh 2结构域是与Keap1的结合结构域,通过其ETGE和DLG基序与Keap1的Kelch结构域进行结合[14],采取破坏Nrf2的DLG基序与Keap1的结合的策略,也是中药Nrf2激活剂的研究热点,例如吴茱萸次碱通过抑制Keap1-Nrf2的相互作用,激活Nrf2/ARE信号通路来改善炎症[15];Neh3结构域可与三磷酸腺苷(ATP)依赖的染色质解螺旋酶DNA结合蛋白6(CHD6)结合,影响ARE依赖的相关基因表达[16];Neh4和Neh5结构域通过与环磷腺苷效应元件结合蛋白或类固醇受体共激活因子3结合来调控Nrf 2的转录激活[17];Neh 6结构域在基于磷酸化和泛素化的Nrf2活性调节中起作用,其DSGIS和DSAPGS模块与糖原合成酶激酶3β(GSK-3β)和β转导重复相容蛋白(β-TrCP)相互作用[18];Neh7结构域可以通过与类视黄醇X受体相互作用来抑制Nrf2[19]。见图 1。
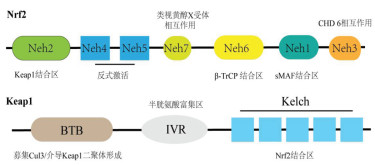
|
| 图 1 Nrf2与Keap1的结构示意图 |
Keap1是富含半胱氨酸的锌指同源二聚体,主要存在于细胞质中,正常生理状态下与肌动蛋白结合锚定于胞浆[20]。Keap1主要的功能结构域为BTB、间隔区(IVR)、Kelch 3个结构域。其中BTB结构域的功能主要为募集cullin 3,介导Keap1的同源二聚化[20];Kelch结构域主要负责与Nrf2的Neh2结构域结合[21];IVR结构域的特征在于富含半胱氨酸残基,感应细胞的氧化应激状态,见图 1。Nrf2激活依赖于Keap1中的氧化还原敏感性半胱氨酸残基,其中C273、C151和C288是3个鉴定和研究比较充分的半胱氨酸残基,也是影响Keap1与Nrf2结合的主要半胱氨酸传感器[22-23]。针对该点,目前已经有较多研究发现一些中药单体通过结合到Keap1上关键的半胱氨酸,激活Nrf2而产生细胞保护作用,例如中药毛冬青提取物pubescenoside A通过共价结合Keap1上C151和C434两个半胱氨酸,激活Nrf2/ARE信号通路,对细胞产生保护作用[24]。
1.2 Keap1/Nrf 2/ARE信号通路的抗氧化机制在正常生理状态下,细胞内的Nrf2通过与Keap1以及cullin 3-E3泛素连接酶结合形成复合物而被连续的泛素化降解;当细胞内氧化还原失衡,Keap1上的关键半胱氨酸残基被修饰,导致Keap1的构象变化,随后Keap1与结合亲和力较低的DLG基序解离,泛素化过程被打断,Nrf2的降解过程被抑制[25]。最终大量Nrf2进入细胞核与sMAF结合形成异二聚体,随后与ARE位点结合并启动下游的一系列抗氧化酶基因、细胞解毒酶基因的表达,如血红素加氧酶1(HO-1)、醌氧化还原酶1(NQO1)、γ-谷氨酰半胱氨酸连接酶(GCL)、超氧化物歧化酶(SOD)等,从而维护细胞内的氧化还原平衡,发挥抗炎、抗氧化的作用。
1.3 Nrf2的其他相关激活机制Nrf2作为内源性抗氧化通路的关键开关,除了受到Keap1的调控外,还受到很多激酶的调控,例如磷脂酰肌醇3-激酶(PI3K)、丝裂原活化蛋白激酶(MAPKs)、c-Jun氨基末端激酶(JNK)和细胞外调节蛋白激酶(ERK),这些激酶可以通过磷酸化Nrf2,使Nrf2稳定化进入细胞核而激活[26-27];而GSK-3β除了可以在Neh 6结构域中的DSGIS基序中的丝氨酸处直接磷酸化Nrf2,还能通过激活Fyn激酶促进Nrf2从细胞核转位,导致Nrf2失活[28]。
P62/SQSTM1是1种自噬衔接蛋白,可以通过调控Keap1的自噬降解引起Nrf2的激活。该蛋白中的STGE基序类似于Nrf2的ETGE基序,STGE基序磷酸化后与Keap1的Kelch结构域有更高的结合亲和力,结合Keap1会启动Keap1的自噬降解,随后导致Nrf2无法被泛素化降解而激活[29]。最新的研究发现,黄芪甲苷就可以通过调控P62/Keap1/Nrf2通路,减轻细胞损伤[30]。
2 Nrf2/ARE信号通路在COPD中的作用氧化应激是COPD疾病恶化和进展的主要影响机制,全身性的氧化应激会导致肺部细胞的进一步损伤,加重COPD的并发症,刺激纤维化和肺气肿,加速肺老化。COPD中氧化应激的主要影响因素包括肺部炎症的增加、外源性氧化剂(香烟的烟雾、粉尘)的刺激,内源性氧化剂(活性氧、一氧化氮、超氧阴离子)的增加。多项研究表明,COPD患者中Nrf2的表达受到损害,导致抗氧化防御机制的失衡,例如香烟烟雾(CS)提取物刺激人支气管上皮细胞会导致Nrf2表达低于对照[31];COPD患者的肺中Nrf2表达下调,并且COPD的进展与Nrf2启动子的高甲基化抑制了Nrf2/谷胱甘肽过氧化物酶4的表达相关[32];老年吸烟者和COPD患者肺巨噬细胞的Nrf2表达同样呈现下调[33]。另一方面,大量研究表明Nrf2的缺失会导致肺在各种呼吸系统疾病模型中表现出对损伤的严重性和易感性,例如Nrf2的缺失加剧了臭氧引起的肺部损伤[34-36],而Keap1缺失引起Nrf2的激活则表现出对肺的保护作用,例如能缓解COPD模型小鼠体内的氧化应激和CS诱导的炎症[37]。
综上所述,Nrf2是COPD发病过程中的关键因子,Nrf2的缺失或减少会导致COPD的进一步加重,而Nrf2/ARE信号通路的激活通过上调抗氧化酶和细胞解毒酶的表达,可以抵抗慢阻肺患者内源性和外源性的氧化损伤,从而改善肺部炎症、肺气肿以及相关并发症。因此通过干预Nrf2/ARE信号通路,治疗COPD是中药治疗COPD的1个重要研究方向。
3 中药干预Nrf2/ARE信号通路治疗COPD在慢阻肺的治疗中,中药治疗已经得到了广泛的应用,临床上中药汤剂治疗COPD有效率高,炎症指标以及临床症状改善明显[38]。国内外现代医学研究也表明,中药可以通过干预COPD恶化的关键因子Nrf2,增加机体的抗氧化、抗炎能力,抑制炎症、细胞凋亡等对COPD产生治疗效果[39]。故文章总结了近年来基于Nrf2/ARE信号通路治疗COPD的中药相关研究,并根据不同的Nrf2相关机制进行分类讨论。
3.1 Keap1/Nrf2/ARE经典通路Keap1是Nrf2最重要的负调控因子,在Nrf2的降解上起关键作用。目前关于中药通过激活Keap1/Nrf2/ARE经典通路,治疗COPD的报道也较多。Song等[40]发现丹参的主要活性成分隐丹参酮可以通过抑制Keap1蛋白的表达,激活Nrf2来逆转COPD模型小鼠的肺功能下降、肺气肿、炎性细胞浸润和肺病理损伤,并且肺组织中的肿瘤坏死因子-α(TNF-α)、白细胞介素(IL)-6和IL-1β等炎性细胞因子表达降低,SOD、过氧化氢酶和谷胱甘肽(GSH)等抗氧化物质的活性上升。另外,在中药汤剂的研究上,补肺益肾方被证明可以通过影响Keap1、Nrf2蛋白的表达,提高抗氧化物SOD1、HO-1和GCL水平,来减轻COPD大鼠肺组织病理损伤[41]。也有一项临床研究发现平喘固本汤可以通过降低Keap1的表达,激活Nrf2,调节炎症因子和抗氧化酶的水平,发挥对COPD的治疗作用[42]。
除了通过影响Keap1表达的方式激活Nrf2,也有部分中药通过修饰Keap1上关键的半胱氨酸激活Nrf2的报道。Yang等[43]发现中药灯笼果提取物4β-羟基醉茄内酯E,可以通过修饰Keap1的C151和C288两个半胱氨酸残基,阻断Keap1-Nrf2的相互作用,抑制Nrf2的泛素化,激活Nrf2介导的抗氧化反应,从而有效抑制CS诱导的小鼠肺部的氧化应激和炎症反应。另外基于天然Nrf2激活剂白藜芦醇骨架合成的衍生物二苯乙烯-4,4’-二醇,也被证明通过修饰Keap1蛋白中的C151半胱氨酸,激活Nrf2,增强细胞内的抗氧化能力,最终缓解CS诱导的肺损伤[44]。
P62是1种自噬蛋白,可以通过调控Keap1的自噬降解激活Nrf2。Xu等[45]研究发现,沙棘和银杏叶的主要活性成分异鼠李素可以通过促进p62相关的Keap1降解激活Nrf2,同时其研究结果表明异鼠李素减少了白细胞募集和小鼠IL-6、单核细胞趋化蛋白-1的水平,提高了细胞保护因子HO-1、SOD的表达,降低了香烟烟雾诱导的COPD小鼠的炎症反应。
综上,中药激活Keap1/Nrf2/ARE经典途径治疗COPD的主要通过3种方式包括影响Keap1蛋白的表达、修饰Keap1蛋白的关键半胱氨酸残基、促进P62介导的Keap1降解。其中关于中药影响Keap1-Nrf2蛋白与蛋白间相互作用的研究缺乏,未来对于该方向的深入探讨具有较大的潜在价值。
3.2 激酶相关的Nrf2通路Nrf2/ARE信号通路的激活受到很多激酶的调控,例如PI3K、JNK等,激酶通过磷酸化Nrf2,促使Nrf2稳定化入核,激活Nrf2/ARE信号通路。Hsu等[46]发现银杏叶提取物可以激活ERK、JNK、MAPKs,增加Nrf2的核水平,上调HO-1的表达,从而减少了香烟烟雾提取物诱导的氧化应激和细胞凋亡。此外MAPKs的抑制剂可以废除银杏叶提取物对Nrf2的激活作用,表明银杏叶提取物通过MAPKs/Nrf 2/HO-1信号通路对香烟烟雾提取物诱导的人肺内皮细胞产生治疗效果。也有研究发现黄芩素通过调控JNK/丝裂原活化蛋白激酶(p38)/Nrf2以及铁死亡,可以减轻COPD的炎症和细胞死亡[47]。玉屏风散是中医常用的补益剂,最近的研究表明,玉屏风散可以改善脂多糖诱导的小鼠急性肺损伤,这可能与MAPK/Nrf2/HO-1信号通路相关[48]。另外,Li等[49]发现的补肾防喘方进一步激活Nrf2改善COPD的途径依赖于激酶PI3K和蛋白激酶B,以及Jian等[50]发现枇杷叶三萜酸激活Nrf2通过AMP依赖的蛋白激酶(AMPK)。众多的研究表明激酶相关的Nrf2激活方式在中药治疗慢阻肺上发挥重要作用,然而目前关于中药对于激酶的具体调控机制研究缺失。
3.3 Nrf2与核因子-κB(NF-κB)通路Nrf2/ARE是人体最重要的抗炎抗氧化信号通路,而NF-κB为典型的促炎信号通路。其促炎机制主要基于NF-κB在促炎基因表达中的作用,NF-κB也一直都被认为是新型抗炎药物的“圣杯”。目前有较多的中药被证实可以通过调控Nrf2与NF-κB双通路来治疗COPD。
Dang等[51]发现旋覆花提取物土木香内酯可以通过减弱NF-κB通路的激活,促进Nrf2入核,抑制COPD小鼠的炎症反应、细胞凋亡和氧化应激。其中土木香内酯处理组显著改善了炎症细胞因子IL-1β、TNF-α、IL-6和干扰素(IFN)-γ的表达以及氧化应激标志物丙二醛(MDA)、活性氧(ROS)和SOD的水平。类似的,异甘草素、连翘脂苷、氧化苦参碱和桔梗皂苷D也均被证明可以通过激活Nrf2的同时抑制NF-κB信号通路,改善COPD模型肺部的氧化应激和炎症反应,对COPD起到防治作用[52-55]。除了中药单体的研究报道,Park等[56]证明桑寄生的70%乙醇提取物可以通过增强Nrf2信号通路和抑制NF-κB的激活来缓解COPD小鼠的肺部炎症。此外,枇杷叶三萜酸也可以通过调节AMPK/Nrf 2和NF-κB通路改善吸烟诱导的COPD炎症反应[50]。在中药汤剂也有相关报道,有研究发现补肾防喘方通过激活PI3K/癌基因蛋白激酶B(AKT)-Nrf2和NF-κB信号通路,可以减轻CS诱导的COPD炎症[49]。
总的来说,在抗炎机制的串扰协同上,无论是中药单体还是复杂的中药提取物、中药汤剂,目前研究均发现了对Nrf2与NF-κB通路的双通路的调控作用。
3.4 Nrf2下游机制研究对于中药调控Nrf2治疗COPD的下游机制研究,目前主要涉及一系列氧化还原相关的酶。
其中HO-1是细胞内关键抗氧化酶,其细胞保护作用主要表现在催化分解血红素、避免血红素蓄积损伤细胞,另外催化过程中消耗氧气可减少氧自由基生成。Li等[57]发现黄芩中分离的天然黄酮类化合物千层纸素A通过激活Nrf2,可以上调ARE调节的基因,如HO-1、谷胱甘肽还原酶(GR),上调肺组织GSH水平和GR活性,来减轻香烟烟雾诱导的氧化应激和肺部炎症。另外对于单味中药的总提取物研究,蒲公英总黄酮也均被证明可以提高Nrf2和HO-1的表达,减轻COPD模型肺部的氧化损伤和炎症反应[58]。中药汤剂上,全真一气汤则通过激活Nrf2/HO-1通路来减轻香烟烟雾诱导的COPD小鼠肺气肿、肺部炎症[11]。
NQO1也是重要的Nrf2下游调控蛋白,通过将氧化剂还原为相对稳定的形式,起到了抗氧化的作用,保护细胞免受氧化损伤。Zhu等[39]发现白芥子的主要有效成分异硫氰酸烯丙酯,就通过激活Nrf2/NQO1通路改善肺氧化应激,从而延缓COPD的病理进展。褚婉婷等[59]则发现寡聚原花色素可以提高肺组织内Nrf2、HO1和NQO1的表达水平,拮抗COPD大鼠的氧化应激。
总的来说,基于Nrf2/ARE信号通路的中药治疗COPD机制,表现为通过诱导下游多种抗氧化酶的表达,在COPD的治疗上发挥作用。
4 结语COPD在中医上证型多属本虚标实,虚为脾、肺、肾等脏器之虚,实为痰和瘀等病理产物之实。COPD患者咳嗽或环境伤肺致肺虚,肺主气贯心脉,肺虚则气宣降失常、肺气郁滞,且COPD长期反复、肺虚日久及肾,进而导致肺肾两虚。肾虚则肾不纳气,致水寒射肺,水气凌心,患者出现咳嗽、喘证[60]。肺肾两虚日久则及脾,脾虚会导致痰浊上逆、痰迷心窍,同时气血生化不足,致心虚血瘀。脾肺气虚,患者出现呼吸困难、气短、咳痰;心肾阳虚,患者出现阳气欲脱,喘脱之状。总的来说COPD影响的脏腑主要是脾、肺、肾兼心,与气、血、水有关。而Nrf2/ARE信号通路的激活,通过抵抗外界环境、劳累对于脾、肺、肾的损伤,在中药发挥脾、肺、肾的滋补和保护作用有重要影响。
COPD是1个多机制、多因素调控的过程,其恶化通常包含了多种信号通路以及细胞因子的异常,涉及炎症、氧化应激以及蛋白酶/抗蛋白酶的失衡。其中氧化应激涉及最广,在气道黏液分泌增加、支气管结构异常、肺气肿形成等COPD进展的各个阶段均起驱动作用。因此控制氧化应激,延缓疾病进展是COPD治疗的重要方向。Nrf2/ARE信号通路,是机体最重要的抗氧化信号通路之一,该通路的激活主要通过Nrf2驱动下游抗氧化基因、细胞解毒酶基因来产生抗炎、抗氧化作用。随着中医药现代化的发展,已经有较多学者通过细胞生物学等微观角度研究中药治疗COPD的机制,发现中药通过干预Nrf2/ARE信号通路,可以正调控细胞保护基因的表达,抑制COPD的炎症、氧化应激,改善肺水肿等,对COPD产生治疗效果。
对于中药干预Nrf2治疗慢阻肺的机制,目前的研究发现有经典的Keap1/ Nrf2/ARE信号通路以及激酶途径。其中经典途径的激活,主要围绕中药对于Keap1的影响开展,包括影响Keap1蛋白的表达、修饰Keap1蛋白的关键半胱氨酸残基、促进P62介导的Keap1降解。关于激酶途径,主要围绕中药对于各种激酶的影响,包含ERK、JNK、MAPKs等,通过这些激酶的磷酸化作用,可以稳定化Nrf2,继而入核诱导抗氧化基因的表达。另外关于多机制的协同串扰上,我们通过分类总结发现较多中药可以通过激活Nrf2与抑制NF-κB两条经典通路发挥双机制抗炎、抗氧化作用,见图 2。

|
| 图 2 中药基于Nrf2/ARE信号通路治疗COPD的机制图 |
综上,COPD在中医证型多属本虚标实,治疗上可采用补虚治标的标本兼治方法进行治疗,而现代的药理学机制上,中药通过干预Nrf2/ARE信号通路,调控一系列氧化还原相关的酶,在COPD的治疗上有显著的效果。但是目前关于相关机制的研究,多数都是基于一些炎症、抗氧化或者通路蛋白的表达变化得出的结论,类似中药对于Keap1与Nrf2蛋白与蛋白间的相互作用力深入研究较少。因此未来基于Nrf2/ARE信号通路,对于COPD的中药治疗研究,可以通过研究中药与Nrf2/ARE通路上的相关蛋白相互作用着手,例如采用表面等离子共振、生物膜干涉技术等,测量中药活性成分与Nrf2的相互作用情况。另一方面,中药作用具有多靶点性,而Nrf2/ARE通路与其他信号通路的协同抗炎、抗氧化作用的研究较少。目前研究多数围绕单一通路开展,双机制的研究也局限于炎症相关的Nrf2与NF-κB。相信未来随着中医药研究的深入,中药与靶点的作用会更清晰,中药治疗COPD的多组分、多靶点调控机制也会更明确。
| [1] |
GUARNIER L P, MORO L G, LÍVERO F, et al. Regenerative and translational medicine in COPD: Hype and hope[J]. European Respiratory Review, 2023, 32(169): 220223. DOI:10.1183/16000617.0223-2022 |
| [2] |
VENKATESAN P. GOLD COPD report: 2023 update[J]. The Lancet Respiratory Medicine, 2023, 11(1): 18. DOI:10.1016/S2213-2600(22)00494-5 |
| [3] |
马玉坤, 李红. 中医药在慢阻肺急性加重期疗效明显[J]. 中医临床研究, 2018, 10(19): 143-146. DOI:10.3969/j.issn.1674-7860.2018.19.063 |
| [4] |
栾哲宇, 李小娟, 李杨, 等. 基于"伏邪"理论探讨慢阻肺稳定期的病机与治疗[J]. 中医药学报, 2022, 50(5): 55-58. |
| [5] |
夏逸飞, 孙子凯. 哮喘-慢阻肺重叠的中医辨治思路[J]. 湖南中医药大学学报, 2019, 39(5): 619-622. DOI:10.3969/j.issn.1674-070X.2019.05.013 |
| [6] |
祝荣. 温肾健脾汤治疗哮喘——慢阻肺重叠(脾肾两虚挟瘀证)的临床观察[D]. 长春: 长春中医药大学, 2019.
|
| [7] |
雷晓霞, 毛莉娜. 补肺益气汤加减联合无创辅助通气治疗慢阻肺急性加重期呼吸衰竭疗效观察[J]. 湖北中医杂志, 2023, 45(12): 3-6. |
| [8] |
BARNES P J. Oxidative stress in chronic obstructive pulmonary disease[J]. Antioxidants(Basel, Switzerland), 2022, 11(5): 965. |
| [9] |
BAN W H, RHEE C K. Role of nuclear factor erythroid 2-related factor 2 in chronic obstructive pulmonary disease[J]. Tuberculosis and Respiratory Diseases, 2022, 85(3): 221-226. DOI:10.4046/trd.2021.0162 |
| [10] |
ZENG J M, LI Z Q, LI W Y, et al. Quanzhen Yiqi decoction attenuates inflammation in mice with smoking-induced COPD by activating the Nrf2/HO-1 pathway and inhibiting the NLRP3 inflammasome[J]. Journal of Pharmacy and Phar- macology, 2024, rgae047. |
| [11] |
LI L Y, ZHANG C T, ZHU F Y, et al. Potential natural small molecular compounds for the treatment of chronic obstructive pulmonary disease: An overview[J]. Frontiers in Pharmacology, 2022, 13: 821941. DOI:10.3389/fphar.2022.821941 |
| [12] |
MOI P, CHAN K, ASUNIS I, et al. Isolation of NF-E2-related factor 2(Nrf2), a NF-E2-like basic leucine zipper transcriptional activator that binds to the tandem NF-E2/AP1 repeat of the beta-globin locus control region[J]. Proceedings of the National Academy of Sciences of the United States of America, 1994, 91(21): 9926-9930. |
| [13] |
KANNAN M B, SOLOVIEVA V, BLANK V. The small MAF transcription factors MAFF, MAFG and MAFK: current knowledge and perspectives[J]. Biochimica et Biophysica Acta(BBA)-Molecular Cell Research, 2012, 1823(10): 1841-1846. DOI:10.1016/j.bbamcr.2012.06.012 |
| [14] |
CHENG L K, WANG H H, LI S H, et al. New insights into the mechanism of Keap1-Nrf2 interaction based on cancer-associated mutations[J]. Life Sciences, 2021, 282: 119791. DOI:10.1016/j.lfs.2021.119791 |
| [15] |
ZHANG Y B, YAN T T, SUN D X, et al. Rutaecarpine inhibits KEAP1-NRF2 interaction to activate NRF2 and ameliorate dextran sulfate sodium-induced colitis[J]. Free Radical Biology & Medicine, 2020, 148: 33-41. |
| [16] |
NIOI P, NGUYEN T, SHERRATT P J, et al. The carboxy-terminal Neh3 domain of Nrf2 is required for transcriptional activation[J]. Molecular and Cellular Biology, 2005, 25(24): 10895-10906. DOI:10.1128/MCB.25.24.10895-10906.2005 |
| [17] |
KATOH Y, ITOH K, YOSHIDA E, et al. Two domains of Nrf2 cooperatively bind CBP, a CREB binding protein, and synergistically activate transcription[J]. Genes to Cells, 2001, 6(10): 857-868. DOI:10.1046/j.1365-2443.2001.00469.x |
| [18] |
CHOWDHRY S, ZHANG Y, MCMAHON M, et al. Nrf2 is controlled by two distinct β-TrCP recognition motifs in its Neh6 domain, one of which can be modulated by GSK-3 activity[J]. Oncogene, 2013, 32(32): 3765-3781. DOI:10.1038/onc.2012.388 |
| [19] |
WANG H Y, LIU K H, GENG M, et al. RXRα inhibits the NRF2-ARE signaling pathway through a direct interaction with the Neh7 domain of NRF2[J]. Cancer Research, 2013, 73(10): 3097-3108. DOI:10.1158/0008-5472.CAN-12-3386 |
| [20] |
CULLINAN S B, GORDAN J D, JIN J P, et al. The Keap1-BTB protein is an adaptor that bridges Nrf2 to a Cul3-based E3 ligase: Oxidative stress sensing by a Cul3-Keap1 ligase[J]. Molecular and Cellular Biology, 2004, 24(19): 8477-8486. DOI:10.1128/MCB.24.19.8477-8486.2004 |
| [21] |
CHAUHAN N, CHAUNSALI L, DESHMUKH P, et al. Analysis of dimerization of BTB-IVR domains of Keap1 and its interaction with Cul3, by molecular modeling[J]. Bioinformation, 2013, 9(9): 450-455. DOI:10.6026/97320630009450 |
| [22] |
GATBONTON-SCHWAGER T, YAGISHITA Y, JOSHI T, et al. A point mutation at C151 of Keap1 of mice abrogates NRF2 signaling, cytoprotection in vitro, and hepatoprotection in vivo by bardoxolone methyl(CDDO-me)[J]. Molecular Pharmacology, 2023, 104(2): 51-61. DOI:10.1124/molpharm.123.000671 |
| [23] |
SHILOVSKY G A, DIBROVA D V. Regulation of cell proliferation and Nrf2-mediated antioxidant defense: Conservation of Keap1 cysteines and Nrf2 binding site in the context of the evolution of KLHL family[J]. Life(Basel, Switzerland), 2023, 13(4): 1045. |
| [24] |
CHENG Y Y, CHENG L K, GAO X, et al. Covalent modification of Keap1 at Cys77 and Cys434 by pubescenoside a suppresses oxidative stress-induced NLRP3 inflammasome activation in myocardial ischemia-reperfusion injury[J]. Theranostics, 2021, 11(2): 861-877. DOI:10.7150/thno.48436 |
| [25] |
SUZUKI T, TAKAHASHI J, YAMAMOTO M. Molecular basis of the KEAP1-NRF2 signaling pathway[J]. Molecules and Cells, 2023, 46(3): 133-141. DOI:10.14348/molcells.2023.0028 |
| [26] |
ZHAO Z H, WANG Y, GAO Y H, et al. The PRAK-NRF2 axis promotes the differentiation of Th17 cells by mediating the redox homeostasis and glycolysis[J]. Proceedings of the National Academy of Sciences of the United States of America, 2023, 120(19): e2212613120. |
| [27] |
YU C, XIAO J H. The Keap1-Nrf2 system: a mediator between oxidative stress and aging[J]. Oxidative Medicine and Cellular Longevity, 2021, 2021: 6635460. DOI:10.1155/2021/6635460 |
| [28] |
LI L, CHENG S Q, GUO W, et al. Oridonin prevents oxidative stress-induced endothelial injury via promoting Nrf-2 pathway in ischaemic stroke[J]. Journal of Cellular and Molecular Medicine, 2021, 25(20): 9753-9766. DOI:10.1111/jcmm.16923 |
| [29] |
ICHIMURA Y, WAGURI S, SOU Y S, et al. Phosphorylation of p62 activates the Keap1-Nrf2 pathway during selective autophagy[J]. Molecular Cell, 2013, 51(5): 618-631. DOI:10.1016/j.molcel.2013.08.003 |
| [30] |
WANG L L, LIU C W, WANG L L, et al. Astragaloside Ⅳ mitigates cerebral ischaemia-reperfusion injury via inhibition of P62/Keap1/Nrf2 pathway-mediated ferroptosis[J]. European Journal of Pharmacology, 2023, 944: 175516. DOI:10.1016/j.ejphar.2023.175516 |
| [31] |
汪珊珊. 异硫氰酸烯丙酯上调慢性阻塞性肺疾病肺支气管上皮MRP1与Nrf2表达的研究[D]. 合肥: 安徽中医药大学, 2015.
|
| [32] |
ZHANG Z X, FU C L, LIU J X, et al. Hypermethylation of the Nrf2 promoter induces ferroptosis by inhibiting the Nrf2-GPX4 axis in COPD[J]. International Journal of Chronic Obstructive Pulmonary Disease, 2021, 16: 3347-3362. DOI:10.2147/COPD.S340113 |
| [33] |
SUZUKI M, BETSUYAKU T, ITO Y, et al. Down-regulated NF-E2-related factor 2 in pulmonary macrophages of aged smokers and patients with chronic obstructive pulmonary disease[J]. American Journal of Respiratory Cell and Mole- cular Biology, 2008, 39(6): 673-682. DOI:10.1165/rcmb.2007-0424OC |
| [34] |
CHO H Y, VAN HOUTEN B, WANG X T, et al. Targeted deletion of nrf2 impairs lung development and oxidant injury in neonatal mice[J]. Antioxidants & Redox Signaling, 2012, 17(8): 1066-1082. |
| [35] |
SINGH A, LING G Y, SUHASINI A N, et al. Nrf2-dependent sulfiredoxin-1 expression protects against cigarette smoke-induced oxidative stress in lungs[J]. Free Radical Biology & Medicine, 2009, 46(3): 376-386. |
| [36] |
CHO H Y, GLADWELL W, YAMAMOTO M, et al. Exacerbated airway toxicity of environmental oxidant ozone in mice deficient in Nrf2[J]. Oxidative Medicine and Cellular Longe- vity, 2013, 2013: 254069. |
| [37] |
BLAKE D J, SINGH A, KOMBAIRAJU P, et al. Deletion of Keap1 in the lung attenuates acute cigarette smoke-induced oxidative stress and inflammation[J]. American Journal of Respiratory Cell and Molecular Biology, 2010, 42(5): 524-536. DOI:10.1165/rcmb.2009-0054OC |
| [38] |
刘亚倩, 于会勇. 清肺化痰汤治疗慢阻肺急性加重期痰热壅肺证患者105例[J]. 环球中医药, 2023, 16(1): 155-159. |
| [39] |
ZHU W T, LI C H, DAI T T, et al. Effect of allyl isothiocyanate on oxidative stress in COPD via the AhR/CYP1A1 and Nrf2/NQO1 pathways and the underlying mechanism[J]. Phytomedicine, 2023, 114: 154774. DOI:10.1016/j.phymed.2023.154774 |
| [40] |
SONG H J, JIANG L J, YANG W C, et al. Cryptotanshinone alleviates lipopolysaccharide and cigarette smoke-induced chronic obstructive pulmonary disease in mice via the Keap1/Nrf2 axis[J]. Biomedecine & Pharmacotherapie, 2023, 165: 115105. |
| [41] |
张蓝熙. 基于Keap1/Nrf2/ARE通路探讨补肺益肾方联合电针抗氧化应激治疗COPD机制[D]. 郑州: 河南中医药大学, 2019.
|
| [42] |
QIAN C L, FAN R. Effect of Pingchuan Guben Decoction on patients with chronic obstructive pulmonary disease: Results from a randomized comparative effectiveness research trial[J]. Experimental and Therapeutic Medicine, 2017, 14(4): 3915-3925. DOI:10.3892/etm.2017.5018 |
| [43] |
YANG W J, CHEN X M, WANG S Q, et al. 4β-hydroxywithanolide E from goldenberry(whole fruits of Physalis peruviana L.) as a promising agent against chronic obstructive pulmonary disease[J]. Journal of Natural Products, 2020, 83(4): 1217-1228. DOI:10.1021/acs.jnatprod.9b01265 |
| [44] |
WANG T, DAI F, LI G H, et al. Trans-4, 4'-dihydroxystilbene ameliorates cigarette smoke-induced progression of chronic obstructive pulmonary disease via inhibiting oxidative stress and inflammatory response[J]. Free Radical Biology & Medicine, 2020, 152: 525-539. |
| [45] |
XU Y F, LI J, LIN Z W, et al. Isorhamnetin alleviates airway inflammation by regulating the Nrf2/Keap1 pathway in a mouse model of COPD[J]. Frontiers in Pharmacology, 2022, 13: 860362. DOI:10.3389/fphar.2022.860362 |
| [46] |
HSU C L, WU Y L, TANG G J, et al. Ginkgo biloba extract confers protection from cigarette smoke extract-induced apoptosis in human lung endothelial cells: Role of heme oxygenase-1[J]. Pulmonary Pharmacology & Therapeutics, 2009, 22(4): 286-296. |
| [47] |
LIU L, ZHANG Y S, WANG L, et al. Scutellarein alleviates chronic obstructive pulmonary disease through inhibition of ferroptosis by chelating iron and interacting with arachidonate 15-lipoxygenase[J]. Phytotherapy Research, 2023, 37(10): 4587-4606. DOI:10.1002/ptr.7928 |
| [48] |
WANG Y, WANG Y C, MA J, et al. Yuping Fengsan ameliorates LPS-induced acute lung injury and gut barrier dysfunction in mice[J]. Journal of Ethnopharmacology, 2023, 312: 116452. DOI:10.1016/j.jep.2023.116452 |
| [49] |
LI Q P, WANG G F, XIONG S H, et al. Bu-Shen-Fang-Chuan formula attenuates cigarette smoke-induced inflammation by modulating the PI3K/Akt-Nrf2 and NF-κB signalling pathways[J]. Journal of Ethnopharmacology, 2020, 261: 113095. DOI:10.1016/j.jep.2020.113095 |
| [50] |
JIAN T Y, DING X Q, LI J W, et al. Triterpene acids of loquat leaf improve inflammation in cigarette smoking induced COPD by regulating AMPK/Nrf2 and NFκB pathways[J]. Nutrients, 2020, 12(3): 657. DOI:10.3390/nu12030657 |
| [51] |
DANG X M, HE B B, NING Q, et al. Alantolactone suppresses inflammation, apoptosis and oxidative stress in cigarette smoke-induced human bronchial epithelial cells through activation of Nrf2/HO-1 and inhibition of the NF-κB pathways[J]. Respiratory Research, 2020, 21(1): 95. DOI:10.1186/s12931-020-01358-4 |
| [52] |
YU D, LIU X, ZHANG G X, et al. Isoliquiritigenin inhibits cigarette smoke-induced COPD by attenuating inflammation and oxidative stress via the regulation of the Nrf2 and NF-κB signaling pathways[J]. Frontiers in Pharmacology, 2018, 9: 1001. DOI:10.3389/fphar.2018.01001 |
| [53] |
CHENG L, LI F, MA R, et al. Forsythiaside inhibits cigarette smoke-induced lung inflammation by activation of Nrf2 and inhibition of NF-κB[J]. International Immunopharmacology, 2015, 28(1): 494-499. DOI:10.1016/j.intimp.2015.07.011 |
| [54] |
PENG J Q, CAI Z M, WANG Q, et al. Carboxymethyl chitosan modified oxymatrine liposomes for the alleviation of emphysema in mice via pulmonary administration[J]. Molecules, 2022, 27(11): 3610. DOI:10.3390/molecules27113610 |
| [55] |
GAO W, GUO Y, YANG H X. Platycodin D protects against cigarette smoke-induced lung inflammation in mice[J]. International Immunopharmacology, 2017, 47: 53-58. DOI:10.1016/j.intimp.2017.03.009 |
| [56] |
PARK S W, LEE A Y, LIM J O, et al. Loranthus tanakae franch. & sav. suppresses inflammatory response in cigarette smoke condensate exposed bronchial epithelial cells and mice[J]. Antioxidants, 2022, 11(10): 1885. DOI:10.3390/antiox11101885 |
| [57] |
LI J H, TONG D X, LIU J, et al. Oroxylin A attenuates cigarette smoke-induced lung inflammation by activating Nrf2[J]. International Immunopharmacology, 2016, 40: 524-529. DOI:10.1016/j.intimp.2016.10.011 |
| [58] |
陈芳. 蒲公英总黄酮对香烟烟雾所致慢性阻塞性肺疾病的抗氧化损伤作用及机制研究[D]. 长春: 吉林大学, 2018.
|
| [59] |
褚婉婷, 张淑香, 褚星霞. 寡聚原花色素通过激活Nrf2拮抗慢性阻塞性肺疾病大鼠的氧化应激[J]. 广州中医药大学学报, 2021, 38(2): 373-378. |
| [60] |
乔丹凤, 李阳轲. 基于中医"三焦"学说治疗慢阻肺机理探析[J]. 内蒙古中医药, 2024, 43(1): 120-122. |
 2024, Vol. 43
2024, Vol. 43


