文章信息
- 李晓宇, 梁丽娜, 高云, 陈强, 李佳豪, 郭惠怡
- LI Xiaoyu, LIANG Lina, GAO Yun, CHEN Qiang, LI Jiahao, GUO Huiyi
- 明睛颗粒联合雷珠单抗对湿性年龄相关性黄斑变性纤维血管膜纤维化相关蛋白表达的影响
- Mingjing Granules combined with leizumab on vascular membrane fibrosis associated proteins in wet age-related macular degeneration
- 天津中医药大学学报, 2024, 43(2): 130-137
- Journal of Tianjin University of Traditional Chinese Medicine, 2024, 43(2): 130-137
- http://dx.doi.org/10.11656/j.issn.1673-9043.2024.02.06
-
文章历史
收稿日期: 2023-09-12
2. 中国中医药循证医学中心眼科疾病项目组, 北京 100040
2. Ophthalmology Program Team, China Evidence-Based Medicine Center of Traditional Chinese Medicine, Beijing 100040, China
年龄相关性黄斑变性(AMD)是一种随年龄增加而发病率上升并导致患者中心视力下降的疾病,临床上分为“干性”和“湿性”两种类型,其中湿性AMD又称作新生血管性AMD(nAMD),其主要病理特征是脉络膜新生血管(CNV)[1]。由于新生血管的结构与功能不健全,导致局部渗出、出血反复发作,继而发生纤维化改变,最终导致瘢痕形成[2]。抗血管内皮生长因子(VEGF)药物是治疗nAMD的主流疗法,可有效促进CNV的消退,但发生纤维化改变时,抗VEGF药物疗效非常有限。有研究表明,黄斑区已出现纤维血管膜或盘状瘢痕等眼底表现的患者,抗VEGF药物对视力提升几乎没有任何帮助[3]。明睛颗粒即凉血化瘀方,是国医大师唐由之根据多年临床经验针对nAMD所创立,方中以蒲黄为君药,配合二至丸、黄芪、枸杞子、丹参等药物组成,以达滋阴养血、凉血化瘀之功效[4]。明睛颗粒前期临床研究结果显示:单纯应用凉血化瘀方治疗nAMD,视力有一定程度的提升,视网膜中央厚度(CRT)降低,可稳定眼底出血、渗出情况,是一种安全有效的治疗方法[5-6];明睛颗粒联合抗VEGF药物治疗,较单纯应用抗VEGF药物治疗,视力、CRT、眼底出血渗出面积均见到显著差异(P<0.05)[7]。由以上临床研究可以看出,明睛颗粒对nAMD有一定疗效,与抗VEGF联合治疗效果更为显著。联合用药是否可以抑制nAMD纤维化过程,减少纤维血管膜生成,突破单纯抗VEGF治疗的瓶颈是研究重点。据此,采用两阶段激光法诱导nAMD纤维血管膜BN大鼠模型,观察明睛颗粒与抗VEGF药物联合治疗对病变以及纤维化相关蛋白的影响,进一步探讨明睛颗粒的作用机制。
1 实验材料 1.1 实验动物SPF级雄性BN大鼠,8周龄,体质量(160~180)g,购于北京维通利华公司。实验动物生产许可证号:SCXK(京)2021-0006,使用许可证号:SYXK(京)2019-0049,常规饲料适应性喂养7天,经眼前节及眼底检查无眼部病变可纳入实验。本实验经中国中医科学院眼科医院伦理委员会通过,实验动物福利与伦理均符合《实验动物管理条例》和《北京市实验动物管理条例》。饲养温度18~25 ℃,湿度40%~70%,暴露于12 h光/暗循环,自由饮食、水。
1.2 主要试剂与仪器复方托吡卡胺滴眼液购自参天制药(中国)有限公司(生产批号:MP2222);10%荧光素钠注射液购自Alcon公司(生产批号:J0VJ5);Davidson’s fixative购自Phygene Biotechnology Co. Ltd公司生产(生产批号:20220310);AF488偶联同工凝集素B4购自美国thermo fisher公司生产(生产批号:2409033);盐酸氯胺酮注射液购自浙江九旭药业有限公司(生产批号:H20223609);盐酸赛拉嗪注射液购自敦化市圣达动物药品有限公司(生产批号:20211001);兔抗Collagen 1抗体购自美国Abcam公司(生产批号:ab270993);兔抗Fibronectin抗体购自美国Abcam公司(生产批号:268020);兔抗α-SMA抗体购自美国Abcam公司(生产批号:ab280888);兔抗TGF-β1抗体购自武汉三鹰生物技术有限公司(生产批号:21898);荧光二抗羊抗兔594购自美国Abcam公司(生产批号:ab150077);DAPI抗体购自武汉博士德生物工程有限公司(生产批号:AR1176);RNeasy plus Universal Mini kits购自德国QIAGEN公司(生产批号:73404);iScript cDNA Synthesis Kit购自美国Bio-Rad公司(生产批号:1708891);iTaq Universal SYBR Green Supermix购自美国Bio-Rad公司(生产批号:1725121)。
Novus Spectra DP型Nd:YAG倍频激光治疗机(美国Lumenis公司);OPTO-RIS型视网膜成像系统(英国Optoprobe Science LTD公司);Envisu R2210型光学相干断层扫描仪(德国Leica公司);LSM880型激光共聚焦扫描显微镜(德国ZEISS公司);7500型RT-PCR检测仪(ABI公司)。
2 实验方法 2.1 两阶段激光诱导大鼠nAMD纤维血管膜模型建立盐酸氯胺酮-盐酸赛拉嗪混合麻醉剂肌注(4 mL/kg)麻醉BN大鼠,右眼单眼造模,复方托吡卡胺滴眼液散瞳,0.4%盐酸奥布卡因滴眼液局麻。第一阶段激光:氪激光在后极部距视盘约2~3个PD处眼底血管间光凝3、6、9三个点位,设定参数:光斑直径100 μm,曝光时间0.1 s,功率280 mW。激光聚焦后一枪击破Bruch’s膜,伴有气泡产生为有效点,若无气泡产生或伤及血管则为无效点。在第一阶段激光后7 d,激光束瞄准7 d前建立的激光斑,参数设定与第一阶段相同,进行第二阶段激光[8]。
2.2 分组与给药根据ARIFIN提出的资源方程法进行动物实验的样本量计算[9],组间ANOVA公式:n=DF/k+1,n为每组动物数量,k为组数。取整得n=15,三组共45只。采用随机数字表法,将45只造模后的BN大鼠随机分为3组:模型组、抗VEGF药物组(抗VEGF组)、明睛颗粒联合抗VEGF药物组(MJKL+抗VEGF组)。模型组:予蒸馏水灌胃;抗VEGF组:予玻璃体腔注射雷珠单抗注射液,盐酸氯胺酮-盐酸赛拉嗪混合麻醉剂肌注(4 mL/kg)麻醉大鼠,复方托吡卡胺滴眼液散瞳。一手固定大鼠头部并用显微镊固定球结膜,另一手持微量注射器沿45°方向从眼球颞侧角膜缘外约2 mm处进针,在瞳孔区看到针尖后,缓慢注射雷珠单抗5 μL/眼。注药后等待10s缓慢拔出针头,以防止药液外流。术后予左氧氟沙星眼膏涂眼。MJKL+抗VEGF组:予玻璃体腔注射雷珠单抗注射液同上,同时予明睛颗粒灌胃,灌胃量1 g/mL/只/d。10只正常BN大鼠不造模,常规饲养作为对照。造模后1 d开始给药,连续给药40 d。
2.3 眼底彩照(FP)、眼底血管荧光造影(FFA)活体观察病变麻醉大鼠,复方托吡卡胺滴眼液充分散大右眼瞳孔,使用OPTO-RIS型视网膜成像系统对大鼠眼底进行拍照。再将光源转换到Blue通道,腹腔注射10%的荧光素钠注射液0.15~0.2 mL,与显微镜镜头接触并调至最佳拍照角度。拍照完成后用氯化钠注射液冲洗双眼,用氧氟沙星眼膏点眼以预防感染。通过Image J对病变面积与光密度值(MD)进行测量。
2.4 光学相干断层扫描(OCT)活体观察病变局部高度打开Envisu R2210型光学相干断层扫描仪,将麻醉且瞳孔散大状态的实验鼠放于鼠台,双眼角膜保持湿润,通过轻微挪动鼠台位置与调节旋钮,使成像清晰。通过Bioptigen Diver图像处理软件与Image J软件对病变高度进行测量。
2.5 HE染色观察予过量复合麻醉剂处死BN大鼠,快速剪断视神经后取出眼球,固定液中固定后放于石蜡包埋盒,放入全自动组织脱水机进行脱水,将完成脱水的组织装于已标记好的包埋盒中浸入60 ℃石蜡完成包埋。将蜡块进行连续石蜡切片,展片烤片后进行HE染色,室温晾干后可光学显微镜下观察各组视网膜病理改变。
2.6 视网膜色素上皮(RPE)-脉络膜-巩膜铺片取材后全眼球置于4%多聚甲醛液中固定24 h后去除眼前节,再将眼杯置于4%多聚甲醛液中固定1 h,取出眼杯并做4个放射状切口,用显微镊小心去除视网膜神经上皮层,确认RPE-脉络膜-巩膜复合体可完全铺展;将脉络膜铺片置于装有0.25% Triton溶液的24孔板,加入2% BSA,加入IB4凝集素,避光4 ℃孵育24 h。将脉络膜铺片铺展于载玻片上,滴入抗荧光衰减封片剂后封上盖玻片,4℃避光保存,激光共聚焦显微镜下观察。
2.7 免疫荧光染色分析在(-23±2)℃下行垂直视网膜的8 μm冰冻切片,室温风干后放于-20 ℃冰箱。从-20 ℃取出切片,置于57 ℃恒温箱中烤片30 min。滴加1% TritonX-100溶液,快速滴加2% BSA,加入一抗(Collagen-1,Fibronectin,α-SMA,TGF-β1),加入二抗,加DAPI溶液,抗荧光衰减封片剂封片,荧光显微镜下观察蛋白表达情况。
2.8 qRT-PCR采用TRIzol提取试剂盒提取每组视网膜组织的总RNA,并对RNA浓度进行测定。根据iScript cDNA Synthesis Kit试剂盒的相关说明将RNA经逆转录合成cDNA模板。由北京鼎国昌盛生物技术有限责任公司合成引物,引物序列见表 1。以GAPDH为内参基因,扩增完成后采用PCR仪自动分析软件进行荧光数据分析,用比较Ct法对各组Collagen-1 mRNA,Fibronectin mRNA,α-SMA mRNA和TGF-β1 mRNA的表达量进行分析测定。
采用GraphPad Prism 8.0.1进行统计分析与图表制作。计量资料数据采用均数±标准差(x±s)表示,符合正态分布且方差齐的计量资料选取单因素方差分析(one-way ANOVA)进行组间的比较,采用LSD-t检验进行两两比较;选取t检验进行两组间的比较。当P<0.05时,差异具有统计学意义。
3 结果 3.1 nAMD纤维血管膜模型的建立FP结果显示氪激光光凝致使Bruch’s膜破裂,光凝部位呈灰白色水肿,第一阶段激光光凝后,光斑处未见出血;7 d后行第二阶段激光,光凝部位呈灰白色水肿,部分光斑处可见到出血。FFA与OCT结果显示:第二阶段激光后40 d,纤维血管膜生成。见图 1。
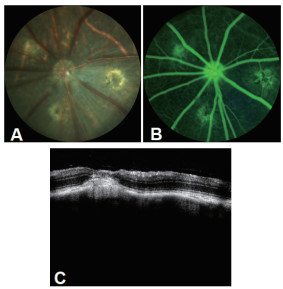
|
| 注:模型组二次激光后40 d:A. FP图像;B. FFA图像;C. OCT图像。 图 1 模型的建立 |
模型组病变渗出面积与MD值均较正常组显著升高(P<0.05);抗VEGF组、MJKL+抗VEGF组渗出面积与MD值较模型组显著降低(P<0.05)。MJKL+抗VEGF组MD值较抗VEGF组显著降低(P<0.05),但渗出面积差异无统计学意义(P>0.05)。见图 2。
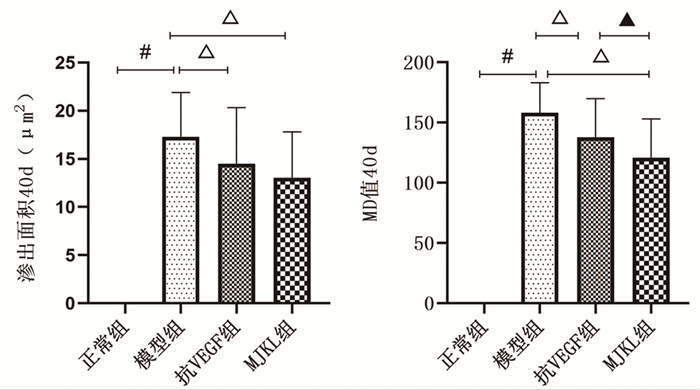
|
| 注:与正常组比较,#P<0.05;与模型组比较,△P<0.05;与抗VEGF药物组比较,▲P<0.05。 图 2 病变渗漏情况 |
模型组病变局部高度值均较正常组显著升高(P<0.05);抗VEGF组、MJKL+抗VEGF组较模型组显著降低(P<0.05);MJKL+抗VEGF组较抗VEGF组显著降低(P<0.05)。见图 3。
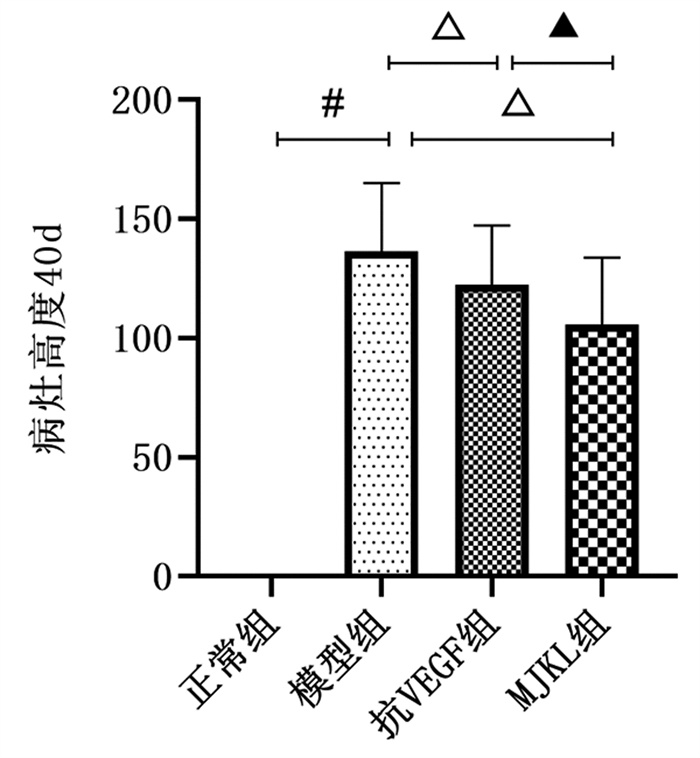
|
| 注:与正常组比较,#P<0.05;与模型组比较,△P<0.05;与抗VEGF药物组比较,▲P<0.05。 图 3 病变高度情况 |
H&E染色结果示:正常组视网膜结构完整,排列清晰有序;模型组造模后40 d,光斑处视网膜神经上皮层水肿隆起、视网膜结构紊乱、纤维血管膜形成最为明显;抗VEGF组视网膜结构损伤程度较模型组明显减轻;MJKL+抗VEGF组视网膜结构损伤程度最轻。见图 4。
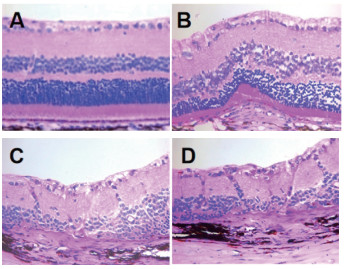
|
| 注:A.正常组(×40);B.模型组(×40);C.抗VEGF组(×40);D. MJKL+ 抗VEGF组(×40)。 图 4 HE染色显示病理组织改变 |
脉络膜铺片结果显示:正常组未见病变,模型组病变面积较正常组显著增大(P<0.05);抗VEGF组、MJKL+抗VEGF组较模型组显著减少(P<0.05);MJKL+抗VEGF组较抗VEGF组显著减少(P<0.05)。见图 5。

|
| 注:A.正常组;B.模型组;C.抗VEGF组;D. MJKL+抗VEGF组。 图 5 脉络膜铺片显示病变面积 |
Collagen-1、Fibronectin、TGF-β1荧光强度结果显示:模型组均显著高于正常组(P<0.05);抗VEGF组、MJKL+抗VEGF组显著低于模型组(P<0.05);MJKL+抗VEGF组较抗VEGF组显著降低(P<0.05)。α-SMA荧光强度结果显示:模型组显著高于正常组(P<0.05);抗VEGF组、MJKL+抗VEGF组显著低于模型组(P<0.05);但MJKL+抗VEGF组与抗VEGF组之间差异无统计学意义(P>0.05)。见图 6、图 7。
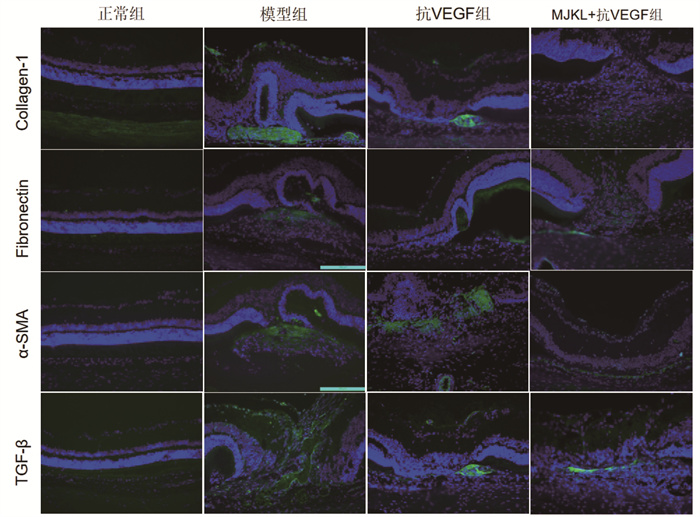
|
| 图 6 免疫荧光显示Collagen-1、Fibronectin、α-SMA、TGF-β1表达 |
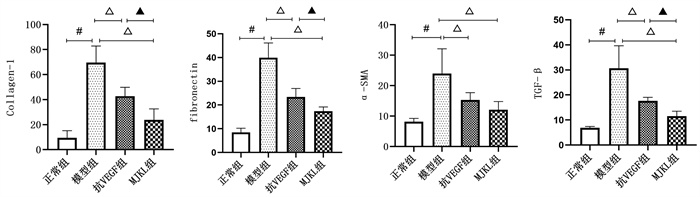
|
| 注:与正常组比较,#P<0.05;与模型组比较,△P<0.05;与抗VEGF药物组比较,▲P<0.05。A. Collagen-1;B. Fibronectin;C. α-SMA;D. TGF-β1。 图 7 Collagen-1、Fibronectin、α-SMA、TGF-β1荧光强度 |
Collagen-1 mRNA、Fibronectin mRNA、α-SMA mRNA、TGF-β1 mRNA相对表达量结果显示:模型组均显著高于正常组(P<0.05);抗VEGF组、MJKL+抗VEGF组显著低于模型组(P<0.05);MJKL+抗VEGF组显著低于抗VEGF组(P<0.05)。见图 8。
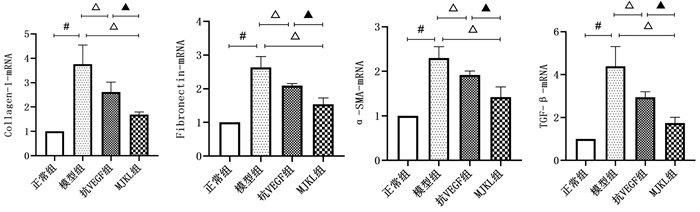
|
| 注:与正常组比较,#P<0.05;与模型组比较,△P<0.05;与抗VEGF药物组比较,▲P<0.05。A. Collagen-1 mRNA;B. Fibronectin mRNA;C. α-SMA mRNA;D. TGF-β1 mRNA。 图 8 qRT-PCR显示Collagen-1 mRNA、Fibronectin mRNA、α-SMA mRNA、TGF-β1 mRNA相对表达量 |
新生血管的管壁结构畸形脆弱,容易导致渗漏与出血,这种管壁的破坏与引发的局部炎症可释放基质细胞和免疫细胞,从而促使新生血管内皮束向纤维血管膜的转变,这一转化过程被称作“血管纤维化转换”[10]。在血管纤维化转换过程中,视网膜色素上皮细胞、内皮细胞和部分巨噬细胞发生凋亡,导致纤维化成分占据病变的主导地位。CNV的纤维化改变虽然可以对渗出起到一定限制发展的作用,但过度纤维化最终会导致视网膜下瘢痕形成,以至于永久性的黄斑形态改变和视力丧失[11]。临床上,nAMD黄斑区纤维血管膜的改变表现为视网膜内或视网膜下的黄白色隆起区域,边界较为清楚,通常含有血管组织,其形成、发展过程与成纤维细胞、细胞生长因子及细胞外基质的共同作用有关。为了剖析继发于nAMD的视网膜下纤维化的机制,首先要建立合适的动物模型。本研究在传统一次激光建立CNV模型的基础上[12],改进为通过两阶段的激光灼伤以诱导渗漏或出血,相较于传统的激光造模法,两阶段激光使病灶面积更大,持续时间长,且具有高水平的纤连蛋白表达。在第二阶段激光造模后40d,FP可见边界清晰的灰黄色改变,伴有出血、渗出及水肿,OCT示中高反射,组织病理学可见纤维化改变且病变处可检测到纤维化相关蛋白的表达,与nAMD纤维血管膜改变相符。该模型的建立,更加适合于研究黄斑纤维化的发病机制和评价抗nAMD的治疗药物[10]。
随着抗VEGF药物在临床的广泛应用,抗VEGF药物虽然可以在短期内快速控制并改善病情,但越来越多的研究发现应用抗VEGF药物治疗后期可出现纤维化改变,严重影响患者视力。Heier等[13]予nAMD患者每月1次玻璃体腔注射雷珠单抗,连续给药24月,随访2~6年后发现,过半的患者出现了黄斑区纤维化。Roman等[14]发现nAMD患者接受贝伐单抗治疗后发生了RPE撕裂现象,认为与血管的纤维化有关。此外,Hwang等[15]报道了黄斑区没有明显出血的患者在接受抗VEGF药物治疗后也发生了严重的黄斑部纤维化病变,由此说明纤维化改变并非出血引起,而应用抗纤维化疗法可能对患者后期视力有益。nAMD纤维血管膜在中医病名中并无记载,根据其症状,可归为“视瞻昏渺”“视直如曲”“暴盲”等范畴。本病与年老体弱有关,以虚为本,因虚致病,虚实夹杂。与阳明脉衰、生化乏源,天癸竭、天真衰,筋不动、肝气衰等病机有关[16]。国医大师唐由之根据多年临床经验认为nAMD的基本病机为肝肾阴虚为本,虚火灼络为标,临床诊疗nAMD应以凉血化瘀为主要治法,创立凉血化瘀方(即明睛颗粒),在提升视力,改善眼底出血、渗出情况,均起到一定作用[17-18]。在抗VEGF药物的基础上联合明睛颗粒的治疗方案,或可提升抗VEGF药物的疗效范围与作用时间,中西医结合治疗方案或许是当下nAMD后期纤维化改变的突破点。
多种细胞因子及蛋白参与了纤维化过程,如转化生长因子-β1(TGF-β1)、α-平滑肌肌动蛋白(α-SMA)、1型胶原蛋白(Collagen-1)及纤维连接蛋白(FN)等[19-20]。转化生长因子-β(TGF-β)具有调节细胞生长、增殖、分化的作用,是促进细胞外基质的形成并抑制其降解的主要介质,在纤维形成过程中起主导作用。TGF-β1是纤维化过程中的关键调节因子,可以激活下游的Smad信号,从而促进新生血管生成、成纤维细胞增生、肌成纤维细胞分化、基质沉积、胶原合成等病理过程,引起组织发生纤维化改变。Gian等[21]研究发现nAMD患者中TGF-β1持续升高,表明TGF-β1参与了nAMD,且TGF-β1的作用与VEGFA无关。Collagen-1(Ⅰ型胶原)是软组织纤维化的最终效应分子。在Col1α1-GFP小鼠中,脉络膜血管系统中的部分周细胞被GFP标记,用作谱系示踪剂来研究周细胞在视网膜下纤维化中的作用,结果显示将脉络膜血管周围生态位确定为光凝后视网膜下纤维化的新来源。在TGF-β1高表达的转基因小鼠模型中,Collagen-1基因表达上调,组织纤维化改变更为明显。因此,通过调控TGF-β1的表达来抑制Collagen-1的过度形成从而减少组织纤维化形成值得进一步探索与研究。此外,成年哺乳动物含有大量间质及血管周围的成纤维细胞,它们能够转化为肌成纤维细胞,从而表达收缩性蛋白,如α-平滑肌肌动蛋白(α-SMA)。纤维连接蛋白(FN)广泛存在于动物组织和组织液中,有研究表明,纤维化组织中成纤维细胞表面FN呈过度表达状态。
本实验结果显示:与单纯抗VEGF组相比,MJKL+抗VEGF组在病变渗出强度、病变面积、病变高度等方面改善程度更为显著,从形态学及组织病理学方面显示出联合治疗的优势。而从纤维化相关蛋白表达分析来看,MJKL+抗VEGF组Collagen-1、Fibronectin、TGF-β1、α-SMA因子的荧光强度和mRNA相对表达量亦均低于抗VEGF组。由此可见,明睛颗粒联合抗VEGF药物,较单纯应用抗VEGF药物能更好地抑制实验性nAMD纤维血管膜生长。此外,课题组同期进行了明睛颗粒治疗nAMD的前瞻性、随机、双盲、安慰剂平行对照、多中心的临床研究,结果显示在最佳矫正视力、黄斑出血面积与渗出面积中均可见到明睛颗粒联合抗VEGF药物组优于单纯应用抗VEGF组,且随访1年时联合用药组纤维化发生率为25%,而单纯应用抗VEGF组为31.43%,与本次动物实验结果相一致。
综上,本研究通过对两阶段激光建立实验性nAMD纤维血管膜模型进行研究,发现明睛颗粒联合抗VEGF药物较单一应用抗VEGF药物,在降低TGF-β1、Collagen-1、Fibronectin、α-SMA纤维化相关蛋白的表达及抑制纤维血管膜病变中显示出更强的作用,提示明睛颗粒可能通过降低纤维化相关蛋白的表达水平,对nAMD后期纤维化改变起到一定的抑制作用。本结果为明睛颗粒在nAMD中晚期的应用提供了理论基础,亦为中药联合抗VEGF药物治疗提供了实验依据。
| [1] |
刘家琦, 李凤鸣. 实用眼科学[M]. 3版. 北京: 人民卫生出版社, 2010.
|
| [2] |
阳雪, 曹晓光, 龙琴. 补体C3a促进人视网膜色素上皮细胞分泌血管内皮生长因子的研究[J]. 中国医科大学学报, 2015, 44(11): 966-969, 974. |
| [3] |
DANIEL E, TOTH C A, GRUNWALD J E, et al. Risk of scar in the comparison of age-related macular degeneration treatments trials[J]. Ophthalmology, 2014, 121(3): 656-666. DOI:10.1016/j.ophtha.2013.10.019 |
| [4] |
李晓宇, 梁丽娜, 高云, 等. 国医大师唐由之从"血中伏火"论治脉络膜新生血管性疾病[J]. 中华中医药杂志, 2022, 37(9): 5164-5167. |
| [5] |
江伟. 凉血化瘀方治疗湿性老年性黄斑变性回顾性临床研究及作用机制探讨[D]. 北京: 中国中医科学院, 2012.
|
| [6] |
王慧娟, 唐由之, 巢国俊, 等. 凉血化瘀方治疗湿性老年性黄斑变性患者90例临床观察[J]. 中医杂志, 2010, 51(4): 316-318. |
| [7] |
于磊, 秦虹. 凉血化瘀方联合抗VEGF药物治疗湿性年龄相关性黄斑变性的临床观察[J]. 中国中医眼科杂志, 2020, 30(9): 643-647. |
| [8] |
LITTLE K, LLORIÁN-SALVADOR M, TANG M, et al. A two-stage laser-induced mouse model of subretinal fibrosis secondary to choroidal neovascularization[J]. Translational Vision Science & Technology, 2020, 9(4): 3. |
| [9] |
Arifin WN, Zahiruddin WM. Sample Size Calculation in Animal Studies Using Resource Equation Approach. The Malaysian Journal of Medical Sciences: MJMS. 2017 Oct; 24(5): 101-105. DOI: 10.21315/mjms2017.24.5.11.PMID:29386977;PMCID:PMC5772820.
|
| [10] |
KARIS L, MARIA LS, MIAO T, et al. Macrophage to myofibroblast transition contributes to subretinal fibrosis secondary to neovascular age-related macular degeneration[J]. Journal of neuroinflammation, 2020, 25, 17(1): 355. |
| [11] |
JAFFE G J, MARTIN D F, TOTH C A, et al. Macular morphology and visual acuity in the comparison of age-related macular degeneration treatments trials[J]. Ophthalmology, 2013, 120(9): 1860-1870. DOI:10.1016/j.ophtha.2013.01.073 |
| [12] |
TOBE T, ORTEGA S, LUNA J D, et al. Targeted disruption of the FGF2 gene does not prevent choroidal neovascularization in a murine model[J]. The American Journal of Pathology, 1998, 153(5): 1641-1646. DOI:10.1016/S0002-9440(10)65753-7 |
| [13] |
HEIER J S. Pathology beyond neovascularization: New targets in age-related macular degeneration[J]. Retina, 2009, 29(6 Suppl): S39-S41. |
| [14] |
RONAN S M, YOGANATHAN P, CHIEN F Y, et al. Retinal pigment epithelium tears after intravitreal injection of bevacizumab(avastin) for neovascular age-related macular degeneration[J]. Retina, 2007, 27(5): 535-540. DOI:10.1097/IAE.0b013e3180cc2645 |
| [15] |
HWANG J C, DEL PRIORE L V, FREUND K B, et al. Development of subretinal fibrosis after anti-VEGF treatment in neovascular age-related macular degeneration[J]. Ophthalmic Surgery, Lasers and Imaging Retina, 2011, 42(1): 6-11. DOI:10.3928/15428877-20100924-01 |
| [16] |
李晓宇, 梁丽娜, 高云, 等. 从"眼天年"浅析年龄相关性黄斑变性的卫生之道[J]. 中国中医眼科杂志, 2022, 32(10): 794-797. |
| [17] |
唐由之, 周尚昆, 冯俊, 等. 中药治疗湿性晚期老年性黄斑变性临床疗效观察[J]. 中国中医眼科杂志, 2009, 19(6): 340-341. |
| [18] |
王慧娟, 唐由之, 巢国俊, 等. 凉血化瘀方治疗湿性老年性黄斑变性患者90例临床观察[J]. 中医杂志, 2010, 51(4): 316-318. |
| [19] |
HU H H, CHEN D Q, WANG Y N, et al. New insights into TGF-β/Smad signaling in tissue fibrosis[J]. Chemico-Biological Interactions, 2018, 292: 76-83. DOI:10.1016/j.cbi.2018.07.008 |
| [20] |
LAN H Y. Diverse roles of TGF-β/Smads in renal fibrosis and inflammation[J]. International Journal of Biological Sciences, 2011, 7(7): 1056-1067. DOI:10.7150/ijbs.7.1056 |
| [21] |
TOSI G M, CALDI E, NERI G, et al. HTRA1 and TGF-β1 concentrations in the aqueous humor of patients with neovascular age-related macular degeneration[J]. Investigative Ophthalmology & Visual Science, 2017, 58(1): 162-167. |
 2024, Vol. 43
2024, Vol. 43





