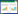文章信息
- 曹小霞, 边子妍, 丁金国, 董莹, 张月, 李玉红, 姜苗苗, 常艳旭, 张鹏
- CAO Xiaoxia, BIAN Ziyan, DING Jinguo, DONG Ying, ZHANG Yue, LI Yuhong, JIANG Miaomiao, CHANG Yanxu, ZHANG Peng
- 基于网络药理学和分子对接探讨瓜蒌皮注射液治疗冠心病的作用机制
- To investigate the mechanism of Gualoupi Injection in the treatment of coronary heart disease based on network pharmacology and molecular docking
- 天津中医药大学学报, 2024, 43(3): 193-200
- Journal of Tianjin University of Traditional Chinese Medicine, 2024, 43(3): 193-200
- http://dx.doi.org/10.11656/j.issn.1673-9043.2024.03.01
-
文章历史
收稿日期: 2023-10-17
2. 天津中医药大学, 现代中医药海河实验室, 天津 301617;
3. 上海第一生化药业有限公司, 上海 200240
2. Haihe Laboratory of Modern Chinese Medicine, Tianjin University of Traditional Chinese Medicine, Tianjin 301617, China;
3. SPH No.1 Biochemical & Pharmaceutical Co. Ltd., Shanghai 200240, China
冠心病又名冠状动脉粥样硬化性心脏病,是指冠状动脉发生粥样硬化病变引起血管管腔狭窄或阻塞,造成心肌缺血缺氧或坏死的心脏病,其基本病理包括缺血、缺氧、炎症、氧化应激和加剧血管和心肌过程的功能障碍等[1-2],在心力衰竭、心律失常、急性冠状动脉综合征(心肌梗死、不稳定型心绞痛)等方面具有显著疗效[3]。
瓜蒌皮注射液收载于《国家中成药汇编》,是瓜蒌皮提取物经阳离子交换树脂精制后制得的灭菌水溶液,主要功效为行气除满、开胸除痹,临床上用于痰浊阻络之冠心病、稳定型心绞痛的治疗。临床研究表明,瓜蒌皮注射液对冠心病、心绞痛、慢性心力衰竭、心肌梗死及脑梗死等疾病具有治疗作用,倪杰等[4]研究表明使用强心利尿药加用瓜蒌皮注射液治疗心力衰竭疗效确切,联合用药显著降低患者血清中炎症因子BNP、超敏C反应蛋白和同型半胱氨酸的水平。瓜蒌皮注射液治疗组患者相对于常规组心脏功能指数显著提高、血脂水平显著降低,不良心血管事件的发生率降低[5]。瓜蒌皮注射液具有促进冠状动脉扩张、改善血液凝集状态、逆转心肌组织的过度氧化应激、改善急性心肌缺血等药理作用[6]。瓜蒌皮注射液可以显著增强急性心肌缺血大鼠血浆中内皮型一氧化氮合酶活性,显著降低血浆中内皮素、血栓素B2水平,提高大鼠心肌细胞中超氧化物歧化酶(SOD)的活性,降低丙二醛(MDA)的含量[6],并可显著提升脑缺血再灌氧化损伤大鼠和缺血缺氧性脑病大鼠脑组织中的SOD活性,降低MDA含量[7-8]。
瓜蒌皮注射液临床疗效确切,是常用的冠心病治疗药物之一,然而其药效物质基础不清楚、作用机制尚缺乏系统研究,亟需进行深入研究。网络药理学是研究复杂药物作用机制的有效方法,可以将中药活性成分与疾病靶基因通过复杂网络联系起来,系统地阐明中药在分子水平上的作用机制。为了更好地探索瓜蒌皮注射液活性成分治疗冠心病的潜在分子机制,研究借助网络药理学方法,从化学成分、作用靶点和信号通路多方面对瓜蒌皮注射液干预冠心病的作用机制进行系统研究,以期为进一步揭示瓜蒌皮注射液的药理作用机制提供理论基础。
1 实验方法 1.1 化学成分及成分靶点收集通过文献总结获取瓜蒌皮注射液中所含化学成分共58个,基于中药系统药理学数据库与分析平台TCMSP(http://ibts.hkbu.edu.hk/LSP/tcmsp.php)和SwissADME(http://www.swissadme.ch/)筛选其中活性成分,通过PharmMapper网站预测活性成分对应的靶点,通过UniProt数据库(https://www.uniprot.org/)规范、校正靶点名称并去除重复靶点。
1.2 冠心病相关靶点筛选及成分-疾病靶点交集在GeneCards数据库(https://www.genecards.org/)和OMIM数据库(https://www.omim.org/),输入“coronary heart disease”关键词,检索疾病靶点,获得冠心病的靶点,采用韦恩图将活性成分靶点与疾病靶点取交集获得共同靶点。
1.3 靶点蛋白相互作用(PPI)网络的构建将共同靶点导入String数据库,物种选择Homo Sapiens,进行蛋白相互作用分析,保存为TSV格式后导入cytoscape 3.7.2进行可视化分析。
1.4 京都基因与基因组百科全书(KEGG)通路富集分析和基因本体(GO)功能富集分析采用Metascape在线网站对共同靶点进行通路分析,选择Homo Sapiens,富集过程中各参数Min Overlap设为3,Min Enrichment设为1.5,P Value Cutoff设为0.01,分别对靶点蛋白进行生物过程(BP)、细胞组成(CC)、分子功能(MF)富集分析以及KEGG通路富集分析,将导出后的数据按照指定格式导入微生信作图,绘制气泡图。
1.5 成分-靶点网络构建将共同靶点对应化学成分,建立type文件和network文件,导入cytoscape建立化学成分-靶点图,进行可视化分析。
1.6 分子对接分析为了进一步验证瓜蒌皮注射液有效化学成分的潜在靶标,将其有效化学成分与筛选得到的度值较高的核心蛋白激酶B抗体(AKT1)(PDBID:6HHG)、表皮生长因子受体(EGFR)(PDBID:5Y9T)、非受体酪氨酸激酶(SRC)(PDBID:2BDJ)、热休克蛋白90AA1(HSP90AA1)(PDBID:5H22)、半胱氨酸蛋白酶3(CASP3)(PDBID:3GJR)、雌激素受体1(ESR1)(5W9C)、纤溶酶原(PLG)(8AQL)进行分子对接。从TCMSP数据库下载Mol 2格式文件,在此数据库搜索不到的,从Pubchem数据库(https://pub-chem.ncbi.nlm.nih.gov/)下载瓜蒌皮注射液活性成分的SDF格式文件,使用Chem3D软件转化为Mol 2格式文件。从Protein DataBank数据库(PDB,https://www.rcsb.org/)获取PPI网络中核心靶点的3D结构的PBD格式文件。首先采用PyMOL软件对蛋白质进行去水,提取配体等处理,再用Auto Dock 1.5.6软件将关键蛋白及化合物pdb格式转为pdbqt格式并寻找活性口袋,最后通过Auto Dock Vina软件进行将小分子化合物与核心靶点进行半柔性对接,并计算化合物与核心靶点之间的结合能以预测它们的亲和力,结合能负值越高表明构象越稳定。
2 实验结果 2.1 瓜蒌皮注射液活性成分的筛选通过文献检索共收集瓜蒌皮注射液58个化学成分,通过pubchem导出SDF格式文件,通过TCMSP[口服生物利用度(OB)≥30%]和SwissADME(符合胃肠道吸收即GI absorption为“High”和5个Lipinski、Ghose、Egan、Veber和Muegge类药性参数中两个为“yes”)筛选出23个活性成分,在其余化学成分中通过查阅文献发现有6个化合物报道有相关生物活性和药理作用,因此也纳入活性成分,共获得29个活性成分。
共筛选出29个活性成分。采用Pharmmapper预测有效成分靶点,去除重复值共获得有效成分靶点171个。见表 1。
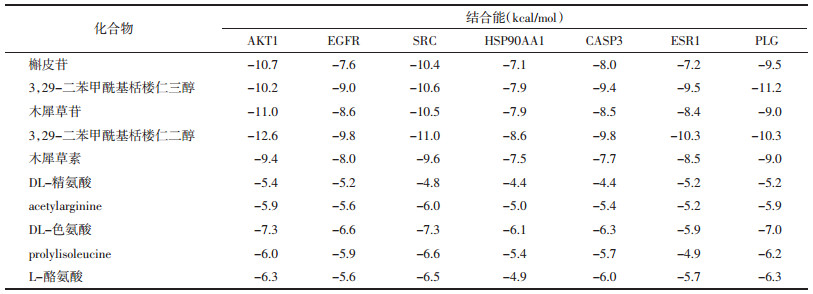
通过OMIM数据库总结获得491个疾病靶点,GeneCards数据库筛选得到2 753个疾病靶点,将2个数据库合并去重后共获得疾病靶点2 708个。将活性成分靶点与疾病靶点作交集,得到交集靶点,通过韦恩图表示,见图 1。
|
| 图 1 冠心病-活性成分韦恩图 |
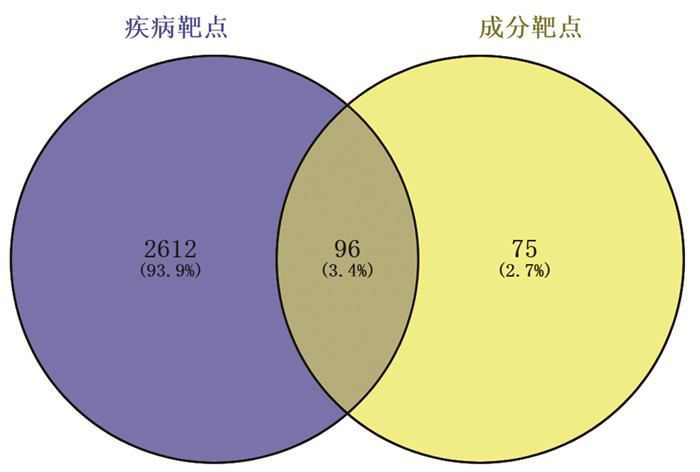
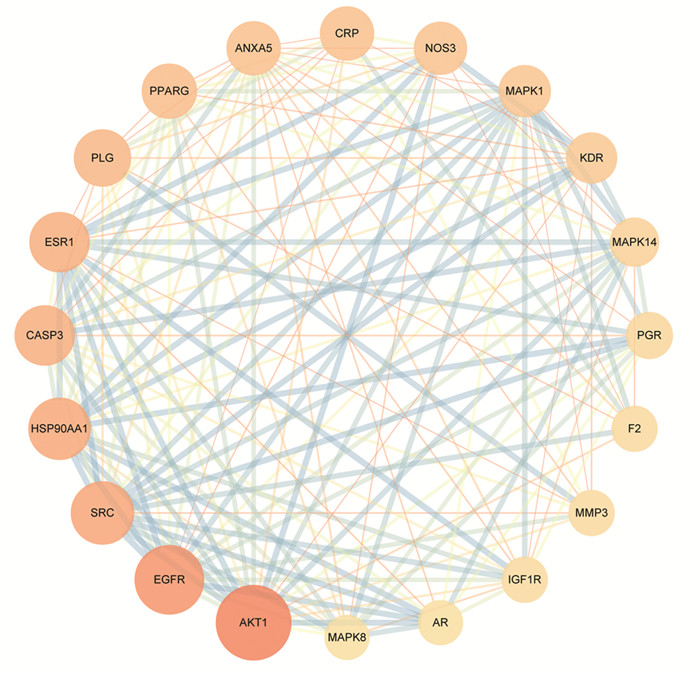
将获得的交集靶点导入STRING11.0数据库构建初始PPI网络,见图 2,隐藏无相互作用的节点,保存为TSV格式导入cytoscape 3.7.2进行可视化分析,构建的PPI网络中包含92个节点,586条边,通过2倍degree值20筛选出核心子网络,获得靶点20个,见图 3,degree值排在靠前位置的有AKT1、EGFR、SRC、HSP90AA1、CASP3、ESR1、PLG。
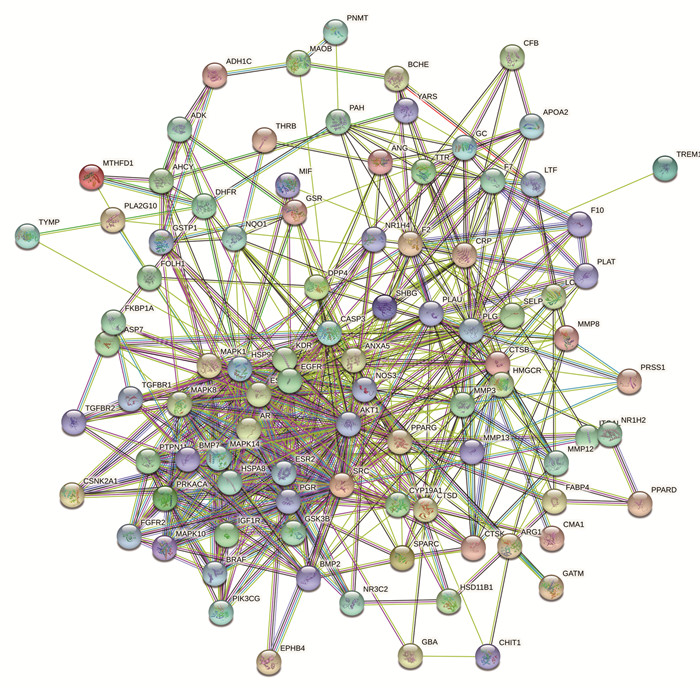
|
| 图 2 初始PPI图 |
|
| 图 3 核心靶点网络 |
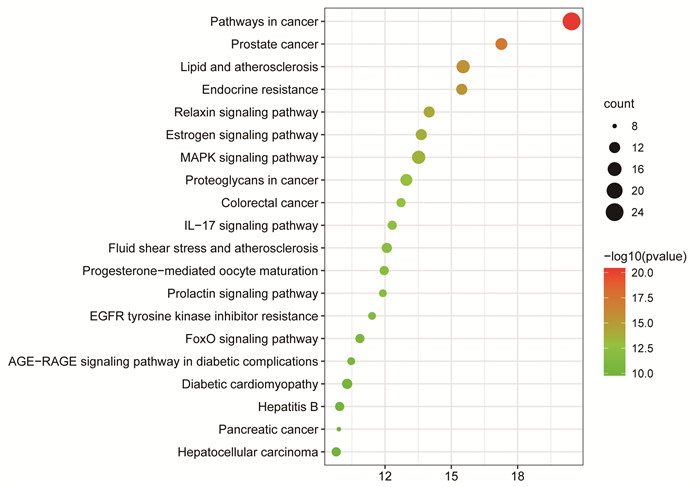
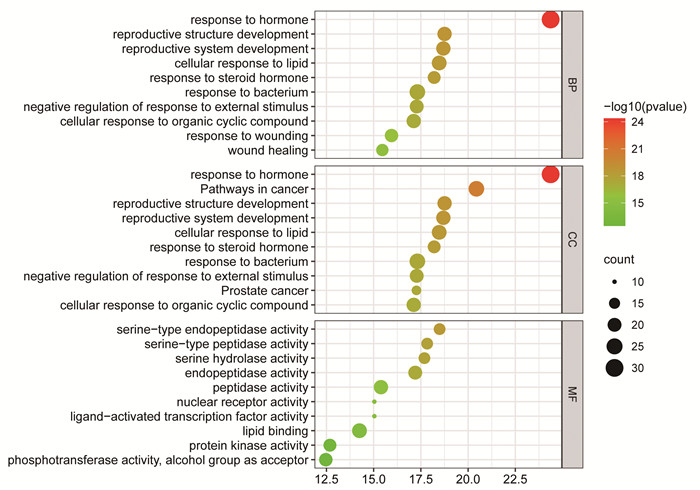
将交集靶点导入Metascape数据库进行KEGG、GO富集分析,按1.4所述生成KEGG富集图(图 4)和GO富集分析图(图 5)。结果表明,与瓜蒌皮注射液冠心病密切相关通路有丝裂原活化蛋白激酶(MAPK)、白介素(IL)-17、叉头框蛋白O(FoxO)信号通路等,GO功能分析生物学进程涉及激素反应,细胞对脂质的反应,涉及到对蛋白激酶活性等方面的功能。
|
| 图 4 KEGG富集图 |
|
| 图 5 GO富集图 |
将活性成分、共同靶点按照“1.5”项下文件导入Cytoscape 3.8.2软件构建成分-靶点网络,该网络包括125个节点,440条边,按照degree值排序,获得前10位活性成分分别为:槲皮苷、3,29-二苯甲酰基栝楼仁三醇、木犀草苷、3,29-二苯甲酰基栝楼仁二醇、木犀草素、DL-精氨酸、acetylarginine、DL-色氨酸、prolylisoleucine、L-酪氨酸。
2.6 分子对接分析瓜蒌皮中10个活性成分与7个关键靶点的分子对接结果见表 2、图 6。结果显示,关键活性成分和核心蛋白均可以自发结合且结合能力较强,体现了瓜蒌皮注射液多成分、多靶点协同作用的特点。根据对接评分筛选最佳结合模式进行可视化分析,见图 7,发现AKT1(6HHG)与3,29-二苯甲酰基栝楼仁二醇、木犀草苷和槲皮苷呈现出较低的对接评分,分别为-12.6 kcal/mol、-11.0 kcal/mol和-10.7 kcal/mol;SRC与3,29-二苯甲酰基栝楼仁二醇、3,29-二苯甲酰基栝楼仁三醇呈现出较低对接评分,分别为-11.0 kcal/mol和-10.6 kcal/mol;PLG与3,29-二苯甲酰基栝楼仁三醇呈现出较低对接评分,为-11.2 kcal/mol。

|
| 图 6 瓜蒌皮注射液活性成分与核心靶点的分子对接结合能热图 |

|
| 图 7 瓜蒌皮注射液活性成分与对应核心靶点的分子对接可视化图 |
本研究基于网络药理学进行活性成分筛选,发现瓜蒌皮注射液干预冠心病的活性成分可能有槲皮苷、3,29-二苯甲酰基栝楼仁三醇、木犀草苷、3,29-二苯甲酰基栝楼仁二醇、木犀草素、DL-精氨酸、acetylarginine、DL-色氨酸、prolylisoleucine和L-酪氨酸。这些化学成分可能通过降低血脂水平、抑制炎症、改善心肌缺血、逆转氧化应激来防治冠心病,槲皮苷可通过调节血脂代谢,清除氧自由基、抑制脂质过氧化,防止动脉粥样硬化的形成[9]。木犀草苷通过抑制活性氧(ROS)的产生以及抑制自噬相关来减轻心肌肥厚[10],木犀草苷可以提高抗氧化能力,抑制心肌细胞凋亡来改善心肌细胞损伤[11]。木犀草素可以改善受损的线粒体形态,调节MAPK通路来保护大鼠心肌缺血/再灌注损伤,调节糖脂代谢改善肥大性H9c2细胞[12-13],木犀草素还可以通过抑制转化生长因子-β受体1信号通路进而抑制血管平滑肌细胞的增殖和迁移,对心血管系统具有保护作用[14]。
3.2 关键靶点分析通过网络药理学成分筛选、靶点预测以及网络分析,可发现占据网络中心位置的主要是AKT1、EGFR、SRC、HSP90AA1、ESR1、PLG等靶点,可能是瓜蒌皮注射液干预冠心病进程的关键作用靶点。
瓜蒌皮注射液可能通过AKT1来发挥促进冠状动脉扩张的作用。AKT1可以介导血管内皮一氧化氮合成酶的磷酸化来调节血管张力、舒张血管、增强血流量、促进细胞存活[15-16],通过减少血管平滑细胞凋亡来稳定动脉粥样硬化斑块作用[17]。
瓜蒌皮注射液可能通过EGFR抑制炎症反应。EGFR抑制剂能显著抑制心肌损伤小鼠心肌炎症、纤维化和心肌细胞凋亡[18]。在血管紧张表Ⅱ(AngⅡ)诱导小鼠心脏血管内侧肥大及纤维化模型中,通过抑制EGFR激活和内质网应激,可以减轻血管重塑,防止血管肥大和血管周围纤维化[19]。
PLG靶点可能与瓜蒌皮注射液改善血液的凝集状态相关。研究发现不稳定型心绞痛和心肌梗死患者血浆中纤溶酶活性降低,PLG含量增加,纤溶活性降低,容易诱发冠状动脉血栓的形成[20]。
瓜蒌皮注射液可能通过HSP90AA1来抑制氧化应激。Liu等[21]研究发现HSP90AA1高表达的冠心病患者生存率较高。HSP90AA1可以调节细胞增殖和凋亡来降低耗氧,从而达到对心肌细胞的保护作用[22]。
瓜蒌皮注射液可能通过ESR1发挥抗炎作用。冠心病患者外周血中存在ESR1基因的高甲基化和低表达状态[23]。当上调ESR1的mRNA和蛋白表达后,冠心病患者的TNF-α、IL-6、MCP-1等生化指标明显降低,有效减少巨噬细胞泡沫细胞的形成,减轻炎症反应[24]。
3.3 生物功能和信号通路富集分析通过GO功能富集分析可知,生物学进程主要涉及激素反应、细胞对脂质的反应,对蛋白激酶活性等方面的功能。通过KEGG富集分析预测,瓜蒌皮注射液防治冠心病的信号通路主要为MAPK、IL-17,FoxO信号通路等,这3个信号通路主要与抗炎、逆转氧化应激、改善血脂代谢作用相关。
MAPK信号通路调控炎症、细胞凋亡、细胞周期和生长有效保护心肌细胞,减少主动脉斑块的形成,降低内皮细胞的炎症反应和细胞凋亡[3, 25-26]。IL-17诱发炎症反应参与了心室重构的发展过程[27]。FoxO1通过抑制炎症反应和氧化应激反应,改善血脂代谢异常,保护心功能[28-29]。
4 结语文章运用网络药理学手段筛选了瓜蒌皮注射液治疗冠心病的主要药效成分及作用靶点,结合分子对接技术进行了虚拟验证,并初步探讨了其潜在作用机制。结果表明,瓜蒌皮注射液的活性成分可能通过调控AKT1、EGFR、SRC、HSP90AA1、ESR1、PLG等核心靶点及MAPK、IL-17、FoxO信号通路以达到治疗冠心病的作用。分子对接结果发现AKT1与3,29-二苯甲酰基栝楼仁二醇、木犀草苷和槲皮苷等对接更为稳定。由此可见,瓜蒌皮注射液治疗冠心病的作用机制是一个多成分、多靶点、多通路的复杂过程。网络药理学研究有其局限性,本研究是在分子机制层面并结合参考文献进行的预测探讨,有待进一步通过体内外实验验证预测的活性成分、关键靶点及通路,以证实瓜蒌皮注射液治疗冠心病的作用机制。
| [1] |
王子焱, 范金茹. 冠心病心绞痛中医现代研究进展[J]. 中西医结合心脑血管病杂志, 2020, 18(24): 4161-4164. DOI:10.12102/j.issn.1672-1349.2020.24.013 |
| [2] |
DONG Y, CHEN H W, GAO J L, et al. Molecular machinery and interplay of apoptosis and autophagy in coronary heart disease[J]. Journal of Molecular and Cellular Cardiology, 2019, 136: 27-41. DOI:10.1016/j.yjmcc.2019.09.001 |
| [3] |
孟岩, 吴威, 王诗瑶, 等. 中药治疗冠心病相关信号通路研究进展[J]. 辽宁中医药大学学报, 2023, 25(5): 86-92. |
| [4] |
倪杰, 周果, 顾建国. 瓜蒌皮注射液在冠心病慢性心力衰竭患者中的疗效观察[J]. 南通大学学报(医学版), 2020, 40(6): 586-587. |
| [5] |
夏瑾燕. 瑞舒伐他汀联合瓜蒌皮注射液对老年急性心肌梗死患者内皮舒张功能、心脏功能及血脂水平的影响[J]. 中国老年学杂志, 2018, 38(22): 5384-5386. DOI:10.3969/j.issn.1005-9202.2018.22.003 |
| [6] |
赵启韬, 黄臻辉, 琚姝, 等. 瓜蒌皮注射液干预急性心肌梗死的机制研究[J]. 中成药, 2014, 36(8): 1745-1747. DOI:10.3969/j.issn.1001-1528.2014.08.041 |
| [7] |
冯祝婷, 吕凌丽, 钟金萍, 等. 瓜蒌皮注射液对新生大鼠缺血缺氧性脑损伤的保护作用研究[J]. 山东化工, 2021, 50(15): 27-29. DOI:10.3969/j.issn.1008-021X.2021.15.011 |
| [8] |
张国良, 曲震理, 丁可. 瓜蒌皮注射液对大鼠脑缺血再灌氧化损伤的保护作用[J]. 中国实用医药, 2011, 6(32): 248-249. DOI:10.3969/j.issn.1673-7555.2011.32.198 |
| [9] |
邢影, 孙继泽, 牟凤辉, 等. 槲皮苷对实验性高脂血症大鼠血脂代谢的影响[J]. 特产研究, 2014, 36(2): 43-46. DOI:10.3969/j.issn.1001-4721.2014.02.011 |
| [10] |
周利春, 管延辉, 韩秀珍. 木犀草苷对angⅱ诱导的心肌肥厚的作用研究[A]. 第十一届海峡两岸心血管科学研讨会、2017年全国心脑血管药理学术会议、中国卒中学会第一次新药研讨会论文集[C]. 宁波, 2017: 59.
|
| [11] |
孙潇. 冠心丹参方对氧化应激性心肌细胞损伤保护作用的物质基础及作用机制研究[D]. 北京: 北京协和医学院, 2011.
|
| [12] |
YU D S, LI M W, TIAN Y Q, et al. Luteolin inhibits ROS-activated MAPK pathway in myocardial ischemia/reperfusion injury[J]. Life Sciences, 2015, 122: 15-25. DOI:10.1016/j.lfs.2014.11.014 |
| [13] |
WANG J, GAO T, WANG F, et al. Luteolin improves myocardial cell glucolipid metabolism by inhibiting hypoxia inducible factor-1α expression in angiotensin Ⅱ/hypoxia-induced hypertrophic H9c2 cells[J]. Nutrition Research, 2019, 65: 63-70. DOI:10.1016/j.nutres.2019.02.004 |
| [14] |
WU Y T, CHEN L, TAN Z B, et al. Luteolin inhibits vascular smooth muscle cell proliferation and migration by inhibiting TGFBR1 signaling[J]. Frontiers in Pharmacology, 2018, 9: 1059. DOI:10.3389/fphar.2018.01059 |
| [15] |
YING Z K, XIE X Y, CHEN M J, et al. Alpha-lipoic acid activates eNOS through activation of PI3-kinase/Akt signaling pathway[J]. Vascular Pharmacology, 2015, 64: 28-35. DOI:10.1016/j.vph.2014.11.004 |
| [16] |
HUANG J Q, CAI C H, ZHENG T Y, et al. Endothelial scaffolding protein ENH (Enigma homolog protein) promotes PHLPP2(pleckstrin homology domain and leucine-rich repeat protein phosphatase 2)-mediated dephosphorylation of AKT1 and eNOS (endothelial NO synthase) promoting vascular remodeling[J]. Arteriosclerosis, Thrombosis, and Vascular Biology, 2020, 40(7): 1705-1721. DOI:10.1161/ATVBAHA.120.314172 |
| [17] |
ALLARD D, FIGG N, BENNETT M R, et al. Akt regulates the survival of vascular smooth muscle cells via inhibition of FoxO3a and GSK3[J]. The Journal of Biological Chemistry, 2008, 283(28): 19739-19747. DOI:10.1074/jbc.M710098200 |
| [18] |
LI W X, FANG Q L, ZHONG P, et al. EGFR Inhibition Blocks Palmitic Acid-induced inflammation in cardiomyocytes and Prevents Hyperlipidemia-induced Cardiac Injury in Mice[J]. Scientific Reports, 2016, 6: 24580. DOI:10.1038/srep24580 |
| [19] |
TAKAYANAGI T, KAWAI T, FORRESTER S J, et al. Role of epidermal growth factor receptor and endoplasmic reticulumstress in vascular remodeling induced by angiotensinⅡ[J]. Hypertension, 2015, 65(6): 1349-1355. DOI:10.1161/HYPERTENSIONAHA.115.05344 |
| [20] |
张清, 区晋禧, 贾国良. 冠心病患者血液纤溶活性的改变[J]. 心肺血管病杂志, 1996, 15(2): 77-18. |
| [21] |
LIU L, ZHANG Y D, DU Y X, et al. The therapeutic effect and targets of cellulose polysaccharide on coronary heart disease (CHD) and the construction of a prognostic signature based on network pharmacology[J]. Frontiers in Nutrition, 2022, 9: 986639. DOI:10.3389/fnut.2022.986639 |
| [22] |
LIU J H, WANG S W, TAN W X, et al. Dual-screening of anti-inflammatory and antioxidant active ingredients of Shenxiang Suhe pill and its potential multi-target therapy for coronary heart disease[J]. Biomedecine & Pharmacotherapie, 2020, 129: 110283. |
| [23] |
靳松, 沈干, 胡世莲, 等. 雌激素受体α启动子区甲基化与冠状动脉粥样硬化的关系[J]. 中国老年学杂志, 2011, 31(7): 1102-1104. DOI:10.3969/j.issn.1005-9202.2011.07.002 |
| [24] |
FAN Y D, LIU J W, MIAO J, et al. Anti-inflammatory activity of the Tongmai Yangxin pill in the treatment of coronary heart disease is associated with estrogen receptor and NF-κB signaling pathway[J]. Journal of Ethnopharmacology, 2021, 276: 114106. DOI:10.1016/j.jep.2021.114106 |
| [25] |
LOGATKINA A V, NIKIFOROV V S, BONDAR S S, et al. Proinflammatory cytokines and signaling pathways in peripheral blood mononuclear cells in patients with coronary artery disease[J]. Klinicheskaia Meditsina, 2017, 95(3): 238-244. |
| [26] |
ZHOU T, LI S N, YANG L H, et al. MicroRNA-363-3p reduces endothelial cell inflammatory responses in coronary heart disease via inactivation of the NOX4-dependent p38 MAPK axis[J]. Aging, 2021, 13(8): 11061-11082. DOI:10.18632/aging.202721 |
| [27] |
刘福丽, 霍小森, 刘芳. Th17/IL-17通路在稳定性冠心病患者心室重构中的作用[J]. 中国免疫学杂志, 2019, 35(8): 982-985. DOI:10.3969/j.issn.1000-484X.2019.08.018 |
| [28] |
王书飞, 刘蕾, 杜林翔, 等. 阿卡地新对冠心病大鼠AMPK/FOXO1信号通路及心功能损害的影响[J]. 天津医科大学学报, 2021, 27(5): 496-501. |
| [29] |
马静, 路胜昔, 景风梅, 等. 和厚朴酚对心肌缺血再灌注损伤小鼠SIRT1/FOXO1通路的影响[J]. 中国循证心血管医学杂志, 2022, 14(3): 340-344. DOI:10.3969/j.issn.1674-4055.2022.03.21 |
 2024, Vol. 43
2024, Vol. 43