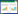文章信息
- 吕振国, 赵鹏, 武恬恬, 欧阳慧子, 何俊
- LYU Zhenguo, ZHAO Peng, WU Tiantian, OUYANG Huizi, HE Jun
- 基于UPLC指纹图谱与多成分定量评价不同产地桑叶药材质量
- Quality evaluation of Mori Folium from different producing areas based on UPLC fingerprint and multi-components determination
- 天津中医药大学学报, 2024, 43(3): 207-211
- Journal of Tianjin University of Traditional Chinese Medicine, 2024, 43(3): 207-211
- http://dx.doi.org/10.11656/j.issn.1673-9043.2024.03.03
-
文章历史
收稿日期: 2023-10-20
2. 现代中医药海河实验室, 天津 301617
2. Haihe Laboratory of Modern Chinese Medicine, Tianjin 301617, China
桑叶为桑科植物桑Morus alba L.的干燥叶,性寒;味甘、苦;归肺、肝经;具有疏散风热,清肺润燥,清肝明目的功效[1];临床上用于治疗风热感冒,肺热燥咳等症[2],是中医清热解毒之要药[3-4]。桑叶始载于《神农本草经》,在中国具有悠久的食用及药用历史,是集食用、药用、保健等多种用途为一体的天然绿色食品。现代研究表明,桑叶具有抗氧化[5]、抗衰老[6]、降血糖[7-8]、调血脂[9]和抗肿瘤[10]等多种药理作用。
桑叶作为药食同源中药[11],其质量优劣对于临床用药有效性与食用安全性具有较大影响[12]。中国桑树种质资源丰富,分布广泛,是世界上桑种最多的国家。由于地理条件、气候和环境等因素影响,不同产区所产桑叶不免存在质量不一的问题,建立全面合理的桑叶质量评价方法非常重要。基于此,研究将超高效液相色谱(UPLC)指纹图谱、化学模式识别技术与指标成分定量相结合,从多角度出发,对不同产地桑叶质量进行评价,为桑叶药材质量提升与应用提供理论依据。
1 仪器与材料 1.1 仪器超高效液相色谱仪(美国安捷伦公司,Agilent 1290);G3KT18273型旋涡混合器(赛默飞世尔科技公司);十万分之一天平(波兰Radwag公司);超纯水制备仪(Millipore公司);超声波清洗机(天津知著科技有限公司)。
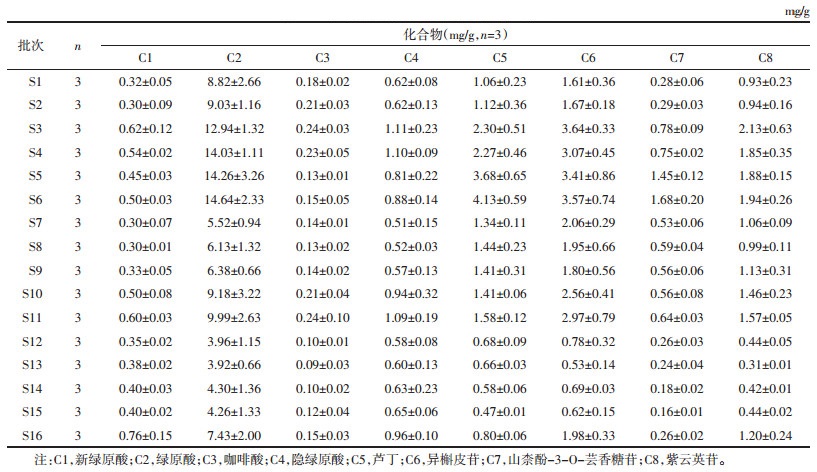
1.2 材料甲醇、乙腈、甲酸(色谱纯,美国Fisher公司);标准对照品绿原酸(批号:DST221010-021)、异槲皮苷(批号:DSTDY000601)、紫云英苷(批号:DSTDZ000102)、新绿原酸(批号:DSTDX001505)、芦丁(批号:DSTDL001702)、咖啡酸(批号:DST191030-013)、隐绿原酸(批号:DST221220-035)和山奈酚-3-O-芸香糖苷(批号:DST200619-075),以上标准对照品由成都德思特生物技术有限公司提供,纯度均大于98.0%。桑叶药材来源信息见表 1。
色谱柱:CORTECS UPLC C18色谱柱(2.1 mm×100 mm,1.6 μm);流动相:A相为0.1%甲酸水,B相为乙腈;梯度洗脱,洗脱梯度:0~20 min,5%~21%B;流速、柱温、进样量和检测波长分别为:0.3 mL/min、35 ℃、2 μL和350 nm。
2.2 配制标准对照品溶液取前述8种标准对照品适量,十万分之一天平精密称定,以80%甲醇对所称标准品进行溶解,最终配制成1 mg/mL的溶液,于4 ℃冰箱储存。
2.3 制备供试品溶液精密称取桑叶药材粗粉(过三号筛)200.0 mg,置于10 mL容量瓶中,加80%甲醇定容至容量瓶刻度线,超声处理1 h(300 W,40 kHz),冷却,补足失质量,摇匀,过微孔滤膜(0.22 μm)即得供试品溶液。
2.4 桑叶UPLC指纹图谱的建立 2.4.1 精密度实验取第13批次桑叶粗粉,制备供试品溶液,连续进样6次,以第9号芦丁色谱峰为参照色谱峰(S),计算得到各共有峰相对保留时间的相对标准偏差(RSDRt)小于0.43%,相对峰面积的相对标准偏差(RSDS)小于2.80%,表明仪器精密度良好。
2.4.2 重复性实验取第13批次桑叶粗粉,平行制备6份供试品溶液,进样测定,以第9号芦丁色谱峰为参照峰(S),计算得RSDRt小于2.12%,RSDS小于4.30%,表明该方法重复性良好。
2.4.3 稳定性实验取第13批次桑叶粗粉,制备供试品溶液,在0、2、4、8、12、24 h时间点下分别进样,以第9号芦丁色谱峰为参照峰(S),计算得RSDRt小于1.10%,RSDS小于4.92%,表明供试品溶液在24 h内稳定性良好。
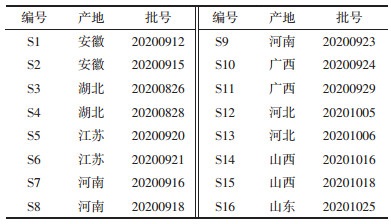
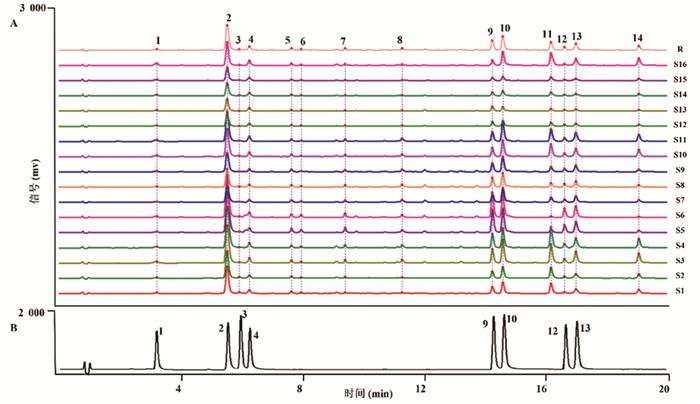
2.4.4 桑叶UPLC指纹图谱的建立与相似度评价将16批桑叶UPLC色谱数据导入“中药色谱指纹图谱相似度评价系统(国家药典委员会,2012)”,以第1批样品色谱图为参照图谱,采用平均数法生成对照图谱,建立16批桑叶药材的叠加指纹图谱以及对照指纹图谱(R),见图 1 A。14个峰被标定为共有峰,通过比对标准对照品溶液的色谱图,见图 1 B,共8个成分被指认,分别为新绿原酸(1号峰),绿原酸(2号峰),咖啡酸(3号峰),隐绿原酸(4号峰),芦丁(9号峰),异槲皮苷(10号峰),山奈酚-3-O-芸香糖苷(12号峰)和紫云英苷(13号峰)。相似度分析结果见表 2,由表可知,结果均在0.962以上,初步说明16批样品的化学成分一致性较高,质量均一稳定。
|
| 注:A,16批桑叶叠加图谱及对照图谱;B,混合标准品溶液色谱图。1,新绿原酸;2,绿原酸;3,咖啡酸;4,隐绿原酸;9,芦丁;10,异槲皮苷;12,山奈酚-3-O-芸香糖苷;13,紫云英苷。 图 1 UPLC指纹图谱图 |
化学计量学分析模型由SIMCA-P14.1(Umetrics, Umea, Sweden)建立,其统计学特性通过R2X、R2Y和Q2进行评估。
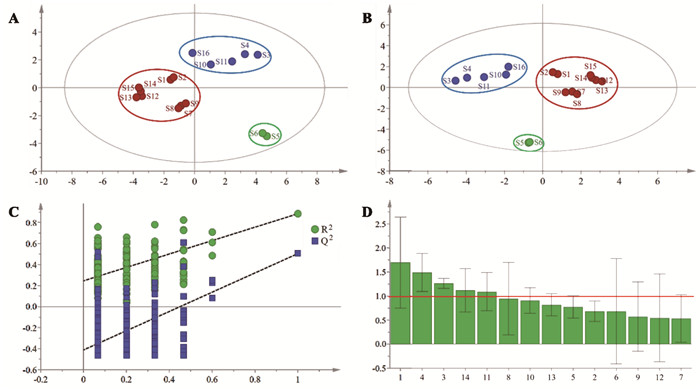
2.4.5.1 主成分分析(PCA)采用SIMCA 14.1软件,以16批桑叶药材的14个共有峰的峰面积为变量进行PCA分析。R2为0.978,Q2为0.968,表明该模型具有较高的解释能力和预测性能。PCA得分图结果显示,16批桑叶药材可分为3类,S5、S6药材聚为第一类,S1、S2、S7-S9、S12-S15桑叶药材聚为第二类,S3、S4、S10、S11和S16桑叶药材聚为第三类。PCA结果显示,位于太湖流域的江苏产桑叶单独聚为第一类,位于中国中部地区的安徽、河南、山西和华北地区的河北产桑叶聚为第二类,华中地区的湖北、华南地区的广西和华东地区的山东产桑叶聚为第三类。由此可知,不同产地桑叶质量与地理来源相关性较大。此外,结合下文含量测定结果可知,在此实验所评价的16批桑叶中,第一类江苏产桑叶所测得化合物总含量最高,安徽、河南、山西和河北产桑叶次之。具体见图 2 A与后文含量测定部分。
|
| 注:A,PCA散点图;B,PLS-DA散点图;C,置换检验验证模型图;D,VIP图。 图 2 化学计量学分析结果图 |
根据主成分分析结果,以共有峰峰面积为变量进行PLS-DA分析。该模型具有较好的预测能力(R2X,R2Y,Q2值分别为0.992,0.960,0.737),可以被用于评价与分析不同产地桑叶药材间的质量差异。通过PLS-DA模型得分图(图 2B)可知,不同产地桑叶药材也明显分为3类,与PCA结果一致。对两个分类变量进行了200次置换检验,如图 2C所示,Q2点所在回归线与Y轴交于0以下且左侧点的所有排列值均远低于右上角原始点的值(R2=0.247<0.3,Q2=-0.412<0.05),表明该模型没有过拟合,有效可靠。
为进一步筛选区分不同产地桑叶药材间的标志性成分,选取了变量投影重要度(VIP)>1的成分作为差异性成分。由图 2D可知,差异显著性排序为1号峰(新绿原酸)>4号峰(隐绿原酸)>3号峰(咖啡酸)>14号峰>11号峰。
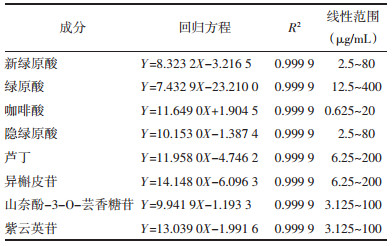
2.5 含量测定 2.5.1 线性关系考察精密量取各对照品储备液适量,使用80%甲醇依次稀释,得到标准曲线中各浓度混合对照品溶液,取各上述溶液进样分析,记录相应峰面积,以色谱峰面积为纵坐标(Y),质量浓度为横坐标(X),绘制含量测定的标准曲线,计算线性回归方程,结果见表 3。
取第13批次桑叶粗粉,制备供试品溶液,连续进样6次,计算得8个待测成分的峰面积RSD均小于0.26%,表明仪器日内精密度良好。每天重复进样2次,连续进样3 d,计算得8个待测成分峰面积RSD均小于0.45%,表明仪器日间精密度良好。
2.5.3 重复性实验取第13批次桑叶粗粉,平行制备6份供试品溶液,进样测定,计算得8个待测成分的含量RSD分别均小于2.19%,表明该方法重复性良好。
2.5.4 稳定性实验取第13批次桑叶粗粉,制备供试品溶液,在0、2、4、8、12、24 h时间点下分别进样,计算得8个待测成分的峰面积RSD均小于分别为3.38%,表明供试品溶液在24 h内稳定性良好。
2.5.5 加样回收率实验精密称取6份桑叶粉末100.0 mg,分别加入各对照品适量,平行制备6份供试品溶液,进样测定,记录峰面积,计算新绿原酸、绿原酸、咖啡酸、隐绿原酸、芦丁、异槲皮苷、山柰酚-3-O-芸香糖苷和紫云英苷的平均加样回收率,依次为107.68%、103.07%、102.21%、103.45%、100.56%、99.95%、111.23%、102.98%,RSD值均小于1.49%,表明该方法的准确度符合要求。
2.5.6 含量测定取各批次桑叶粉末制备供试品溶液,进样分析,按照外标法计算各成分含量,结果见表 4。
研究考察了提取方式对主要色谱峰的影响,结果显示回流与超声提取法对主要色谱峰的影响并不显著。在绿色化学的理念下为提高效率,研究采用超声提取法。同时,研究还考察了提取时间(0.5、0.75、1、1.5 h)、提取溶剂(30%甲醇、50%甲醇、80%甲醇、甲醇)对色谱峰的影响。结果显示,以80%甲醇为提取溶剂,提取时间为1 h所得色谱峰响应较强且数量最多。
3.2 色谱条件的优化研究考察了流动相、柱温和流速对色谱峰分离的影响。结果显示,当柱温为35 ℃,乙腈-0.1%甲酸水为流动相在0.3 mL/min流速下进行检测时,基线平稳,20 min内即可完成主要色谱峰的良好分离。
研究将UPLC指纹图谱、化学计量学和指标成分含量测定相结合,从多角度综合评价了不同来源桑叶的质量。该方法专属性强,分析时间短,可为桑叶药材质量标准的提升与临床应用提供参考。
| [1] |
国家药典委员会. 中华人民共和国药典[M]. 北京: 中国医药科技出版社, 2020: 310-311.
|
| [2] |
林闪闪, 王梦娇, 许金国, 等. 桑叶化学成分与药理作用研究进展及其质量标志物预测分析[J]. 中草药, 2023, 54(15): 5112-5127. |
| [3] |
陈淑莹, 侯小涛, 黄显婷, 等. 桑叶化学成分、药理作用及应用研究进展[J]. 辽宁中医药大学学报, 2023, 25(4): 207-220. |
| [4] |
罗文涛, 冯菊红, 王理想, 等. 桑叶黄酮类化合物的研究进展[J]. 化学与生物工程, 2021, 38(7): 8-13. DOI:10.3969/j.issn.1672-5425.2021.07.002 |
| [5] |
刘文强, 董壮壮, 孙庆, 等. 桑叶茶中多酚、黄酮含量与抗氧化作用的相关性研究[J]. 食品科技, 2023, 48(2): 239-245. |
| [6] |
吕庆银, 陈阳, 赖富丽, 等. 桑叶提取物活性成分及其抗氧化与α-葡萄糖苷酶抑制活性研究[J]. 食品科技, 2023, 48(1): 175-180. |
| [7] |
任岩海, 刘洪凤, 韩智学. 桑叶多糖对2型糖尿病大鼠血糖血脂的影响[J]. 中医药学报, 2013, 41(1): 20-21. |
| [8] |
韦芳媚, 陈春, 李超, 等. 桑叶提取物、茶多酚及其复配物的抗氧化和降血糖活性[J]. 食品工业科技, 2018, 39(21): 299-305. |
| [9] |
贺燕, 邹莉芳, 黄先智, 等. 桑叶水提物对高脂饮食小鼠粪便中胆固醇代谢产物的影响[J]. 现代食品科技, 2019, 35(5): 37-45, 295. |
| [10] |
盛晨鸣, 施晓艳, 丁泽贤, 等. 桑叶不同提取物对肿瘤细胞的细胞毒性作用[J]. 贵阳中医学院学报, 2019, 41(2): 30-33, 45. |
| [11] |
黄金枝, 俞燕芳, 胡桂萍, 等. 30份药食用桑叶营养品质评价及相关性研究[J]. 食品与发酵工业, 2020, 46(7): 155-160. |
| [12] |
史锐, 刘苗苗, 丛龙娇, 等. 基于HPLC指纹图谱评价同属不同种桑叶的药材质量[J]. 中华中医药学刊, 2022, 40(7): 207-212, 280-281. |
 2024, Vol. 43
2024, Vol. 43