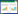文章信息
- 刘奉云, 安然, 王睦天, 李修齐, 刘威威, 赵启亮, 刘凯, 尹延重, 孙宏源, 常力, 张慧琪, 刘旻
- LIU Fengyun, AN Ran, WANG Mutian, LI Xiuqi, LIU Weiwei, ZHAO Qiliang, LIU Kai, YIN Yanzhong, SUN Hongyuan, CHANG Li, ZHANG Huiqi, LIU Min
- 麻杏石甘汤对铜绿假单胞菌肺炎大鼠细菌清除效应及中性粒细胞浸润和炎症因子的影响
- Effection of Maxing Shigan Tang on bacterial clearance, polymorphioc neutrophils infiltration, and inflammatory factors in rats with pseudomonas aeruginosa pneumonia
- 天津中医药大学学报, 2024, 43(3): 212-219
- Journal of Tianjin University of Traditional Chinese Medicine, 2024, 43(3): 212-219
- http://dx.doi.org/10.11656/j.issn.1673-9043.2024.03.04
-
文章历史
收稿日期: 2023-10-30
2. 国家中医针灸临床医学研究中心, 天津 300381;
3. 天津中医药大学, 天津 301617
2. National Clinical Research Center for Chinese Medicine Acupuncture and Moxibustion, Tianjin 300381, China;
3. Tianjin University of Traditional Chinese Medicine, Tianjin 301617, China
铜绿假单胞菌(PA)是导致医院获得性肺炎的重要病原体,且近年来感染率有上升的趋势[1-2]。由于PA的高度代谢灵活性,可分泌多种毒力因子,并能适应宿主的固有免疫[3],导致PA肺炎死亡率高,有研究显示重症监护室(ICU)中的PA肺炎患者30 d内病死率高达22%[4],同时PA极易产生耐药性且耐药机制复杂,故对抗感染治疗造成极大的挑战。麻杏石甘汤出自《伤寒论》,临床可用于治疗各种类型的肺炎[5],有体外实验证明麻杏石甘汤对PA有一定抗菌作用[6],但目前尚无体内实验研究报道。多项研究显示[7-8],PA肺炎死亡病例的感染灶存在中性粒细胞(PMNs)过度浸润的病理现象,而PMNs浸润主要受肿瘤坏死因子-α(TNF-α)、白介素(IL)-8和IL-10的调节。本研究在课题组预实验的基础上,拟采用气管滴注法建立PA肺炎大鼠模型,观察麻杏石甘汤对大鼠肺脏细菌的清除效应,并探索其对PMNs浸润和炎症因子的影响,以初步解释麻杏石甘汤治疗PA肺炎可能的作用机制。
1 材料 1.1 动物实验动物选取雄性SD大鼠120只,体质量(180±10)g,购自北京华阜康生物科技股份有限公司,动物资格许可证号:SCXK(京)2019-0008,在易生源基因科技(天津)有限公司动物房内适应性喂养3 d。通过实验动物委员会伦理审批(编号:YSY-DWLL-2022282)。
1.2 药物及制备麻杏石甘汤:麻黄30 g,苦杏仁10 g,炙甘草15 g,石膏碎(绵裹)60 g,中药饮片由天津中医药大学第一附属医院中药房提供。参考伤寒论煎煮法,生麻黄先煎20 min,再加入其余3味药材煎30 min,制备含生药0.5 g/mL的中药浓缩煎剂,4 ℃避光保存备用。头孢他啶(海南合瑞制药股份有限公司,批号:220504)。以上均4 ℃避光保存备用。
1.3 试剂与仪器哥伦比亚血平板(广东环凯微生物科技有限公司,批号:M2357Y),伊红染液(北京中杉金桥生物科技有限公司,批号:ZLI-9613),苏木素染液(北京中杉金桥生物科技有限公司,批号:ZLI-9610),酸性乙醇分化液(源叶生物,批号:R20777)。免疫组化抗原修复缓冲液(北京中杉金桥生物技术有限公司,批号:ZLI-9065),髓过氧化物酶(MPO)抗体(武汉三鹰,批号:66177-1-LG)。小鼠二步法检测试剂盒(北京中杉金桥生物技术有限公司,批号:PV-9002),RAT TNF-α ELISA试剂盒(上海科兴,批号:F3056-A),RAT IL-8 ELISA试剂盒(上海科兴,批号:F3071-A),RAT IL-10 ELISA试剂盒(上海科兴,批号:F3051-A)。恒温箱(上海一恒,型号:D hP9121B),比浊仪(BioMérieux Densi C hEK Plus),病理切片机(徕卡仪器有限公司,型号:LEiCA histoCore MULTICUT),包埋机(金华市华速科技有限公司,型号:ES500-1),组织摊片机(金华市华速科技有限公司,型号:ES500-3 h),显微镜(OLYMPUS,型号:OLYMPUS CKX43-LP),组织研磨仪(武汉塞维尔生物科技有限公司,型号:KZ-Ⅲ-F),全景扫片仪(3D hISTEC h),酶标仪(北京普朗科技有限公司,型号:DNM-9602),超净工作台(苏净安泰,型号:SW-CJ-2F)。
2 方法 2.1 PA肺炎大鼠模型制备取PA标准菌株少许接种于哥伦比亚血平板,倒置于恒温箱(37 ℃)孵育培养18~24 h,染色镜检确认为G-杆菌,单个菌落转种营养肉汤(100 mL)、繁殖。次日取浑浊肉汤,重复离心10 min,2 500 r/min,离心半径19 cm。去上清液及加生理盐水混匀操作,采用比浊法,菌落形成单位(CFU),调整菌悬液浓度为6×108 CFU/mL。大鼠术前禁食8 h,称质量,腹腔注射10%水合氯醛(3 mL/kg)麻醉大鼠,将其仰卧位固定,剃除体毛暴露皮肤,局部皮肤消毒,无菌操作下暴露气管,抽吸PA菌液(0.2 mL),于软骨环间注入菌液。大鼠直立并左右旋转,以保证肺部两侧菌液分布均匀,缝合切口。空白组气管滴注等体积生理盐水。造模后观察大鼠肺组织病理学特征和肺组织细菌学鉴定结果作为模型构建成功的评价指标,本研究预实验[9]表明造模后12 h大鼠可见明显肺炎表现。
2.2 实验分组及给药雄性SD大鼠120只,随机分5组(对照组、模型组、西药组、中药组、中西医结合组),每组24只,分4个时点(模型成功后0、12、24、72 h)。给药量和给药方法根据“人和动物间体表面折算的等效剂量比率表”计算得出。造模后12 h(记为造模成功后0 h)给药,西药组肌注头孢他啶(每次180 mg/kg,每日2次);中药组予麻杏石甘汤浓缩煎剂2 mL灌胃,每日2次;中西医结合组予麻杏石甘汤浓缩煎剂灌胃及头孢他啶肌注(剂量同前);此3组为药物干预组。对照组、模型组予等体积生理盐水灌胃,每日2次。并于造模成功后12、24、72 h重复上述给药操作。
2.3 取材分别于模型成功后0、12、24、72 h取材,每时点每组6只。大鼠麻醉后无菌操作打开腹腔,腹主动脉采血,用乙二胺四乙酸(EDTA)采血管取2 mL样本送检血常规,同时取3.5 mL样本置于促凝采血管(5 mL)中常温离心15 min,3 500 r/min,离心半径19 cm。取上清液,分装于离心管,冰上转运,-20 ℃保存待测;无菌操作打开胸腔,分离右肺组织,取右肺下叶用于检测肺组织匀浆细菌计数,取右肺上叶用4%多聚甲醛溶液固定72 h以上,石蜡包埋、切片,用于后续肺组织病理学及MPO表达量检测。
2.4 检测指标与方法 2.4.1 肺组织病理学表现将右肺上叶组织切片脱蜡、复水后进行苏木精-伊红(HE)染色(苏木素染色5 min,自来水漂洗,0.5%酸性乙醇分化2 s,自来水漂洗,0.2%氨水返蓝10 s,自来水冲洗,伊红染色1 min,自来水冲洗至干净),再脱水、透明、封片,将切片置于显微镜下观察组织病理变化。
2.4.2 肺组织匀浆细菌计数称取50~70 mg右肺下叶肺组织进行研磨,低温下匀浆并倍比稀释,选取合适的浓度,均匀涂布于血平板并置于37 ℃恒温培养箱中孵育24 h,次日对血平板进行菌落计数,并计算每克肺组织CFU数目,每克肺组织CFU数=菌落数×100×稀释倍数。
2.4.3 外周血PMNs计数用动物血球分析仪采用大鼠模式,检测外周血PMNs计数。
2.4.4 肺组织MPO检测将右肺上叶组织切片脱蜡、复水后严格按照试剂盒操作说明使用免疫组织化学法检测MPO水平,每张切片随机选取3个不同视野(×200),用FIJI图像分析软件计算每个视野的积分光密度(IOD)。
2.4.5 血清TNF-α、IL-8、IL-10检测取腹主动脉血清,按照ELISA试剂盒操作检测TNF-α、IL-8、IL-10的含量。
2.5 统计学方法实验数据采用SPSS21.0统计软件进行统计分析。计量资料以均数±标准差(x±s)表示,采用双因素方差分析(Two-Way ANOVA)进行多组间均数比较,多重比较采用LSD法、Dunnett(T3)法;不符合正态分布时,采用非参数检验。P<0.05表示差异有统计学意义。
3 结果 3.1 肺组织病理空白组大鼠肺组织结构基本正常,模型组与各药物干预组大鼠在不同时点肺组织均出现不同程度的炎症表现。72 h时,模型组肺组织结构中度异常,实质化程度较前稍有减轻,PMNs浸润较前减少;与模型组相比,药物干预组肺部炎症表现均明显改善,肺泡结构较为清晰,部分区域肺泡上皮细胞增生,肺泡壁增厚,并可见少量PMNs浸润;中西医结合组损伤程度最轻,偶见肺泡壁增厚及PMNs浸润,见图 1。
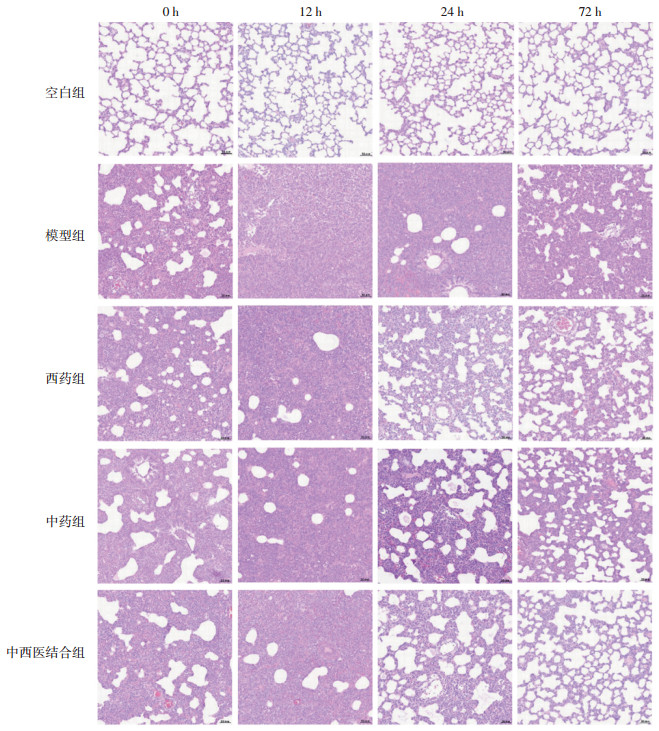
|
| 注:比例尺为50 μm。 图 1 各时点肺组织病理变化(×200) |
空白组各时点肺组织细菌培养均无PA菌落生长,模型组和各药物干预组肺组织可培养出PA菌落,且细菌载量均呈下降趋势;72 h时,与模型组相比,药物干预组细菌计数均降低,差异有统计学意义(P<0.05),说明中西医治疗均可降低肺组织细菌载量,促进局部细菌清除,见表 1和图 2。

|
| 图 2 不同时间点大鼠肺组织细菌清除情况(x±s) |
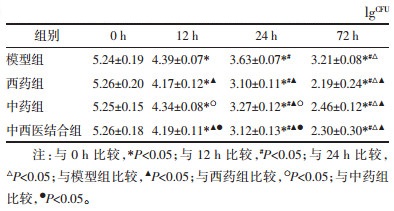
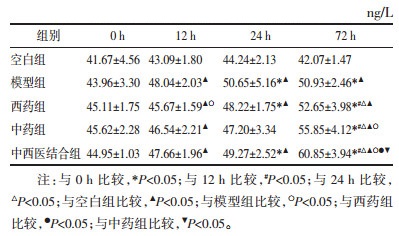
空白组各时点外周血PMNs计数无明显变化,差异无统计学意义(P>0.05),模型组和西药组呈持续上升趋势,中药组和中西医结合组呈先上升后下降趋势,差异均无统计学意义(P>0.05),见表 2。
空白组肺组织MPO低水平表达,模型组呈先上升后下降趋势,药物干预组均呈下降趋势;72 h时,与模型组比较,药物干预组MPO表达量均低于模型组,差异有统计学意义(P<0.05),见表 3。积分光密度图像显示,空白组肺组织MPO低水平表达,支气管腔、肺泡腔内偶见棕黄色颗粒,模型组及各药物干预组肺组织中在不同时间有不同程度的黄色至棕黄色颗粒,可见于肺实质及肺泡间隔内,见图 3。

|
| 注:比例尺为50 μm。 图 3 各组大鼠不同时点肺组织MPO免疫组化(×200) |
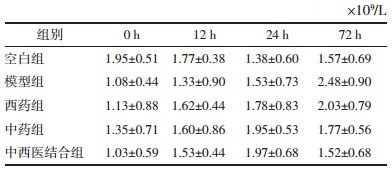
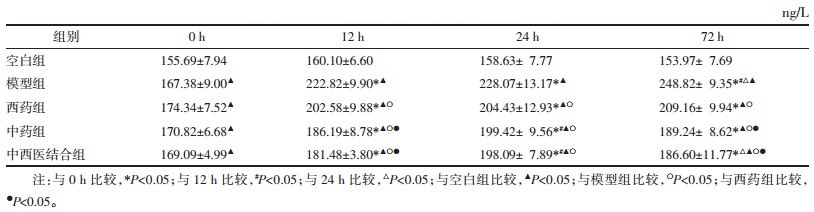
模型组与西药组呈持续上升趋势,中药组和中西医结合组呈先上升后下降趋势,24 h为其转折点;72 h时,组间浓度由高到低依次为模型组、西药组、中药组、中西医结合组,差异有统计学意义(P<0.05),见表 4。
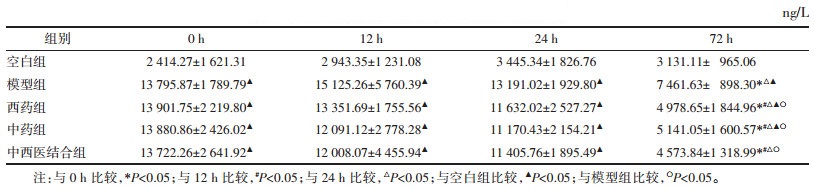
模型组呈持续上升趋势,药物干预组呈先上升后下降趋势,24 h为其转折点;72 h时,组间浓度由高到低依次为模型组、西药组、中药组、中西医结合组,差异无统计学意义(P>0.05),见表 5。
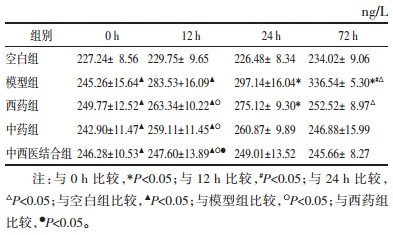
模型组与药物干预组均呈持续上升趋势;72 h时,与模型组比较,中药组和中西医结合组均高于模型组,差异有统计学意义(P<0.05),见表 6。
PA肺炎多见于院内感染,易感人群多为伴免疫缺陷疾病的患者,故易导致不良结局。西医治疗PA肺炎以抗生素杀菌为主,但抗生素的最佳干预时长很难确定,且抗生素的频繁使用会提高呼吸道PA的耐药率[10-11],新兴的治疗方法如抗菌肽、噬菌体等又因为成本高、安全性低而不能广泛应用于临床。中药有着来源广、成本低、不易耐药的优势,可以通过多种药物靶点及分子机制治疗PA感染[12]。PA肺炎中医属“肺热病”范畴,核心病机是气分热盛,治疗当以辛凉宣泄法,麻杏石甘汤是该法的代表方剂,麻黄与石膏配伍宣肺透邪,泄气分之邪热,苦杏仁肃降肺气,炙甘草调和诸药,本方应用于临床可缩短肺炎退热时间和咳嗽消失时间,提高PA肺炎的临床疗效[13],但是麻杏石甘汤对PA肺炎的具体作用机制尚待研究。
研究结果显示,在观察终点72 h时,病理组织学上药物干预组较模型组肺部炎症表现明显改善,中西医结合组损伤程度最轻,提示着麻杏石甘汤治疗PA肺炎有一定疗效,且与抗生素联合应用疗效可能会叠加,既往亦有麻杏石甘汤可减轻肺炎动物模型肺部病理损伤的报道[14]。72 h时点,各药物干预组肺组织细菌计数均低于模型组,说明肺部感染得到了有效的控制,中药组、西药组及中西医结合组3组间细菌计数无显著性差异,说明中药在降低肺部细菌菌量上效果不亚于抗生素,可能做为临床抗生素治疗失败后的备选治疗,有动物实验研究显示甘草的主要成分(甘草甜素)可抑制铜绿假单胞菌生物被膜的形成[15],且有体外实验表明麻黄对铜绿假单胞菌有一定的抗菌活性,但常规口服剂量远不能达到应有的抑菌血药浓度[16],现有的药理学证据不能完全解释中药汤剂的疗效机制,麻杏石甘汤主要成分是否对PA有直接的杀伤作用仍需今后进一步实验探究。
西医研究发现,PMNs来源于骨髓,成熟后分布于游离池(血管为主)和储蓄池(脾为主)。细菌入侵宿主后,在炎症因子刺激下,游离池的PMNs进入感染灶发挥吞噬、杀菌作用,当炎症进一步加重,储蓄池的PMNs启动,以促进感染灶PMNs的浸润,最大限度地发挥杀菌效应[17-18]。本研究结果中,0 h时点,即注射菌液后12 h,模型组及各药物干预组外周血PMNs计数均低于空白组,提示循环血中PMNs大量迁移至肺部感染灶;0~24 h,模型组及各药物干预组PMNs计数均呈上升趋势,提示细菌入侵宿主后,机体快速从储蓄池募集PMNs;24 h时点,外周血PMNs计数中西医结合组 > 中药组 > 西药组 > 模型组,说明在肺炎早期中药可能有助于循环血PMNs的补充;24~72 h,模型组和西药组外周血PMNs计数继续上升,而中药组、中西医结合组呈下降趋势,72 h时点PMNs计数模型组 > 西药组 > 中药组 > 中西医结合组,提示随着细菌载量降低,中药可能调控机体某种负反馈机制,以抑制PMNs过度募集、激活,避免过度炎症反应。MPO主要存在于PMNs的嗜天青颗粒中,在PMNs募集到感染灶的过程中,MPO随之释放到细胞环境中[19],检测肺组织病灶中MPO表达水平,可以反映PMNs在肺组织的浸润情况。在72 h时点,药物干预组MPO表达量均低于模型组,说明中西医治疗均能通过降低菌量,以改善PMNs的肺组织浸润。
模型组促炎因子TNF-α和IL-8持续上升,中药组和中西医结合组促炎因子浓度在24 h出现下降趋势,在72 h时点,中西医结合组和中药组均低于西药组,这表明麻杏石甘汤可能对TNF-α和IL-8的分泌有抑制作用。西药组TNF-α变化趋势与模型组相同,说明抗生素发挥直接杀菌作用,与宿主本身的免疫调节无直接联系。西药组IL-8也呈先上升后下降趋势,有研究显示,IL-8在细菌性肺炎患者肺内起着对PMNs募集和激活的作用[20],随着肺内PA菌量的减少,IL-8分泌速度也会降低,从西药组72 h时点MPO表达量低于模型组可佐证此点,但具体机制尚需进一步研究。各组抑炎因子IL-10均呈持续上升趋势,符合肺炎的病理发展规律,72 h时点,其浓度由高到低依次为中西医结合组、中药组、西药组及模型组,提示麻杏石甘汤可促进IL-10的分泌。
综上,麻杏石甘汤能有效的治疗PA肺炎,降低肺部病原体菌量,并可能通过促进IL-10,抑制TNF-α、IL-8的分泌,以改善肺部PMNs浸润,从而减少肺部的炎症损伤。72时点各药物干预组药效对比,在改善肺部病理上,中西医结合组优于中药组和西药组;在降低菌量上3组之间无明显差异,而中药与抗生素的降菌机制可能不同;在改善炎症相关指标上,中西医结合组、中药组均优于西药组,且中西医结合组治疗效果最优。本研究样本量少,且因为炎症因子在体内可由多种细胞分泌,为网状调控,故不能明确中药对其直接的作用,同时本研究构建的PA肺炎模型不能完全模拟复杂的临床情况,后续可进一步探索麻杏石甘汤是否在体内对PA有直接抗菌作用以及其如何影响炎症因子的分泌,明确量-效关系以更好地阐释中药的内在作用机制,为临床治疗提供依据。
| [1] |
钱文, 李小东, 刘璐, 等. 某三甲医院铜绿假单胞菌痰培养阳性患者细菌耐药及抗菌药物应用分析[J]. 实用预防医学, 2023, 30(8): 1007-1011. DOI:10.3969/j.issn.1006-3110.2023.08.027 |
| [2] |
ELMASSRY M M, COLMER-HAMOOD J A, KOPEL J, et al. Anti-Pseudomonas aeruginosa vaccines and therapies: An assessment of clinical trials[J]. Microorganisms, 2023, 11(4): 916. DOI:10.3390/microorganisms11040916 |
| [3] |
JURADO-MARTÍN I, SAINZ-MEJÍAS M, MCCLEAN S. Pseudomonas aeruginosa: An audacious pathogen with an adaptable arsenal of virulence factors[J]. International Journal of Molecular Sciences, 2021, 22(6): 3128. DOI:10.3390/ijms22063128 |
| [4] |
DENIS J B, LEHINGUE S, PAULY V, et al. Multidrug-re-sistant Pseudomonas aeruginosa and mortality in mechani-cally ventilated ICU patients[J]. American Journal of Infec-tion Control, 2019, 47(9): 1059-1064. DOI:10.1016/j.ajic.2019.02.030 |
| [5] |
熊兴江. 基于重症病例及现代病理生理机制的小柴胡汤合麻杏石甘汤方证条文内涵解读及其治疗肺部感染、慢性阻塞性肺疾病急性加重等急危重症体会[J]. 中国中药杂志, 2023, 48(10): 2606-2612. |
| [6] |
朱耀萱, 陈伟, 王振中, 等. 麻杏石甘汤抗菌活性的空间异质性及其物理结构基础[J]. 药学学报, 2021, 56(8): 2112-2118. |
| [7] |
MAZOR R, PASTAN I. Immunogenicity of immunotoxins containing Pseudomonas exotoxin A: Causes, consequences, and mitigation[J]. Frontiers in Immunology, 2020, 11: 1261. DOI:10.3389/fimmu.2020.01261 |
| [8] |
任晓婷, 徐炎, 孙丽平. 麻杏石甘汤现代研究进展及展望[J]. 吉林中医药, 2020, 40(8): 1106-1109. |
| [9] |
安然, 刘奉云, 赵启亮, 等. 广泛耐药铜绿假单胞菌肺炎大鼠模型的制备[J]. 海南医学院学报, 2023, 29(15): 1128-1134. |
| [10] |
周子微, 赵克霞, 乐文清, 等. 2019-2022年呼吸道铜绿假单胞菌耐药率与抗菌药物使用频度的相关性分析[J]. 临床肺科杂志, 2023, 28(8): 1239-1243. DOI:10.3969/j.issn.1009-6663.2023.08.022 |
| [11] |
BOUGLÉA, TUFFET S, FEDERICI L, et al. Comparison of 8 versus 15 days of antibiotic therapy for Pseudomonas aeruginosa ventilator-associated pneumonia in adults: a randomized, controlled, open-label trial[J]. Intensive Care Med, 2022, 48(7): 841-849. DOI:10.1007/s00134-022-06690-5 |
| [12] |
徐英莉, 庞博, 曹姗, 等. 中药防治耐药铜绿假单胞菌肺炎感染机制研究进展[J]. 中国药物警戒, 2023, 20(1): 57-60. |
| [13] |
李凯, 杨丰文, 庞稳泰, 等. 麻杏石甘汤治疗社区获得性肺炎随机对照试验的系统评价[J]. 中国中药杂志, 2021, 46(5): 1268-1275. |
| [14] |
李鹏, 张元媛, 张浩然, 等. 基于转录组数据解析麻杏石甘汤治疗肺炎的多尺度作用机制[J]. 中国实验方剂学杂志, 2023, 29(1): 82-90. |
| [15] |
黄盼, 王志鹏, 肖琛闻, 等. 甘草甜素对铜绿假单胞菌生物被膜形成的抑制作用[J]. 农业生物技术学报, 2022, 30(3): 570-579. |
| [16] |
高贵阳, 黄志昂, 黄晓辉, 等. 鱼腥草等12种中药对铜绿假单胞菌的体外抗菌活性研究[J]. 中医临床研究, 2019, 11(13): 18-21. |
| [17] |
BURN G L, FOTI A, MARSMAN G, et al. The neutrophil[J]. Immunity, 2021, 54(7): 1377-1391. DOI:10.1016/j.immuni.2021.06.006 |
| [18] |
COWLAND J B, BORREGAARD N. Granulopoiesis and granules of human neutrophils[J]. Immunological Reviews, 2016, 273(1): 11-28. DOI:10.1111/imr.12440 |
| [19] |
ARNHOLD J. The dual role of myeloperoxidase in immune response[J]. International Journal of Molecular Sciences, 2020, 21(21): 8057. DOI:10.3390/ijms21218057 |
| [20] |
ABUL H, ABUL A, KHAN I, et al. Levels of IL-8 and myeloperoxidase in the lungs of pneumonia patients[J]. Molecular and Cellular Biochemistry, 2001, 217(1/2): 107-112. DOI:10.1023/A:1007264411006 |
 2024, Vol. 43
2024, Vol. 43