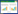文章信息
- 郝婷, 马英, 焦扬, 宋佑坤, 刘树业, 朱彧
- HAO Ting, MA Ying, JIAO Yang, SONG Youkun, LIU Shuye, ZHU Yu
- 基于网络药理学和分子对接的宣肺败毒方治疗急性呼吸窘迫综合征的机制及验证研究
- Mechanism and confirmatory study of Xuanfei Baidu Decoction on treating ARDS based on network pharmacology and molecular docking
- 天津中医药大学学报, 2024, 43(4): 292-301
- Journal of Tianjin University of Traditional Chinese Medicine, 2024, 43(4): 292-301
- http://dx.doi.org/10.11656/j.issn.1673-9043.2024.04.02
-
文章历史
收稿日期: 2023-12-12
2. 天津医科大学药学院, 天津 300070;
3. 天津中医药大学第一附属医院药学部, 国家中医针灸临床医学研究中心, 天津 300193;
4. 天津市第三中心医院检验科, 天津市重症疾病体外生命支持重点实验室, 天津市人工细胞工程技术研究中心, 天津市肝胆研究所, 天津 300170
2. School of Pharmacy, Tianjin Medical University, Tianjin 300070, China;
3. Department of Pharmacy, First Teaching Hospital of Tianjin University of Traditional Chinese Medicine, National Clinical Research Center for Chinese Medicine Acupuncture and Moxibustion, Tianjin 300193, China;
4. Department of Clinical Laboratory, The Third Central Hospital of Tianjin, Tianjin Key Laboratory of Extracorporeal Life Support for Critical Diseases, Artificial Cell Engineering Technology Research Center, Tianjin Institute of Hepatobiliary Disease, Tianjin 300170, China
急性呼吸窘迫综合征(ARDS)是一种由肺内或肺外因素引起的,以非心源性肺水肿造成的顽固性低氧血症为显著特征的异质性临床综合征,一般起病急且发生双肺浸润性改变[1]。ARDS的病理变化主要包括渗出期、增生期和纤维化期3个阶段,其本质是多种炎症细胞及其释放的炎症介质和细胞因子介导的肺部炎症损伤,主要发病机制为炎症反应失调和肺泡毛细血管内皮屏障受损,进而引起肺组织炎症和纤维样坏死[2]。ARDS严重危害人类生命,2020年美国有近30 000名患者被诊断为ARDS,约占重症监护病房收治人数的10%及接受机械通气治疗患者的24%,病死率高达35%~46%[3]。
目前,ARDS的治疗方法仍以减少肺应激、肺损伤和改善心肺功能等为主,但上述疗法仅能起到缓解症状的作用,且应用糖皮质激素具有一定不良反应[4]。作用已经被多年临床实践所证实,中药抗炎具有靶点众多、资源丰富、毒副作用较小等优势[5]。ARDS符合中医“暴喘”“喘脱”等范畴,多个研究证实中药可以通过调节细胞因子网络、抗氧化、抗炎症等多种途径对ARDS发挥治疗作用[6]。宣肺败毒方是在麻杏石甘汤、麻杏薏甘汤、葶苈大枣泻肺汤、千金苇茎汤等经典名方基础上凝练而来,由麻黄、苦杏仁、青蒿草、虎杖、马鞭草、葶苈子、甘草、苍术等13味中药配伍而成,具有宣肺化湿、清热透邪、泻肺解毒等功效,对缓解ARDS患者临床症状和改善预后具有确切效果[7]。本研究拟通过网络药理学技术分析其活性成分与靶点的相互作用,对明确宣肺败毒方治疗ARDS的机制与开发该方新的临床适应症具有重要意义。
1 材料和方法 1.1 主要材料宣肺败毒颗粒购自山东步长制药股份有限公司(国药准字C20210003),BALB/c小鼠购自北京华阜康生物科技有限公司[许可证号:SCXK(京)2019-0008],细胞因子联合检测试剂盒购自美国BD公司,丙二醛(MDA)、超氧化物歧化酶(SOD)、谷胱甘肽(GSH)含量试剂盒均购自北京索莱宝科技有限公司,GSH过氧化物酶4(GPX4)含量试剂盒购自武汉伊莱瑞特生物科技股份有限公司,FACSCantoⅡ流式细胞仪购自美国BD公司,酶标仪购自美国Thermo Fisher Scientific公司。
1.2 活性成分、靶点筛选及相互作用网络的构建通过中药系统药理学数据库和分析平台(TCMSP,http://tcmspw.com),以“麻黄”“苍术”“藿香”“青蒿”“虎杖”“马鞭草”“薏苡仁”“芦根”“葶苈子”“苦杏仁”“化橘红”“甘草”为关键词,筛选条件设定为药物相似性(DL)≥0.18及口服生物利用度(OB)≥30%。获取活性成分和靶点信息后,通过Genecards数据库(www.genecards.org)、SwissTargetPrediction数据库(www.swisstargetprediction.ch)、蛋白质数据库(https://www.uniprot.org)进行靶点匹配,通过Cytoscape 3.8.0软件构建宣肺败毒方“活性成分-靶点”相互作用网络图。将上述靶点通过STRING数据库(https://www.string-db.org/)筛选物种为人类且评分≥0.7的度值排名前10位的靶点,通过Cytoscape 3.8.0软件构建靶点间蛋白相互作用分析图(PPI)。
1.3 靶点功能分析选取度值>中位数的靶点导入DAVID数据库(https://david.ncifcrf.gov/),设定物种为人。通过基因本体(GO)功能分析宣肺败毒方活性成分治疗ARDS靶点涉及的生物过程(BP)、分子功能(MF)和细胞组分(CC)。通过京都基因与基因组百科全书(KEGG)通路富集分析上述靶点涉及的信号通路。
1.4 活性成分-靶点分子对接运用ChemDraw 22.0.0软件绘制活性成分结构,通过PDB数据库(http://www.wwpdb.org/)下载靶点蛋白Jun(PDB ID:1A02)、白细胞介素(IL)-6(PDB ID:4O9H)、TP53(PDB ID:6SIQ)、蛋白激酶B1(AKT1,PDB ID:2UZV)、白蛋白(ALB,PDB ID:4LA0)、血管内皮生长因子A(VEGFA,PDB ID:62BR)、信号转导和转录激活因子3(STAT3,PDB ID:6NJS)、CASP3(PDB ID:3DEH)、IL-1β(PDB ID:6Y8M)和前列腺素内过氧化物合酶2(PTGS2,PDB ID:3NT1)的3D结构,导入Schrödinger软件(2023版)蛋白准备模块处理蛋白结构,将下载的靶点晶体结构导入,参数设定为Assign bond orders(修正化学键)、Add hydrogens(加氢)、Treat metals(处理金属离子)、Cap termini by adding ACE & NMA residues(修正N端和C端残疾结构错误),使N端和C端的氨基酸残基呈中性,去除结构中的水分子和杂原子。选择OPLS_2005立场优化蛋白质结构,以Samplewaterorientations为参数来优化氢键,收敛标准为RMSD0.5Å。利用薛定谔软件中的Glide(对接)模块进行药物和蛋白对接,选择Receptor grid generation(受体盒子产生),以原始配体为盒子中心,自动生成受体盒子文件,采用标准精度的柔性对接,获得对接情况及最低结合能。配体与受体的结合能越低,其结合构象越稳定。中外文献均表明,Schrödinger软件计算出的分子结合自由能<0 kJ/mol认为化合物和靶蛋白可以自发结合,≤-20.92 kJ/mol(-5 kcal/mol)认为其具有较好的结合活性,≤-29.29 kJ/mol(-7 kcal/mol)认为具有较为强烈的结合活性[8-10]。
1.5 ARDS小鼠模型构建及给药采用4~6周龄雌性BALB/c小鼠,体质量21~25 g,于实验前适应性饲养1周,饲养温度25 ℃,湿度60%,自由饮食,所有行为学实验操作步骤均严格参照动物伦理协会指导原则进行。采用100 g/L水合氯醛对小鼠进行腹腔注射(4 mL/kg),麻醉后仰位于45 °平板,将脂多糖(LPS,500 μg/kg)滴于小鼠咽后壁,放于笼中使其自然苏醒,构建ARDS小鼠模型。
参考宣肺败毒方的常用剂量[119 g/(60 kg×1剂)]及“人和动物间体表面积折算的等效剂量比率表”,计算出小鼠的等效剂量为[17 g/(1 kg×1剂)],设置低剂量组(17 g/kg)和高剂量组(68 g/kg),小鼠灌胃给予相应剂量的宣肺败毒方。LPS造模1 d后,连续灌胃宣肺败毒方28 d,后对小鼠进行解剖,开展后续实验,对照组为生理盐水灌胃。
1.6 流式细胞及酶联免疫吸附(ELISA)实验取小鼠肺泡灌洗液,4 ℃条件下12 000 r/min离心10 min(离心半径8.6 cm),取上清,按照细胞因子联合检测试剂盒方法处理后,采用流式细胞术分析肺泡灌洗液中IL-2、IL-4、IL-6、IL-10、肿瘤坏死因子(TNF)-α和干扰素(IFN)-γ。取小鼠肺组织,按照试剂盒说明书方法通过酶标仪检测肺组织中GSH、MDA、SOD和GPX4含量。
1.7 统计学分析采用SPSS 21.0统计软件进行统计学分析。计量资料以均数±标准差(x±s)表示,组间比较采用单因素方差分析,组间多重比较采用LSD-t检验。P<0.05为差异具有统计学意义。
2 结果 2.1 宣肺败毒方成分筛选通过TCMSP数据库以OB≥30%且DL≥0.18条件检索苍术、甘草、藿香、虎杖、化橘红、苦杏仁、芦根、麻黄、马鞭草、青蒿、葶苈子、薏苡仁中的化合物,剔除缺少靶点预测数据的化合物,筛选出活性化合物205个,其中4个来自苍术、88个来自甘草、9个来自藿香、10个来自虎杖、7个来自化橘红、16个来自苦杏仁、1个来自芦根、22个来自麻黄、11个来自马鞭草、19个来自青蒿、12个来自葶苈子、6个来自薏苡仁,具体见开放科学(资源服务)标识码(OSID)。根据上述成分数据绘制成分网络图,度值排名前8位的化合物分别是槲皮素、山柰酚、β-谷甾醇、豆甾醇、木犀草素、异鼠李素、柚皮苷和光甘草定。见表 1及图 1。
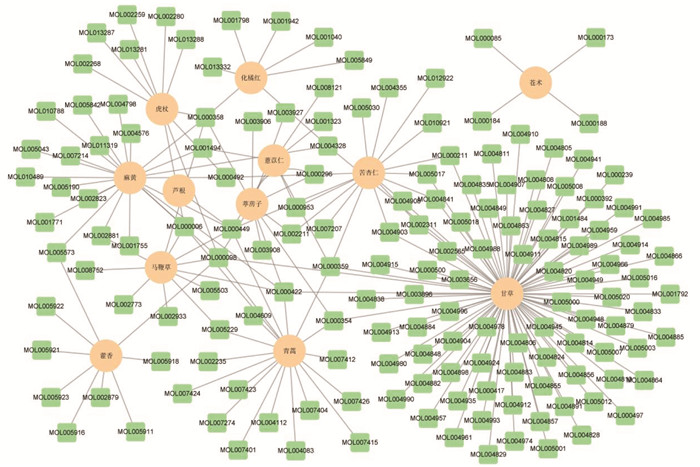
|
| 图 1 宣肺败毒方药物成分网络图 |
通过Uniprot、SwissTargetPrediction、GeneCards数据库进行ARDS相关靶点预测,剔除重复靶点后得到成分靶点325个,疾病靶点958个。由药物成分-靶点网络可见本方中存在1个化合物与多个靶点相互作用以及不同化合物共同作用于同一个靶点的现象,体现了中药多成分与多靶点之间的共同作用,见OSID。采用Venn分析将成分靶点与疾病靶点取交集,获得核心靶点107个,作为宣肺败毒方治疗ARDS的潜在靶点并绘制PPI网络图(图 2A),并选取度值排名前10位的交集靶点Jun、IL-6、TP53、AKT1、ALB、VEGFA、STAT3、CASP3、IL-1β和PTGS2绘制PPI网络图(图 2B)。宣肺败毒方与ARDS的交集靶点见OSID。
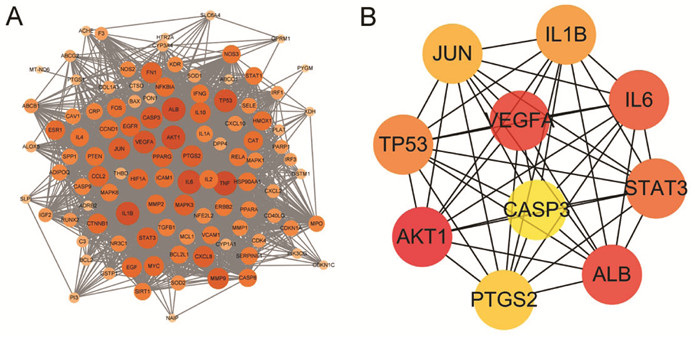
|
| 注:A.全部交集靶点的PPI网络;B.度值排名前10位的交集靶点PPI网络。 图 2 宣肺败毒方与ARDS交集靶点的PPI网络图 |
将宣肺败毒方的靶点通过GO富集分析得到GO条目(P<0.05)416个,包括生物过程(BP)342个、细胞成分(CC)22个、分子功能(MF)52个,根据P值进行排序,每个模块选取排名前10位的条目。富集分析结果表明,生物学过程涉及基因表达的正性调控(positive regulation of gene expression)、源于RNA聚合酶Ⅱ启动子的pri-miRNA的转录正性调控(positive regulation of pri-miRNA transcription from RNA polymerase Ⅱ promoter)、细胞凋亡的负性调控(negative regulation of apoptotic process)、药物反应(response of drug)、细胞凋亡的正性调控(positive regulation of apoptotic process)、细胞因子活性(cytokine activity)等(图 3A)。细胞成分涉及大分子复合物(macromolecular complex)、线粒体(mitochondria)、胞外区(extracellular region)、转录因子复合物(transcription factor complex)、核质(nucleoplasm)、RNA聚合酶Ⅱ转录因子复合物(RNA polymerase Ⅱtranscription factor complex)等(图 3B)。分子功能主要包括酶结合(enzyme binding)、转录因子结合(transcription factor binding)、相同蛋白结合(identical protein binding)、蛋白磷酸酶结合(protein phosphatase binding)、RNA聚合酶Ⅱ序列特异性DNA结合转录因子结合(RNA polymerase Ⅱ sequence-specific DNA binding transcription factor binding)等(图 3C)。KEGG通路富集分析共得到138条通路,根据P值排序选取前20位信号通路,涉及IL-7信号通路(IL-7 signaling pathway)、TNF信号通路(TNF signaling pathway)和Toll样受体信号通路(Toll-like receptor signaling pathway)等炎性反应相关信号通路(图 3D)。
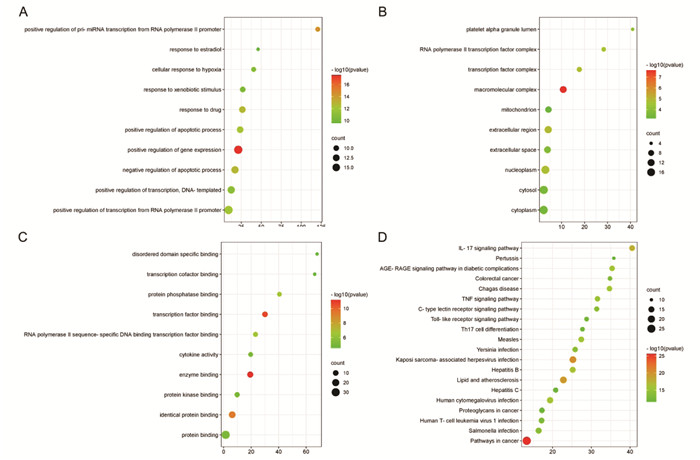
|
| 注:A.生物过程分析;B.细胞成分分析;C.分子功能分析;D.KEGG分析。 图 3 宣肺败毒方作用靶点GO分析 |
运用薛定谔软件,将本方中度值排在前8位的化合物槲皮素、山柰酚、β-谷甾醇、豆甾醇、木犀草素、异鼠李素、柚皮苷和光甘草定与度值排名前10位的交集靶点进行分子对接。结合能越低提示结合的构象越稳定,从图 4可以看到上述化合物同铁死亡相关蛋白蛋白激酶B(AKT)、TP53、ALB、Jun和PTGS2具有强烈或较好的结合活性,提示铁死亡抑制可能是宣肺败毒方治疗ARDS的重要机制。而豆甾醇的结合力均为0 kJ/mol,提示可能存在其他作用机制。根据上述结果,本研究选取目标化合物与交集靶点蛋白结合能≤-20.92 kJ/mol的组合进行可视化(图 5)。本研究中选取的ALB、VEGFA、Jun和IL-6靶点晶体结构采用无原配体同源模建方法建立,而AKT、CASP3、PTGS2、STAT3、TP53和IL-1β靶点晶体结构原配体及Schrödinger软件对接计算的结合自由能分别是(2S)-1-[3-(环己基甲氧基)苯基]-3-[5-(3-甲基-1H-吲唑-5-基)吡啶-3-基]氧基-2-丙胺:-49.93 kJ/mol、异喹啉-1,3,4(2H)-三酮:-24.94 kJ/mol、(2S)-2-(6-甲氧基萘)-2-丙酸:-32.30 kJ/mol、SD-36:-3.24 kJ/mol、4-氯-7-丙烷-2-基氧基-1-苯并噻吩-2-甲脒:-39.85 kJ/mol和4-[(5-溴吡啶-2-基)氨基]-4-氧代丁酸:-24.37 kJ/mol,关键成分与CASP3、PTGS2、STAT3、TP53和IL-1β的结合自由能优于或接近原配体。
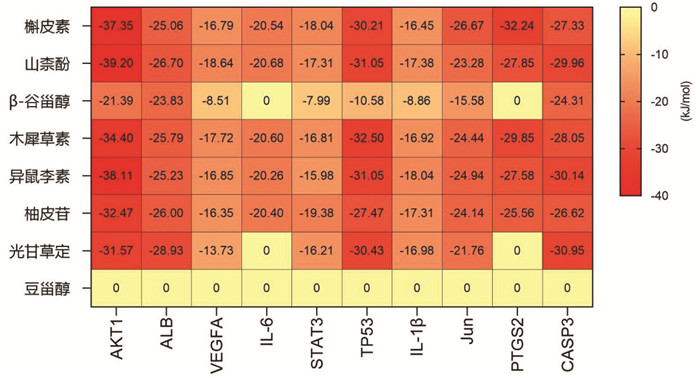
|
| 图 4 宣肺败毒方活性成分与靶点结合能的热图分析 |

|
| 注:A.丙氨酸;C.半胱氨酸;D.天冬氨酸;E.谷氨酸;F.苯丙氨酸;G.甘氨酸;I.异亮氨酸;K.赖氨酸;L.亮氨酸;M.甲硫氨酸;N.天冬酰胺;P.脯氨酸;Q.谷氨酸;R.精氨酸;S.丝氨酸;T.苏氨酸;V.缬氨酸;W.色氨酸;Y.酪氨酸。 图 5 宣肺败毒方活性成分与靶点蛋白对接结果 |
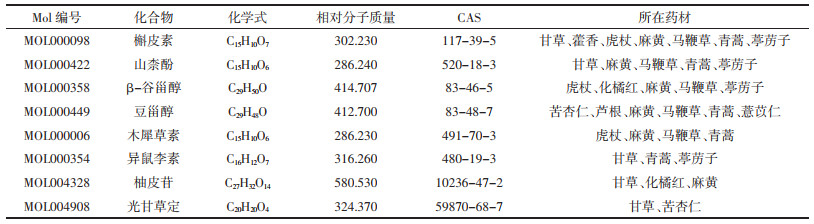
对小鼠灌胃宣肺败毒方28 d后,取肺泡灌洗液采用流式细胞术观察小鼠肺部炎症因子水平变化,结果表明宣肺败毒方可以降低LPS诱发的炎症因子异常升高。见表 2。
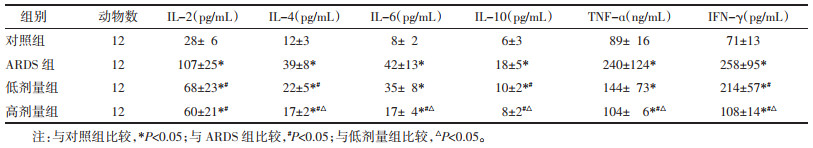
网络药理学分析提示宣肺败毒方能够抑制铁死亡。GPX4是铁死亡的重要特异性标志物,氧化还原系统失衡是导致铁死亡的重要原因。为验证宣肺败毒方抑制铁死亡的假设,对小鼠灌胃宣肺败毒方28 d后,观察小鼠肺组织GSH、MDA、SOD和GPX4变化,结果表明宣肺败毒方可以缓解LPS诱发的氧化还原失衡。见表 3。
ARDS造成的病理损伤主要是由于各种因素引起肺部广泛炎症改变,导致肺部肺泡和小血管的通透性与敏感性异常升高,主要包含肺水肿、肺部顺应性降低、肺部气体交换能力减弱等。目前针对ARDS的治疗方法以应用糖皮质激素为主,但存在不良反应较多等缺点。古籍中有与ARDS临床表现的相似记载,如《中藏经》中“不病而暴喘促死者”、《黄帝内经》中“故肺病者,喘息鼻张”,而现代中医认为ARDS的发病与外邪侵袭或他脏传变有关[11-12]。宣肺败毒方具有宣肺、降气、清热利湿之效,许多成分均有治疗ARDS的作用。
本研究通过网络药理学技术对宣肺败毒方进行活性成分和靶点筛选分析,发现度值排名前8位的活性成分分别为山柰酚、柚皮苷、光甘草定、豆甾醇、异鼠李素、槲皮素、β-谷甾醇、木犀草素,提示这8种成分可能是宣肺败毒方治疗ARDS的关键作用物质。炎症因子在ARDS炎症性损伤的形成及发展过程中扮演重要角色。ARDS可以导致炎症细胞活化并释放细胞因子,进一步促进黏附分子和白细胞的聚集与迁移,造成血管通透性增大及毛细血管内皮细胞屏障破坏,TNF-α和IL-1β、IL-6等细胞因子可以通过氧化应激促进肺水肿,并对肺脏进行持续损伤,最终导致呼吸系统衰竭[13-14]。豆甾醇和β-谷甾醇是一种植物性甾醇,具有抗炎、抗氧化、调节免疫等作用,可以通过增强SOD活性、抑制炎性因子的释放与聚集等途径发挥黏膜保护作用。山柰酚、柚皮苷、光甘草定、异鼠李素、木犀草素和槲皮素均属于黄酮类化合物,与TNF-α和IL-1β、IL-6等细胞因子具有较强的结合能力与抑制活性,可以通过抑制丝裂原活化蛋白激酶(MAPK)和STAT3等信号通路抑制中性粒细胞聚集在炎性反应的位置,减轻炎症反应,并缓解氧化损伤[15-22]。
宣肺败毒方治疗ARDS度值排名前10位的交集靶点为Jun、IL-6、TP53、AKT1、ALB、VEGFA、STAT3、CASP3、IL-1β和PTGS2。Jun是AP-1转录因子家族的主要成员,受AKT1调控后可以减少过氧化物酶体的数量,导致毛细血管的通透性增强,并促进炎症介质释放[23]。IL-1β、IL-6可以诱导STAT3活化,STAT3激活后可以增强辅助性T细胞17(Th17细胞)分化和炎症细胞募集,促进细胞因子释放[24-25]。TP53和CASP3可以诱导细胞凋亡,造成气道组织损伤,VEGFA在维持肺泡结构完整及肺损伤后的修复方面具有重要作用[26-27]。PTSG2可以上调核转录因子-κB(NF-κB)的表达,发挥促炎作用[28]。Toll样受体在气道免疫应答、炎症调控等过程中发挥重要作用。Toll样受体通路可以激活固有免疫应答并通过IL-7等信号通路调控适应性免疫系统,其异常活化可以诱发宿主产生过激的炎症反应,从而引发“细胞因子风暴”出现ARDS症状[29-30]。生物信息学分析结果也证实,宣肺败毒方不仅可以通过抗氧化应激作用缓解ARDS症状,还可以通过调控TNF、Toll样受体和IL-7等信号通路,减少血管损伤和细胞因子分泌,抑制细胞凋亡和炎症细胞募集浸润。为了验证网络药理学对宣肺败毒方靶点的分析结果,本研究通过小鼠实验发现宣肺败毒方可以降低ARDS小鼠肺泡灌洗液中IL-2、IL-4、IL-6、IL-10、TNF-ɑ和IFN-γ含量,证实了网络药理学对宣肺败毒方炎症因子靶点的预测。
分子对接结果显示宣肺败毒方的活性成分山柰酚、柚皮苷、光甘草定、异鼠李素、槲皮素、β-谷甾醇、木犀草素与靶点具有较好的结合能力,其中AKT、TP53、ALB、Jun、CASP3和PTGS2靶点与配体活性分子结合效果最好,结合能均小于-20.92 kJ/moL,豆甾醇与配体活性分子的结合力均为0 kJ/mol,可能因为其抗炎活性与上述靶点的关联性不强。铁死亡是一种新发现的细胞程序性死亡形式,其主要特征为脂质过氧化(MDA含量增加和SOD失活)、GSH含量减少和GPX4失活,主要由铁介导的氧化损伤、脂质过氧化和细胞膜损伤驱动,与炎症表现关系密切[31]。铁死亡能够激活固有免疫系统,调控炎症信号通路,释放细胞因子,进而造成炎性损伤[32]。中药干预铁死亡的研究较少,有研究通过网络药理学技术筛选出青蒿素等天然产物可以调节铁相关基因[33]。本研究通过网络药理学分析得到的宣肺败毒方靶点AKT、TP53、ALB、Jun和PTGS2均是铁死亡相关蛋白,GPX4是铁死亡的重要特异性标志物[34]。本研究通过小鼠实验发现宣肺败毒方可以降低ARDS小鼠肺组织中MDA含量,上调GSH含量及SOD、GPX4活性,提示宣肺败毒方治疗ARDS的作用机制可能与干预铁死亡途径有关,验证了宣肺败毒方抑制铁死亡的假设。
4 结论本研究采用网络药理学方法发现宣肺败毒方治疗ARDS的机制与缓解氧化损伤与细胞凋亡、调控炎症信号通路、减少炎症细胞募集浸润和细胞因子分泌有关。既往宣肺败毒方的网络药理学研究多关注于新型冠状病毒感染的治疗机制及新型冠状病毒的3CL蛋白酶与血管紧张素转化酶Ⅱ(ACE2)的相关靶点对接,对ARDS等其他呼吸系统疾病的治疗机制及靶点缺乏深入研究[35-36]。本研究通过分子对接技术不仅模拟了宣肺败毒方的活性成分与ARDS相关靶点的结合情况,还发现宣肺败毒方可以干预铁死亡途径,显示了中药治疗机制多途径、多靶点的特点,为宣肺败毒方的临床应用提供了理论依据。
| [1] |
XU Y H, XI Y, CAI S J, et al. Venovenous extracorporeal membrane oxygenation for COVID-19 and influenza H1N1 associated acute respiratory distress syndrome: a comparative cohort study in China[J]. Journal of Intensive Medicine, 2023, 3(4): 326-334. DOI:10.1016/j.jointm.2023.07.003 |
| [2] |
YUAN X, ZHAO Z, CHAO Y, et al. Effects of early versus delayed application of prone position on ventilation-perfusion mismatch in patients with acute respiratory distress syndrome: a prospective observational study[J]. Crit Care, 2023, 27(1): 462. DOI:10.1186/s13054-023-04749-3 |
| [3] |
PARCHA V, KALRA R, BHATT S P, et al. Trends and geographic variation in acute respiratory failure and ARDS mortality in the United States[J]. Chest, 2021, 159(4): 1460-1472. DOI:10.1016/j.chest.2020.10.042 |
| [4] |
NIEMAN G F, KACZKA D W, ANDREWS P L, et al. First stabilize and then gradually recruit: a paradigm shift in protective mechanical ventilation for acute lung injury[J]. Journal of Clinical Medicine, 2023, 12(14): 4633. DOI:10.3390/jcm12144633 |
| [5] |
QIN X, WU Y L, ZHAO Y, et al. Revealing active constituents within traditional Chinese Medicine used for treating bacterial pneumonia, with emphasis on the mechanism of baicalein against multi-drug resistant Klebsiella pneumoniae[J]. Journal of Ethnopharmacology, 2024, 321(10): 117-128. |
| [6] |
AN Y, ZHANG H, WANG R, et al. Biomarkers, signaling pathways, and programmed cell death in acute lung injury and its treatment with traditional Chinese medicine: a narrative review[J]. European Review for Medical and Pharmacological Sciences, 2023, 27(21): 10157-10170. |
| [7] |
WANG X R, ZHANG J Z, LUO L F, et al. Comparative pharmacokinetics of 24 major bioactive components in normal and ARDS rats after oral administration of Xuanfei Baidu Granules[J]. Journal of Ethnopharmacology, 2022, 296(13): 115-122. |
| [8] |
田文国, 陈金鹏, 王春芳, 等. 基于网络药理学和分子对接探究肠炎宁颗粒治疗功能性腹泻和腹泻型肠易激综合征的作用机制[J]. 中草药, 2022, 53(22): 7135-7147. |
| [9] |
曹梦珍, 赵旭, 郑艳芳, 等. 基于分子对接与实验验证的板蓝根及其活性成分抗乙型肝炎病毒作用机制研究[J]. 中草药, 2023, 54(7): 2127-2134. |
| [10] |
MAGARÒG, PRATI F, GAROFALO B, et al. Virtual screening approach and investigation of structure-activity relationships to discover novel bacterial topoisomerase inhibitors targeting gram-positive and gram-negative pathogens[J]. Journal of Medicinal Chemistry, 2019, 62(16): 7445-7472. DOI:10.1021/acs.jmedchem.9b00394 |
| [11] |
PENG W J, QI H, ZHU W S, et al. Lianhua Qingke ameliorates lipopolysaccharide-induced lung injury by inhibiting neutrophil extracellular traps formation and pyroptosis[J]. Pulmonary Circulation, 2023, 13(4): 122-135. |
| [12] |
黄承军, 徐宇, 秘乐, 等. 细胞自噬在急性呼吸窘迫综合征中的研究进展[J]. 天津医药, 2023, 51(6): 668-672. |
| [13] |
徐平, 何亚荣, 曹钰. 急性呼吸窘迫综合征肺毛细血管内皮细胞损伤的生物标志物研究进展[J]. 中华急诊医学杂志, 2022, 31(4): 564-567. DOI:10.3760/cma.j.issn.1671-0282.2022.04.026 |
| [14] |
甘志新, 贺斌峰, 徐剑铖, 等. 基于两种因子同步检测方法探讨TNF-α及IL-6在预测ARDS发生中的作用[J]. 第三军医大学学报, 2020, 42(5): 493-498. |
| [15] |
ÖNAL H, ARSLAN B, ÜÇÜNCÜ E N, et al. Treatment of COVID-19 patients with quercetin: a prospective, single center, randomized, controlled trial[J]. Turk Biyoloji Dergisi, 2021, 45(4): 518-529. |
| [16] |
QIAN J C, CHEN X M, CHEN X J, et al. Kaempferol reduces K63-linked polyubiquitination to inhibit nuclear factor-κB and inflammatory responses in acute lung injury in mice[J]. Toxicology Letters, 2019, 306(2): 53-60. |
| [17] |
LIU W J, YUAN L, CHE M Y, et al. Exploring the mechanism of Dahuang-Tusizi drug pair in the treatment of diabetes nephropathy based on network pharmacology and immune infiltration analysis[J]. Medicine, 2023, 102(47): 3619-3626. |
| [18] |
HOU Y P, LI J, DING Y, et al. Luteolin attenuates lipopolysaccharide-induced acute lung injury/acute respiratory distress syndrome by activating alveolar epithelial sodium channels via cGMP/PI3K pathway[J]. Journal of Ethno-pharmacology, 2022, 282(15): 1146-1154. |
| [19] |
ZHANG M, ZHANG X K, PEI J, et al. Identification of phytochemical compounds of Fagopyrum dibotrys and their targets by metabolomics, network pharmacology and molecular docking studies[J]. Heliyon, 2023, 9(3): 129-140. |
| [20] |
AMELIMOJARAD M, AMELIMOJARAD M. Interleukin-6 inhibitory effect of natural product naringenin compared to a synthesised monoclonal antibody against life-threatening COVID-19[J]. Reviews in Medical Virology, 2023, 33(4): 244-255. |
| [21] |
IBRAHIM R M, ABDEL-BAKI P M, ELMASRY G F, et al. Combinative effects of akarkara root-derived metabolites on anti-inflammatory and anti-alzheimer key enzymes: integrating bioassay-guided fractionation, GC-MS analysis, and in silico studies[J]. BMC Complementary Medicine and Therapies, 2023, 23(1): 413. DOI:10.1186/s12906-023-04210-6 |
| [22] |
WU J S, LAN Y J, WU J H, et al. Sepsis-induced acute lung injury is alleviated by small molecules from dietary plants via pyroptosis modulation[J]. Journal of Agricultural and Food Chemistry, 2023, 71(32): 12153-12166. DOI:10.1021/acs.jafc.2c08926 |
| [23] |
AN L L, ZHAO J X, SUN X, et al. S-allylmercaptocysteine inhibits mucin overexpression and inflammation via MAPKs and PI3K-Akt signaling pathways in acute respiratory distress syndrome[J]. Pharmacological Research, 2020, 159(14): 1050-1063. |
| [24] |
KHOKHAR M, TOMO S, PUROHIT P. MicroRNAs based regulation of cytokine regulating immune expressed genes and their transcription factors in COVID-19[J]. Meta Gene, 2022, 31(7): 100-109. |
| [25] |
CAI M S, YE H H, ZHU X Y, et al. Fibroblast growth factor 21 relieves lipopolysaccharide-induced acute lung injury by suppressing JAK2/STAT3 signaling pathway[J]. Inflammation, 2024, 47(1): 209-226. DOI:10.1007/s10753-023-01905-3 |
| [26] |
HERRINGTON C S, POULSOM R, COATES P J. Recent advances in pathology: the 2019 annual review issue of the journal of pathology[J]. The Journal of Pathology, 2019, 247(5): 535-538. DOI:10.1002/path.5255 |
| [27] |
JOSUTTIS D, SCHWEDLER C, HEYMANN G, et al. Vascular endothelial growth factor as potential biomarker for COVID-19 severity[J]. Journal of Intensive Care Medicine, 2023, 38(12): 1165-1173. |
| [28] |
CASSIMERIS L, ENGILES J B, GALANTINO-HOMER H. Interleukin-17A pathway target genes are upregulated in Equus caballus supporting limb laminitis[J]. PLoS One, 2020, 15(12): 232-239. |
| [29] |
盛雅琪, 朱华栋. Toll样受体与肺部感染的研究进展[J]. 中国医师杂志, 2022, 24(3): 473-476. |
| [30] |
蒋云飞, 孙昊, 张劲松, 等. Toll样受体3在呼吸系统疾病中的研究进展[J]. 中华急诊医学杂志, 2021, 30(9): 1161-1164. |
| [31] |
LIU H X, YAN L H, NIU H Y, et al. Effects of glutathione tablets on ferroptosis pathway and oxidative stress-related indexes in serum of patients undergoing sevoflurane inhalation general anesthesia and its clinical significance[J]. Alternative Therapies in Health and Medicine, 2023, 18(11): 964-974. |
| [32] |
LI Y, WANG T, SUN P, et al. Farrerol alleviates hypoxic-ischemic encephalopathy by inhibiting ferroptosis in neonatal rats via the Nrf2 pathway[J]. Physiological Research, 2023, 72(4): 511-520. |
| [33] |
龚卓之, 曹增, 姚梦茜, 等. 从铁死亡探讨溃疡性结肠炎不同时期的发病机制及相关天然药物筛选[J]. 中草药, 2023, 54(7): 2187-2196. |
| [34] |
XIE J H, LIU M X, GAO Y T, et al. Integration of metabolomics and network pharmacology to reveal the protective mechanism underlying Qibai Pingfei capsule on chronic obstructive pulmonary disease[J]. Frontiers in Pharmacology, 2023, 14(15): 1258-1268. |
| [35] |
王毅, 李翔, 张俊华, 等. 基于网络药理学的宣肺败毒汤治疗新型冠状病毒肺炎机制研究[J]. 中国中药杂志, 2020, 45(10): 2249-2256. |
| [36] |
薛岳进, 屈彬, 邵瑞, 等. 基于网络药理学分析宣肺败毒方治疗SARS、MERS和COVID-19的作用机制[J]. 现代药物与临床, 2021, 36(12): 2473-2487. |
 2024, Vol. 43
2024, Vol. 43