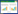文章信息
- 杜紫菲, 史鑫蕊, 袁晓艺, 王冰钰, 王勇
- DU Zifei, SHI Xinrui, YUAN Xiaoyi, WANG Bingyu, WANG Yong
- 基于NF-κB通路探讨温经汤合琥珀散对寒凝血瘀型子宫内膜异位症大鼠的影响
- Investigating the effects of Wenjing Decoction combined with Hupo Powder on cold-congealed blood stasis in endometriosis rats, using the NF-κB pathway
- 天津中医药大学学报, 2024, 43(4): 313-320
- Journal of Tianjin University of Traditional Chinese Medicine, 2024, 43(4): 313-320
- http://dx.doi.org/10.11656/j.issn.1673-9043.2024.04.05
-
文章历史
收稿日期: 2023-12-01
子宫内膜异位症(EMs)是一种子宫内膜的腺体和基质生长在宫腔外的妇科炎症性疾病。据统计,世界范围内约有1.76亿育龄期女性患有EMs[1],EMs虽然大多是良性肿瘤,但却有增生、浸润、转移等恶性行为,并且具有复发率高的特点。美国生殖医学会于2012年指出,EMs与不孕关系密切,25%~50%的不孕患者患有EMs,30%~50%的EMs患者合并不孕[2]。EMs的发病机制尚不明确,明确其机制并寻找能够缓解临床症状且安全有效的治疗药物是当前研究的重点。
温经汤出自《金匮要略·妇人杂病脉证并治》,为张仲景调经之祖方,是治疗“瘀血在少腹不去”之要剂。前期临床研究证实,温经汤可以有效改善EMs患者痛经等症状,缩小异位囊肿[3]。琥珀散载于《普济本事方》,具有化瘀止痛的功效,活血行气之力较强,临床治疗EMs取得了良好的疗效[4]。实验研究发现,温经汤与琥珀散均能够通过减轻炎症反应,降低肿瘤坏死因子和促炎因子表达等,从而达到缓解EMs病灶增生、浸润、转移等行为的治疗效果[5]。王勇教授认为温经汤并非以攻瘀为主,重点在温阳通脉、通补兼施。而琥珀散行气破血、攻瘀止痛之力彰,温阳散寒功效不及温经汤。临床经验证实,两方合用对于治疗寒凝血瘀型EMs效果更佳,故本研究选用温经汤合琥珀散作为干预用药。
EMs具有同肿瘤相似的恶性生物学行为,如浸润、侵袭、种植复发率高等。有大量研究表明核转录因子-κB(NF-κB)通路参与并促进了肿瘤的发生、转移及侵袭过程[6]。NF-κB是一个转录因子家族的通用名称,其功能是作为二聚体,调节与免疫、炎症和细胞存活有关的基因。临床上EMs患者处于分泌晚期时,NF-κB通路被发现在内膜表达出现异常调控[7],提示在EMs的发生、发展过程中,NF-κB信号通路的参与可能是重要原因。因此,本研究拟从NF-κB信号通路角度探究温经汤合琥珀散对寒凝血瘀型EMs模型大鼠的潜在作用机制,为其临床疗效提供基础实验依据。
1 材料 1.1 动物60只无特定病原体(SPF)级雌性未孕SD大鼠,体质量(235±15) g,8周龄,购自斯贝福(北京)生物技术有限公司,动物生产许可证号:SCXK(京)2019-0010。动物于广州中医药大学动物实验中心饲养,实验伦理审查批准号:20220414001。
1.2 药物温经汤合琥珀散,参考全国高等中医药院校规划教材《金匮要略》(第十一版)及中国医药科技出版社出版的《普济本事方》,方药组成:吴茱萸5 g,党参15 g,麦冬20 g,制半夏10 g,炙甘草10 g,桂枝10 g,白芍10 g,当归10 g,川芎10 g,牡丹皮10 g,阿胶6 g,生姜15 g,大枣30 g,三棱6 g,莪术6 g,乌药6 g,延胡索10 g,刘寄奴10 g,琥珀6 g,中药购自广州医科大学附属中医医院。孕三烯酮(华润紫竹药业,国药准字H19980020),盐酸肾上腺素(上海全宇生物科技动物药业有限公司,批号:163231220),苯甲酸雌二醇(宁波第二激素厂,批号:181214)。
1.3 试剂大鼠白细胞介素-1β(IL-1β)酶联免疫吸附(ELISA)试剂盒、大鼠肿瘤坏死因子-α(TNF-α)ELISA试剂盒购自Elabscience公司,批号分别为E-EL-R0012c、E-EL-R2856c;兔NF-κB p65(NF-κB p65)(D14E12)抗体、兔NF-κB抑制蛋白α(IkBα)(Ser32 14D4)抗体、兔NF-κB激酶亚基β抑制因子(IKKβ)(D30C6)抗体、兔甘油醛-3-磷酸脱氢酶(GAPDH)均购自美国CST公司,批号分别为#8242、#2859、#8943、#5174;二抗购自SAB公司,批号为L35193。
1.4 仪器5810R型高速低温离心机(德国Eppenndorf Centrifuge公司),Multi Skan3酶标仪(上海科华有限责任公司),Power PacTM Basic型垂直电泳仪(美国Bio-Rad公司),CRYOSTAR NX50型冰冻切片机(美国Thermo公司),ChemiDoc MP化学发光凝胶成像仪(美国Bio-Rad公司)。
2 方法 2.1 分组8周龄大鼠适应性饲养1周后,将所有大鼠按照随机数字表法随机分为假手术组、模型组、孕三烯酮组、温经汤合琥珀散组,其中假手术组、模型组、孕三烯酮组各10只,温经汤合琥珀散组30只。假手术组10只大鼠仅进行开腹而不进行手术,其余50只复制寒凝血瘀EMs模型,分为两步进行造模,采用“自体内膜移植术+冰水浴”,随机分为模型组、孕三烯酮组与温经汤合琥珀散低、中、高剂量组,每组10只。
2.2 模型制备 2.2.1 寒凝血瘀证大鼠模型的制备及评价方法参照参考文献[8]。除假手术组外,其余大鼠每日9:00置于0~1 ℃的冰水中浸泡8 min,当大鼠出现反应迟钝、腿部僵直欲沉或呼吸微弱时结束,每日1次。捞出后迅速用干毛巾擦拭,同时注意保温。分别于冰水浴的第7、14天,皮下注射0.1%盐酸肾上腺素(0.8 mg/kg),共2次,间隔4 h,2次注射之间将大鼠置于0~1 ℃的冰水中浸泡5 min,末次造模后的12 h内禁食不禁水,冰水浴过程中死亡4只。
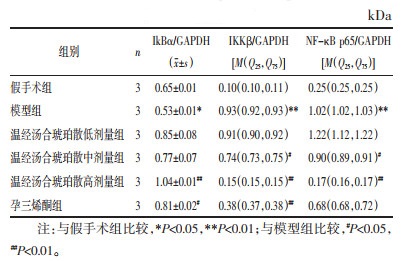
模型组大鼠经冰水浸泡2周后,出现反应迟钝、皮毛松散无光泽、喜弓背扎堆、饮食量减少、大便不成形等表现,辨为寒凝证。同时,模型组大鼠唇色变暗、耳部血管增粗呈暗红色、舌质紫暗、舌底络脉增粗且颜色紫暗,辨为血瘀证。而假手术组大鼠唇色呈淡红色,耳部血管清晰细小、颜色鲜红,舌质淡红,舌下络脉细小,反应灵敏,皮毛贴身光滑,饮食及二便正常。与假手术组比较,模型组大鼠血液流变学各项指标均升高。凝血功能方面,部分凝血活酶时间(TT)降低,纤维蛋白原(FIB)含量升高,提示寒凝血瘀型大鼠造模成功。假手术组和模型组大鼠舌质、舌下络脉、耳部血管的状态比较见图 1。
|
| 图 1 大鼠舌质、舌下络脉、耳部血管状态 |
在寒凝血瘀证造模结束后休息2 d,随机选取10只大鼠仅开腹而不进行内膜移植,设为假手术组。剩余寒凝血瘀证模型大鼠进行自体内膜移植,具体操作:采用1.5%巴比妥钠以3 mL/kg剂量对大鼠进行腹腔给药麻醉。在尿道口上方约1 cm处沿腹中线切开腹壁和腹膜,找到子宫,将其充分暴露。取右侧子宫近端距子宫角1 cm处进行结扎,远端距卵巢1 cm处结扎,剪下右侧中间段子宫。将剪下的子宫体置于盛有无菌生理盐水的培养皿中,纵向切开子宫腔,分离子宫内膜及肌层,将其修剪为约5 mm×5 mm大小的子宫内膜组织。将修剪后的子宫内膜组织缝合固定在切口的左侧腹壁处,检查无出血后给予腹腔注射抗生素预防感染,术后缝合。术后第10天,皮下注射苯甲酸雌二醇注射液(剂量为0.1 mL/kg),持续3 d,促进异位灶生长,密切观察大鼠腹部切口愈合情况,术后感染死亡3只。
手术后4周随机抽取模型大鼠3只,可见大鼠爪甲、耳缘紫暗,舌色紫暗,舌底脉络增粗且色暗,较为符合寒凝血瘀症状,同时开腹探查异位灶生长情况,肉眼观察可见移植物呈隆起状透亮结节或呈囊状水泡,其囊内充满黄色或透亮浆液,移植物表面被结缔组织覆盖并有血管生成。病理方面,取大鼠异位内膜组织,进行苏木精-伊红(HE)染色,光学显微镜下观察可见移植病灶呈现出典型的子宫内膜组织形态,上皮细胞呈柱状排列,出现假复层结构,间质细胞明显增加,腺体数量增多,腺上皮呈立方排列,血管丰富,与正常子宫内膜相比,上皮细胞层薄,表示寒凝血瘀型EMs大鼠造模成功。
2.3 给药造模成功后,假手术组和模型组大鼠每日给予生理盐水(10 mL/kg)灌胃,灌服4周;温经汤合琥珀散低、中、高剂量组分别参照成人临床用药等效剂量的1、2、4倍给予9.69、19.38、38.75 g/kg中药灌胃,给药4周;孕三烯酮组在造模后第5周开始给予孕三烯酮(0.25 mg/kg)灌胃,每周灌胃2次(周一、周四),共灌胃4周。
2.4 标本采集与提取末次给药结束后24 h,麻醉并腹主动脉采血处死大鼠,分别收集4、2、2 mL血液用于血液流变学检测、凝血功能检测及离心取上清液。取2 mL血液于4 ℃放置12 h后离心15 min(3 000 r/min,离心半径12 cm),将抽取的上清液放入-80 ℃冰箱冻存待测。取假手术组正常位置的子宫内膜组织和其余各组的子宫异位内膜组织,生理盐水漂洗后剪取0.5 g投入液氮速冻,后放入-80 ℃冰箱冻存待测。其余子宫组织使用4%多聚甲醛溶液固定后脱水、包埋、切片,进行HE染色。
2.5 检测指标 2.5.1 HE染色观察内膜组织病理形态学变化将采集的组织切片进行HE染色,中性树脂封片,光学显微镜下观察组织形态,采集图像。观察子宫内膜上皮层有无变薄、萎缩是否呈线状排列、细胞排列紧密程度、内膜是否脱落、间质细胞有无减少及变小、血管有无减少与增生、纵切面异位内膜有无呈现缝隙状改变、腺体有无萎缩等情况。
2.5.2 ELISA法检测各组大鼠血清TNF-α、IL-1β含量将各组血清于4 ℃解冻后,按照TNF-α和IL-1β的ELISA试剂盒说明书步骤进行检测。
2.5.3 全血血液流变学及凝血功能检测各组大鼠分别腹主动脉采血4 mL至肝素钠采血管进行血液流变学检测,取2 mL至枸橼酸钠采血管进行凝血功能检测。
2.5.4 蛋白免疫印记(Western Blot)法检测子宫内膜组织中NF-κB p65、IkBα、IKKβ蛋白表达取冻存的各组子宫内膜组织0.5 g,用蛋白提取试剂盒提取蛋白,二喹啉甲酸(BCA)试剂盒测定蛋白浓度,分别取15 μg样品在电泳仪中进行电泳、转膜并封闭2 h,加入NF-κB p65、IkBα、IKKβ(1:5 000)一抗溶液,4 ℃孵育过夜,用TBST漂洗3次,每次5 min,加入羊抗兔二抗溶液室温孵育2 h,再用TBST漂洗3次,每次5 min,进行化学发光显色,使用凝胶成像仪采集并拍摄图像,ImageJ分析各组蛋白灰度值。
2.6 统计学方法所有实验数据采用SPSS 25.0统计软件和GraphPad Prism软件进行统计学分析。计量资料满足正态分布及方差齐性检验时,以均数±标准差(x±s)表示,组间比较采用单因素方差分析,两两比较采用LSD-t法;非正态分布的数据采用中位数(上四分位数,下四分位数)[M(Q25,Q75)]表示,组间比较采用秩和检验。P<0.05为差异具有统计学意义。
3 结果 3.1 对寒凝血瘀型EMs大鼠内膜组织病理形态学的影响假手术组大鼠子宫内膜组织结构完整,多数为间质细胞,腺体和血管丰富,上皮细胞排列整齐且连续,呈长柱状;模型组大鼠子宫内膜结构重度异常,腺体具有明显核空泡,间质可见红细胞浸润;温经汤合琥珀散低剂量组大鼠的子宫内膜组织形态中度异常,上皮细胞呈柱状排列,可见假复层结构,间质细胞明显,腺体数量较多;温经汤合琥珀散中剂量组大鼠的子宫内膜结构轻度异常,腺体内个别细胞空泡化,间质细胞较少,有散在炎性细胞;温经汤合琥珀散高剂量组大鼠的子宫内膜结构轻度异常,部分腺体呈囊性扩张,可见少量分泌物;孕三烯酮组大鼠的异位病灶轻度异常,间质细胞结构较松散,轻度水肿。见图 2。

|
| 图 2 温经汤合琥珀散对大鼠子宫内膜组织病理形态的影响(HE,×400) |
与假手术组比较,模型组大鼠红细胞聚集指数、高切还原黏度、中切还原黏度、低切还原黏度、血液黏度均升高(P<0.05或P<0.01)。与模型组比较,温经汤合琥珀散低、中剂量组及孕三烯酮组大鼠红细胞聚集指数降低(P<0.05或P<0.01),温经汤合琥珀散低、中剂量组及孕三烯酮组大鼠全血高切还原黏度降低(P<0.05或P<0.01),温经汤合琥珀散低、高剂量组及孕三烯酮组大鼠全血中切还原黏度降低(P<0.05),温经汤合琥珀散低、中剂量组及孕三烯酮组大鼠全血低切还原黏度降低(P<0.05或P<0.01),温经汤合琥珀散中剂量组及孕三烯酮组大鼠血液黏度降低(P<0.05)。见表 1。
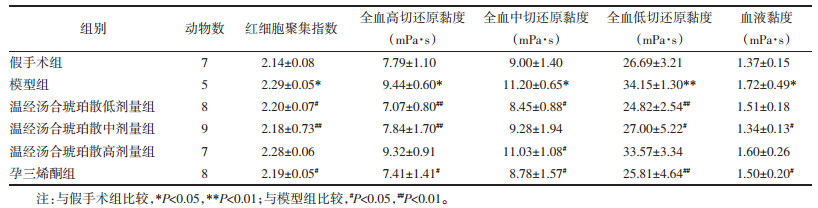
与假手术组比较,模型组大鼠红细胞刚性指数、变形指数、电泳时间升高(P<0.05或P<0.01)。与模型组比较,温经汤合琥珀散低、中、高剂量组大鼠红细胞刚性指数降低(P<0.05),温经汤合琥珀散低、中剂量组及孕三烯酮组大鼠红细胞变形指数降低(P<0.05),温经汤合琥珀散低、中剂量组及孕三烯酮组大鼠红细胞电泳时间降低(P<0.05或P<0.01)。见表 2。
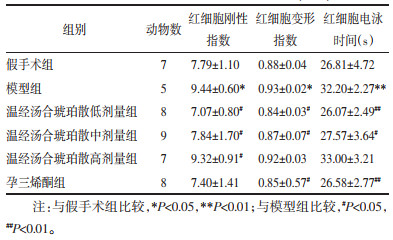
与假手术组比较,模型组大鼠TT降低(P<0.05),FIB升高(P<0.01)。与模型组比较,温经汤合琥珀散低、中剂量组及孕三烯酮组大鼠TT延长(P<0.05或P<0.01),温经汤合琥珀散低、中剂量组大鼠FIB降低(P<0.05或P<0.01)。见表 3。
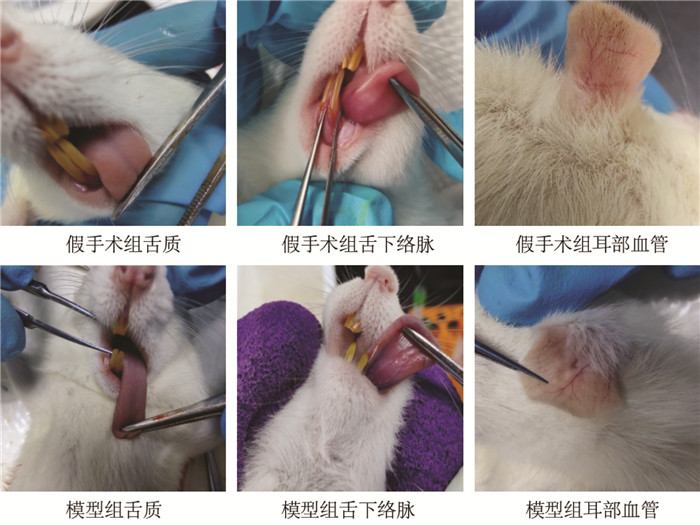
与假手术组比较,模型组大鼠血清TNF-α、IL-1β含量升高(P<0.05或P<0.01)。与模型组比较,温经汤合琥珀散低、中、高剂量组大鼠TNF-α表达量降低(P<0.01),温经汤合琥珀散低剂量组大鼠IL-1β表达量降低(P<0.05)。见图 3。
|
| 注:1,假手术组;2,模型组;3,孕三烯酮组;4,温经汤合琥珀散低剂量组;5,温经汤合琥珀散中剂量组;6,温经汤合琥珀散高剂量组。与假手术组比较,*P<0.05,**P<0.01;与模型组比较,#P<0.05,##P<0.01。 图 3 各组大鼠血清TNF-α、IL-1β浓度(x±s,n=6) |
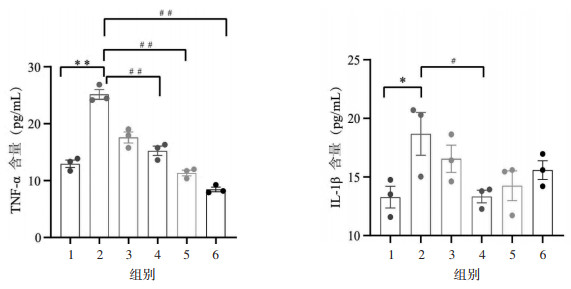
与假手术组比较,模型组大鼠NF-κB p65、IKKβ蛋白表达升高(P<0.01),IkBα蛋白表达降低(P<0.05)。与模型组比较,温经汤合琥珀散高剂量组及孕三烯酮组大鼠IkBα蛋白表达升高(P<0.05或P<0.01),温经汤合琥珀散中、高剂量组及孕三烯酮组大鼠IKKβ蛋白表达降低(P<0.05或P<0.01),温经汤合琥珀散中、高剂量组大鼠NF-κB p65蛋白表达降低(P<0.05或P<0.01)。见图 4及表 4。
|
| 图 4 各组大鼠IKKβ、IkBα、NF-κB p65、GAPDH蛋白表达条带图 |
中医理论认为“寒凝”为EMs的外因,为疾病之标;“血瘀”为EMs的基本病机,为疾病之本,而气滞、气虚、寒凝等属于致瘀因素。临床上EMs以寒凝血瘀证较为多见。本研究采用温经汤合琥珀散加减治疗EMs,方中吴茱萸归脾、胃经,可驱中焦之寒;麦冬归心经,可清心养阴。两者共用,既能驱中焦之寒,又可润脾土之燥。为制约吴茱萸温燥之性,故加阿胶、麦冬,可滋阴养血生津[9-11]。当归、川芎、白芍、牡丹皮入血分,归肝经,可活血行气、祛瘀止痛[12-13]。党参、桂枝、甘草温阳化瘀,补益后天之本。半夏、生姜均归脾经,温中止呕、散结通脉。三棱味苦性平,善于破血中之气;莪术味辛性温,长于破气中之血,两者均入肝经,能升能降,合用可使气血双破,止痛消积之力彰[14-15]。刘寄奴止痛行血,消癥瘕。琥珀活血散瘀,归心、肝经。延胡索入肝、脾经,活血行气止痛。乌药可温经散寒,行气止痛。
临床研究表明,温经汤温阳通脉、通补兼施,可以用于改善EMs患者的临床症状[16-17]。琥珀散行气破血、攻瘀止痛[18]。两方合用可以治疗寒凝血瘀型EMs,共奏温经散寒、活血通脉、逐瘀止痛、行气消癥之效,改善寒凝血瘀型EMs患者的临床症状。在本研究中,肉眼观察到大鼠的舌下脉络由增粗、颜色紫暗变化为细小、颜色鲜红,舌质由紫暗改善为粉红,血液流变学及凝血功能也得到改善,用药各组的血浆黏度、红细胞聚集指数、红细胞刚性指数、红细胞变形指数、红细胞电泳时间均降低。其中,温经汤合琥珀散中剂量组降低红细胞聚集指数、血液黏度效果最显著。比较各组大鼠的凝血时间,发现温经汤合琥珀散在升高TT与降低FIB效果方面作用显著,以上实验结果均提示温经汤合琥珀散可以改善寒凝血瘀型EMs相关中医证候[19]。
西医认为EMs是常见的妇科炎症性疾病,不孕与EMs有密切联系[20]。EMs的治疗方法日益增多,但是由于其机制的复杂性,使得目前在治疗的安全性、复发率以及对卵巢储备功能的疗效等方面仍存在争议[21]。目前有关EMs发病机制的主流学说包括免疫炎症学说、Sampson的经血逆流学说等,认为EMs患者体内的自然杀伤(NK)细胞毒性降低,导致免疫监视功能下降,随经血逆流的内膜组织或内膜细胞不能被清除,从而定植于腹腔,使免疫系统调节失控,具体表现为众多的免疫细胞被激活,分泌白细胞介素、肿瘤坏死因子等一系列炎症介质、细胞因子及血管内皮生长因子,促进血管生成及异位内膜细胞的增殖与生长。与现有研究结论相符,Yang等[22]将NK细胞与EMs异位内膜基质细胞、单核细胞来源的巨噬细胞共培养,发现NK细胞CD16、NK细胞2族成员D(NKG2D)及NK细胞的细胞毒作用显著降低,共培养体系中的IL-1β、白细胞介素-10(IL-10)等水平显著升高。另外,IL-1β一方面通过巨噬细胞聚集,促进血管形成,另一方面刺激子宫内膜间质细胞血管内皮生长因子的分泌,对异位灶的血管形成具有正向调节作用[23]。有研究发现,IL-1β的表达量增加也是导致EMs患者术后出现粘连的潜在原因[24]。该研究表明TNF-α是免疫活性细胞合成和分泌的一类介导炎症和免疫反应的多肽蛋白,参与EMs的发生与发展,促进子宫内膜细胞增殖,诱导腹膜间质细胞表达黏附因子,有利于异位子宫内膜黏附于腹膜表面,在腹膜病灶周围形成新生微小血管,参与并加速EMs的病理进程,促使异位内膜与盆腔粘连[25]。本研究发现,与假手术组比较,模型组大鼠血清TNF-α、IL-1β含量升高;与模型组比较,各给药组大鼠TNF-α、IL-1β含量均出现不同程度降低,以上实验结果说明温经汤合琥珀散及孕三烯酮可能通过调节免疫系统抑制众多的免疫细胞激活,减少IL-1β分泌,从而提高NK细胞的细胞毒性,促进免疫监视功能,进一步减少异位内膜细胞的免疫逃逸,抑制EMs的发生与发展,达到治疗EMs的效果。另外,各给药组大鼠IL-1β含量降低也提示温经汤合琥珀散及孕三烯酮可以阻止巨噬细胞聚集,抑制异位灶的血管生成,减少子宫内膜细胞增殖,降低黏附因子数量,阻止子宫内膜黏附于腹膜表面。与现有研究结果一致,抗TNF-α治疗可以抑制EMs的进展,IL-1β在免疫调节和炎症发展过程中发挥重要作用[26]。
NF-κB信号通路与EMs的发生、发展关系密切。有实验证明NF-κB蛋白下调与NF-κB的抑制蛋白IkBα上调,可以抑制血管生成[27],故EMs的发生、发展也与NF-κB通路的活化程度有关。在NF-κB通路的活化过程中,是由TNF-α、IL-1β与细胞膜上的受体结合,向下游传递信号与肿瘤坏死因子受体相关因子结合,激活IkB激酶复合体(IKKβ、IKKα、IKKγ),使NF-κB的抑制蛋白IkBα发生磷酸化后被泛素化降解,NF-κB p65被释放入核,发挥转录因子功能,调控抗凋亡基因、炎症基因和TNF-α、IL-1β的正、负反馈表达。本研究发现温经汤合琥珀散能够下调NF-κB p65和IKKβ的蛋白表达量,上调NF-κB的抑制蛋白IkBα的表达量,提示温经汤合琥珀散可能通过减少TNF-α、IL-1β分泌,抑制其与细胞膜上的受体结合,进而阻止IkB激酶复合体(IKKβ、IKKα、IKKγ)激活,导致NF-κB的抑制蛋白IkBα不能被泛素化降解,最终阻止NF-κB p65释放入核,达到抑制NF-κB信号通路活化的效果[28]。其中温经汤合琥珀散高剂量组治疗效果最明显,优于温经汤合琥珀酸低、中剂量组及孕三烯酮组,在治疗EMs方面发挥重要作用。
综上,温经汤合琥珀散可以改善寒凝血瘀型EMs大鼠的舌质、舌下络脉、耳部血管状态,抑制炎症反应,通过调节NF-κB p65、IkBα、IKKβ的蛋白表达,降低TNF-α、IL-1β表达,其作用机制可能与NF-κB信号通路相关。但需要指出的是,本研究涉及的炎症因子及验证实验不够全面,有待进一步深入探讨和补充。
| [1] |
FOTI P V, FARINA R, PALMUCCI S, et al. Endometriosis: clinical features, MR imaging findings and pathologic correlation[J]. Insights into Imaging, 2018, 9(2): 149-172. DOI:10.1007/s13244-017-0591-0 |
| [2] |
Practice Committee of the American Society for Reproducitve Medcine. The clinical relevance of luteal phase deficiency: a committee opinion[J]. Fertility and Sterility, 2012, 98(5): 1112-1117. DOI:10.1016/j.fertnstert.2012.06.050 |
| [3] |
汤艳秋, 吴燕虹. 温经汤治疗子宫内膜异位症痛经30例临床观察[J]. 江苏中医药, 2015, 47(6): 36-37. |
| [4] |
程曦, 陈晓瑶, 张悦健, 等. 经典名方与中成药治疗子宫内膜异位症的临床应用研究进展[J]. 药物评价研究, 2023, 46(7): 1389-1395. |
| [5] |
王素霞, 张丽霞. 琥珀散对子宫内膜异位症大鼠NO及NOS作用研究[J]. 中华中医药学刊, 2010, 28(7): 1430-1432. |
| [6] |
马小鸿. SREBP1通过激活NF-κB通路诱导子宫内膜样腺癌孕激素抵抗的机制研究[D]. 济南: 山东大学, 2022.
|
| [7] |
PONCE C, TORRES M, GALLEGUILLOS C, et al. Nuclear factor kappaB pathway and interleukin-6 are affected in eutopic endometrium of women with endometriosis[J]. Reproduction, 2009, 137(4): 727-737. DOI:10.1530/REP-08-0407 |
| [8] |
丛慧芳, 谷栩萌, 张天婵, 等. 寒凝血瘀型子宫内膜异位症大鼠模型的制备[J]. 中医药学报, 2018, 46(1): 74-79. |
| [9] |
宋芷琪. 叶天士《临证指南医案》治疗外感温热类温病用药规律研究[D]. 沈阳: 辽宁中医药大学, 2022.
|
| [10] |
尹柏坤. 《血证论》治疗血证方剂的配伍特点研究[D]. 哈尔滨: 黑龙江中医药大学, 2022.
|
| [11] |
赵进喜, 张立山, 张保春, 等. 人参黄芪, 益气可培元; 麦冬阿胶, 养阴能存津[J]. 环球中医药, 2019, 12(6): 875-877. DOI:10.3969/j.issn.1674-1749.2019.06.012 |
| [12] |
丁宁. 《妇人大全良方》妇人血证辨治规律研究[D]. 北京: 中国中医科学院, 2022.
|
| [13] |
甘东伶. 基于数据挖掘技术探讨中医治疗子宫内膜异位症的证-药规律[D]. 南宁: 广西中医药大学, 2021.
|
| [14] |
金德, 于同月, 安学冬, 等. 三棱的临床应用及其用量探究[J]. 吉林中医药, 2021, 41(12): 1661-1664. |
| [15] |
唐荣霜, 石洲, 李晋奇, 等. 三棱莪术药对的研究进展[J]. 实用医院临床杂志, 2021, 18(5): 226-229. DOI:10.3969/j.issn.1672-6170.2021.05.062 |
| [16] |
周艳艳, 刘阳阳, 任静雯, 等. 基于"一气周流"学说探析《金匮要略》温经汤[J]. 中国中医基础医学杂志, 2021, 27(3): 488-489. |
| [17] |
康燕, 黄明华, 李海鹏, 等. 温经汤改善子宫内膜异位症患者临床症状及免疫功能的作用分析[J]. 中药材, 2020, 43(2): 482-485. |
| [18] |
林陶秀, 张文娟, 郭亚楠, 等. 基于"凡血证总以祛瘀为要"探讨琥珀散治疗子宫内膜异位症痛经的临床应用思路[J]. 现代中医临床, 2022, 29(5): 31-34. DOI:10.3969/j.issn.2095-6606.2022.05.007 |
| [19] |
王韫琪, 李兆萍, 向丽娟. 温经汤对寒凝血瘀型卵巢储备功能减退中医证候及卵巢功能的影响[J]. 中华中医药学刊, 2023, 41(6): 217-220. |
| [20] |
官华成, 徐洁颖, 徐步芳. 子宫内膜异位症患者孕激素抵抗的研究进展[J]. 中华生殖与避孕杂志, 2023, 43(7): 740-744. |
| [21] |
章婷婷, 方小玲. 子宫内膜异位症生育力保护策略[J]. 中国实用妇科与产科杂志, 2021, 37(3): 281-285. |
| [22] |
YANG H L, ZHOU W J, CHANG K K, et al. The crosstalk between endometrial stromal cells and macrophages impairs cytotoxicity of NK cells in endometriosis by secreting IL-10 and TGF-Β[J]. Reproduction, 2017, 154(6): 815-825. DOI:10.1530/REP-17-0342 |
| [23] |
王诗瑶, 孙贇. NLRP3炎症小体/IL-1β信号通路在子宫内膜异位症中的研究进展[J]. 国际妇产科学杂志, 2021, 48(6): 691-695. |
| [24] |
STOCKS M M, CRISPENS M A, DING T B, et al. Therapeutically targeting the inflammasome product in a chimeric model of endometriosis-related surgical adhesions[J]. Reproductive Sciences, 2017, 24(8): 1121-1128. DOI:10.1177/1933719117698584 |
| [25] |
SMALE S T. Hierarchies of NF-κB target-gene regulation[J]. Nature Immunology, 2011, 12(8): 689-694. DOI:10.1038/ni.2070 |
| [26] |
D'ANTONIO M, MARTELLI F, PEANO S, et al. Ability of recombinant human TNF binding protein-1 (r-hTBP-1) to inhibit the development of experimentally-induced endometriosis in rats[J]. Journal of Reproductive Immunology, 2000, 48(2): 81-98. DOI:10.1016/S0165-0378(00)00073-5 |
| [27] |
LIU X F, YE F, XIONG H B, et al. IL-1β induces IL-6 production in retinal Müller cells predominantly through the activation of p38 MAPK/NF-κB signaling pathway[J]. Experimental Cell Research, 2015, 331(1): 223-231. DOI:10.1016/j.yexcr.2014.08.040 |
| [28] |
庄梦斐, 曹阳, 张婷婷, 等. 温经汤对子宫内膜异位症小鼠TLR4/NF-κB通路的影响研究[J]. 现代中西医结合杂志, 2023, 32(2): 165-170, 176. DOI:10.3969/j.issn.1008-8849.2023.02.004 |
 2024, Vol. 43
2024, Vol. 43