文章信息
- 靳亚静, 党玲玲, 陈希瑜, 张田圆, 王彧, 邵瑞
- JIN Yajing, DANG Lingling, CHEN Xiyu, ZHANG Tianyuan, WANG Yu, SHAO Rui
- 虎杖苷抗氧化活性研究进展
- Recent advances in antioxidant activity of Polydatin
- 天津中医药大学学报, 2024, 43(4): 333-340
- Journal of Tianjin University of Traditional Chinese Medicine, 2024, 43(4): 333-340
- http://dx.doi.org/10.11656/j.issn.1673-9043.2024.04.08
-
文章历史
收稿日期: 2023-11-08
2. 组分中药国家重点实验室, 天津 301617;
3. 天津中医药大学中医药研究院, 天津 301617
2. State Key Laboratory of Component-based Chinese Medicine, Tianjin 301617, China;
3. Institute of Traditional Chinese Medicine, Tianjin University of Traditional Chinese Medicine, Tianjin 301617, China
虎杖(Polygonum cuspidatum Sieb. et Zucc.)为蓼科(Polygonaceae)蓼属(Polgohum L.),最早记载于《名医别录》,具有利胆退黄、清热解毒、散瘀止痛、止咳化痰之功效[1],被广泛应用于中医药领域。虎杖苷(Polydatin)是从中药虎杖的干燥根茎中提取的单体,是虎杖的主要有效成分。在2020年版《中华人民共和国药典》中,以大黄素和虎杖苷含量作为虎杖的质量标准[2]。虎杖苷是白藜芦醇与葡萄糖结合的产物,也称为白藜芦醇苷,在其他物质(如红酒、坚果、蔬菜、水果、啤酒)以及含有可可、巧克力的产品中也存在[3]。
现代药理学研究表明,虎杖苷具有抗炎、抗氧化、抗肿瘤、抗菌和免疫调节等作用,尤其表现出较强的抗氧化药理活性,并在肿瘤[4]、心血管疾病[5]、糖尿病[6]、神经退行性疾病[7]、肝脏/呼吸系统疾病[8]和骨骼/女性疾病[9-10]等疾病中均表现出良好的治疗效果。本研究对近年来虎杖苷抗氧化的药理作用和相关机制进行综述,深入挖掘其抗氧化潜力,为其在临床疾病中的更多应用提供参考。
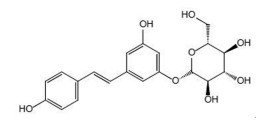
1 虎杖苷理化性质和药代动力学特点虎杖苷最初是从虎杖中分离出来的单晶化合物,它是白藜芦醇(3,4′,5-三羟基二苯乙烯)的葡萄糖苷,其中与C-3位结合的葡萄糖苷基取代了羟基,属于二苯乙烯类成分(图 1)。虎杖苷为无色或微黄色晶体(丙酮),熔点为223~226 ℃,易溶于甲醇、乙醇,可溶于水,微溶于乙酸乙酯。虎杖苷对氧化酶较稳定,可以通过葡萄糖载体以主动转运的方式进入细胞。自然界中的虎杖苷衍生物主要有4种,包括反式多氢白藜芦醇、反式白藜芦醇、顺式多氢白藜芦醇和顺式白藜芦醇。反式异构体的生物活性高于顺式异构体[11]。
|
| 图 1 虎杖苷的化学结构式 |
药代动力学研究发现虎杖苷的吸收、分布和代谢与其生物活性有关。既往研究发现,98.4%的虎杖苷经口服后在肠道和肝脏进行代谢,主要代谢产物是白藜芦醇。虎杖苷和白藜芦醇可以相互转化,在胃中保持平衡,但在体内还是以虎杖苷为主,两者在体内有相似的代谢产物,因此药理活性也较为相似。与白藜芦醇相比,虎杖苷具有更高的生物利用度和抗氧化活性[12]。作为天然抗氧化剂,迄今为止虎杖苷已被大量开展研究及报道,但目前尚没有研究者对虎杖苷的抗氧化机制进行全面综述。基于此,本文全面阐述了虎杖苷在临床常见疾病中的抗氧化活性和机制,为虎杖苷的进一步开发应用奠定基础。
2 虎杖苷在氧化应激相关疾病中的应用 2.1 脑及神经系统疾病人的中枢神经系统尤其是大脑因对脂质、氧气需求高,及神经元与神经胶质细胞的极高分化水平,使其容易受到氧化应激的影响[13]。氧化应激可以通过蛋白修饰、促进炎症、诱导细胞凋亡、损害线粒体功能等机制,干扰多种信号通路,损伤神经细胞,在神经系统疾病的发生、发展中扮演重要的角色。近年来,虎杖苷对神经系统疾病的抗氧化作用主要体现在脑卒中、帕金森病、阿尔茨海默病、中枢神经系统(脑/脊髓)损伤和糖尿病神经病变等研究。
2.1.1 缓解缺血性卒中缺血性卒中由大脑主要动脉[最常见的是大脑中动脉(MCA)]或其分支闭塞引起,其特征是血流永久性或短暂性阻塞,阻碍氧气和必需营养素输送到大脑。在缺血早期发生线粒体功能障碍和氧化磷酸化解耦联并产生大量活性氧(ROS),导致广泛的氧化应激。产生的ROS会破坏脂质、蛋白质和脱氧核糖核酸(DNA),并通过血浆和细胞器膜过氧化引起细胞内细胞器破坏,例如内质网和线粒体。进而可能进一步产生生物活性游离脂肪酸的释放,如花生四烯酸和DNA片段化,最终激活损伤途径,导致细胞坏死和凋亡。Shah等[14]在慢性大脑中动脉闭塞(MCAO)的大鼠模型中发现腹腔注射30 mg/kg虎杖苷后,可以抑制p38丝裂原活化蛋白激酶(p38MAPK)和c-Jun N-末端激酶的活化来减少梗死体积并减轻神经行为缺陷,同时上调内源性抗氧化剂核转录因子红细胞系2相关因子2(Nrf2)、血红素氧合酶1(HO-1)和硫氧还蛋白途径,并减少皮质组织中的炎症和ROS。Ruan等[15]研究也发现静脉注射虎杖苷1 mg/kg能够抑制MCAO模型中的神经炎症和ROS,降低胶质瘤相关癌基因Patched-1(Ptch1)、同系物1(Gli1)和超氧化物歧化酶(SOD)1、核转录因子-κB(NF-κB)的水平减弱氧化应激,并改善血脑屏障的通透性。此外,还有报道表明虎杖苷通过控制Nrf2/抗氧化反应元件(ARE)途径和下游基因产生来增强大鼠的神经功能,并减少氧化应激[16]。Nrf2作为一种重要的氧化还原敏感转录因子,能够诱导调控细胞内Ⅱ相解毒酶和抗氧化酶的组成型和诱导型表达,以改善机体的氧化应激。当ROS或亲电体侵袭细胞时,Nrf2从Kelch样环氧氯丙烷相关蛋白1(Keap1)中解离并快速进入细胞核,结合ARE发挥抗氧化作用[17]。由此可见,虎杖苷可以通过清除大量ROS,增加机体的抗氧化能力,缓解ROS对神经细胞的损伤,改善神经系统功能。
2.1.2 缓解中枢神经系统(脑/脊髓)损伤创伤性脑损伤(TBI)造成的继发性损伤可以导致长期的神经病理学改变,包括代谢改变、氧化应激、神经炎症、轴索损伤、神经血管改变和最终神经退行性改变。损伤后耗氧率、代谢率升高会增加产生ROS的可能性。氧化应激可以导致线粒体功能障碍、血脑屏障(BBB)破坏、感觉运动功能障碍和继发性神经元损伤[18]。研究表明,给予TBI大鼠模型腹腔注射30 mg/kg虎杖苷可以降低ROS的产生,阻断TBI诱导的丙二醛(MDA)表达,增加受损皮质中的SOD水平并调节p38MAPK信号通路和线粒体凋亡通路,改善TBI大鼠的神经学评分和生存期[19]。另有研究显示,虎杖苷通过抑制体内外Nrf2/HO-1信号传导的氧化应激和细胞凋亡,从而缓解脊髓损伤(SCI)[7]。此外,虎杖苷在氧-葡萄糖剥夺/再氧合处理的脊髓运动神经元中上调Nrf2/HO-1和NAD(P)H醌脱氢酶1(NQO-1),逆转了小鼠模型中脊髓缺血/再灌注诱导的线粒体和神经元损伤[20]。因此,虎杖苷可以通过调节线粒体应激,减少氧化应激对脑组织的损伤。
2.1.3 缓解帕金森病(PD)PD的主要病理表现为黑质致密(SNc)中多巴胺能神经元丧失。线粒体损伤、氧化应激、α-突触核蛋白聚集和蛋白质降解受损均与PD的发病机制有关,而电子传递链复合物I抑制和氧化应激升高是PD发生的早期阶段。由于多巴胺从突触囊泡释放到突触间隙或细胞质中产生的大量氧化剂,多巴胺能神经元容易受到氧化应激的影响[21]。脂多糖(LPS)可以诱导氧化应激的发生,黑质中注射LPS会选择性地诱导多巴胺能神经元的死亡,而在LPS诱导的PD模型中,虎杖苷(25、50、100 mg/kg)抑制AKT(蛋白激酶B)/糖原合酶激酶3(GSK3β)-Nrf2信号轴的激活以预防PD[22]。此外,多巴胺可以诱导人神经母细胞瘤SH-SY5Y细胞脂质过氧化和细胞凋亡[23]。体外实验研究表明,虎杖苷能够显著降低鱼藤酮诱导的人多巴胺能神经元细胞SH-SY5Y的线粒体功能障碍和ROS的产生,通过激活雷帕霉素靶蛋白(mTOR)-自噬相关基因5(Atg5)自噬途径和抑制过氧化物酶体增殖活化受体γ辅激活因子1β(PGC1β)-线粒体融合蛋白2(MFN2)融合途径发挥神经保护作用[24]。
2.1.4 缓解阿尔茨海默病及认知/记忆功能障碍细胞外Aβ蛋白聚集沉积形成淀粉样斑块是阿尔茨海默病病理学最主要的特征。Aβ的细胞外积累和线粒体功能受损可能引发自由基的形成,而过度的氧化应激造成随之而来的神经元损失,由此形成恶性循环。因此,氧化应激是阿尔茨海默病的重要病理特征。Zhang等[25]发现虎杖苷可以显著改善过氧化氢(H2O2)诱导神经元细胞的线粒体功能障碍,抑制线粒体ROS产生,这主要与环磷腺苷效应元件结合蛋白(CREB)信号传导的激活有关。CREB可以在Ser133位点发生磷酸化,进入细胞核并与CREB响应元件结合,促进多种抗氧化和解毒基因的转录和表达,从而抑制神经元氧化损伤。在研究虎杖苷对肿瘤患者的保护作用时,Tong等[26]发现大多数患者因使用化学治疗药物而出现认知障碍,虎杖苷(50 mg/kg)使用后可以通过上调Nrf2抑制阿霉素(DOX)诱导的氧化应激,改善化学治疗引起的认知障碍。目前临床的药物治疗多针对修饰淀粉样蛋白级联反应,并无靶向氧化应激的相关药物,而虎杖苷强大的抗氧化活性具有应用潜力。
2.1.5 缓解糖尿病神经病变(DPN)DPN是糖尿病的主要并发症,发病率很高。DPN发病机制复杂,其中氧化应激是与其他病理生理机制相互作用导致DPN发生的关键机制之一。氧化损伤促进神经结构变化,如轴突变性、节段性脱髓鞘和雪旺细胞凋亡,导致DPN中髓鞘和无髓鞘纤维的损伤和/或丢失[27]。Bheereddy等[16]在糖尿病大鼠和高糖(30 mmol/L)处理的小鼠神经母细胞瘤(Neuro-2a)细胞中,发现虎杖苷可以显著减轻糖尿病大鼠的机械性和热性痛觉过敏,改善糖尿病大鼠的运动/感觉神经传导速度和血流速度,使高糖暴露的Neuro-2a细胞线粒体超氧化物、膜电位正常化,改善神经突生长。虎杖苷(50、100、150 μmol/L)激活Nfr2和乙二醛酶1(GLO1)、抑制Keap1和晚期糖基化终产物受体(RAGE)表达,对糖尿病模型中的雪旺细胞和坐骨神经具有明显的神经保护作用[28]。目前临床上尚未发现最有效的药物组合来对抗高血糖和氧化应激,而氧化应激在神经系统损伤中扮演重要角色,因此抗氧化治疗不容忽视。
2.2 代谢性疾病 2.2.1 缓解2型糖尿病(T2DM)T2DM是最常见的代谢性疾病之一。已有研究证明,在高血糖条件下可以观察到氧化DNA损伤标志物升高及抗氧化酶活性降低[29]。上文也提到高葡萄糖水平可以增加ROS的产生,进而导致应激敏感的细胞内信号通路的激活,造成细胞损伤,同时也与介导胰岛素抵抗和胰岛素分泌受损有关。Yousef等[30]在体内外糖尿病模型中发现虎杖苷通过降低脂质过氧化,改善抗氧化状态,抑制胰腺炎症反应,表现出保护胰岛β细胞功能和抑制氧化应激损伤的潜在作用。
此外,由ROS产生增加引起的氧化应激在晚期糖尿病并发症的发病机制中也起着关键作用。1)糖尿病性心肌病:高血糖诱导的氧化应激已经被证实可以导致心脏损伤和炎症。烟酰胺腺嘌呤二核苷酸磷酸(NADPH)氧化酶是ROS产生的关键酶,而在糖尿病心肌中NADPH氧化酶的活性显著增加。100 mg/(kg·d)的虎杖苷可以显著抑制T2DM模型大鼠NADPH氧化酶和NF-κB激活,发挥心脏保护作用[31]。Yu等[32]提出虎杖苷(20 mg/kg)可以通过激活跨膜受体蛋白Notch-1/发状分裂相关增强子1(Hes1)介导的张力蛋白同源蛋白(PTEN)/Akt信号通路改善氧化应激损伤,有效减轻糖尿病引起的心肌缺血再灌注(MI/R)损伤,改善左心室功能。2)糖尿病肾病(DN):在糖尿病的发生与发展过程中,SOD、抗氧化剂维生素E和α-硫辛酸的水平降低,从而损伤人体自身的抗氧化系统[29]。研究发现,负载虎杖苷的壳聚糖纳米颗粒可以通过减少肾脏MDA水平,增加抗氧化酶[SOD、过氧化氢酶(CAT)和谷胱甘肽(GSH))]的活性改善链脲佐菌素诱导的糖尿病大鼠早期DN[33]。ROS过量产生是DN患者发生肾小管间质损伤和纤维化的重要机制之一。研究发现体外聚丙烯酰胺水凝胶(PA凝胶)的刚度梯度可以模拟体内肾脏纤维化的刚度,从而影响肾脏成纤维细胞的内张力。虎杖苷可以抑制不同刚度梯度的PA凝胶激活的成纤维细胞活化、Yes相关蛋白(YAP)表达和ROS产生,发挥抗肾纤维化作用[34]。另有研究表明,虎杖苷100 mg/kg通过上调Cx32的表达,促进k48连接的NADPH氧化酶4(NOX4)的多泛素化和降解,从而降低肾脏氧化应激水平,最终改善糖尿病肾纤维化的病理进展[35]。虎杖苷可以改善KKAy小鼠和高血糖诱导的小鼠肾足细胞(MPC5细胞)线粒体形态并减轻线粒体功能障碍,抑制细胞ROS的生成能力,同时抑制动力相关蛋白1(Drp1)逆转高血糖诱导的足细胞凋亡,从而保护DN小鼠的肾功能[36]。目前,临床关于糖尿病的治疗药物主要针对增加胰岛素分泌(胰岛素注射液)和降低机体胰岛素抵抗(胰岛素增敏剂、二甲双胍等)两个方面,而虎杖苷可以抑制氧化应激这一重要环节,有望成为辅助治疗用药,缓解糖尿病并减少其并发症的发生。
2.2.2 缓解动脉粥样硬化(AS)对AS发病机制的认识有很多,其中氧化应激产生的ROS可以引起脂质和DNA氧化、内皮功能障碍和炎症,影响血管系统,促进AS[37]。在不同的病理条件下,氧化剂水平升高,氧化导致AS低密度脂蛋白(LDL)形成氧化LDL(ox-LDL),进而激活内皮细胞、巨噬细胞、不同炎症级联及随后的蛋白和细胞损伤,直接参与AS性心血管疾病(ASCVD)的进展[38]。载脂蛋白E(ApoE)是极低密度脂蛋白(VLDL)和高密度脂蛋白(HDL)的组成部分,参与胆固醇的运输与对三酰甘油中脂蛋白成分的正常分解代谢。50 mg/(kg·d)虎杖苷通过降低主动脉和肝脏中ROS的产生和肝脏中NADPH氧化酶主要亚型NADPH氧化酶2(NOX2)和NOX4的蛋白表达,减轻ApoE缺陷(ApoE-/-)小鼠AS[39]。研究表明,虎杖苷可以通过抑制乳酸脱氢酶(LDH)和ROS的释放,增加GSH过氧化物酶(GSH-Px)和SOD的活性,从而保护H2O2诱导的人脐静脉内皮细胞(HUVECs)中的氧化应激损伤[40]。除此之外,虎杖苷还可以逆转ox-LDL诱导的HUVECs细胞凋亡、脂质积累和血管生成抑制[40]。上述研究发现,虎杖苷通过其显著的抗氧化活性发挥心血管保护作用。
2.2.3 缓解非酒精性脂肪肝(NAFLD)或非酒精性脂肪性肝炎(NASH)肝脏是发生许多氧化过程的器官,因此是氧化应激损伤的重要目标[41]。NAFLD的发病机制是一个涉及多种机制的多因素过程,最终导致氧化还原平衡紊乱。在此过程中,脂质代谢受损、线粒体功能障碍、β氧化损伤和内质网应激(ER)都会增加ROS的产生,从而导致脂质过氧化。氧化还原平衡受损也会影响抗氧化反应(如Nrf2途径),并导致抗氧化剂(GSH和SOD)水平降低[42]。研究发现,在高果糖喂养诱导的NAFLD模型中,给予虎杖苷可以促进miR-200a表达,激活Keap1-Nrf2抗氧化途径[43],并通过减少ROS驱动的硫氧还蛋白互作蛋白(TXNIP)过表达和脂质过氧化物MDA,增强肝脏中的抗氧化酶SOD来缓解氧化应激,改善脂质代谢紊乱,缓解肝损伤[44]。Li等[45]研究发现虎杖苷(5 mg/kg)可以通过下调NOX4来减弱蛋氨酸胆碱缺乏饮食(MCD)诱导的NASH小鼠肝脏氧化应激。实验证明抗氧化反应对NAFLD具有潜在治疗作用,而虎杖苷可以通过调节Nrf2抗氧化反应途径对多种代谢疾病发挥抗氧化作用,缓解氧化应激带来的肝损伤。
2.3 其他氧化应激相关疾病 2.3.1 呼吸系统疾病严重急性呼吸道综合征冠状病毒(SARS-CoV)等病原体触发氧化应激-NF-κB-Toll样受体信号通路,导致急性肺损伤。与SARS-CoV-2相关的氧化应激和炎症会增加组织损伤的严重程度。葡萄糖6-磷酸脱氢酶(G6PD)可以通过磷酸戊糖途径产生NADPH氧化酶,从而调控ROS产生。而虎杖苷可以直接抑制G6PD活性抑制氧化应激[46]。ROS的过度激活可以引发气道炎症,促进气道疾病的发生、发展。在卵清蛋白(OVA)诱导的小鼠哮喘模型中,给予虎杖苷(100 mg/kg)治疗后可以显著抑制肺组织ROS的产生,促进Nrf2调控的抗氧化酶HO-1和醌氧化还原酶-1(NQO-1)表达,抑制NADPH氧化酶1(NOX1)和NOX4表达,抑制肺纤维化,减轻ROS诱导的气道重塑[47]。由此可见,虎杖苷的抗氧化作用对呼吸系统的保护至关重要。
2.3.2 其他因素引起的肝损伤在乙醇诱导的大鼠酒精性肝病(ALD)模型中,虎杖苷通过下调细胞色素P4502E1(CYP2E1)、上调Nrf2/HO-1对乙醇诱导的肝脏损伤发挥抗氧化作用[48]。Lai等[49]利用H2O2荧光探针检测乙醇诱导的斑马鱼幼虫ALD模型的ROS,发现虎杖苷可以抑制ROS产生,防止肝脏受到氧化应激伤害。虎杖苷还可以抑制肝脏4-羟壬二酸酯(4-HNE)生成和NOX4表达,并增加GSH、GSH巯基转移酶(GST)、SOD、GSH-Px和过氧化物酶(CAT)等抗氧化剂的活性,对四氯化碳引起的肝损伤具有保护和治疗作用[50]。
2.3.3 炎症性肠病溃疡性结肠炎和炎症性肠病是由肠上皮屏障功能障碍引起及表征的。除了与该病有关的炎症机制外,氧化应激以及ROS和氮物质也可能与组织损伤及肠纤维化有关[51]。炎症性肠病的黏膜发炎区域和肠壁深层可以观察到氧化应激,虎杖苷可以有效降低右旋糖酐硫酸钠(DSS)诱导的结肠炎小鼠MDA水平,增加抗氧化酶SOD和GSH-Px活性,促进Nrf2的核转录,增加Nrf2、HO-1和NQO-1的表达,发挥肠道保护作用[52]。
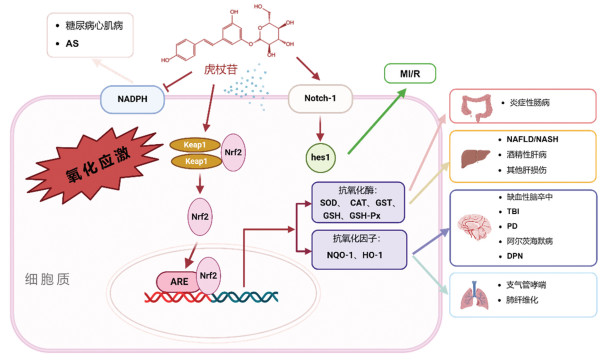
2.3.4 肿瘤之前已经在多种肿瘤中检测到ROS信号转导,最常见于三阴性乳腺癌。ROS的过量产生导致NF-κB、Wnt、基质金属蛋白酶(MMP)、表皮生长因子受体(EGFR)和磷脂酰肌醇3激酶(PI3K)/AKT通路等致癌信号通路上调,增强细胞的存活与增殖能力,并造成DNA损伤与遗传不稳定性。ROS还可以启动氧化应激诱导的肿瘤细胞凋亡[53]。随着抗肿瘤药物的研究与开发,肿瘤患者的生活质量得到一定改善,但耐药性也是需要面对的问题。ROS可以通过氧化还原敏感转录因子、刺激细胞分化及细胞代谢重编程介导耐药机制[54]。因此,虎杖苷的抗氧化活性也能作为缓解肿瘤耐药性的潜在药物,今后可以开展更为广泛的临床试验进行深入研究。虎杖苷抗氧化活性研究概况见图 2。
|
| 图 2 虎杖苷抗氧化活性研究概况 |
氧化应激是指体内自由基生成过量,氧化和抗氧化作用失衡的一种状态,并被认为是导致衰老和疾病的一个重要因素。在大部分疾病中,氧化应激可以随着疾病的发生及发展产生,从而成为导致疾病加重的次要因素。而氧化应激产生的氧自由基一旦造成组织损伤后不可逆转,其后续可以引起细胞产生一系列的应激信号并激活相关通路,加重病情,因此抗氧化剂的早期应用必不可少。近年来,人们一直关注寻找天然抗氧化剂,用以防止体内发生氧化损伤。虎杖苷因其强大的抗氧化活性,成为一种很有前途的抗氧化剂,也因此受到人们的广泛关注。
通过以上研究发现,虎杖苷在神经系统疾病、非酒精性肝病、肝损伤、呼吸系统疾病及炎症性肠病中主要通过调控Nrf2-Keap1-ARE通路提高下游抗氧化酶(HO-1、NQO-1、SOD等)的活性发挥抗氧化作用;在代谢性疾病中(如AS及糖尿病),主要通过抑制NADPH氧化酶(NOX2、NOX4)的活性抑制ROS的产生;虎杖苷还能够通过激活Notch-1/Hes1通路改善心肌缺血再灌注损伤;并且,虎杖苷在这些疾病中可能同时通过多个途径发挥作用。笔者也发现在不同组织和疾病中,虎杖苷通过调控Nrf2-Keap1-ARE通路抑制氧化应激反应,主要包含两个途径:一是抑制氧化应激相关产物,如MDA、ROS等的释放;二是增加天然抗氧化系统中抗氧化酶(SOD、CAT、GPX等)的活性,减少抗氧化失衡对机体的损伤,从而在多种疾病的抗氧化过程中具有显著疗效。目前,白藜芦醇作为Nrf2的激活剂,在多种疾病(包括T2DM、慢性肾脏疾病、内皮功能障碍和代谢综合征等)研究中已经进入临床试验阶段[55]。因此,虎杖苷可能作为激活Nrf2途径的潜在活性物质。除此之外,在一些慢性疾病中,炎症与氧化应激具有相互促进的关系。炎症发生时,中性粒细胞可以在短时间内释放大量ROS,产生的ROS可以启动炎症相关通路,两者相互促进。而虎杖苷能够同时发挥抗炎及抗氧化作用,延缓疾病的发生与发展。
然而,对虎杖苷的药代动力学研究提示,虎杖苷进入体内后需要经过肠道微生物酶解转化为白藜芦醇才能吸收入血,而白藜芦醇的功效不及虎杖苷,因此研究虎杖苷的制剂和靶向给药,提高虎杖苷在体内的生物利用度还需持续进行。目前,临床上虎杖苷用药剂量与疾病之间的相关性尚无系统性研究。2015年,由海王生物公司自主研发用于治疗心血管疾病的虎杖苷注射液通过美国食品药品监督管理局(FDA)的评审,获批在美国进入临床试验,目前已在美国完成人体耐受性和药代动力学试验(批号:CTR20132636)。2017年,海王生物提交了“虎杖苷注射液”国际多中心临床试验申请并获受理,同时正在开展美国Ⅱ期临床试验(批号:CTR20160804),试验期间发现虎杖苷在人类范围具有良好的耐受性。除此以外,关于虎杖苷开发利用的专利申请近年来不断增加,主要包括虎杖苷的提取、分析、制剂及疾病应用研究,其中疾病研究集中在虎杖苷抗肿瘤、治疗肺系疾病、炎症性疾病及抗痴呆等方面。由此可见,虎杖苷具有巨大的研发潜力和应用价值,并有望成为防治氧化应激相关临床疾病的特色新药。因此,为了将虎杖苷作为天然抗氧化剂更广泛地应用于临床,还需要对其进行更深入、更系统的研究。
| [1] |
WU M, LI X Y, WANG S Z, et al. Polydatin for treating atherosclerotic diseases: a functional and mechanistic overview[J]. Biomedecine & Pharmacotherapie, 2020, 128(11): 110-118. |
| [2] |
国家药典委员会. 中华人民共和国药典(2020年版)[M]. 北京: 中国医药科技出版社, 2020.
|
| [3] |
KARAMI A, FAKHRI S, KOOSHKI L, et al. Polydatin: pharmacological mechanisms, therapeutic targets, biological activities, and health benefits[J]. Molecules, 2022, 27(19): 64-74. |
| [4] |
MELE L, NOCE M L, PAINO F, et al. Glucose-6-phosphate dehydrogenase blockade potentiates tyrosine kinase inhibitor effect on breast cancer cells through autophagy perturbation[J]. Journal of Experimental & Clinical Cancer Research, 2019, 38(1): 160. DOI:10.3760/cma.j.issn.1001-9030.2019.01.050 |
| [5] |
DONG M, LIAO S Y, CHEN Y W, et al. Trans-Polydatin protects the mouse heart against ischemia/reperfusion injury via inhibition of the renin-angiotensin system (RAS) and Rho kinase (ROCK) activity[J]. Food & Function, 2017, 8(6): 2309-2321. |
| [6] |
GONG W Y, LI J, CHEN Z Q, et al. Polydatin promotes Nrf2-ARE anti-oxidative pathway through activating CKIP-1 to resist HG-induced up-regulation of FN and ICAM-1 in GMCs and diabetic mice kidneys[J]. Free Radical Biology & Medicine, 2017, 106(5): 393-405. |
| [7] |
LYU R X, DU L L, ZHANG L X, et al. Polydatin attenuates spinal cord injury in rats by inhibiting oxidative stress and microglia apoptosis via Nrf2/HO-1 pathway[J]. Life Sciences, 2019, 217(2): 119-127. |
| [8] |
LI T, LIU Y T, XU W, et al. Polydatin mediates Parkin-dependent mitophagy and protects against mitochondria-dependent apoptosis in acute respiratory distress syndrome[J]. Laboratory Investigation, 2019, 99(6): 819-829. DOI:10.1038/s41374-019-0191-3 |
| [9] |
KANG L, LIU S W, LI J C, et al. Parkin and Nrf2 prevent oxidative stress-induced apoptosis in intervertebral endplate chondrocytes via inducing mitophagy and anti-oxidant defenses[J]. Life Sciences, 2020, 243(3): 117-124. |
| [10] |
LI R, MAIMAI T, YAO H M, et al. Protective effects of polydatin on LPS-induced endometritis in mice[J]. Microbial Pathogenesis, 2019, 137(8): 103-112. |
| [11] |
MIKULSKI D, MOLSKI M. Quantitative structure-antioxidant activity relationship of trans-resveratrol oligomers, trans-4, 4'-dihydroxystilbene dimer, trans-resveratrol-3-O-glucuronide, glucosides: trans-piceid, cis-piceid, trans-astringin and trans-resveratrol-4'-O-beta-D-glucopyranoside[J]. European Journal of Medicinal Chemistry, 2010, 45(6): 2366-2380. DOI:10.1016/j.ejmech.2010.02.016 |
| [12] |
WANG H L, GAO J P, HAN Y L, et al. Comparative studies of polydatin and resveratrol on mutual transformation and antioxidative effect in vivo[J]. International Journal of Phytotherapy and Phytopharmacology, 2015, 22(5): 553-559. DOI:10.1016/j.phymed.2015.03.014 |
| [13] |
JAGANJAC M, MILKOVIC L, ZARKOVIC N, et al. Oxidative stress and regeneration[J]. Free Radical Biology & Medi-cine, 2022, 181(5): 154-165. |
| [14] |
SHAH F A, KURY L A, LI T, et al. Polydatin attenuates neuronal loss via reducing neuroinflammation and oxidative stress in rat MCAO models[J]. Frontiers in Pharmacology, 2019, 10(6): 663. |
| [15] |
RUAN W C, LI J W, XU Y Z, et al. MALAT1 up-regulator polydatin protects brain microvascular integrity and ameliorates stroke through C/EBPβ/MALAT1/CREB/PGC-1α/PPARγ pathway[J]. Cellular and Molecular Neurobiology, 2019, 39(2): 265-286. DOI:10.1007/s10571-018-00646-4 |
| [16] |
BHEEREDDY P, YERRA V G, KALVALA A K, et al. SIRT1 activation by polydatin alleviates oxidative damage and elevates mitochondrial biogenesis in experimental diabetic neuropathy[J]. Cellular and Molecular Neurobiology, 2021, 41(7): 1563-1577. |
| [17] |
郭瑞俊, 郭佩俊, 韩云彪, 等. 基于氧化应激探讨Nrf2/HO-1信号通路与临床疾病关系研究进展[J]. 河北医药, 2022, 44(20): 3157-3162. |
| [18] |
FESHARAKI-ZADEH A. Oxidative stress in traumatic brain injury[J]. International Journal of Molecular Sciences, 2022, 23(21): 13000. |
| [19] |
FAKHRI S, TOMAS M, CAPANOGLU E, et al. Antioxidant and anticancer potentials of edible flowers: where do we stand?[J]. Critical Reviews in Food Science and Nutrition, 2022, 62(31): 8589-8645. |
| [20] |
ZHAN J H, LI X, LUO D, et al. Polydatin attenuates OGD/R-induced neuronal injury and spinal cord ischemia/reperfusion injury by protecting mitochondrial function via Nrf2/ARE signaling pathway[J]. Oxidative Medicine and Cellular Longevity, 2021, 202(11): 668-672. |
| [21] |
DIONÍSIO P A, AMARAL J D, RODRIGUES C M P. Oxidative stress and regulated cell death in Parkinson's disease[J]. Ageing Research Reviews, 2021, 67(2): 101-112. |
| [22] |
HUANG B X, LIU J X, MENG T Y, et al. Polydatin prevents lipopolysaccharide (LPS)-induced Parkinson's disease via regulation of the AKT/GSK3β-Nrf2/NF-κB signaling axis[J]. Frontiers in Immunology, 2018, 9(13): 252-257. |
| [23] |
POTDAR S, PARMAR M S, RAY S D, et al. Protective effects of the resveratrol analog piceid in dopaminergic SH-SY5Y cells[J]. Archives of Toxicology, 2018, 92(2): 669-677. |
| [24] |
BAI H, DING Y Q, LI X, et al. Polydatin protects SH-SY5Y in models of Parkinson's disease by promoting Atg5-mediated but parkin-independent autophagy[J]. Neurochemistry International, 2020, 134(7): 104-116. |
| [25] |
ZHANG H H, LI Y D, XUN Y, et al. Polydatin protects neuronal cells from hydrogen peroxide damage by activating CREB/Ngb signaling[J]. Molecular Medicine Reports, 2022, 25(1): 9. |
| [26] |
TONG Y F, WANG K J, SHENG S H, et al. Polydatin ameliorates chemotherapy-induced cognitive impairment (chemo-brain) by inhibiting oxidative stress, inflammatory response, and apoptosis in rats[J]. Bioscience, Biotechnology, and Bio-chemistry, 2020, 84(6): 1201-1210. |
| [27] |
LIN Q X, LI K Z, CHEN Y N, et al. Oxidative stress in diabetic peripheral neuropathy: pathway and mechanism-based treatment[J]. Molecular Neurobiology, 2023, 60(8): 4574-4594. |
| [28] |
CHEN L L, CHEN Z X, XU Z Q, et al. Polydatin protects Schwann cells from methylglyoxal induced cytotoxicity and promotes crushed sciatic nerves regeneration of diabetic rats[J]. Phytotherapy Research, 2021, 35(8): 4592-4604. |
| [29] |
SINGH A, KUKRETI R, SASO L, et al. Mechanistic insight into oxidative stress-triggered signaling pathways and type 2 diabetes[J]. Molecules, 2022, 27(3): 950. |
| [30] |
YOUSEF A I, SHAWKI H H, EL-SHAHAWY A A, et al. Polydatin mitigates pancreatic β-cell damage through its antioxidant activity[J]. Biomedecine & Pharmacotherapie, 2021, 133(11): 111-127. |
| [31] |
TAN Y Y, CHEN L X, FANG L, et al. Cardioprotective effects of polydatin against myocardial injury in diabetic rats via inhibition of NADPH oxidase and NF-κB activities[J]. BMC Complementary Medicine and Therapies, 2020, 20(1): 378. |
| [32] |
YU L M, LI Z, DONG X, et al. Polydatin protects diabetic heart against ischemia-reperfusion injury via Notch1/Hes1-mediated activation of pten/akt signaling[J]. Oxidative Medi-cine and Cellular Longevity, 2018, 201(12): 275-295. |
| [33] |
EL-HAMEED A M. Polydatin-loaded chitosan nanoparticles ameliorates early diabetic nephropathy by attenuating oxidative stress and inflammatory responses in streptozotocin-induced diabetic rat[J]. Journal of Diabetes and Metabolic Disorders, 2020, 19(2): 1599-1607. |
| [34] |
HE M L, FENG L, CHEN Y, et al. Polydatin attenuates tubulointerstitial fibrosis in diabetic kidney disease by inhibiting YAP expression and nuclear translocation[J]. Frontiers in Physiology, 2022, 13(6): 927-936. |
| [35] |
CHEN Z Q, SUN X H, LI X J, et al. Polydatin attenuates renal fibrosis in diabetic mice through regulating the Cx32-Nox4 signaling pathway[J]. Acta Pharmacologica Sinica, 2020, 41(12): 1587-1596. |
| [36] |
ZHENG N, LIANG T, XU X H, et al. Polydatin impairs mitochondria fitness and ameliorates podocyte injury by suppressing Drp1 expression[J]. Journal of Cellular Physiology, 2017, 232(10): 2776-2787. |
| [37] |
BATTY M, BENNETT M R, YU E. The role of oxidative stress in atherosclerosis[J]. Cells, 2022, 11(23): 3843. |
| [38] |
AHMAD P, ALVI S S, IQBAL D, et al. Insights into pharmacological mechanisms of polydatin in targeting risk factors-mediated atherosclerosis[J]. Life Sciences, 2020, 254(10): 117-126. |
| [39] |
PENG Y, XU J, ZENG Y, et al. Polydatin attenuates atherosclerosis in apolipoprotein E-deficient mice: role of reverse cholesterol transport[J]. International Journal of Phytotherapy and Phytopharmacology, 2019, 62(9): 152-159. |
| [40] |
WANG D J, ZHOU Z F, YUAN L. Polydatin reverses oxidation low lipoprotein (oxLDL)-induced apoptosis of human umbilical vein endothelial cells via regulating the miR-26a-5p/BID axis[J]. European Journal of Histochemistry, 2022, 66(4): 3505. |
| [41] |
CHEN Z, TIAN R F, SHE Z G, et al. Role of oxidative stress in the pathogenesis of nonalcoholic fatty liver disease[J]. Free Radical Biology & Medicine, 2020, 152(7): 116-141. |
| [42] |
ARROYAVE-OSPINA J C, WU Z M, GENG Y N, et al. Role of oxidative stress in the pathogenesis of non-alcoholic fatty liver disease: implications for prevention and therapy[J]. Antioxidants, 2021, 10(2): 174. |
| [43] |
ZHAO X J, YU H W, YANG Y Z, et al. Polydatin prevents fructose-induced liver inflammation and lipid deposition through increasing miR-200a to regulate Keap1/Nrf2 pathway[J]. Redox Biology, 2018, 18(3): 124-137. |
| [44] |
ZHAO G S, YANG L, ZHONG W S, et al. Polydatin, a glycoside of resveratrol, is better than resveratrol in alleviating non-alcoholic fatty liver disease in mice fed a high-fructose diet[J]. Frontiers in Nutrition, 2022, 9(8): 857-879. |
| [45] |
LI R, LI J Z, HUANG Y J, et al. Polydatin attenuates diet-induced nonalcoholic steatohepatitis and fibrosis in mice[J]. International Journal of Biological Sciences, 2018, 14(11): 1411-1425. |
| [46] |
DOUSTIMOTLAGH A H, EFTEKHARI M. Glucose-6-phosphate dehydrogenase inhibitor for treatment of severe COVID-19:Polydatin[J]. Clinical Nutrition ESPEN, 2021, 43(3): 197-199. |
| [47] |
ZENG H Z, WANG Y M, GU Y X, et al. Polydatin attenuates reactive oxygen species-induced airway remodeling by promoting Nrf2-mediated antioxidant signaling in asthma mouse model[J]. Life Sciences, 2019, 218(3): 25-30. |
| [48] |
HUANG Q H, XU L Q, LIU Y H, et al. Polydatin protects rat liver against ethanol-induced injury: involvement of CYP2E1/ROS/Nrf2 and TLR4/NF-κB p65 pathway[J]. Evidence-Based Complementary and Alternative Medicine, 2017, 20(6): 795-805. |
| [49] |
LAI Y L, ZHOU C Y, HUANG P, et al. Polydatin alleviated alcoholic liver injury in zebrafish larvae through ameliorating lipid metabolism and oxidative stress[J]. Journal of Phar-macological Sciences, 2018, 138(1): 46-53. |
| [50] |
ZHAO X Y, LI R, LIU Y, et al. Polydatin protects against carbon tetrachloride-induced liver fibrosis in mice[J]. Archives of Biochemistry and Biophysics, 2017, 629(1): 1-7. |
| [51] |
PERITORE A F, D'AMICO R, CORDARO M, et al. PEA/polydatin: anti-inflammatory and antioxidant approach to counteract DNBS-induced colitis[J]. Antioxidants, 2021, 10(3): 464. |
| [52] |
CHEN G X, YANG Z Y, WEN D, et al. Polydatin has anti-inflammatory and antioxidant effects in LPS-induced macrophages and improves DSS-induced mice colitis[J]. Immunity, Inflammation and Disease, 2021, 9(3): 959-970. |
| [53] |
SHAH M A, HAMID A, FAHEEM H I, et al. Uncovering the anticancer potential of Polydatin: a mechanistic insight[J]. Molecules, 2022, 27(21): 71-75. |
| [54] |
MOLONEY J N, COTTER T G. ROS signalling in the biology of cancer[J]. Seminars in Cell & Developmental Biology, 2018, 80(1): 50-64. |
| [55] |
FORMAN H J, ZHANG H Q. Targeting oxidative stress in disease: promise and limitations of antioxidant therapy[J]. Nature Reviews Drug Discovery, 2021, 20(9): 689-709. |
 2024, Vol. 43
2024, Vol. 43