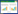文章信息
- 于长祥, 钟雨虹, 邢斌, 贾欣陶, 张瀛, 张青青, 刘志东
- YU Changxiang, ZHONG Yuhong, XING Bin, JIA Xintao, ZHANG Ying, ZHANG Qingqing, LIU Zhidong
- 三七总皂苷及其制剂治疗糖尿病视网膜病变的研究进展
- Research progress of Panax notoginseng saponins and its preparation in the treatment of diabetic retinopathy
- 天津中医药大学学报, 2024, 43(4): 348-355
- Journal of Tianjin University of Traditional Chinese Medicine, 2024, 43(4): 348-355
- http://dx.doi.org/10.11656/j.issn.1673-9043.2024.04.10
-
文章历史
收稿日期: 2024-01-11
2. 天津中医药大学, 现代中药发现与制剂技术教育部工程研究中心, 天津 301617
2. Engineering Research Center of Modern Chinese Medicine Discovery and Preparation Technique, Ministry of Education, Tianjin University of Traditional Chinese Medicine, Tianjin 301617, China
糖尿病视网膜病变(DR)是指糖尿病导致的视网膜微血管损害所引起的并发症,是一种全球发病率较高的致盲性眼病[1]。随着糖尿病发病率的升高,DR的发病率也逐年升高。2021年国际糖尿病联盟发布的全球糖尿病地图(第10版)显示,全球约5.37亿成年人患糖尿病,1/3的糖尿病患者面临发生DR的风险[2-3]。中国糖尿病人群患DR的发病率为24.7%~37.5%,已经成为中国成年人视力损害的常见病因,严重影响患者的生活质量[4]。三七总皂苷作为三七中提取的有效成分被广泛应用于DR的防治,与其他药物联合应用疗效显著。但针对三七总皂苷治疗DR的综述较少,本文对三七总皂苷治疗DR的作用机制进行系统总结,并分析了治疗DR的市售三七总皂苷制剂及其新剂型的开发,为其在临床上更好地发挥治疗DR的作用和更好地开发新剂型提供科学依据。
1 DR的病理变化DR的主要临床病理特征表现为视网膜微血管基底膜增厚、视网膜血管通透性增加,进而形成微动脉瘤,视网膜毛细血管阻塞导致视网膜缺血与缺氧,引起病理性新生血管增生、玻璃体积血、视神经节细胞损伤及视网膜脱离[5-7]。视网膜微血管由内皮细胞和周细胞组成。正常视网膜微血管中周细胞与内皮细胞的数量比为1∶1,周细胞凋亡是DR的标志,DR状态下周细胞与内皮细胞的数量比下降至1∶4[8]。周细胞的丢失会导致周细胞与内皮细胞间的紧密连接遭到破坏,造成血管通透性增加,无细胞毛细血管形成[9];内皮细胞异常增殖会形成过多的病理性新生血管,促进DR的发生和发展[10]。
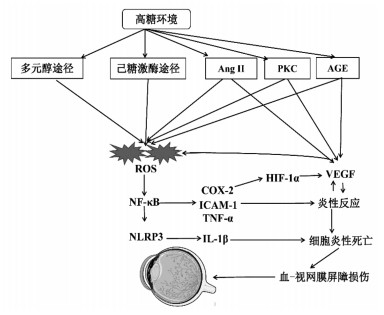
2 DR的病因及发病机制DR的病因与发病机制尚不明确。有研究表明,DR的主要原因是糖尿病血糖长期控制不佳造成的,其次还与遗传、糖尿病病程、血压异常、血脂异常有关[11-12]。目前,普遍认为DR的发病机制与高血糖引起机体发生氧化应激、细胞因子作用和炎症反应等多因素相关[13]。机体处于高血糖情况下,会激活多种信号传导代谢途径,主要有多元醇途径、蛋白激酶C(PKC)途径、己糖激酶途径、晚期糖基化终产物(AGE)途径及血管紧张素Ⅱ(AngⅡ)途径。这些代谢途径能够导致氧化应激、炎症和血管功能障碍的发生,同时引起多种生长因子水平上调,最终导致DR的发生与发展。这是由于视网膜氧气需求量大以及需要利用大量血糖供能,致使视网膜更易于发生氧化应激[14]。氧化应激反应增强,会促进生长因子分泌,激活细胞因子,发生炎性反应,而细胞因子和生长因子会进一步上调氧化应激水平,最终形成恶性循环,造成细胞功能障碍、坏死、凋亡和死亡[15]。总结国内外对DR代谢和分子水平认识的相关研究报道,归纳其发病机制为:1)活性氧的过度积累,是由上述提到的5种代谢途径增强还原型烟酰胺腺嘌呤二核苷磷酸(NADPH)氧化酶的活性引起的[16]。2)血管内皮生长因子(VEGF)的上调,包括缺氧诱导因子-1α(HIF-1α)对VEGF的调节[17];AngⅡ、PKC、AGE代谢途径使核转录因子-κB(NF-κB)活化,诱导VEGF表达增加[18-20]。3)炎症反应增多,包括白三烯介导的毛细血管损伤[21];NF-κB活化,在基因水平进行调节,参与炎症反应[22];VEGF上调,引起细胞间黏附分子-1(ICAM-1)等炎症因子释放[23-24]。具体发病机制见图 1。
|
| 图 1 DR发病机制示意图 |
三七为五加科植物三七Panax notoginseng(Burk.)F.H.Chen的干燥根和根茎。三七味甘、微苦,性温,具有散瘀止血、消肿止痛的功效。三七总皂苷是三七的主要活性成分群,包括三七皂苷R1、人参皂苷Rg1及人参皂苷Rb1[25]。现代研究发现三七总皂苷具有抗炎、抗氧化、降低血糖、降低血脂、抗肿瘤、抑制视网膜新生血管形成等药理作用[26-27]。因为三七总皂苷具有多靶点、多通路的优势,临床常应用三七总皂苷治疗心血管疾病、糖尿病及其并发症、周围血管疾病等[28]。近年来三七总皂苷治疗DR的效果逐渐受到研究者关注,目前研究发现三七总皂苷对抵抗氧化应激、下调炎症因子和细胞因子等具有较强作用[29-31],有利于防治DR进展。
3.1 抗氧化氧化应激与DR的发生、发展具有重要联系。三七总皂苷能够有效抑制机体高血糖状态下的氧化应激反应。研究发现,当给予高糖诱导的大鼠视网膜毛细血管内皮细胞(RCECs)不同浓度的三七总皂苷时,细胞活力明显升高,且浓度为100 μg/mL的三七总皂苷效果最佳[32]。三七总皂苷经处理后,增加了细胞内超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和谷胱甘肽过氧化物酶(GSH-PX)的活性,谷胱甘肽(GSH)含量也有所增加,并减少了NADPH氧化酶4(Nox4)的表达,从而发挥抗氧化作用,防止高糖诱导的细胞损伤。正常情况下,机体氧化与抗氧化系统处于动态平衡,抗氧化系统包括酶抗氧化系统和非酶抗氧化系统。酶抗氧化系统包括SOD、CAT和GSH-PX等,非酶抗氧化系统包括GSH、维生素C和维生素E等[33]。Fan等[34]研究发现,20 μmol/L的三七总皂苷中人参皂苷Rb1单体治疗高糖诱导的大鼠RCECs时,提高了SOD和CAT的活性,降低了Nox4和聚腺苷二磷酸核糖聚合酶(PARP)的活性,重新建立了细胞氧化还原平衡,抑制了细胞凋亡与DNA损伤,并且提高了内皮细胞的抗氧化能力,表明三七总皂苷的抗氧化作用与其成分中的人参皂苷Rb1相关。
3.2 抗炎炎症也是DR主要的发病机制之一。白细胞聚集、黏附于内皮细胞表面是DR炎症反应中最重要的组织形态学特征。Li等[35]研究证明血栓通(主要成分为三七总皂苷)对链脲霉素(STZ)诱导的DR大鼠改善作用明显,血栓通显著降低了大鼠视网膜中糖基化终末产物(AGE)及AGE受体(RAGE)蛋白的产生,抑制了肿瘤坏死因子-α(TNF-α)、转化生长因子-β1(TGF-β1)、ICAM-1等炎症因子的过表达。ICAM-1是白细胞整合素成分之一,其表达增加使得白细胞的黏附性变强,引起血管阻塞、神经退行性病变等问题,导致DR的发生和发展[36]。下调TNF-α、TGF-β1表达,会抑制血管病理性增生,缓解视网膜损伤[37],说明血栓通改善DR的机制与抑制炎症反应有关。李彬等[38]研究进一步发现人参皂苷Rg1对2型糖尿病造成的视网膜病变也具有保护作用,能够降低2型糖尿病小鼠视网膜神经节细胞、外网状层和中网状层的核苷酸结合寡聚化结构域样受体3(NLRP3)炎症小体表达,同时也能降低2型糖尿病小鼠视网膜炎症因子白细胞介素-1β(1L-1β)、NF-κB的表达。NLRP3炎症小体是一种多聚体胞质蛋白复合物,能够促进炎症细胞因子IL-1β的成熟与释放,调节炎症相关疾病[39]。这些研究结果均表明三七总皂苷可以通过抑制炎性反应发挥改善DR的作用。
3.3 下调细胞因子VEGF表达VEGF是一种重要的调节细胞增殖和新陈代谢的细胞因子,其在DR的发生、发展中扮演重要角色,控制VEGF的表达能够在炎症反应和病理血管增生等方面发挥关键作用。田丽敏[40]研究发现将三七总皂苷通过腹腔注射或者玻璃体腔注射至氧诱导的视网膜病变小鼠时,两种不同给药方式均能使VEGF、HIF-1α、PKC蛋白及其对应的mRNA表达明显下调。与模型组比较,治疗组可以明显抑制血管病理性增生、视网膜血管增粗,使弯曲明显改善,表明三七总皂苷可以通过下调VEGF、HIF-1α、PKC的表达来改善氧诱导的视网膜病变新生血管情况。Zhou等[41]研究发现糖尿病小鼠口服三七皂苷R1后,抑制了VEGF表达,降低了小鼠视网膜中的氧化应激和炎症反应程度,从而改善了视网膜血管变性、视网膜厚度减少和视网膜功能受损状况。细胞水平上,给予三七皂苷R1能够维持高葡萄糖诱导下的大鼠视网膜Muller细胞活性,减少细胞凋亡,稳定细胞微环境,继而控制VEGF异常释放,证明三七总皂苷中的单体三七皂苷R1能够抑制视网膜新血管的生成,为三七总皂苷治疗DR提供科学依据。
4 治疗DR的三七总皂苷市售制剂三七总皂苷已经被证实具有治疗DR的作用,但三七总皂苷存在水溶性差、生物利用度低等问题[42]。为解决上述问题,研究者通过制剂手段开发了许多三七总皂苷的剂型。目前上市的三七总皂苷制剂主要以片剂、胶囊剂和注射剂为主,集中在血塞通与血栓通两种商品类目下,包括血塞通片、血塞通分散片、注射用血塞通(冻干)、血栓通胶囊、血塞通软胶囊、血塞通滴丸、血塞通颗粒、血塞通注射液、血栓通注射液和注射用血栓通(冻干)等。血塞通与血栓通的区别在于三七总皂苷的比例不同,血塞通中人参皂苷Rb1含量最高,Rg1+R1+Re>27.5%,而血栓通中人参皂苷Rg1比例最高,Rg1+R1+Re>38%[43]。因此,临床上常用血栓通治疗眼部疾病,例如视网膜中央静脉阻塞症、角膜病、内眼病、眼前方出血、DR[44];血塞通主要用于治疗心脑血管疾病,在治疗眼部疾病时需要与其他药物合用。从市场占有率来讲,生产三七总皂苷相关制剂的企业主要有广西梧州制药、昆药集团股份有限公司、黑龙江珍宝岛药业和广东众生药业,共占据市场份额的83%,以上数据经药智数据库(https://db.yaozh.com/xszb)查阅获取。在众多三七总皂苷市售制剂中,只有血塞通注射液、注射用血塞通(冻干)、血栓通注射液、注射用血栓通(冻干)进入国家基本药物目录。由于具备更高的制备工艺与稳定性,注射用血栓通和注射用血塞通的冻干粉已经逐渐成为三七总皂苷的主要剂型。相比较而言,三七总皂苷口服制剂的市场占有率偏低。
然而,静脉注射血栓通和血塞通可能会出现恶心呕吐、皮疹、荨麻疹等不良反应,且患者依从性往往较差[45-46]。眼内注射给药后也容易引起眼部感染、出血及视网膜脱落等,且治疗费用较为昂贵[47]。对于口服给药方式,患者依从性较好,但三七总皂苷需要经过全身吸收入血,并透过血眼屏障运送至病灶发挥治疗效果[48],且三七总皂苷在胃部不稳定,其分子量大,渗透性低,故药物在眼部组织的浓度相对较低,导致治疗效果不佳,频繁给药更容易出现全身毒性等不良反应[49]。鉴于以上局限性,开发三七总皂苷新剂型以增加三七总皂苷的溶解度、延长体内作用时间、提高生物利用度和减少不良反应仍是亟需解决的关键科学问题。
5 制剂技术开发三七总皂苷新剂型众多学者为提高三七总皂苷的生物利用度,开发了一系列新剂型,包括注射用微乳、眼用凝胶、口服肠溶性微丸、缓释片、微球、微乳、脂质体等,并研发了新的给药途径,如经皮给药、肺部给药、鼻腔给药,为用于治疗DR三七总皂苷制剂的开发提供参考。
5.1 注射用微乳微乳是由水相、油相、表面活性剂、助表面活性剂按一定比例自发形成的一种粒径≤200 nm的分散体系,具有黏度低、增加难溶药物溶解度、热力学稳定、制备简单、生物相容性好、注射时疼痛感轻等优点。从经济方面来说,生产注射用微乳的设备简单,辅料价格低,操作方便,实验周期短,经济效益较高。邢月等[50]以大豆磷脂、油酸聚乙二醇甘油酯制备三七总皂苷微乳,粒径在(170.23±0.91)nm,测得人参皂苷Rg1、三七皂苷R1的质量分数分别为1.983%、0.606%。家兔耳缘静脉注射0.34 mL微乳(剂量为6.74 mg/kg)和1.97 mL注射用血栓通(冻干)溶液(以人参皂苷Rg1计),采用液相色谱-串联质谱(LC-MS/MS)法进行眼部房水部位的药代动力学研究,结果发现与注射用血栓通(冻干)溶液组相比,微乳组与注射用血栓通(冻干)组人参皂苷Rg1、三七皂苷R1的达峰时间(tmax)基本相同,人参皂苷Rg1、三七皂苷R1的达峰浓度(Cmax)分别提高了2.1、6.6倍、药时曲线下面积(AUC0~8 h)分别提高了1.9、7.2倍,两组分的生物利用度分别为(290.62±63.64)%和(587.78±148.07)%,说明三七总皂苷微乳中的油相增强其亲酯性在眼内的消除速度较慢,进一步提高了三七总皂苷血眼屏障的渗透性。此外,微乳粒径较小,与眼部接触面积相对较大,利于透过血眼屏障,增强药物吸收能力。
5.2 眼用凝胶凝胶剂是指药物与能形成凝胶的辅料制成的均一、混悬或乳剂型的乳胶稠厚液体或半固体制剂。眼用凝胶一般为水凝胶,与普通滴眼液相比,具有载药量大、黏附作用强、眼部滞留时间长、能够释放及眼部生物利用度高、辅料成本低、利于大批量生产等优点。根据凝胶形成的机制可以分为温度敏感型、pH敏感型、离子敏感型等。Lu等[51]以pH敏感聚合物卡波姆940和增稠剂羟丙基甲基纤维素E4M作为眼用凝胶基质,制备三七总皂苷pH敏感型凝胶。以家兔为研究对象,三七总皂苷凝胶与注射用血栓通体内药代动力学结果表明,凝胶组中人参皂苷Rg1和三七皂苷R1的Cmax分别是注射用血栓通的1.89、1.74倍,人参皂苷Rg1和三七皂苷R1在凝胶组的生物利用度分别为(6 322.35±2 723.59)%、(8 167.25±1 342.50)%,这是由于在非生理条件下,三七总皂苷凝胶为自由流动液体,给药后在眼部的pH条件下形成凝胶,可以延长药物滞留时间,从而提高药物生物利用度。
5.3 缓释片缓释片具有延长药物有效浓度作用时间、降低药物峰谷浓度波动的特点。与普通片剂相比,具有减少患者服药次数、经济实惠、降低不良反应等优势。冯亮等[52]采用粉末直接压片法,将三七总皂苷粉末、乙基纤维素、微晶纤维素均匀混合后,加入润滑剂硬脂酸镁和助流剂微粉硅胶混匀,直接压片。在Beagle犬体内的药代动力学实验发现,与市售血塞通片相比,三七总皂苷缓释片tmax延后,平均滞留时间(MRT)延长,但缓释片与普通片的AUC基本相同。其中,人参皂苷Rg1、人参皂苷Rb1及三七皂苷R1的tmax分别延长了2.5、1.3、1.5倍;MRT分别延长了1.7、2.0、2.3倍,表明缓释片与普通片相比起到了一定的缓慢释放作用。
5.4 口服脂质体脂质体是一种将药物包封于类脂质双分子层中的新型载药系统。脂质体一般由磷脂、胆固醇等内源性物质组成,生物相容性良好,与细胞具有亲和性,稳定性高,成药性好,可以改善口服药物的生物利用度。吕竟夷等[53]采用薄膜分散法制备三七总皂苷口服胆盐脂质体,以市售血栓通胶囊和注射用血栓通作为对照,分别进行血栓通胶囊和胆盐脂质体制备的大鼠灌胃实验、注射用血栓通尾静脉实验,取血进样,进行体内药代动力学研究,结果发现血栓通胶囊的tmax为1.5 h,制备三七总皂苷口服胆盐脂质体的tmax为2.6 h,表明自制胆盐脂质体具有一定的缓释作用,延长了三七总皂苷的吸收时间,两者Cmax基本相同,自制胆盐脂质体与血栓通胶囊的相对生物利用度为166.72%,胆盐脂质体的绝对生物利用度是血栓通胶囊的1.7倍。
5.5 肠溶微丸肠溶微丸能够有效防止三七总皂苷在胃部被酸和酶破坏,其包被的肠溶性外衣可以使三七总皂苷在肠段崩解、吸收。但从经济层面来说,制备微丸多采用挤出滚圆制丸法,制备难度较高,且收率不高。因此,开发高性能新辅料或改进制备技术是肠溶微丸的突破方向[54-55]。赖春花等[56]采用挤出滚圆技术制备三七总皂苷丸心,再以丙烯酸树脂类材料EudragitL30D-55制作包衣,避免了三七总皂苷在胃部遭到降解,其抗酸性较好,但未进行体内药代动力学研究。
6 展望随着中国人口老龄化加剧及生活水平提高,DR患者数量可能会越来越多,形势较为严峻。虽然三七总皂苷通过多靶点、多通路治疗DR效果较好,但DR的发病机制及三七总皂苷治疗DR的机制仍不明确。本文总结了DR的主要发病机制与氧化应激、炎症和细胞因子上调有关。国内外学者除了通过临床试验或动物实验的方式研究三七总皂苷治疗DR的相关机制,同时也进行了网络药理学和分子对接研究,从理论上探索治疗DR的潜在机制。DR的治疗方式众多,玻璃体切除术和全视网膜激光光凝术会对患者的眼部造成创伤,且术后并发症较多,手术费用昂贵。中药单体和复方对DR具有较好的治疗效果,但对晚期DR治疗效果欠佳,且需多次服药,患者的依从性相对较差。纳米技术的发展为开发三七总皂苷等中药单体和复方新剂型提供了可能,一定程度上克服了常规剂型溶解性差、生物利用度低等问题。目前,三七总皂苷投入生产和临床应用的剂型不多,用于临床的制剂商品名为血塞通或血栓通。市售血塞通或血栓通的剂型包括普通片剂、胶囊剂、滴丸、注射液和注射用干粉,值得注意的是注射剂较口服剂型的市场效益更高,可能归因于其更高的稳定性和疗效。当前其他大部分新剂型仍然处于研究阶段,主要包括口服缓释片、渗透泵片、肠溶微丸等。由于眼部结构的特殊性,口服三七总皂苷需要经过全身吸收入血,并透过血眼屏障运送至病灶才能发挥治疗效果,因此开发眼用局部给药的剂型更利于三七总皂苷治疗DR。普通滴眼剂具有配制容易、使用方便等优点,但溶液滴眼后会立即被结膜囊内的泪液稀释,并很快从泪道排出。为延长作用时间,增加药物渗透性,降低毒性,开发三七总皂苷的眼用凝胶、眼用脂质体和眼用药膜是未来剂型开发的主要方向。总之,DR的复杂性无疑对科学工作者提出更多挑战,分析并鉴别DR的发病机制及病理特征,探索包括三七总皂苷在内的各种药物治疗DR的潜在机制,开发最佳剂型,将会有利于更多的临床医务工作者和科研工作者早日为治疗DR提出更有效的方案。制剂技术开发三七总皂苷新剂型的典型实例见表 1。
| [1] |
AL-ZABADI H, TAHA I, ZAGHA R. Clinical and molecular characteristics of diabetic retinopathy and its severity complications among diabetic patients: a multicenter cross-sectional study[J]. Journal of Clinical Medicine, 2022, 11(14): 3945. DOI:10.3390/jcm11143945 |
| [2] |
LEE R, WONG T Y, SABANAYAGAM C. Epidemiology of diabetic retinopathy, diabetic macular edema and related vision loss[J]. Eye and Vision, 2015, 2(1): 17. DOI:10.1186/s40662-015-0026-2 |
| [3] |
SUCIU C I, SUCIU V I, CUTAS A, et al. Interleaved optical coherence tomography: clinical and laboratory biomarkers in patients with diabetic macular edema[J]. Journal of Personalized Medicine, 2022, 12(5): 765. DOI:10.3390/jpm12050765 |
| [4] |
郝兆虎. 糖尿病视网膜病变[J]. 开卷有益-求医问药, 2021, 41(12): 41-42. |
| [5] |
PORTA M. Endothelium: the main actor in the remodelling of the retinal microvasculature in diabetes[J]. Diabetologia, 1996, 39(6): 739-744. DOI:10.1007/BF00418548 |
| [6] |
SCHALKWIJK C G, STEHOUWER C D A. Vascular complications in diabetes mellitus: the role of endothelial dysfunction[J]. Clinical Science, 2005, 109(2): 143-159. DOI:10.1042/CS20050025 |
| [7] |
万文萃, 龙洋. 糖尿病视网膜病变的流行病学、病因学与发病机制研究现状[J]. 眼科新进展, 2022, 42(9): 673-679. |
| [8] |
HALL A P. Review of the pericyte during angiogenesis and its role in cancer and diabetic retinopathy[J]. Toxicologic Pathology, 2006, 34(6): 763-775. DOI:10.1080/01926230600936290 |
| [9] |
YANG S T, ZHANG J Y, CHEN L L. The cells involved in the pathological process of diabetic retinopathy[J]. Biome-dicine & Pharmacotherapy, 2020, 132(7): 110-118. |
| [10] |
MARTIN A R, BAILIE J R, ROBSON T, et al. Retinal pericytes control expression of nitric oxide synthase and endothelin-1 in microvascular endothelial cells[J]. Microvascular Research, 2000, 59(1): 131-139. DOI:10.1006/mvre.1999.2208 |
| [11] |
BAIN S C, KLUFAS M A, HO A, et al. Worsening of diabetic retinopathy with rapid improvement in systemic glucose control: a review[J]. Diabetes, Obesity & Metabolism, 2019, 21(3): 454-466. |
| [12] |
AHSAN H. Diabetic retinopathy: biomolecules and multiple pathophysiology[J]. Diabetes & Metabolic Syndrome, 2015, 9(1): 51-54. |
| [13] |
COUCHA M H, ELSHAER S L, ELDAHSHAN W S, et al. Molecular mechanisms of diabetic retinopathy: potential therapeutic targets[J]. Middle East African Journal of Ophthalmology, 2015, 22(2): 135-144. DOI:10.4103/0974-9233.154386 |
| [14] |
ANDERSON R E, RAPP L M, WIEGAND R D. Lipid peroxidation and retinal degeneration[J]. Current Eye Research, 1984, 3(1): 223-227. DOI:10.3109/02713688408997203 |
| [15] |
CECILIA O M, JOSÉALBERTO C G, JOSÉN P, et al. Oxidative stress as the main target in diabetic retinopathy pathophysiology[J]. Journal of Diabetes Research, 2019, 20(19): 8562-8578. |
| [16] |
万光明, 薛瑢. 从视网膜氧化应激与微血管改变谈糖尿病视网膜病变的发病机制和防治策略[J]. 眼科新进展, 2022, 42(7): 505-509. |
| [17] |
陈焓, 李志洪. 血清VEGF、HIF-1α及Hcy与2型糖尿病视网膜病变的相关性[J]. 川北医学院学报, 2022, 37(2): 220-223. |
| [18] |
YAMAGISHI S, NAKAMURA K, MATSUI T, et al. Pigment epithelium-derived factor inhibits advanced glycation end product-induced retinal vascular hyperpermeability by blocking reactive oxygen species-mediated vascular endothelial growth factor expression[J]. The Journal of Biological Chemistry, 2006, 281(29): 20213-20220. DOI:10.1074/jbc.M602110200 |
| [19] |
DAS EVCIMEN N, KING G L. The role of protein kinase C activation and the vascular complications of diabetes[J]. Pharmacological Research, 2007, 55(6): 498-510. DOI:10.1016/j.phrs.2007.04.016 |
| [20] |
BEHL T, KOTWANI A. Potential of angiotensinⅡreceptor blockers in the treatment of diabetic retinopathy[J]. Life Sciences, 2017, 176(1): 1-9. |
| [21] |
杨红申, 王来, 杨卫, 等. 白三烯受体拮抗剂对致敏大鼠血管内皮生长因子及其受体表达的影响[J]. 中华结核和呼吸杂志, 2009, 32(3): 177-181. |
| [22] |
薛晓彤, 曹明芳. NF-κB在糖尿病视网膜病变中的研究进展[J]. 中医临床研究, 2020, 12(7): 146-148. |
| [23] |
侯鹏飞, 马楼艳, 杜军辉. 炎症在糖尿病视网膜病变中的作用机制[J]. 职业与健康, 2017, 33(10): 1438-1440. |
| [24] |
ZHANG M Y, ZHOU M, CAI X, et al. VEGF promotes diabetic retinopathy by upregulating the PKC/ET/NF-κB/ICAM-1 signaling pathway[J]. European Journal of Histochemistry, 2022, 66(4): 3522. |
| [25] |
孙丽艳, 张默涵, 张红丹. 三七总皂苷的药理作用研究进展[J]. 世界最新医学信息文摘, 2016, 16(82): 29-30. |
| [26] |
梁晓莲, 刘纤纤, 李文莉, 等. 三七总皂苷药理作用及临床应用研究进展[J]. 湖北农业科学, 2021, 60(6): 15-19. |
| [27] |
ZHANG Y, CHI X Q, WANG Z, et al. Protective effects of Panax notoginseng saponins on PME-Induced nephrotoxicity in mice[J]. Biomedecine&Pharmacotherapie, 2019, 116(15): 1089-1100. |
| [28] |
国家中医心血管病临床医学研究中心, 中国医师协会中西医结合医师分会, 中国中西医结合学会活血化瘀专业委员会, 等. 三七总皂苷制剂临床应用中国专家共识[J]. 中国中西医结合杂志, 2021, 41(10): 1157-1167. |
| [29] |
WANG Q H, KUANG N, HU W Y, et al. The effect of Panax notoginseng saponins on oxidative stress induced by PCV2 infection in immune cells: in vitro and in vivo studies[J]. Journal of Veterinary Science, 2020, 21(4): e61. DOI:10.4142/jvs.2020.21.e61 |
| [30] |
黄家林, 田代雄. 三七总皂苷抗炎免疫药理研究进展[J]. 中华中医药杂志, 2016, 31(11): 4657-4660. |
| [31] |
HU S N, LIU T T, WU Y L, et al. Panax notoginseng saponins suppress lipopolysaccharide-induced barrier disruption and monocyte adhesion on bEnd.3 cells via the opposite modulation of Nrf2 antioxidant and NF-κB inflammatory pathways[J]. Phytotherapy Research, 2019, 33(12): 3163-3176. DOI:10.1002/ptr.6488 |
| [32] |
FAN Y, QIAO Y, HUANG J M, et al. Protective effects of Panax notoginseng saponins against high glucose-induced oxidative injury in rat retinal capillary endothelial cells[J]. Evidence-Based Complementary and Alternative Medicine, 2016, 201(13): 5326-5332. |
| [33] |
郭妮. 抗氧化应激在糖尿病周围神经病变治疗中的作用研究[J]. 右江民族医学院学报, 2013, 35(5): 678-680. |
| [34] |
FAN C L, MA Q, XU M, et al. Ginsenoside Rb1 attenuates high glucose-induced oxidative injury via the NAD-PARP-SIRT axis in rat retinal capillary endothelial cells[J]. International Journal of Molecular Sciences, 2019, 20(19): 4936. DOI:10.3390/ijms20194936 |
| [35] |
LI R L, WANG J X, CHAI L J, et al. Xueshuantong for injection (lyophilized) alleviates streptozotocin-induced diabetic retinopathy in rats[J]. Chinese Journal of Integrative Medicine, 2020, 26(11): 825-832. DOI:10.1007/s11655-020-3088-5 |
| [36] |
CHIBBER R, BEN-MAHMUD B M, CHIBBER S, et al. Leukocytes in diabetic retinopathy[J]. Current Diabetes Reviews, 2007, 3(1): 3-14. |
| [37] |
朱琳, 徐云生. 糖尿病视网膜病变炎症机制与中医药治疗研究进展[J]. 海南医学院学报, 2022, 28(18): 1435-1440. |
| [38] |
李彬, 张大传, 李学望, 等. 人参皂苷Rg1抑制NLRP3炎症小体对2型糖尿病小鼠视网膜病变的保护作用[J]. 中国中药杂志, 2022, 47(2): 476-483. |
| [39] |
丁杨, 胡容. NLRP3炎症小体激活及调节机制的研究进展[J]. 药学进展, 2018, 42(4): 294-302. |
| [40] |
田丽敏. 三七总皂苷对氧诱导新生小鼠视网膜病变新生血管的作用[D]. 恩施: 湖北民族学院, 2017.
|
| [41] |
ZHOU P, XIE W J, MENG X B, et al. Notoginsenoside R1 ameliorates diabetic retinopathy through PINK1-dependent activation of mitophagy[J]. Cells, 2019, 8(3): 213. |
| [42] |
王崑仑, 赵修华, 祖元刚, 等. 三七总皂苷原粉和超微粉的理化性质比较研究[J]. 植物研究, 2011, 31(4): 508-512. |
| [43] |
傅萍, 刘仲义. 指纹图谱测定注射用血塞通、血栓通注射液及注射用血脉通的化学成分[J]. 华西药学杂志, 2007, 22(1): 76-78. |
| [44] |
陈雅慧, 傅春升, 孙爱萍, 等. 三七总皂苷制剂研究进展[J]. 中南药学, 2018, 16(6): 812-816. |
| [45] |
王怡鑫, 蒋刚, 蔡红, 等. 我院及成都地区血栓通注射液不良反应分析[J]. 中成药, 2017, 39(3): 660-664. |
| [46] |
彭佑武. 38例注射用血塞通不良反应临床分析[J]. 国外医药(抗生素分册), 2014, 35(2): 88-89, 95. |
| [47] |
DEDANIA V S, BAKRI S J. Systemic safety of intravitreal anti-vascular endothelial growth factor agents in age-related macular degeneration[J]. Current Opinion in Ophthalmology, 2016, 27(3): 224-243. |
| [48] |
陈祖基. 眼病的药物治疗[J]. 中华眼科杂志, 1997, 33(2): 154-159. |
| [49] |
费倩倩. 基于斑马鱼幼鱼模型与代谢组学技术的三七总皂苷毒性及其机制研究[D]. 南京: 南京中医药大学, 2019.
|
| [50] |
邢月, 卢鹏, 闫宏丽, 等. 三七总皂苷微乳在家兔眼部的药动学研究[J]. 中成药, 2020, 42(1): 7-11. |
| [51] |
LU P, WANG R X, XING Y, et al. Development and evaluation of Panax notoginseng saponins contained in an in situ pH-triggered gelling system for sustained ocular posterior segment drug delivery[J]. Acupuncture and Herbal Medicine, 2021, 1(2): 107-121. |
| [52] |
冯亮, 蒋学华, 王凌. 三七总皂苷缓释片的释放性能及体内外相关性研究[J]. 中国药业, 2009, 18(21): 18-20. |
| [53] |
吕竟夷, 梁丽玲. 三七总皂苷口服脂质体的制备及大鼠体内药动学研究[J]. 中南药学, 2017, 15(7): 902-907. |
| [54] |
庄重, 游冬梅, 李金龙, 等. 兰索拉唑肠溶微丸制备工艺及稳定性研究[J]. 沈阳药科大学学报, 2018, 35(6): 437-442. |
| [55] |
韩敏. 新型肠溶包衣材料水分散体的制备及性能研究[D]. 杭州: 浙江大学, 2014.
|
| [56] |
赖春花, 郑琴, 杨明, 等. 三七总皂苷肠溶微丸的制备及处方工艺优化[J]. 中国中药杂志, 2009, 34(11): 1359-1363. |
| [57] |
张洪, 黄徐英. 三七总皂苷壳聚糖缓释微球的制备及体外释放特性研究[J]. 广东药学院学报, 2006, 22(5): 479-482. |
| [58] |
钟玲, 臧志和. 三七总皂苷微孔渗透泵控释片体外释放度研究[J]. 中成药, 2007, 29(6): 821-824. |
| [59] |
韩旻, 傅韶, 方晓玲. 三七总皂苷油包水微乳的处方筛选及体内外评价[J]. 药学学报, 2007, 42(7): 780-786. |
| [60] |
朱春燕, 陈卫. 以卡波普为黏附材料的三七总皂苷生物黏附片的研制与体外评价[J]. 中国药学杂志, 2007, 42(24): 1877-1880. |
| [61] |
徐白, 沈蕴琪, 方晓玲, 等. 三七总皂苷复方脂质体凝胶剂的制备及皮肤给药研究[J]. 中国临床药学杂志, 2007, 16(3): 144-148. |
| [62] |
沈央, 方晓玲. 三七总皂苷脂质体的药剂学性质及大鼠肺部给药药动学研究[J]. 中草药, 2004, 35(7): 745-749. |
| [63] |
吴云娟, 沙先谊, 李婵, 等. 星点设计效应面优化法优化三七总皂苷鼻腔用粉雾剂[J]. 中成药, 2005, 27(1): 10-15. |
 2024, Vol. 43
2024, Vol. 43