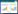文章信息
- 张晓晓, 战秀俊, 张庆瑞, 姜其宝, 李晓格, 贾丽, 赵晶, 姜苗苗
- ZHANG Xiaoxiao, ZHAN Xiujun, ZHANG Qingrui, JIANG Qibao, LI Xiaoge, JIA Li, ZHAO Jing, JIANG Miaomiao
- 大血藤多酚组分的化学表征及抗氧化活性研究
- Study on chemical characterization and antioxidant activity of polyphenols from Sargentodoxa cuneata
- 天津中医药大学学报, 2024, 43(5): 390-399
- Journal of Tianjin University of Traditional Chinese Medicine, 2024, 43(5): 390-399
- http://dx.doi.org/10.11656/j.issn.1673-9043.2024.05.02
-
文章历史
收稿日期: 2023-11-16
2. 组分中药国家重点实验室, 天津 301617;
3. 现代中医药海河实验室, 天津 301617;
4. 首都医科大学附属北京同仁医院口腔科, 北京 100730
2. State Key Laboratory of Component-Based Chinese Medicine, Tianjin 301617, China;
3. Haihe Laboratory of Modern Chinese Medicine, Tianjin 301617, China;
4. Department of Stomatology, Beijing Tongren Hospital, Capital Medical University, Beijing, 100730, China
大血藤(Sargentodoxa cuneata(Oliv.)Rehd. et Wils.)为木通科(Lardizabalaceae)大血藤属(Sargentodoxa)的干燥藤茎。最早以血藤为名,又名红藤,大活血等。主产于江苏、湖北、广西和河南等地[1]。至今已有900多年的历史,其民间药方众多,可外敷也可煎服,临床上多用于治疗类风湿性关节炎、结肠炎、阑尾炎、子宫内膜异位症和盆腔炎等疾病[2]。大血藤中富含多酚类物质且具有抗氧化活性,在清除DPPH·和ABTS·,吸收过氧自由基(ORAC)以及抑制AAPH诱导的超螺旋质粒DNA链断裂的方面活性显著[3]。大血藤中多酚类包括一些大极性成分如红景天苷和热不稳定成分等,为了最大程度地提取大血藤多酚类成分,本实验改变以往对总多酚成分的提取方法,采用甲醇冷浸和70%乙醇-水加热回流相结合的方式对大血藤的干燥藤茎进行提取。在对所提取的总酚类成分进行含量测定时,2020版《中国药典》中新增了总酚含量的测定标准—福林酚。目前文献研究中大血藤多酚含量的测定多采用Folin-Ciocalteu法,以没食子酸为标准品,紫外法测定在760 nm波长处的吸光度,这和《中国药典》规定的大血藤的多酚含量测定相一致。但Folin-Ciocalteu法反应的确切化学性质尚不清楚,且目前报道的不同样品中多酚含量的测定条件都不相同,原因可能是该法会受到样品中多酚的类型和数量的影响,故本实验对最大吸收波长进行筛选,选择与提取物中总酚成分相适应的波长,更精确的对其进行含量测定。然后对提取成分进行化学表征,推测提取物中总酚成分的类型,希望能进一步丰富该药材的物质研究基础。最后,使用DPPH、ABTS法评价大血藤提取物体外抗氧化活性,为后期研究的开展提供一定的参考依据。
1 仪器与试药 1.1 仪器超高液相色谱仪(美国Waters公司);多功能酶标仪(瑞士TECAN公司);超高效液相色谱-四极杆-静电场轨道阱高分辨质谱(美国赛默飞世尔科技公司);色谱柱(美国Waters公司)。
1.2 试药Folin & Ciocalteu试剂(批号:47641)、1,1-二苯基-2-苦基肼(批号:D9132,DPPH)均由美国Merck公司提供;Na2CO3(分析纯,天津市风船化学试剂科技有限公司);K2S2O3(批号:P823296,上海麦克林生化科技有限公司);2,2-联氨-二(3-乙基苯并噻唑啉-6-磺酸)二铵盐(批号:P823296,上海生工生物工程股份有限公司);Trolox(批号:S30953)、隐绿原酸(批号:B21587)、新绿原酸(批号:B21396)均由上海源叶生物科技有限公司提供;甲醇、乙腈(色谱级,美国Fisher公司)。
大血藤药材(产地:江苏,批号:20181222)购自北京本草方源药业集团有限公司。经天津中医药大学中医药研究院吴红华副研究员鉴定为木通科大血藤属植物大血藤Sargentodoxa cuneata(Oliv.)Rehd.et Wils.的干燥藤茎。
2 实验方法 2.1 大血藤提取物的制备称取约500 g大血藤的干燥藤茎,粉碎,加入5 L甲醇于室温浸泡2次,每次72 h,将得到的大血藤冷浸液进行抽滤、减压浓缩,并控制温度在35 ℃以下,得到提取物浸膏1。剩余的药渣用5 L的70%乙醇加热回流提取3次,每次2 h,将得到的大血藤提取液进行抽滤、减压浓缩,得到提取物浸膏2。将上述大血藤浸膏1和浸膏2合并后,加入适量纯水混悬均匀,浓缩得到浓度适宜的水的混悬液。随后,该混悬液进行真空冷冻干燥,得到大血藤提取物的冻干粉末84.1 g,留后续相关实验使用。
2.2 Folin-Ciocalteu法测定总多酚含量 2.2.1 Na2CO3溶液的制备精密称取10.000 3 g无水Na2CO3于50 mL容量瓶中,加入屈臣氏蒸馏水溶解,并定容至刻度线处,充分振荡摇匀,室温放置,备用。
2.2.2 含量测定供试品溶液的制备精密称取“2.1项”的大血藤提取物粉末6.00 mg于棕色离心管中,加70%甲醇水10.0 mL,充分振荡混匀,超声2 min并涡旋5 min后离心(14 000 r/min,10 min)。取上清液过0.22 μm微孔滤膜,收集洗脱液于新的棕色离心管中,得到浓度为600 μg/mL的供试品溶液。
2.2.3 没食子酸对照品的制备精密称取没食子酸标准品5.00 mg,同上述“2.2.2项”处理方法一致,得到浓度为500 μg/mL的对照品溶液1。精确量取800 μL的对照品溶液1于棕色EP管中加1200 μL的70%甲醇水,涡旋5 min得到浓度为200 μg/mL的对照品溶液2。
2.2.4 优化测定波长精密量取供试品溶液、对照品溶液2、70%甲醇水溶液400 μL,分别置于10 mL的棕色容量瓶中,加6 mL的水,充分振荡摇匀;再加入0.5 mL的福林酚试剂,充分振荡摇匀;0.5~8 min内加入1.5 mL的20%碳酸钠溶液,并加水至容量瓶刻度线处,充分振荡摇匀。在75 ℃水浴中放置10 min,取反应后的溶液200 μL,加入到96微孔板中,设置3个复孔,在400~800 nm波长范围内每隔20 nm测定吸光度,做三个平行实验取平均值,其中70%甲醇水为空白对照组调零。绘制吸光度曲线,确定最佳测定波长。
2.2.5 没食子酸标准曲线的测定精确量取200、400、600、800、1000、1200、1400、1 600 μL对照品溶液1于5.0 mL棕色EP管中,加入适量70 %的甲醇水配制成浓度为50、100、150、200、250、300、350、400 μg/mL。分别准确量取不同浓度的对照品溶液400 μL,按上述“2.2.4项”的测定方法,在最佳测定波长下测定吸光度。每个浓度做三个平行实验取平均值,并绘制标准曲线。
2.2.6 大血藤提取物多酚含量的测定精确量取3份400 μL供试品溶液1,同上述“2.2.5项”的测定方法一致,测定吸光度。带入对照品的标准曲线,计算提取物中多酚的含量。
2.3 大血藤多酚类成分化学表征 2.3.1 化学表征供试品溶液制备同“2.2.2项”的制备方法一致。
2.3.2 对照品溶液的制备精密称取各标准品1.00 mg,加入1 mL的70%甲醇,超声2 min,涡旋5 min混匀,室温下离心(14 000 r/min,10 min),得到浓度为1 mg/mL的标准品溶液,逐级稀释最终配成浓度为200 μg/mL的标准品溶液,分别取适量于waters进样小瓶待测。
2.3.3 大血藤多酚类成分表征的色谱条件和质谱条件色谱条件:色谱柱为ΜPLC-HSS-T3(Waters ACQΜITY ΜPLC®-1.8 μm,2.1×100 mm)(美国Waters公司);流动相为乙腈(A)-0.1%甲酸水溶液(B),洗脱程序:0~2 min,2%~8% A;2~6 min,8% A;6~10 min,8%~12% A;10~24 min,12%~28% A;24~25 min,28%~40%;25~30 min,40% A;30~31 min,40%~95% A;31~35 min,95% A;35~36 min,95%~2% A;36~40 min,2% A;体积流量0.3 ml/min;进样量3 μL。
质谱条件:采用电喷雾离子源,正、负离子检测模式;喷雾电压(IS)(3.0 kV/(3.5 kV;鞘气流量(N2)35 L/h;辅助气流量(N2)10 L/h;毛细管温度:350 ℃;辅助器加热温度350 ℃;一级正、负离子全扫描模式(m/z 100~1500 amu)分辨率70000 FWHM;二级目标离子检测模式分辨率17500 FWHM;碰撞模式为高能量碰撞解离(HCD);碰撞能量为30,40,50。采用Thermo Scientific UltiMate 3000超高效液相质谱仪(美国赛默飞世尔科技公司)进行数据采集。
2.4 大血藤多酚类成分体外抗氧化活性检测 2.4.1 DPPH自由基清除能力测定精密称取5.00 mg的DPPH,置于50 mL棕色容量瓶中,70%甲醇水超声溶解,并定容至刻度线,混匀,即得浓度为0.25 mmoL/L的DPPH自由基溶液,现配现用,4 ℃存放。精密称取上述“2.1项”的大血藤提取物10.00 mg于15 mL的棕色离心管中,加10.0 mL的70%甲醇水溶解,同上述“2.2.2项”下供试品溶液的制备,得到浓度为1 mg/mL的供试品溶液,取640 μL于2.0 mL的棕色EP管中,加360 μL 70%甲醇水振荡混匀,涡旋5 min,得到的母液按照每个浓度2倍的比例依次稀释7个浓度,获得不同浓度的供试品溶液。精密称取Trolox标准品10.00 mg,同上述处理方法一致,得到不用浓度的对照品溶液。通过设置空白对照组来消除提取物本身的影响,分组和反应体系见表 1。将96微孔板置于提前预热到37℃的酶标仪中,每隔5 min在λ=517 nm测定吸光度,一共测定30 min。每组设置3个复孔,平行操作3次,计算IC50值。
DPPH自由基清除活性的计算公式如下:

|
(2-1) |
其中OD样品是DPPH自由基+供试品吸光度值,OD空白是供试品+70%甲醇水吸光度值,OD对照是DPPH自由基+70%甲醇水吸光度值。
2.4.2 ABTS自由基清除能力测定精密称取ABTS 38.41 mg,置于10 mL的棕色容量瓶中,用50%甲醇水溶解,定容至刻度,振荡均匀,即得浓度为7.00 mmoL/L的ABTS甲醇水溶液,现配现用。
精密称取过硫酸溶液钾K2S2O8 6.63 mg,置于10 mL的棕色容量瓶中,用50%的甲醇水溶解,定容至刻度,振荡混匀,即得K2S2O8溶液。
将ABTS甲醇水溶液和K2S2O8溶液等体积混合,置于棕色容量瓶中,振荡混匀,静置,待反应20 h后,用50%甲醇水按1∶3比例稀释即得到浓度为0.88 mmoL/L的ABTS自由基溶液。供试品与对照品溶液如上述DPPH自由基法中制备相同。ABTS自由基清除能力的测定如上述DPPH自由基法相同。分组和反应体系与表 1类似。37 ℃孵育10 min,在λ=734 nm处测定吸光度。每组设置3个复孔,平行操作3次,计算IC50值。其计算公式参照DPPH自由基清除活性的计算公式。
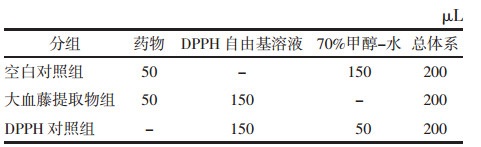
3 结果与分析 3.1 大血藤总多酚含量测定结果简单的紫外-可见分光光度法比色反应常被用于监测植物提取物中多酚的含量,因为和HPLC、HPCE、GC相比,这种方法具有操作起来更快更容易,成本低,准确度和精密度较高等优点[4]。其中Folin-Ciocalteu法常被作为多酚在植物组织中量化的标准方法[5-8],除此之外常见的还有普鲁士蓝法和酒石酸亚铁法。迄今为止,大血藤多酚含量的测定多采用Folin-Ciocalteu法,其也是《中国药典》规定的大血藤多酚含量测定的方法。该反应原理为在碱性溶液中钨钼酸可以将多酚化合物定量氧化,溶液颜色由黄变蓝,显示出一定的紫外吸收[9-10]。文献中很多中药提取物多酚含量测定的波长存在一定的分歧[11-13],所以本实验在400~800 nm对提取物和对照品进行了吸光度的测定。如图 1(A)可知,化合物在740 nm处达到最大吸收,空白对照组的吸光度曲线浮动变化不大。因此选定740 nm作为最佳测定波长。
|
| 图 1 (A)紫外-可见吸收光谱(B)没食子酸标准曲线 |
有文献证实反应体系中最终的甲醇浓度对吸光度值的测定有一定的影响[14],因为甲醇的存在会降低无机盐碳酸钠的溶解度,也就是会降低离子的溶剂化和盐的解离,在一定程度上促进碳酸钠生成沉淀。Cicco和Lattanzio等发现最终反应体系溶液中含有1%~6%的甲醇不会导致沉淀形成[15]。本实验的10 mL容量瓶中甲醇的浓度为2.8%,是在允许范围内。图 1(B)是标准品没食子酸的线性回归曲线。在20~140 μg/mL范围内的线性回归方程为y=0.00 658 2x+0.031 66(R2=0.996 8),将待测样品的吸光度带入回归方程得大血藤提取物中总多酚含量约为32.34%。
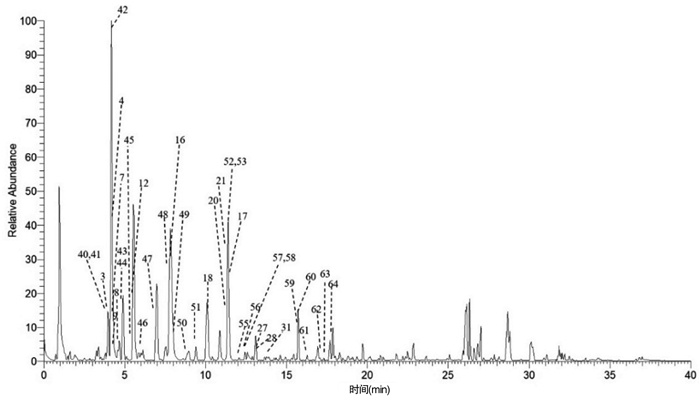
3.2 大血藤多酚类成分总离子流图的建立用70%甲醇水复溶大血藤提取物,采用超高效液相色谱-四极杆-静电场轨道阱高分辨质谱仪(美国赛默飞世尔科技公司)检测,利用Thermo ScientificTM XcaliburTM系统(Thermo Fisher Scientifc,Bremen,Germany)来编辑质谱分析方法、采集和处理数据,根据正、负离子模式下准分子离子峰的精确分子量、同位素丰度比、氮规则等原则,在误差±10 ppm范围预测可能的分子式和化合物结构。大血藤提取物的正、负离子模式下离子流图如图 2和3所示。依据标准品、文献比对和赛默飞Compound Discover 3.0数据匹配等手段,正离子模式下一共推测出个41化学成分,除去和正离子重复的之后20个化学成分后,负离子模式还推测出30个化学成分,但其中存在着一些化合物互为同分异构体,可能还需用标准品进一步比对和确定。这71个化学成分的质谱信息见表3与表4,包括酚酸和酚苷类成分(phenol and phenolic glycosides)、木脂素类成分(lignan)、苯丙素类成分(phenylproionic acids)、黄酮类成分(flavonoids)、三萜类成分(triterpenoids)及其他成分(others)。
|
| 图 2 大血藤提取物正离子模式下的离子流图 |
|
| 图 3 大血藤提取物负离子模式下的离子流图 |
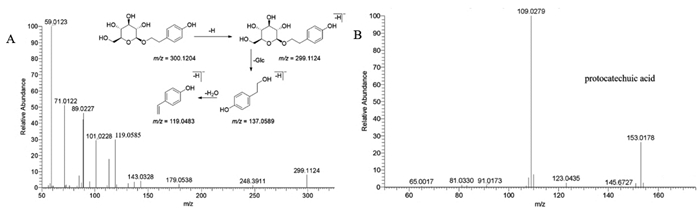
酚酸类及酚苷化合物在负离子模式下相应较好,多以[M-H]-的准分子离子峰形式存在,苷元易发生CO、CO2、H2O等中性分子丢失,而酚苷会先脱去相应的糖,大多数是丢失掉m/z=162的1分子葡萄糖片段,随后丢失CO、CO2等中性分子。化学成分研究表明大血藤含有原儿茶酸、对羟基苯甲酸、香草酸、丁香酸、酪醇、红景天苷、丁香酸葡萄糖苷等化合物。其中,红景天苷是目前文献和中国药典中衡量大血藤质量的重要指标之一,其对照品出峰时间在5.70 min左右,样品出峰时间在5.64 min左右,两者质谱图都对应m/z=299的基峰以及m/z=137和119的特征碎片离子,推测分子式为C14H29O7,两者的质谱信息几乎一致,并与文献[16]对比,故确定此处化合物为红景天苷,其质谱图与裂解方式见图 4A。
|
| 图 4 (A)提取物中红景天苷的质谱图与裂解途径(B)提取物中原儿茶酸的质谱图 |
负离子模式下,出峰时间为4.25 min处给出基峰m/z=315.108 1[M-H]-峰,二级碎片信息为m/z=153.054 1[M-H-Glc](和135.043 5[M-H-Glc-H2O]-,其135.043 5比红景天苷的碎片119.058 5多了16 Da的分子量,根据质谱软件给出的预测分子式C14H20O8和文献[3]比对,初步推测此处该化合物为3,4-二羟基苯乙基葡糖苷,结构比红景天苷在苯环多了1个羟基基团。其苷元为羟基酪醇,在保留时间为4.27 min处给出准分子离子峰155.070 2[M+H]+,误差为-0.456 ppm,碎片离子信息为137.0597[M+H-H2O]+,119.049 3[M+H-2H2O]+,推测此处化合物为羟基酪醇。同理,负离子模式下出峰时间4.62 min处给出准分子离子峰197.044 4[M-H]-,其碎片离子m/z=182.020 6由于CH3(15 Da)的丢失,而m/z=166.997 0另一个甲基的丢失,和文献[3]对比推测此处为丁香酸。在保留时间为4.59 min处,负离子模式下检测到m/z=359.0977[M-H]-的一级质谱信息,对应的分子式为C15H20O10,误差为(1.578 ppm,主要碎片离子为m/z=197.044 1和135.043 5,推测该碎片可能为其母离子失去一分子葡萄糖162 Da残基,紧接着在丢失中性片段CO2而得,推测为丁香酸的六碳糖,再参考本植物所含有的化学成分,推测该处化合物为丁香酸葡萄糖苷。
提取物中原儿茶酸在负离子模式下的出峰时间为4.19 min,根据准分子离子峰[M-H]-为m/z=153.053 9,推测分子式为C7H6O4,且误差符合要求。二级质谱图显示生m/z=109.027 9[M-H-CO2]-的特征离子碎片,与原儿茶酸对照品质谱图(详见图 4B)及文献[17]比对,故确定此处化合物为原儿茶酸。在负离子模式下,保留时间为3.94 min处的准分子离子峰为m/z=315.071 4[M-H]-,质谱软件给出的推测分子式为C13H16O9,误差为(1.128 ppm,符合要求,且给出二级碎片m/z=153.017 8[M-H-Glc]-和109.027 9[M-H-Glc-CO2]-,这和原儿茶酸的碎片几乎一致,推测该处化合物可能为原儿茶酸的六碳糖苷,目前从大血藤中分离出原儿茶酸-3-O-葡萄糖苷和原儿茶酸-4-O-葡萄糖苷,因此推测该峰为原儿茶酸-3-O-葡萄糖苷或原儿茶酸-4-O-葡萄糖苷。
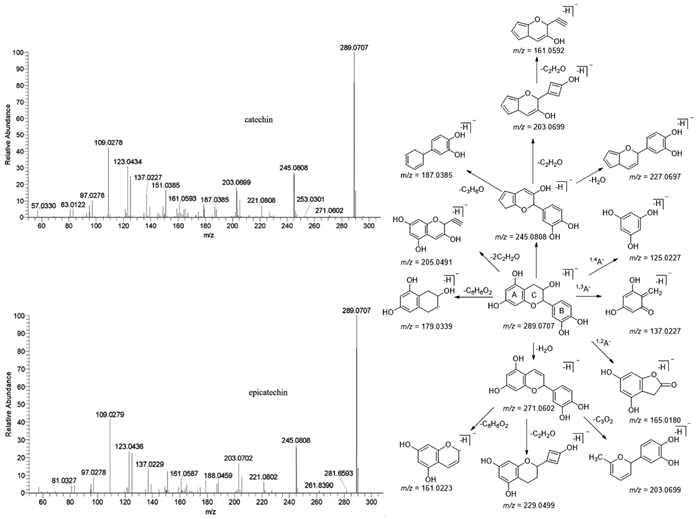
3.2.2 黄酮类化合物解析从大血藤藤茎中分离出来最常见最重要的黄酮类成分是黄烷-3-醇类,比如表儿茶素、儿茶素、原花青素B2以及原花青素的聚合物。儿茶素和表儿茶素均形成m/z=289[M-H]-的母核离子,二级质谱中存在m/z=271[M-H-H2O]-和245[M-H-COO]-等特征碎片离子。查阅文献,依据相关报道[18]推测两者的裂解方式见图 5。
|
| 图 5 提取物中表儿茶素和儿茶素的质谱图与裂解途径 |
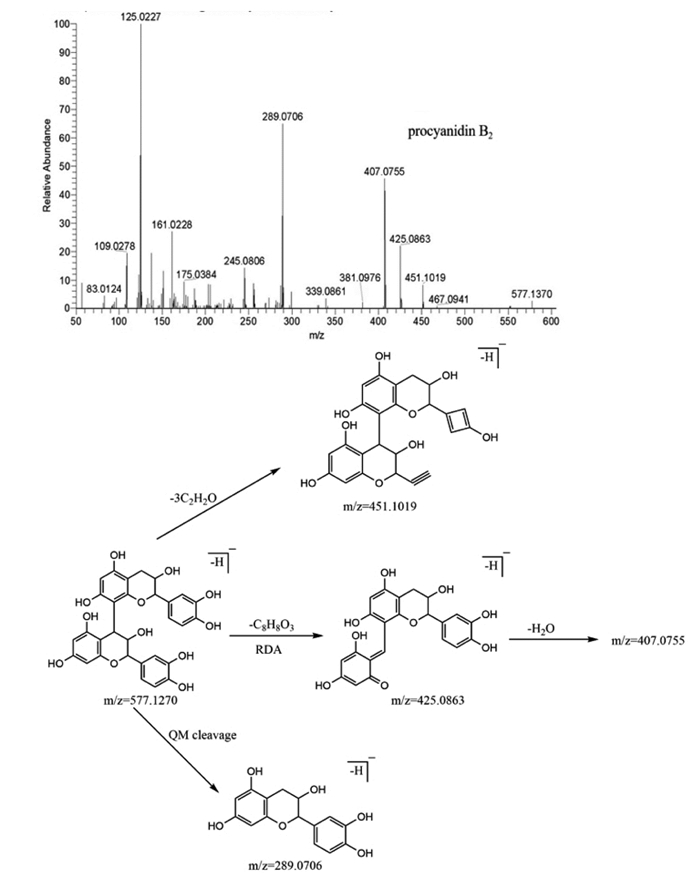
本研究还发现了以表儿茶素/儿茶素为结构单元聚合在一起的成分,并提取出共有的碎片片段为m/z=425、407、289,根据精确相对分子质量和碎片信息,推测可能存在原花青素B2、B type proanthocyanidin tetramer和B type proanthocyanidin的化学成分。以原花青素B2为例,保留时间为10.12 min,负离子模式下,准分子离子峰为577.127 0[M-H]-,推测分子式为C30H26O12,误差为(1.625,符合准确度的要求,与文献比对推测此处化合物为原花青素B2。如图 7所示,原花青素B2发生逆狄尔斯-阿德尔(RDA)产生的m/z=425.086 3的碎片离子峰,紧接着脱水产生m/z=407.075 5的碎片离子峰,而m/z=289.070 6的碎片离子是由原花青素B2发生醌甲基裂解类黄酮聚合键(QM cleavage)产生的,此外,准分子离子峰m/z=577.127 0脱去儿茶素单元和中性片段CO2产生m/z=245.080 6的碎片离子。基于文献[19],具体裂解见图 6。
|
| 图 6 提取物中原花青素B2的质谱图与裂解途径 |
大血藤含有的苯丙素类成分有阿魏酸、咖啡酸、绿原酸、N-反式对香豆酰酪胺等。其中绿原酸作为大血藤药材质量监测的重要指标之一,也具有广泛的有益的生物活性。绿原酸和隐绿原酸、新绿原酸互为同分异构体。在负离子模式下,保留时间为4.84 min、7.98 min和8.73 min都出现了基峰为m/z=353[M-H]-的准分子离子峰,二级碎片较强的峰均为m/z=191或173的碎片离子峰,质谱软件计算出精确分子式均为C16H18O9,初步推测这3个峰为绿原酸及其同分异构体。然后基于对照品比对和文献参考,确定依次为新绿原酸、绿原酸、隐绿原酸。文献[20]中列出三者相关碎片信息如下:m/z=191[M-H-caffeoyl]-、m/z=179[caffeic acid-H]-、m/z=173[M-Hcaffeoyl-H2O]-、m/z=161 [caffeic acid-H-H2O]-、m/z=135[M-H-caffeoyl-CO2]-,三者质谱图与裂解途径如图 7所示。
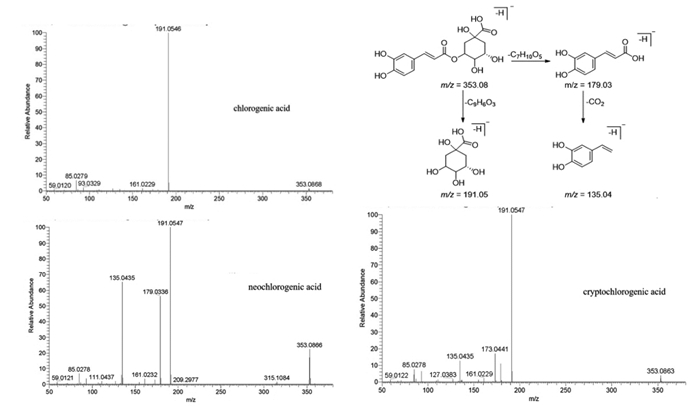
|
| 图 7 提取物中新绿原酸、绿原酸和隐绿原酸的质谱图与裂解途径 |
DPPH自由基清除实验是常用的抗氧化性测定实验[21],反应原理为当体系中加入自由基清除剂时,其会与DPPH自由基反应,使深紫色的DPPH醇溶液褪色。本实验发现在监测的30 min内大血藤提取物抗氧化曲线和对照品Trolox相比受时间影响比较明显,可能是提取物中含有抗氧化物质的种类和含量不同所造成的,如图 8A、8B所示,这也和图 8C所呈现的结果相一致。如图 8C本实验所示,前15 min DPPH和大血藤提取物混合液的吸光度的下降速度较快,而25 min之后混合液吸光度下降的速率与DPPH对照组一致,在这之后观察到的吸光度数值的下降实际是该反应产生的具有颜色的醌类化合物与试剂等发生反应产生无色化合物所引起的吸光度的变化[22],因此大血藤提取物样品与DPPH溶液混合后应该25 min内测定完毕。
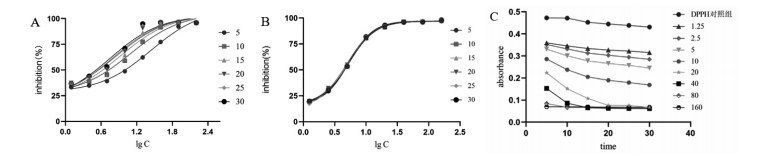
|
| 图 8 (A)大血藤提取物不同反应时间内抗氧化曲线的变化(B)标准品Trolox不同反应时间内抗氧化曲线的变化(C)不同反应时间DPPH和大血藤提取物混合液的吸光度的变化 |
DPPH自由基清除实验中以强抗氧化物质水溶性VE类似物Trolox作为对照,大血藤提取物冻干粉70%甲醇水溶液为待测样品,分别绘制反应25 min后7个不同浓度点的剂量-效应曲线,得到相应的半抑制浓度IC50值为4.88、8.99 μg/mL,说明了大血藤总多酚对DPPH自由基具有一定的清除作用,如图 9所示。
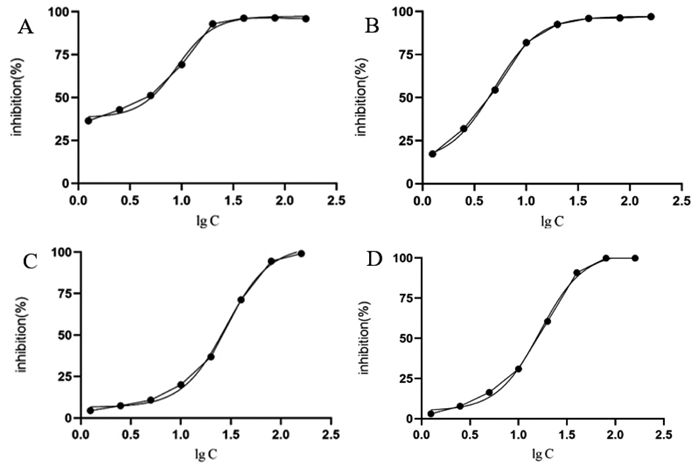
|
| 图 9 大血藤总多酚(A)与Trolox(B)的DPPH自由基清除曲线、大血藤总多酚(C)与Trolox(D)的ABTS自由基清除曲线 |
ABTS在过硫酸钾氧化剂的作用下生成稳定的蓝绿色的ABTS·+,反应体系中存在抗氧化物质时,ABTS·+的产生会被抑制,通过在734 nm处吸光度的变化反应样品的抗氧化能力[23]。通过Trolox和大血藤总多酚的效应-剂量曲线可得两者对ABTS自由基的半抑制浓度IC50值为16.68、28.32 μg/mL,证实两者对ABTS自由基皆有抑制作用,如图 9所示。
4 讨论和结论植物多酚是一类存在于植物体内的多羟基酚类化合物,也是植物体内最丰富的次级代谢产物,具有很强的体外和体内抗氧化活性[24-25],这归于其清除自由基、提供氢原子或电子、螯合金属阳离子的能力,而决定这些能力的关键因素在于植物多酚的结构。植物多酚的结构大致可分为类黄酮类(黄酮醇、黄酮、黄烷醇、二氢黄酮、异黄酮、原花青素)、酚酸类、木脂素类、二苯乙烯类和水解单宁类等[26]。相关化学成分研究表明[27]大血藤藤茎中含有多种多酚类物质。因此,本实验以2020版《中国药典》中规定的大血藤多酚含量的测定方法为参照对其进行总多酚含量测定同时首次进行质谱表征,推测总多酚成分中的详细种类,再通过体外抗氧化实验来评价其抗氧化活性。实验中,由于苷类成分极性较大,用有机溶剂回流提取时提取不完全,热不稳定性成分在加热过程中会发生裂解等变化,所以为了使大极性和热不稳定性的多酚成分最大程度地提取,改变了以往的提取方法,采用了先冷浸后加热回流的方式。由于福林酚法会受到样品中多酚的类型和数量的影响,导致结果不准确,所以实验前先对波长进行筛选,发现740 nm处为最大吸收波长,在此波长下测得总酚含量约为32.34%,该方法可能后续还需要改进和完善,因为特定的样品需要特定的验证方法,这样才会使结果准确可靠。
对大血藤多酚组分研究检索后,发现肖明明等[28]用UV、MS、1H-NMR波谱信息确定了8种多酚成分,除此之外,笔者未见国内外对大血藤多酚组分质谱表征的研究,而本实验通过高分辨质谱对大血藤多酚组分进行质谱检测,快速表征到了大血藤提取物中的多酚组分,共推测鉴定出62个多酚组分,包括28个酚酸和酚苷类成分、13个木脂素类成分、12个苯丙素类成分、9个黄酮类成分,和9个其他成分共71个。其中,基于系统化学成分分离得到的对照品和标准对照品,根据出峰时间和碎片裂解,一共比对确证了红景天苷、绿原酸、表儿茶素、儿茶素、阿魏酸等15个成分;基于文献比对和数据库匹配,一共推断出了56个成分。虽然本实验结合数据库和文献比对推测这71个化学成分中含有13个木脂素类成分,但存在一峰对应多个成分的现象,其后续鉴定工作还需不断完善。最后,体外抗氧化实验表明提取物对DPPH和ABTS自由基都具有一定的清除作用,IC50值分别为4.88 μg/mL、16.68 μg/mL,具有一定抗氧化活性,且DPPH反应时间为25 min即可。
| [1] |
TIAN S, LEI S Q, HU W, et al. Repeated range expansions and inter-/postglacial recolonization routes of Sargentodoxa cuneata (Oliv.) Rehd. Et Wils.(Lardizabalaceae) in subtropical China revealed by chloroplast phylogeography[J]. Molecular Phylogenetics and Evolution, 2015, 85: 238-246. DOI:10.1016/j.ympev.2015.02.016 |
| [2] |
张莹莹, 李诒光, 季巧遇, 等. 大血藤现代研究进展[J]. 亚太传统医药, 2018, 14(11): 81-84. |
| [3] |
YANG L G, YIN P P, CAO X X, et al. Screen for potential candidate alternatives of Sargentodoxa cuneata from its six adulterants based on their phenolic compositions and antioxidant activities[J]. International Journal of Molecular Sciences, 2019, 20(21): 5427. DOI:10.3390/ijms20215427 |
| [4] |
BLAINSKI A, LOPES G C, DE MELLO J C P. Application and analysis of the folin ciocalteu method for the determination of the total phenolic content from Limonium brasiliense L[J]. Molecules, 2013, 18(6): 6852-6865. DOI:10.3390/molecules18066852 |
| [5] |
WOOTTON-BEARD P C, MORAN A, RYAN L. Stability of the total antioxidant capacity and total polyphenol content of 23 commercially available vegetable juices before and after in vitro digestion measured by FRAP, DPPH, ABTS and Folin-Ciocalteu methods[J]. Food Research International, 2011, 44(1): 217-224. DOI:10.1016/j.foodres.2010.10.033 |
| [6] |
CHEN G L, CHEN S G, ZHAO Y Y, et al. Total phenolic contents of 33 fruits and their antioxidant capacities before and after in vitro digestion[J]. Industrial Crops and Products, 2014, 57: 150-157. DOI:10.1016/j.indcrop.2014.03.018 |
| [7] |
MUSCI M, YAO S C. Optimization and validation of Folin-Ciocalteu method for the determination of total polyphenol content of Pu-erh tea[J]. International Journal of Food Sciences and Nutrition, 2017, 68(8): 913-918. DOI:10.1080/09637486.2017.1311844 |
| [8] |
AINSWORTH E A, GILLESPIE K M. Estimation of total phenolic content and other oxidation substrates in plant tissues using Folin-Ciocalteu reagent[J]. Nature Protocols, 2007, 2(4): 875-877. DOI:10.1038/nprot.2007.102 |
| [9] |
SINGLETON V L, ORTHOFER R, LAMUELA-RAVENTS R M. Analysis of total phenols and other oxidation substrates and antioxidants by means of folin-ciocalteu reagent[M]. Amsterdam: Elsevier, 1999: 152-178.
|
| [10] |
SINGLETON V L, ROSSI J A Jr. Colorimetry of total phenolics with phosphomolybdic-phosphotungstic acid reagents[J]. American Journal of Enology and Viticulture, 1965, 16(3): 144-158. DOI:10.5344/ajev.1965.16.3.144 |
| [11] |
MARTINS G R, MONTEIRO A F, DO AMARAL F R L, et al. A validated Folin-Ciocalteu method for total phenolics quantification of condensed tannin-rich açaí(Euterpe oleracea Mart.) seeds extract[J]. Journal of Food Science and Technology, 2021, 58(12): 4693-4702. DOI:10.1007/s13197-020-04959-5 |
| [12] |
CHEN L Y, CHENG C W, LIANG J Y. Effect of esterification condensation on the Folin-Ciocalteu method for the quantitative measurement of total phenols[J]. Food Chemistry, 2015, 170: 10-15. DOI:10.1016/j.foodchem.2014.08.038 |
| [13] |
RAMIREZ-SANCHEZ I, MAYA L, CEBALLOS G, et al. Fluorescent detection of (-)-epicatechin in microsamples from cacao seeds and cocoa products: Comparison with Folin-Ciocalteu method[J]. Journal of Food Composition and Analysis: an Official Publication of the United Nations University, International Network of Food Data Systems, 2010, 23(8): 790-793. |
| [14] |
CICCO N, LANORTE M T, PARAGGIO M, et al. A reproducible, rapid and inexpensive Folin-Ciocalteu micro-method in determining phenolics of plant methanol extracts[J]. Microchemical Journal, 2009, 91(1): 107-110. DOI:10.1016/j.microc.2008.08.011 |
| [15] |
CICCO N, LATTANZIO V. The influence of initial carbonate concentration on the folin-ciocalteu micro-method for the determination of phenolics with low concentration in the presence of me-thanol: A comparative study of real-time monitored reactions[J]. American Journal of Analytical Chemistry, 2011, 2(7): 840-848. DOI:10.4236/ajac.2011.27096 |
| [16] |
唐诚芳, 蒋思萍, 陈彬, 等. LC-MS/MS法分析西藏不同产地大花红景天中主要化学组成[J]. 中山大学学报(自然科学版), 2013, 52(6): 99-103. |
| [17] |
黄斌, 胡燕珍, 李雪, 等. 基于UPLC-Q-TOF-MS技术分析乌蕨中的化学成分[J]. 实用中西医结合临床, 2021, 21(9): 155-159. |
| [18] |
王晴, 卢志威, 刘月红, 等. UPLC-Q-TOF/MSE结合诊断离子过滤方法快速分析大黄中酚类成分[J]. 中国中药杂志, 2017, 42(10): 1922-1931. |
| [19] |
邓莉, 褚仕超, 刘章武, 等. 蚕豆皮中低聚原花青素结构的初步鉴定[J]. 中国酿造, 2013, 32(2): 137-143. |
| [20] |
向青, 王小花, 林慧, 等. HPLC-DAD-Q-TOF-MS/MS法的银黄颗粒主要成分定性与定量研究[J]. 中成药, 2015, 37(1): 105-112. |
| [21] |
IONITA P. The chemistry of DPPH· free radical and congeners[J]. International Journal of Molecular Sciences, 2021, 22(4): 1545. DOI:10.3390/ijms22041545 |
| [22] |
FOTI M C. Use and abuse of the DPPH (·) radical[J]. Journal of Agricultural and Food Chemistry, 2015, 63(40): 8765-8776. DOI:10.1021/acs.jafc.5b03839 |
| [23] |
GULCIN İ. Antioxidants and antioxidant methods: An updated overview[J]. Archives of Toxicology, 2020, 94(3): 651-715. DOI:10.1007/s00204-020-02689-3 |
| [24] |
AFANAS'EV I B, DOROZHKO A I, BRODSKII A V, et al. Chelating and free radical scavenging mechanisms of inhibitory action of rutin and quercetin in lipid peroxidation[J]. Biochemical Pharmacology, 1989, 38(11): 1763-1769. DOI:10.1016/0006-2952(89)90410-3 |
| [25] |
符莎露, 吴甜甜, 吴春华, 等. 植物多酚的抗氧化和抗菌机理及其在食品中的应用[J]. 食品工业, 2016, 37(6): 242-246. |
| [26] |
WANG R F, ZHU W, PENG J M, et al. Lipid rafts as potential mechanistic targets underlying the pleiotropic actions of polyphenols[J]. Critical Reviews in Food Science and Nutrition, 2022, 62(2): 311-324. DOI:10.1080/10408398.2020.1815171 |
| [27] |
ZHANG W, SUN C P, ZHOU S, et al. Recent advances in chemistry and bioactivity of Sargentodoxa cuneata[J]. Journal of Ethnopharmacology, 2021, 270: 113840. DOI:10.1016/j.jep.2021.113840 |
| [28] |
肖明明, 周志红, 赵昕, 等. HSCCC法结合制备型HPLC技术靶向制备分离与鉴定大血藤中的多酚类化合物[J]. 中医药导报, 2018, 24(23): 52-56. |
 2024, Vol. 43
2024, Vol. 43