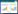文章信息
- 赵浩楠, 张强, 温中庆, 康宁
- ZHAO Haonan, ZHANG Qiang, WEN Zhongqing, KANG Ning
- 补骨脂酚通过线粒体自噬抑制人肝癌Hep3B细胞生长的机制研究
- Mechanism of inducing mitophagy in human hepatocellular carcinoma Hep3B cells by Bakuchiol
- 天津中医药大学学报, 2024, 43(5): 400-406
- Journal of Tianjin University of Traditional Chinese Medicine, 2024, 43(5): 400-406
- http://dx.doi.org/10.11656/j.issn.1673-9043.2024.05.03
-
文章历史
收稿日期: 2023-11-20
2. 天津中医药大学医学技术学院, 天津 301617
2. School of Medical Technology, Tianjin University of Traditional Chinese Medicine, Tianjin 301617, China
肝细胞癌(HCC)是起源于肝细胞的原发性肝癌(PLC),为最常见的恶性肿瘤,其发病率、死亡率高,严重威胁人类健康[1]。然而目前临床上常用于治疗肝癌的药物具有毒副作用强、治疗效果有限等特点。因此,亟须探索高效低毒的肝癌治疗药物[2-3]。
肝癌归属于中医学“癥瘕、积聚、臌胀、肥气、积证、痃癖”等范畴。《医宗必读·积聚》云:“积之成者,正气不足而后邪气踞之”[4-5]。可见,正气亏虚是肝癌发生发展的本质原因。因此,扶正固本法是肝癌的基本治则。扶正固本类中药补骨脂是补骨脂Psoralea corylifolia L.的干燥成熟果实,具有温肾助阳、固精缩尿、温脾止泻之功效。补骨脂酚(BAK)是从补骨脂种子中分离得到的一种异戊二烯酚萜类化合物,是补骨脂的主要活性成分之一。研究表明:BAK对乳腺癌、胃癌、前列腺癌和肝癌等多种恶性肿瘤均有一定的抑制作用,主要通过抑制细胞增殖、诱导细胞凋亡和自噬、降低侵袭和转移等多种途径抑制肿瘤细胞生长或转移[6],然而其在抗肝癌方面的机制研究非常少,仅有的报道显示BAK可显著诱导人肝癌HepG-2细胞发生凋亡,可见,BAK抗肝癌的作用机制有待进一步阐明。
自噬(autophagy)作为二型程序性细胞死亡方式,是真核细胞在自噬相关基因的调控下,利用溶酶体降解自身胞质蛋白和受损细胞器的过程,在肿瘤的发生发展中起着抑制或促进作用[7]。线粒体自噬(mitophagy)属于选择性自噬,当线粒体功能异常时,线粒体被自噬小体选择性包裹并在溶酶体中降解。当线粒体受损时,PINK1(PTEN-induced putative kinase protein 1)稳定在线粒体外膜上,随后将E3泛素连接酶Parkin从细胞质中招募到受损的线粒体,并直接在Ser 65磷酸化Parkin使其激活。Parkin泛素化线粒体蛋白并导致线粒体被双层膜包裹,然后与溶酶体融合。作为特异性地清除受损线粒体的自噬途径,尽管线粒体自噬能够维持线粒体的结构和功能,起到保护细胞的作用,但过度的线粒体自噬会损坏线粒体功能,进而导致细胞死亡[8]。因此,药物作用肿瘤细胞导致线粒体自噬性死亡可以作为肿瘤治疗新策略。基于此,本研究探讨BAK诱导肝癌细胞发生线粒体自噬导致细胞生长抑制的相关机制,为BAK应用于抗肝癌治疗提供实验依据。
1 材料方法 1.1 细胞和试剂人肝癌Hep3B细胞株来源于American Type Culture Collection(ATCC,Manassas,VA,USA)。补骨脂酚(Bakuchiol,BAK)由天津中医药大学王跃飞教授惠赠,经HPLC鉴定纯度大于99.5%,在无菌条件下溶解于二甲基亚砜(DMSO)中,-20 ℃冻存。常用试剂和仪器有:DMEM培养基(美国Gibco公司,货号C11995500BT);胎牛血清(上海逍鹏生物科技有限公司,货号C04001-500);MTT噻唑蓝(北京索莱宝科技有限公司,货号:906M051)、BCA蛋白浓度测定试剂盒(北京索莱宝科技有限公司,货号:PC0020);Hoechst 33342荧光分子探针(Invitrogen);MitoTracker Deep Red FM(Invitrogen);Rhodamine 123(Invitrogen);Anti-p62(Protein Tech,货号:18420-1-AP);Anti-Parkin(Protein Tech,种属:Rabbit/IgG,货号:14060-1-AP);Anti-PINK1(Protein Tech,种属:Rabbit/IgG,货号:23274-1-AP);Anti-p-ULK1(Protein Tech,种属:Rabbit/IgG,货号:80218-1-RR);Anti-LAMP1(Protein Tech,种属:Rabbit/IgG,货号:21997-1-AP);MFN2(Protein Tech,种属:Rabbit/IgG,货号:12186-1-AP);Tom20(Protein Tech,种属:Rabbit/IgG,货号:11802-1-AP);Anti-LC3B(Cell Signaling Technology,种属:Rabbit/IgG,货号:4108);β-actin抗体(ZSGB-bio,货号:TA-09);二抗辣根酶标记山羊抗鼠IgG(ZSGB-bio,货号:bs-0296G-Bio)及山羊抗兔IgG(ZSGB-bio,货号:bs-0295G-Bio);RIPA裂解液(Beyotime,货号:P0013C)公司;ECL化学发光底物(Tanon,货号:180-5001);预染蛋白marker(雅酶,货号:WJ103);PMSF(Sigma,货号:93482)等。
1.2 主要仪器细胞培养箱(力康生物医疗科技控股集团,上海)、生物安全柜(苏净集团安泰公司,苏州)、高速冷冻离心机(力康生物医疗科技控股集团,上海)、灭菌锅(平山制作所株式会社,日本)、倒置显微镜(奥林巴斯有限公司,上海)、酶标仪(美国伯腾有限公司,上海)、垂直电泳仪(北京百晶生物科技有限公司,北京)、电转膜仪(北京百晶生物科技有限公司,北京)等。
1.3 细胞培养将人肝癌Hep3B细胞接种在含有10%胎牛血清的DMEM培养液中(含100 U/mL青霉素,100 mg/mL链霉素),于5%CO2培养箱,37 ℃下恒温培养。待贴壁细胞生长成致密单层时,进行传代培养。弃去原培养液,加入胰酶,于37 ℃孵育3 min。将消化下的细胞悬液倒入离心桶中,加入适量培养液,离心半径16 cm,1 000 rpm离心5 min。弃上清,加入新鲜培养液将细胞吹打均匀,转移至新培养瓶中,然后放入培养箱中继续培养。
1.4 MTT法检测细胞生长抑制率1)BAK对Hep3B细胞增殖的影响:将人肝癌Hep3B细胞以5×103个/孔的密度接种于96孔培养板中,每孔100 μL,培养24 h后,加入不同浓度的BAK(0~160 μmol/L),于37 ℃,5%CO2条件下培养。24 h、48 h或72 h后,每孔加入5 mg/mL MTT 100 μL,孵育2.5~3 h,每孔加入150 μL DMSO溶解,震荡10 min,酶标仪490 nm处测定吸光值,并按公式计算存活率:抑制率(%)=[A490(control)-A490(BAK)]/A490(control)×100%。
2)线粒体自噬抑制剂在BAK引起的Hep3B细胞生长抑制中的作用:本实验中,将Hep3B细胞接种于96孔培养板中,培养24 h后,分别加入0.25和0.5 μmol/L CQ和2 nmol/L Baf-A1预处理细胞1 h[31],然后再加入浓度为68 μmol/L的BAK。作用48 h后,采用MTT法测定细胞的抑制率。
1.5 相差显微镜观察细胞形态变化将3.0×106个Hep3B细胞/孔接种于6孔板中,加入50 μmol/L的BAK作用0、6、12、24和48 h,相差显微镜观察加药BAK后的Hep3B的细胞形态变化,并且详细记录下来,拍照比较其相应变化。
1.6 细胞染色与高内涵成像避光操作,吸走黑色96孔板内的原有培养基,提前配制加入0.4 μg/mL的Hoechst 33342、1 μg/mL Rhodamine 123和0.2 μg/mL的Mitotracker Deep Red FM的培养基,防止孔内细胞变干,加入荧光探针的培养基50 μL/孔于96孔培养板中,包裹锡纸放置于37 ℃、5%CO2细胞恒温培养箱30 min。然后吸出后加入PBS洗3次。防止细胞受损,换高糖DMEM完全培养基避光恢复培养10 min。上机检测选择合适激发波长的Hoechst 33342、Rhodamine 123和Mitotracker Deep Red FM相应的荧光通道,10×至20×物镜下,观察挑选合适的明场细胞,选择拍照区域进行调试,荧光效果最佳时进行拍照。检测BAK对Hep3B细胞的细胞核数量、线粒体质量以及线粒体膜电位的影响。
1.7 细胞图像多参数分析使用Perkin Elmer公司的Harmony 3.0软件对高内涵图像进行量化。数据统计采用SPSS 23.0,单因素方差分析各组数据。给药BAK 0 h组作为对照组,给药BAK组与给药BAK 0 h组进行比较,P<0.05。
1.8 蛋白免疫印迹法检测蛋白表达收集BAK处理后的Hep3B细胞,检测BAK对线粒体自噬相关蛋白表达的影响。加入RIPA裂解液,冰浴条件下裂解30 min后,4 ℃下12 000 rpm离心10 min,离心半径16 cm,收集上清液,使用BCA法测定蛋白浓度。利用10%SDS-聚丙烯酰胺凝胶电泳分离蛋白样品,并转至PVDF膜上。一抗孵育过夜,TBST洗涤3次,二抗孵育1 h,TBST洗涤3次,ECL发光底物显色曝光。
1.9 统计学分析数据以均数±标准差(x±s)表示,采用SPSS 23.0统计软件包进行统计分析,组间均数比较采用单因素方差分析。P < 0.05为差异有统计学意义。
2 结果 2.1 BAK对人肝癌Hep3B细胞的生长抑制作用为了评价BAK对细胞的生长抑制作用,我们用MTT法检测了0~160 μmol/L的BAK对人肝癌Hep3B细胞的影响。实验结果如图 1所示:BAK呈时间剂量依赖性抑制Hep3B细胞增殖,其中48 h的半数抑制浓度(IC50)为(68.1±4.87)μmol/L。结果表明BAK抑制人肝癌Hep3B细胞的生长。
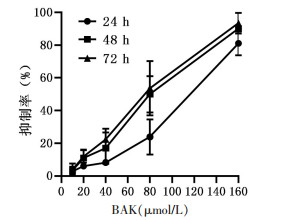
|
| 图 1 BAK对Hep3B细胞增殖的影响(n=4) |
为了明确BAK对人肝癌细胞的影响,我们用相差显微镜观察BAK处理0、6、12、24和48 h后细胞形态的变化,发现正常肝癌细胞在显微镜下观察呈上皮样呈片状的小岛形态,容易抱团聚集叠加生长,细胞饱满,边界清楚。与对照组细胞相比,BAK处理后贴壁细胞减少,细胞变小皱缩,胞浆颜色较深,漂浮细胞增多,说明细胞生长受到抑制。见图 2。

|
| 注:红色箭头表示死细胞,Scale bar=200 μmol/L。 图 2 BAK对Hep3B细胞形态的影响 |
为了探究BAK是否诱导人肝癌细胞线粒体损伤,使用Hochest33342、MitoTracker Deep Red和Rhodamine三种荧光探针染料对人肝癌Hep3B细胞的细胞核和线粒体进行染色,检测加药BAK后,人肝癌Hep3B细胞的细胞核数量、线粒体质量以及线粒体膜电位的相应变化情况。如图 3所示,与对照组相比,BAK作用6、12、24、36、48 h后,Hep3B的细胞核数量呈时间依赖性明显减少,线粒体质量呈时间依赖性显著增多,并且加药BAK 48 h后线粒体出现明显的点状断裂,线粒体膜电位呈时间依赖性显著降低。以上结果提示BAK可引起线粒体发生肿胀裂变,诱导线粒体功能损伤。
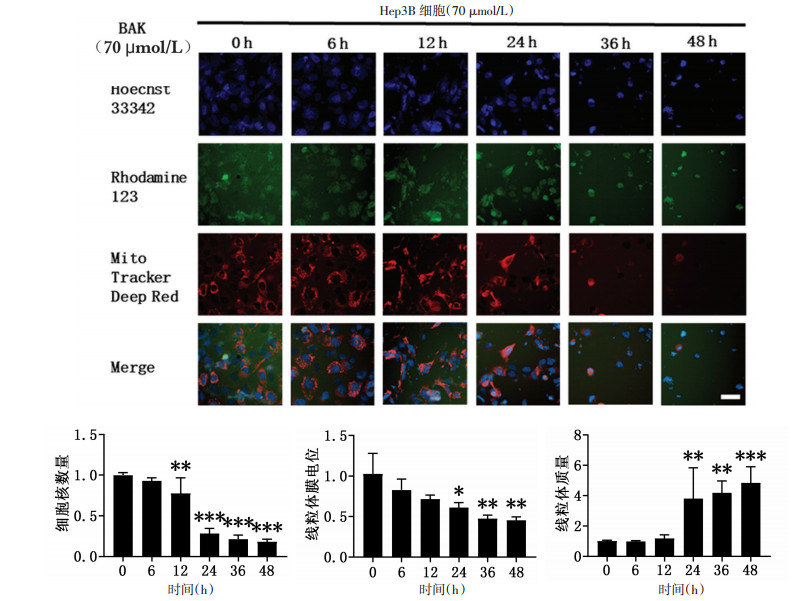
|
| 注:与加药0 h组比较,*P<0.05,**P<0.01,***P<0.001,Scale bar=50 μmol/L。 图 3 BAK作用Hep3B细胞0-48 h对线粒体功能的影响 |
自噬属于是细胞死亡方式的一种。用68 μmol/L BAK处理人肝癌Hep3B细胞0、6、12、24、48、72 h,用Western Blot法考察自噬相关蛋白的表达。如图 4、表 1所示:溶酶体相关膜蛋白1(LAMP1),微管相关蛋白1轻链3(LC3Ⅱ/Ⅰ)呈时间依赖性增多,p62表达量呈时间依赖性减少。说明BAK以时间依赖性的方式诱导细胞自噬。
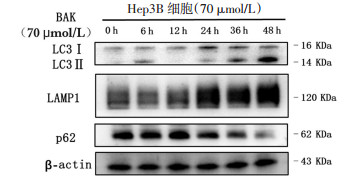
|
| 图 4 Western Blot法考察自噬相关蛋白的表达 |
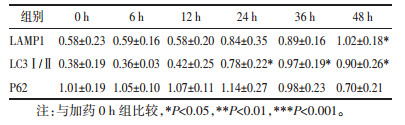
线粒体自噬属于选择性自噬,用Western Blot法考察线粒体自噬相关蛋白的表达,其中PINK1、Parkin表达量增加,Tom20、MFN2表达降低。表明BAK能够诱导人肝癌Hep3B细胞发生线粒体自噬。如图 5、表 2所示。

|
| 图 5 Western Blot法考察线粒体自噬相关蛋白的表达 |
为了探讨BAK诱导的人肝癌Hep3B细胞线粒体自噬与细胞死亡之间的关系,我们引入了线粒体自噬抑制剂氯喹(CQ)和巴弗洛霉素(Baf-A1)。如图 6和图 7所示,加入BAK细胞生长抑制率为(47.5±2.2)%,单独用CQ或Baf-A1对Hep3B细胞生长没有明显影响,而用CQ(0.25 μmol/L)或Baf-A1(2 nmol/L)预处理细胞抑制自噬后再加入BAK,细胞死亡率分别下降至(35.3±0.4)%、(32.5±0.1)%,提示抑制自噬能逆转BAK导致的细胞死亡,表明BAK诱导的线粒体自噬能促进细胞死亡。
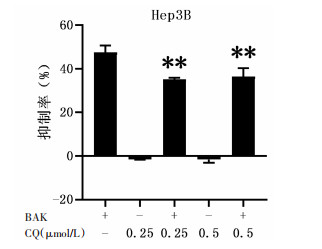
|
| 注:与加药BAK组比较,*P<0.05,**P<0.01。 图 6 MTT法考察CQ对细胞死亡的影响 |
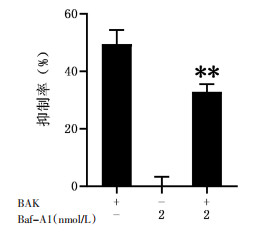
|
| 注:与加药BAK组比较,*P<0.05,**P<0.01。 图 7 MTT法考察Baf-A1对细胞死亡的影响 |
BAK是扶正类中药补骨脂的主要活性成分之一[9]。据报道,BAK生物学活性丰富,可抑制多种肿瘤细胞的增殖[10-12],但BAK诱导肝癌细胞线粒体自噬方面的研究尚未报道。本研究结果表明BAK可以时间剂量依赖性抑制人肝癌Hep3B细胞生长,而课题组前期研究发现其对人正常肝细胞L02没有显著细胞毒作用,10-60 μMBAK作用L02细胞的存活率均高于临床抗肿瘤药物5-FU,提示BAK对细胞生长的抑制作用具有一定的选择性,具有开发为抗肝癌药物的潜力[13]。因此,本研究进一步探究了BAK抗肝癌的作用机制。
自噬是程序性细胞死亡方式之一。自噬小体形成时,LC3-Ⅰ会转变为LC3-Ⅱ,标志着自噬的启动[14]。p62与定位于自噬小体内膜上的LC3-Ⅱ蛋白形成复合物,一同在自噬溶酶体内降解,其蛋白水平的降低提示自噬流通畅[15]。LAMP1位于溶酶体膜上参与自噬小体的成熟,在自噬小体与溶酶体融合形成自噬溶酶体过程中表达增加[16]。可见,LC3-Ⅱ、LAMP1及p62的蛋白水平可以作为检测自噬发生的标志。本研究发现BAK可显著上调LC3-Ⅱ、LAMP1,而下调p62的蛋白表达,表明BAK能够诱导人肝癌Hep3B细胞发生自噬。
课题组研究发现,BAK可以在人肝癌HepG2细胞中引起线粒体膜电位ΔΨm下降,Cyto.c释放[12],这一结果提示BAK会导致人肝癌细胞线粒体受损。本研究进一步发现,BAK能够增加线粒体质量,降低线粒体膜电位,引起线粒体发生肿胀裂变,诱导线粒体功能损伤。有趣的是,线粒体自噬作为一种选择性自噬,可以选择性清除受损的线粒体。这引起我们极大的兴趣探讨BAK能否诱导肝癌细胞发生线粒体自噬。研究表明:PINK1-Parkin信号通路在线粒体自噬调控肿瘤过程中发挥关键作用[17]。当线粒体受损时,PINK1通过线粒体外膜转位酶(Tom)在线粒体外膜积累[18],进而激活并招募Parkin,随后线粒体外膜上的蛋白VDAC1和MFN2被Parkin泛素化[19],诱导线粒体自噬。由于线粒体随后会在自噬溶酶体中被降解,因此线粒体膜上的线粒体标志蛋白Tom20、MFN2也会被降解[20]。另外,对小鼠癌症模型的肿瘤表型分析表明Parkin基因在肝细胞癌中为抑癌基因[21-22],特异性的抑制PINK1-Parkin介导的线粒体自噬会促进肿瘤细胞存活[23-25]。因此,上调PINK1-Parkin进而激活线粒体自噬性可能作为肝癌治疗的潜在策略。本研究中,发现BAK能够上调PINK1和Parkin,而下调Tom20和MFN2的蛋白表达,提示BAK可能通过激活PINK1-Parkin信号而诱导线粒体自噬。
值得注意的是,线粒体自噬在肿瘤细胞治疗中存在争议[8]。研究表明线粒体自噬可通过有效清除受损、有害的线粒体,促进细胞应激下的肿瘤细胞增殖,从而帮助肿瘤细胞调整微环境,并产生耐药性[26-27]。但是,过度的线粒体自噬会引起组织蛋白酶或者其他蛋白水解酶从溶酶体或者自噬溶酶体中泄漏出来而导致细胞增殖抑制[28]。为了确定BAK诱导的线粒体自噬与肝癌细胞增殖的关系,引入自噬抑制剂CQ和Baf-A1,发现这两种抑制剂都可以一定程度上逆转BAK导致的细胞增殖抑制。这一结果表明BAK诱导的线粒体自噬确实起到促进肝癌细胞增殖抑制的作用[29-31]。
综上所述,本研究表明BAK能够通过激活线粒体自噬抑制人肝癌Hep3B细胞增殖,这一结果为BAK的抗肝癌应用提供了理论依据。
| [1] |
LLOVET J M, KELLEY R K, VILLANUEVA A, et al. Hepatocellular carcinoma[J]. Nature Reviews Disease Primers, 2021, 7(1): 6. DOI:10.1038/s41572-020-00240-3 |
| [2] |
BROWN Z J, HEWITT D B, PAWLIK T M. Experimental drug treatments for hepatocellular carcinoma: Clinical trial failures 2015 to 2021[J]. Expert Opinion on Investigational Drugs, 2022, 31(7): 693-706. DOI:10.1080/13543784.2022.2079491 |
| [3] |
ZHENG Z D, ZHANG L L, HOU X T. Potential roles and molecular mechanisms of phytochemicals against cancer[J]. Food & Function, 2022, 13(18): 9208-9225. |
| [4] |
朱席. 明清时期新安医学治疗肿瘤的学术思想总结及用药规律分析[D]. 芜湖: 皖南医学院, 2022.
|
| [5] |
杨英艺. 近10年临床肝癌证候及方药文献研究[D]. 广州: 广州中医药大学, 2017.
|
| [6] |
XIN Z L, WU X, JI T, et al. Bakuchiol: A newly discovered warrior against organ damage[J]. Pharmacological Research, 2019, 141: 208-213. DOI:10.1016/j.phrs.2019.01.001 |
| [7] |
HUANG T Z, SONG X, YANG Y Y, et al. Autophagy and hallmarks of cancer[J]. Critical Reviews in Oncogenesis, 2018, 23(5/6): 247-267. |
| [8] |
LI S N, ZHANG J X, LIU C, et al. The role of mitophagy in regulating cell death[J]. Oxidative Medicine and Cellular Longevity, 2021, 2021: 6617256. |
| [9] |
BACKHOUSE C N, DELPORTE C L, NEGRETE R E, et al. Active constituents isolated from Psoralea glandulosa L. with antiinflammatory and antipyretic activities[J]. Journal of Ethnopharmacology, 2001, 78(1): 27-31. DOI:10.1016/S0378-8741(01)00309-9 |
| [10] |
MA Z Q, XIN Z L, HU W, et al. Forkhead box O proteins: Crucial regulators of cancer EMT[J]. Seminars in Cancer Biology, 2018, 50: 21-31. DOI:10.1016/j.semcancer.2018.02.004 |
| [11] |
VACCA R A, VALENTI D, CACCAMESE S, et al. Plant polyphenols as natural drugs for the management of Down syndrome and related disorders[J]. Neuroscience and Biobehavioral Reviews, 2016, 71: 865-877. DOI:10.1016/j.neubiorev.2016.10.023 |
| [12] |
LEE D E, JANG E H, BANG C, et al. Bakuchiol, main component of root bark of Ulmus davidiana var. japonica, inhibits TGF-β-induced in vitro EMT and in vivo metastasis[J]. Archives of Biochemistry and Biophysics, 2021, 709: 108969. DOI:10.1016/j.abb.2021.108969 |
| [13] |
龙雪, 邱琬婷, 曹世杰, 等. 补骨脂酚通过MAPK途径诱导人肝癌HepG2细胞凋亡的研究[J]. 现代肿瘤医学, 2020, 28(5): 729-735. |
| [14] |
MCLELAND C B, RODRIGUEZ J, STERN S T. Autophagy monitoring assay: Qualitative analysis of MAP LC3-Ⅰ to Ⅱ conversion by immunoblot[J]. Methods in Molecular Biology, 2011, 697: 199-206. |
| [15] |
FANG Y Y, JI L L, ZHU C Y, et al. Liraglutide alleviates hepatic steatosis by activating the TFEB-regulated autophagy-lysosomal pathway[J]. Frontiers in Cell and Developmental Biology, 2020, 8: 602574. DOI:10.3389/fcell.2020.602574 |
| [16] |
CHENG X T, XIE Y X, ZHOU B, et al. Revisiting LAMP1 as a marker for degradative autophagy-lysosomal organelles in the nervous system[J]. Autophagy, 2018, 14(8): 1472-1474. DOI:10.1080/15548627.2018.1482147 |
| [17] |
YIN K L, LEE J, LIU Z L, et al. Mitophagy protein PINK1 suppresses colon tumor growth by metabolic reprogramming via p53 activation and reducing acetyl-CoA production[J]. Cell Death and Differentiation, 2021, 28(8): 2421-2435. DOI:10.1038/s41418-021-00760-9 |
| [18] |
CHEN J, ZHOU C M, YI J, et al. Metformin and arsenic trioxide synergize to trigger Parkin/pink1-dependent mitophagic cell death in human cervical cancer HeLa cells[J]. Journal of Cancer, 2021, 12(21): 6310-6319. DOI:10.7150/jca.61299 |
| [19] |
GEISLER S, HOLMSTRÖM K M, SKUJAT D, et al. PINK1/Parkin-mediated mitophagy is dependent on VDAC1 and p62/SQSTM1[J]. Nature Cell Biology, 2010, 12(2): 119-131. DOI:10.1038/ncb2012 |
| [20] |
MERLINE R, RDIG H, ZENG-BROUWERS J, et al. A20 binding and inhibitor of nuclear factor kappa B (NF-κB)-1(ABIN-1): A novel modulator of mitochondrial autophagy[J]. American Journal of Physiology Cell Physiology, 2023, 324(2): C339-C352. DOI:10.1152/ajpcell.00493.2022 |
| [21] |
TSUCHIYA H, SHINONAGA R, SAKAGUCHI H, et al. NEAT1 confers radioresistance to hepatocellular carcinoma cells by inducing PINK1/parkin-mediated mitophagy[J]. International Journal of Molecular Sciences, 2022, 23(22): 14397. DOI:10.3390/ijms232214397 |
| [22] |
XU Y, LI Y. Regulatory effect of PINK1/Parkin axis on mitophagy in isoniazide-induced hepatocellular injury[J]. Zhong Nan Da Xue Xue Bao Yi Xue Ban=Journal of Central South University Medical Sciences, 2022, 47(9): 1200-1207. |
| [23] |
LIMAGNE E, NUTTIN L, THIBAUDIN M, et al. MEK inhibition overcomes chemoimmunotherapy resistance by inducing CXCL10 in cancer cells[J]. Cancer Cell, 2022, 40(2): 136-152.e12. DOI:10.1016/j.ccell.2021.12.009 |
| [24] |
DENG R, ZHANG H L, HUANG J H, et al. MAPK1/3 kinase-dependent ULK1 degradation attenuates mitophagy and promotes breast cancer bone metastasis[J]. Autophagy, 2021, 17(10): 3011-3029. DOI:10.1080/15548627.2020.1850609 |
| [25] |
ZHENG Y H, HUANG C, LU L, et al. STOML2 potentiates metastasis of hepatocellular carcinoma by promoting PINK1-mediated mitophagy and regulates sensitivity to lenvatinib[J]. Journal of Hematology & Oncology, 2021, 14(1): 16. |
| [26] |
XIAO X, WANG W, LI Y Q, et al. HSP90AA1-mediated autophagy promotes drug resistance in osteosarcoma[J]. Journal of Experimental & Clinical Cancer Research, 2018, 37(1): 201. |
| [27] |
LEE K S, WU Z H, SONG Y, et al. Roles of PINK1, mTORC2, and mitochondria in preserving brain tumor-forming stem cells in a noncanonical Notch signaling pathway[J]. Genes & Development, 2013, 27(24): 2642-2647. |
| [28] |
WANG W J, WANG Y, CHEN H Z, et al. Orphan nuclear receptor TR3 acts in autophagic cell death via mitochondrial signaling pathway[J]. Nature Chemical Biology, 2014, 10(2): 133-140. DOI:10.1038/nchembio.1406 |
| [29] |
RASOOL S, SOYA N, TRUONG L, et al. PINK1 autophosphorylation is required for ubiquitin recognition[J]. EMBO Reports, 2018, 19(4): e44981. DOI:10.15252/embr.201744981 |
| [30] |
RASOOL S, VEYRON S, SOYA N, et al. Mechanism of PINK1 activation by autophosphorylation and insights into assembly on the TOM complex[J]. Molecular Cell, 2022, 82(1): 44-59.e6. DOI:10.1016/j.molcel.2021.11.012 |
| [31] |
KLIONSKY D J, ABDEL-AZIZ A K, ABDELFATAH S, et al. Guidelines for the use and interpretation of assays for monitoring autophagy (4th edition)1[J]. Autophagy, 2021, 17(1): 1-382. |
 2024, Vol. 43
2024, Vol. 43