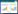文章信息
- 陈利城, 杨帆
- CHEN Licheng, YANG Fan
- 芒柄花素磺酸钠通过MAPKS信号通路缓解OVA诱导哮喘小鼠肺部炎症
- Study on the effect and mechanism of sodium formononetin-3'-sulfonate on OVA-induced asthma mice
- 天津中医药大学学报, 2024, 43(5): 407-412
- Journal of Tianjin University of Traditional Chinese Medicine, 2024, 43(5): 407-412
- http://dx.doi.org/10.11656/j.issn.1673-9043.2024.05.04
-
文章历史
收稿日期: 2023-11-20
哮喘是一种慢性呼吸道疾病,全世界超过3亿人受其影响,其患病率每年都在持续增加[1]。气道炎症和重塑是哮喘的基本要素,气道炎症和重塑引起气道结构的组织学改变,包括气道基底膜增厚、平滑肌增生、纤维化增加,导致肺功能下降[2]。现代医学认为哮喘的病理机制主要是多种气道炎性细胞和炎症介质所引起的炎症、自由基引起的氧化应激、免疫机制以及遗传因素等密切相关[3-6]。糖皮质激素与β2受体激动剂等常规药物对症治疗,如长期大剂量应用则引起明显的不良作用[7-8],高效低毒的新药开发仍是目前刻不容缓的问题。
芒柄花素是一种广泛存在于豆科植物中的化合物,如甘草、葛根、黄芪等,其易溶于无机溶剂,如乙醚、甲醇、乙酸乙酯,但难以溶于水。现代药理学研究发现芒柄花素具有广泛的药理作用,如抗炎、抗氧化、抗肿瘤、降血脂、抗菌、缓解痉挛、抗心律失常、类雌性激素样作用等[9]。由于其难溶解于水,极大地影响生物利用度及临床应用,其磺化盐产物芒柄花素磺酸钠不仅不影响其广泛的药理作用,而且还大幅度增加了水溶性,大大促进了其生物利用度。本实验拟通过卵清蛋白(OVA)诱导小鼠哮喘模型,探讨芒柄花素磺酸钠对该模型的影响及作用机制。
1 材料与方法 1.1 材料 1.1.1 实验动物本实验动物购买于辽宁长生生物技术股份有限公司(SCXK(粤)2019-0011)。具体为:SPF级雄性C57BL/6小鼠60只,体质量为18~22 g。实验方案经广东医科大学动物实验伦理委员会批准,伦理批准号:GDMU-2020-000124。
1.1.2 药物与试剂芒柄花素磺酸钠,纯度>99%,批号:949021-68-5,货号:949021-68-5,购于上海金锦乐实业有限公司;氢氧化铝粉,货号:21645-51-2,购于万荣黄河铝业有限公司;OVA,货号:9006-59-1,购于北京百奥莱博科技有限公司;地塞米松片,批号:20190402,购于广东三才医药集团有限公司;肿瘤坏死因子α(TNF-α)、白细胞介素1β(IL-1β)和白细胞介素6(IL-6)ELISA试剂盒,批号分别为88-7334-27、88-7023-21、88-7164-24,购于美国EBioscience公司;p-p38MAPK、p38MAPK、p-ERK1/2、ERK1/2、β-actin、p-JNK和JNK抗体,批号分别为20201204、20210419、20200614、20200821、20201122和20210312,均购于美国Cell Signaling公司。
1.1.3 仪器S700A全自动轮转石蜡切片机:智祥(广东)生物工程技术有限公司;HS-SW500M显微镜:日本Olympus公司;HS雾化器:可孚医疗科技股份有限公司;TG16G台式高速离心机:常州市亿能实验仪器厂;RS-L共聚焦荧光显微镜:东莞市瑞显光学仪器有限公司;SAF-680型酶标仪:上海巴玖实业有限公司。
1.2 方法 1.2.1 动物分组将实验小鼠按体质量随机分成以下6组,每组10只,分别为CON组、OVA组、MBHS-L组、MBHS-M组、MBHS-H组和DEX组。
1.2.2 构建哮喘小鼠模型主要参考文献[10]进行建模,具体方法如下:动物分别于第1、7和14 d通过小鼠腹腔注射OVA 500 μg/mL进行致敏。随后各组小鼠于第21天开始连续雾化激发4 d,CON组以相同时间点通过腹腔注射和雾化等量生理盐水。于第15天开始每天灌胃相应给予各组小鼠MBHS 20、40、80 mg/kg和DEX 10 mg/kg,1次/天,而CON组和OVA组分别灌胃给与等量生理盐水,第25天取材。
1.2.3 样品采集实验结束后,动物使用5%异氟烷进行适度麻醉并气管插管,右主支气管被结扎,0.2 mL生理盐水重复灌洗左肺,合并3次灌洗液,3 500 r/min离心15 min,离心半径87 mm。收集上清液,细胞沉淀进行涂片。10%中性甲醛中浸泡固定右肺上叶,24 h后进行石蜡包埋切片,行苏木精-伊红(HE)染色,其余肺组织用于Western blot检测。
1.2.4 哮喘评分实验结束前,根据下述评分标准对小鼠哮喘严重程度进行评估。无异常小鼠记为0分;震颤或点头小鼠记为1分;呛咳小鼠记为2分;腹肌痉挛的小鼠记为3分;跌倒的小鼠即为4分。
1.2.5 肺泡灌洗液(BALF)中炎症细胞计数将BALF沉淀进行细胞涂片,凭Diff-Quick染色试剂盒说明书步骤对细胞涂片进行染色,显微镜下观察并计数炎症细胞。
1.2.6 肺组织形态学观察切取2 mm厚度的肺组织,分别经过梯度浓度酒精脱水、二甲苯透明、浸蜡、包埋、切片以及HE染色,封片后于镜下观察肺组织病理变化情况。
1.2.7 酶联免疫吸附法测定BALF中TNF-α、IL-1β和IL-6的水平根据TNF-α、IL-1β和IL-6 ELISA试剂盒说明书步骤,检测BALF样品中TNF-α、IL-1β和IL-6水平。
1.2.8 免疫荧光法检测肺组织p-p38MAPK蛋白表达水平肺组织经1.2.6步骤获得肺组织石蜡切片后,分别经二甲苯、梯度乙醇和纯化水水化,0.5%TritonX-100室温通透20 min,封闭、孵育一抗p-p38MAPK(1∶3 000)、洗片、孵育荧光标记二抗(1∶200)、封片,使用共聚焦荧光显微镜观察并拍照,image J软件分析图片荧光强度。
1.2.9 Western blot法检测肺组织p-ERK1/2,p-JNK和p-p38MAPK蛋白表达水平每孔上样50 μg总蛋白进行SDS-PAGE电泳,然后转于NC膜上,5%脱脂奶粉常温封闭2 h,PBS洗膜5次,5 min/次。4 ℃冰箱中孵育一抗[p-ERK1/2(1∶1 000),ERK1/2(1∶1 000)、p-JNK(1∶1 000)、JNK(1∶1 000)、p-p38MAPK(1∶1 000)、p38MAPK(1∶1 000)和β-actin(1∶1 000)]过夜。PBS洗膜5次,5 min/次。常温孵育二抗1 h,PBS洗膜5次,5 min/次。ECL化学发光试剂浸泡后曝光,Image J软件测量条带灰度值。
1.2.10 统计学处理实验数据经SPSS 19.0软件分析,x±s表示计量资料。采用单因素方差分析条件:符合正态分布和方差齐性,采用非参数秩和检验条件:不符合正态分布和方差齐性。其中P<0.05认为差异有统计学意义。
2 结果 2.1 哮喘评分与CON组小鼠比较,OVA组小鼠的哮喘评分升高(P<0.01),出现严重的哮喘症状,如腹肌抽搐和呛咳等。与OVA组小鼠比较,MBHS组和DEX组小鼠哮喘评分降低(P<0.01),哮喘症状变轻。与MBHS-L组小鼠比较,MBHS-M组、MBHS-H组和DEX组小鼠哮喘评分降低(P<0.05),哮喘症状更轻,见表 1。
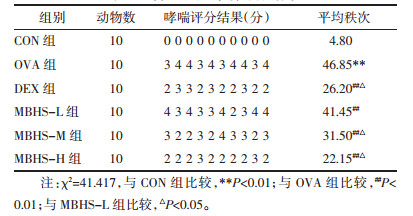
与CON组小鼠比较,OVA组小鼠BALF总细胞、中性粒细胞、淋巴细胞和嗜酸性粒细胞数量明显升高(P<0.01)。与OVA组小鼠相比,MBHS组和DEX组小鼠BALF总细胞、中性粒细胞、淋巴细胞和嗜酸性粒细胞数量明显减少(P<0.01)。与MBHS-L组小鼠比较,MBHS-H组和DEX组小鼠的总细胞、中性粒细胞、淋巴细胞和嗜酸性粒细胞数量明显减少(P<0.05),而RHU-M组小鼠BALF总细胞、中性粒细胞和嗜酸性粒细胞数量也明显减少(P<0.05),见表 2。
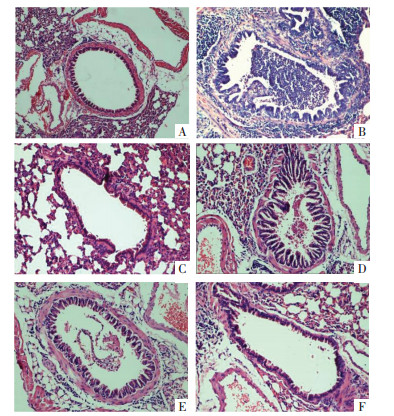
CON组小鼠肺组织结构正常,未见炎性细胞浸润。OVA组小鼠肺组织结构混乱,可见大量炎症细胞浸润。与OVA组小鼠比较,MBHS组和DEX组肺组织结构相对完整,可见少量炎性细胞浸润,MBHS改善呈剂量依赖性,见图 1。
|
| 注:A,CON组,B,OVA组,C,DEX组,D,MBHS-L组,E,MBHS-M组,F,MBHS-H组,HE染色,20×。 图 1 各组小鼠肺组织病理形态学观察(n=10) |
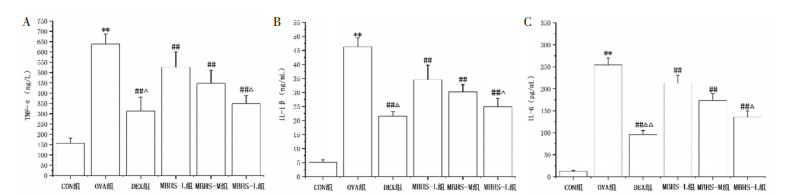
与CON组小鼠比较,OVA组小鼠BALFTNF-α、IL-1β和IL-6水平升高(P<0.01)。与OVA组小鼠比较,MBHS组和DEX组小鼠BALF TNF-α、IL-1β和IL-6水平降低(P<0.01)。与MBHS-L组比较,MBHS-H组和DEX组小鼠BALF TNF-α、IL-1β和IL-6水平降低(P<0.05),见图 2。
|
| 注:与CON组比较,**P<0.01;与OVA组比较,##P<0.01;与MBHS-L组比较,△P<0.05,△△P<0.01。 图 2 各组小鼠BALF中TNF-α、IL-1β和IL-6水平(n=10,x±s) |
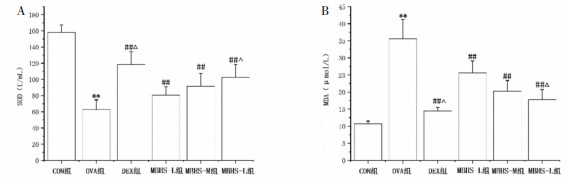
与CON组小鼠比较,OVA组小鼠BALF SOD活性降低(P<0.01),MDA水平升高( P<0.01)。与OVA组小鼠比较,MBHS组和DEX组小鼠BALF SOD活性升高(P<0.01),MDA水平降低(P<0.01)。与MBHS-L组小鼠比较,MBHS-H组和DEX组小鼠BALF SOD活性升高(P<0.05),MDA水平降低(P<0.05),见图 3。
|
| 注:与CON组比较,**P<0.01;与OVA组比较,##P<0.01;与MBHS-L组比较,△P<0.05。 图 3 各组小鼠BALF中SOD活性和MDA水平(n=10,x±s) |
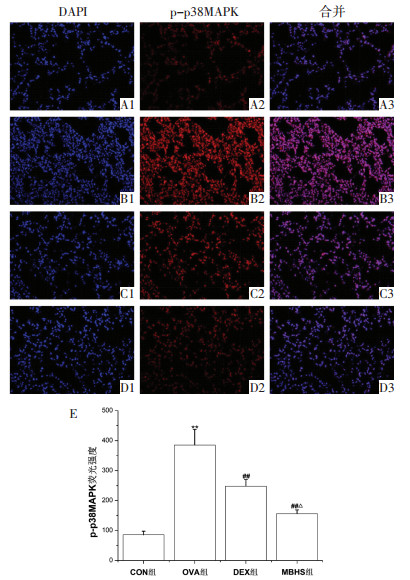
与CON组小鼠比较,OVA组小鼠肺组织p-p38MAPK水平升高(P < 0.01)(图 4A1-B3)。与OVA组小鼠比较,MBHS组和DEX组小鼠比肺组织p-p38MAPK水平降低(P<0.01)(图 4C1-D3)。与DEX组小鼠比较,MBHS组小鼠肺组织p-p38MAPK水平降低(P<0.05)(图 4C1-D3)。
|
| 注:A1-A3为CON组,B1-B3为OVA组,C1-C3为DEX组;D1-D3为MBHS组;E为p-p38MAPK荧光强度图;与CON组比较,**P<0.01;与OVA组比较,##P<0.01;与DEX组比较,△P<0.05。 图 4 各组小鼠肺组织p-p38MAPK蛋白表达水平(n=3,x±s,40×) |
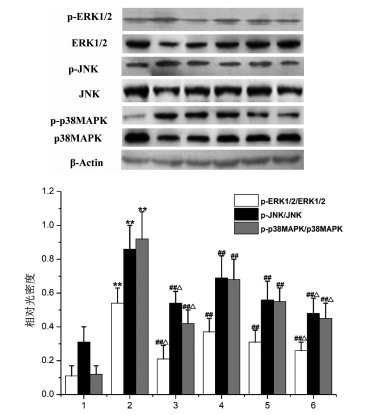
与CON组小鼠比较,各组小鼠肺组织p-ERK1/2,p-JNK和p-p38MAPK蛋白表达量均升高(P < 0.01)。与OVA组小鼠比较,MBHS组和DEX组小鼠肺组织p-ERK1/2,p-JNK和p-p38MAPK蛋白表达量均降低(P < 0.01)。与MBHS-L组比较,MBHS-H组和DEX组小鼠肺组织p-ERK1/2,p-JNK和p-p38MAPK蛋白表达量均降低(P < 0.05)。
|
| 注:1为CON组;2为OVA组;3为DEX组;4为MBHS-L组;5为MBHS-M组;6为MBHS-H;与CON组比较,**P<0.01;与OVA组比较,##P<0.01;与MBHS-L组比较,△P<0.05。 图 5 各组小鼠肺组织p-ERK1/2,p-JNK和p-p38MAPK蛋白表达(n=3,x±s) |
哮喘,作为一种慢性炎症性疾病,由于哮喘患者气道慢性炎症引起高反应性,出现气流受限(可逆性),从而出现胸闷、喘息和气急等常见的哮喘临床症状。其中清晨与夜间发病尤为严重。临床上使用糖皮质激素类药物仍是最为有效的治疗方式[11]。近年来,研究表明具有强大抗炎作用的地塞米松强对哮喘的正面作用得到肯定[12]。故本研究也选用地塞米松作为芒柄花素磺酸钠的阳性对照药。哮喘发病机制复杂,目前尚未阐明,但涉及炎症、免疫和氧化损伤等[3-5]。芒柄花素是一种存在于甘草、葛根、黄芪等豆科植物的化合物(难溶于水),现代药理学研究表明其及其磺酸盐(芒柄花素磺酸钠,溶于水)具有抗炎、抗氧化、抗肿瘤、降血脂、抗菌、缓解痉挛、抗心律失常、类雌性激素样作用等广泛的药理活性[9]。本研究拟通过构建OVA诱导小鼠哮喘模型,探讨芒柄花素磺酸钠对该模型的影响及作用机制,为其抗哮喘药效提供依据。
气道炎性细胞的迁移与聚集是哮喘重要致病因素[13],如大量的单核细胞、嗜酸性粒细胞以及嗜中性粒细胞等,本研究发现OVA组小鼠BALF中以及肺组织病理学切片可见大量的炎症细胞浸润,如嗜酸性粒细胞、中性粒细胞和淋巴细胞数量等。此外,BALF TNF-α、IL-1β和IL-6水平的升高,提示了OVA诱导小鼠哮喘模型构建成功。而给予芒柄花素磺酸钠和地塞米松可明显降低BALF中总细胞、中性粒细胞、淋巴细胞以及嗜酸性粒细胞的数量。同时肺组织病理学切片结果显示给予不同剂量的芒柄花素磺酸钠以及地塞米松后,气管内的炎症细胞浸润和黏液分泌均明显减少,提示芒柄花素磺酸钠以及地塞米松可明显抑制炎症,从而改善动物哮喘的症状。
氧化损伤在哮喘的发病过程中有着重要的作用,SOD和MDA是现代研究机体氧化应激的重要指标之一[14]。SOD作为机体重要的抗氧化酶,可消除有害自由基,起抗氧化损伤作用。氧化损伤后产物MDA与机体氧化损伤程度成正比。本研究发现OVA组BALF中SOD活性较CON组明显降低,而MDA含量明显升高。而给予芒柄花素磺酸钠以及地塞米松后,可升高BALF SOD活性,而降低MDA含量,其中以MBHS-H以及DEX组效果最优。
MAPKS信号通路与哮喘的发生发展密切相关。MAPKS作为多种免疫反应的重要调节因子,通过精确调控炎症基因的转录表达,从而促发炎症,如促进炎症细胞的迁移与活化[15]。近年来,在哮喘相关动物模型中,抑制MAPK可有效控制哮喘的炎症反应,故寻找MAPK抑制剂可能是防治哮喘新的研究思路。MAPK家族相关的信号通路主要包括以下四条途径:1)ERK信号通路途径;2)JNK/ SAPK信号通路途径;3)P38MAPK信号通路途径;4)ERK5/BMK1信号通路途径。ERK主要参与营养相关因子、生长因子等受体信号转导过程,而JNK主要参与细胞多种炎症反应以及多种疾病的发生发展进程,P38MAPK可介导机体炎症反应以及细胞凋亡等[16]。本研究发现芒柄花素磺酸钠以及地塞米松给药组可显著降低小鼠肺组织p-ERK1/2,p-JNK和p-p38MAPK蛋白表达水平。其中以MBHS-H以及DEX组效果最优,提示芒柄花素磺酸钠可能通过MAPK信号通路缓解OVA诱导哮喘小鼠肺部炎症。
综上所述,芒柄花素磺酸钠可改善OVA诱导的哮喘小鼠肺部症状,其机制可能与抑制炎症、抗氧化损伤以及抑制MAPKS信号通路活化有关。
| [1] |
BACKMAN H, RÄISÄNEN P, HEDMAN L, et al. Increased prevalence of allergic asthma from 1996 to 2006 and further to 2016-Results from three population surveys[J]. Clinical & Experimental Allergy, 2017, 47(11): 1426-1435. |
| [2] |
LAMBRECHT B N, HAMMAD H. The immunology of asthma[J]. Nature Immunology, 2015, 16: 45-56. DOI:10.1038/ni.3049 |
| [3] |
PRABHALA P, WRIGHT D B, ROBBE P, et al. Laminin α4 contributes to airway remodeling and inflammation in asthma[J]. American Journal of Physiology Lung Cellular and Molecular Physiology, 2019, 317(6): L768-L777. DOI:10.1152/ajplung.00222.2019 |
| [4] |
SAHINER U M, BIRBEN E, ERZURUM S, et al. Oxidative stress in asthma: Part of the puzzle[J]. Pediatric Allergy and Immunology, 2018, 29(8): 789-800. DOI:10.1111/pai.12965 |
| [5] |
NYAMBUYA T M, DLUDLA P V, MXINWA V, et al. Obesity-related asthma in children is characterized by T-helper 1 rather than T-helper 2 immune response: A meta-analysis[J]. Annals of Allergy, Asthma & Immunology, 2020, 125(4): 425-432.e4. |
| [6] |
GHANI M U, SABAR M F, BANO I, et al. Evaluation of ADAM33 gene's single nucleotide polymorphism variants against asthma and the unique pattern of inheritance in Northern and Central Punjab, Pakistan[J]. Saudi Medical Journal, 2019, 40(8): 774-780. DOI:10.15537/smj.2019.8.24411 |
| [7] |
SIDDIQUI E U, AHMED S. Glucocorticoids induced allergic reaction[J]. JPMA the Journal of the Pakistan Medical Association, 2013, 63(12): 1547-1548. |
| [8] |
OEHME S, MITTAG A, SCHRDL W, et al. Agonist-induced β2-adrenoceptor desensitization and downregulation enhance pro-inflammatory cytokine release in human bronchial epithelial cells[J]. Pulmonary Pharmacology & Thera-peutics, 2015, 30: 110-120. |
| [9] |
王健, 孙瑜, 陈磊, 等. 芒柄花素的现代研究进展[J]. 山西中医学院学报, 2017, 18(5): 74-76, 79. |
| [10] |
朴艺花, 宋艺兰, 王知广, 等. 牛蒡子苷元通过SIRT1/NLRP3途径减轻哮喘小鼠气道炎症[J]. 中国药理学通报, 2021, 37(4): 498-504. |
| [11] |
NAIR P, WENZEL S, RABE K F, et al. Oral glucocorticoid-sparing effect of benralizumab in severe asthma[J]. The New England Journal of Medicine, 2017, 376(25): 2448-2458. DOI:10.1056/NEJMoa1703501 |
| [12] |
薛坤娇, 阮玲瑛, 胡婕, 等. 糖皮质激素调控Keap1-Nrf2通路减轻哮喘小鼠肺氧化应激反应的作用研究[J]. 第三军医大学学报, 2020, 42(8): 807-814. |
| [13] |
高伟霞, 秦小菀, 刘阳, 等. 支气管哮喘患儿诱导痰中炎性细胞类型及炎症相关细胞因子的临床价值研究[J]. 检验医学, 2021, 36(1): 69-74. |
| [14] |
银龙, 图布新吉日嘎拉, 毛勒日额尔德尼. 蒙药让·阿嘎如-8对哮喘模型Balb/c小鼠肺组织SOD、MDA及GSH调节作用研究[J]. 中国民族医药杂志, 2020, 26(7): 54-55, 61. |
| [15] |
董淑敏, 高鹏辉, 梁文华. 马鞭草苷通过NF-κB/MAPK信号通路干预支气管哮喘大鼠气道炎症、气道平滑肌细胞增殖及RhoA表达的研究[J]. 中医药导报, 2021, 27(3): 23-27. |
| [16] |
翟凤婷, 王东梅, 王丹丹, 等. 基于MAPK/ERK信号通路探讨温经化瘀止痛法治疗寒凝血瘀证原发性痛经的机制[J]. 中国实验方剂学杂志, 2021, 27(17): 66-74. |
 2024, Vol. 43
2024, Vol. 43