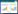文章信息
- 邵莹, 郑毅男, 吴晓杰, 李伟
- SHAO Ying, ZHENG Yinan, WU Xiaojie, LI Wei
- 高效液相-蒸发光散射检测器(HPLC-ELSD)测定红参中的精氨酸单糖苷(AF)及精氨酸双糖苷(AFG)含量
- Established a new method for the determination of arginyl-fructosyl-glucose and arginyl-fructose in Red gensing by high performance liquid chromatography-evaporative light scattering detector
- 天津中医药大学学报, 2024, 43(5): 413-417
- Journal of Tianjin University of Traditional Chinese Medicine, 2024, 43(5): 413-417
- http://dx.doi.org/10.11656/j.issn.1673-9043.2024.05.05
-
文章历史
收稿日期: 2023-11-20
2. 吉林农业大学中药材学院, 长春 130000
2. College of Chinese Medicinal Materials, Jilin Agricultural University, Changchun 130000, China
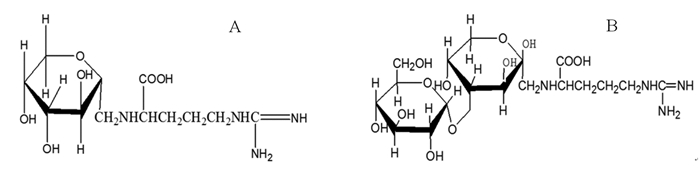
精氨酸单糖苷(AF)和精氨酸双糖苷(AFG)均由郑毅男等首次从红参中分离得到,是鲜人参加工成红参的蒸制和干燥过程中,由精氨酸与麦芽糖,或精氨酸与葡萄糖发生美拉德反应的中间产物,其化学结构如图 1所示[1]。两者均具有抗氧化、降血糖、提高免疫力等多种药理活性[2-8]。
|
| 图 1 AF(A)和AFG(B)结构式 |
研究表明[1, 3-4],AF和AFG均广泛存在于人参根的加工产物--红参和生晒参中,其检测多采用柱前衍生化法[9],这种方法本身要求衍生化反应选择性强、定量进行,还需要考察衍生化试剂,反应条件及产物的稳定性,不利于直接、快速地测定氨基酸及其衍生物[10]。此外,氨基酸自动分析仪的使用也较广泛,这种方法具有分析时间短,检测成本低,工作效率更高的优点,但是与其他液相色谱仪相比,氨基酸自动分析仪管路更细,原理及结构更复杂,受缓冲液pH影响更大,即使配制出的缓冲液相同,将其应用在不同的仪器上,也会受到分离柱反应柱填充的紧密程度等的影响,使得氨基酸图谱可能出现非常明显的差别[11]。为了更加快捷,准确地检测精氨酸及其衍生物,近年,赵雪娇等[12]运用二维液相色谱法同时测定五种氨基酸,Ju,Gyeong Mi等[13-14]等采用离子色谱法快速检测红参中美拉德反应产物AFG,均获得了较好的分析结果。但是,这种检测系统操作起来比较复杂,且对仪器设备要求较高。据文献[15-16]报道,蒸发光检测器常用于氨基酸及其衍生物检测,未见采用高效液相-蒸发光散射检测器(HPLC-ELSD)测定红参及生晒参中AF、AFG的相关报道。本研究选用HPLC-ELSD法进行研究。
1 实验部分 1.1 仪器、试剂与材料AF,AFG为本实验室自制(纯度 > 99.8%)。精氨酸对照品购于美国Sigma公司,JZ,纯度大于99.0%。精氨酸和麦芽糖购于北京市奥博星生物技术有限公司(北京市奥博星生物技术有限公司,北京,中国),AR。冰醋酸购于北京化学试剂有限公司(北京化学试剂有限公司,北京,中国)。三氟乙酸和七氟丁酸购于阿拉丁试剂(上海阿拉丁生化科技股份有限公司,上海,中国),GC。色谱乙腈购自Fisher Chemicals(Thermo Fisher Scientific,Pittsburgh,USA),LC。水为二次蒸馏水。高丽红参,韩国。中国红参,中国吉林。生晒参,中国吉林。在整个研究中使用去离子水,其他化学试剂均为分析级。
高效液相色谱系统厂家购自北京创新通亨科技有限公司。Alltech 2000ES蒸发光散射检测器(N2000工作站)购自天津埃文森科技有限公司。
1.2 实验条件 1.2.1 色谱条件色谱柱:PrevailTM C18(4.6 mm×250 mm,5 μm);流动相A:色谱乙腈,流动相B:5.0 mmol/L七氟丁酸的0.7%三氟乙酸溶液,流动相A与B比例:0 min为0∶100,5min为0∶100,8 min为15∶85,25 min为35∶65;漂移管温度:115 ℃;气体流量:3.2 L/min;柱温35 ℃;进样量:20 μL。
1.2.2 标准品及供试品溶液的制备精密称取精氨酸,AFG和AF适量,分别置容量瓶中,用三重水定容至刻度,配置成1 mg/mL溶液,以0.45 μm微孔滤膜过滤,取续滤液,置4 ℃冰箱保存,备用。
精密称取0.2 g商品红参样品,加入15 mL蒸馏水,室温超声30 min,重复3次,合并提取液,3 000 r/min离心,取上清液,过0.45 μm滤膜,备用。
2 结果与讨论 2.1 方法学考察 2.1.1 线性关系和检出限精密称取AF和AFG各10 mg,分别置于10 mL容量瓶中,用三重水定容至刻度,制成1 mg/mL AF和AFG溶液,并用此溶液作为母液,分别稀释出浓度为0.8,0.6,0.4,0.2,0.02 mg/mL的AF和AFG水溶液,过0.45 μm微孔滤膜,备用,检测,分别以AF和AFG峰面积的对数值y为纵坐标,AF和AFG浓度(g/L)x为横坐标进行线性回归,分别得到线性回归方程,AF:y=1.116 5x+5.492 8(r=0.999 7),AFG:y=1.007 2x+5.600 8(r=0.999 9)。标准曲线的线性范围是0.2~1.00 mg/mL。
当信噪比为3时,测得AF和AFG的最低检测限约为0.015 mg/mL和0.010 mg /mL。
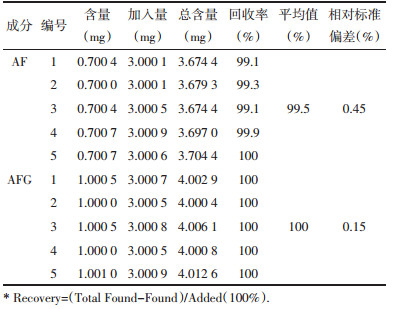
2.1.2 方法的精密度和重复性分别取AF和AFG 1 mg/mL标准品溶液,各连续进样6次,每次进样体积为20 μL,色谱峰的保留时间波动小于0.1 min,结果如表 1所示,峰面积的相对标准偏差(RSD)为0.45%和0.37%。
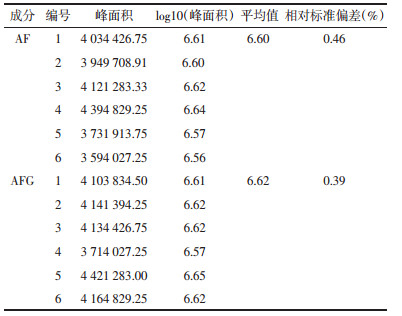
取同一批样品按供试品溶液制备方法平行制备5份,分别进样20 μL,同时取不同浓度的标准品混合溶液各20 μL进样测定,结果如表 2所示,按外标两点法分别取对数值,计算AF和AFG的RSD值分别为0.43%和0.55%。
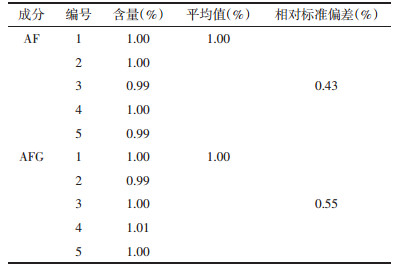
取AF,AFG同一供试品溶液,分别在保存0,2,4,6,8,10 h后以新配制的标准品混合溶液为对照,按外标两点法分别取对数值计算,结果如表 3所示,其RSD分别为0.43%和0.49%,说明供试品溶液在10 h内稳定性好。
精密称取AF、AFG样品粗粉约25 mg置于锥形瓶中,加入一定量的氨基酸标准品混合溶液后,按供试品溶液制备方法制备后测定,结果如表 4所示,加样回收率分别为99.5%和100%,在正常范围内。
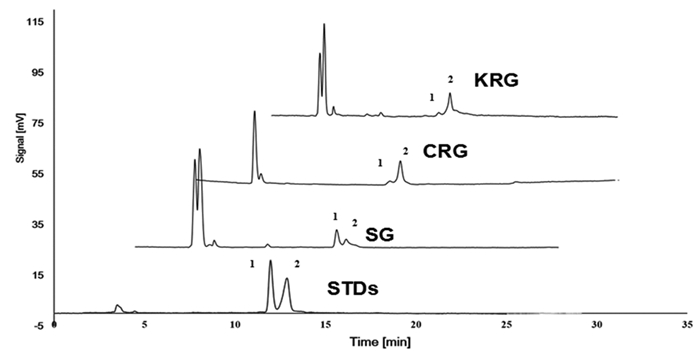
按照如上色谱条件测定AF和AFG,色谱图如图 2(STDs)所示,1为AF,2为AFG。
|
| 图 2 对标准品,高丽红参,中国红参及生晒参的检测 |
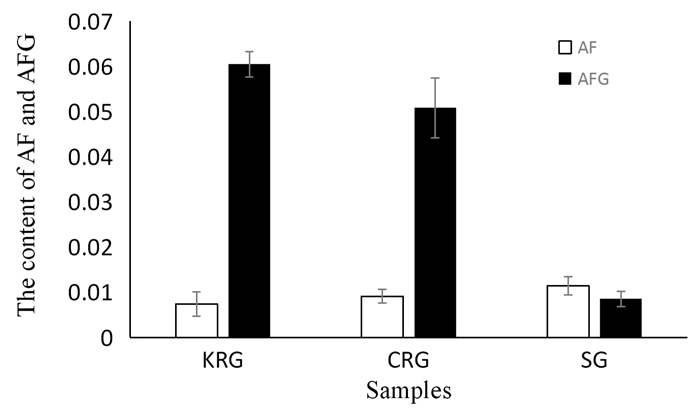
所测商品红参为高丽红参(KRG),中国红参(CRG)和生晒参(SG)。按照如上色谱条件测定制备好的红参提取物中AF和AFG含量。结果如图 3所示。测得KRG,CRG和SG中AF的含量分别为0.74%,0.91%,1.14%,AFG含量分别为6.69%,5.12%,0.85%。采用GraphPad Prism 10.1软件对KRG,CRG和SG中AF、AFG的含量进行组间比较,发现KRG,CRG中AFG含量明显高于SG,差异有统计学意义(P < 0.05),各炮制品间AF含量无显著性差异。
|
| 图 3 样品中AF和AFG含量 |
以甲醇-0.7%三氟乙酸溶液为流动相时,AF与AFG标准品不能达到完全分离;而乙腈-0.7%三氟乙酸溶液分离系统分离效果较好,两峰之间达到基线分离,但大部分色谱峰拖尾严重;在水中加入少量七氟丁酸后,峰形得到了较好的改善。对水相中七氟丁酸的加入量进行了考察,考察浓度分别为3.0,3.5,4.0,4.5,5.0,5.5,6.0 mmol/L,结果表明,浓度为5.0 mmol/L时,各色谱峰对称性积分离度较好,峰形尖锐。
为了在较短时间内分离AF和AFG色谱峰,在上述实验条件基础上,研究了不同梯度洗脱条件对分离效果的影响。最终确定流动相A与B比例:0 min为0∶100,5 min为0∶100,8 min为15∶85,25 min为35∶65可在15 min内同时检测出样品中AF和AFG。
2.2.2 检测器参数蒸发光散射检测器的漂移管温度和气体流量是影响检测结果的重要参数。漂移管温度低于某一温度时,因流动相得不到充分的挥发,基线水平较高;而温度过高时,可能会带来更大的噪音;随着气体流量增大,响应值也随之减小。研究中分别考察了漂移管温度70,90,115 ℃,气体流量2.5 L/min,3.2 L/min,结果表明,在漂移管温度115 ℃、气体流量3.2 L、min时,基线平稳,噪音较小,有适宜的响应值。
2.3 讨论氨基酸及其衍生物的测定方法有多种,例如,离子交换色谱法[14],柱前衍生法[9, 15],电喷雾电离质谱法,氨基酸自动分析仪等[17-18]。蒸发光散射检测器常用于氨基酸检测及糖类,AF、AFG作为氨基酸衍生物为精氨酸与麦芽糖或葡萄糖发生美拉德反应产生,考虑糖类及氨基酸的特性,本研究采用HPLC-ELSD对其含量测定方法进行考察。本研究针对AF、AFG的特点,对流动相配比、流动相梯度、漂移管温度、气体流量等进行研究。并通过线性关系、检出限、精密度、重现性、稳定性、回收率等指标对方法学进行考察,并进行样品测定。在最佳条件下,AF和AFG的检测限分别为0.015和0.02 mg/mL。AF和AFG线性关系的平方差均为0.999 4,表明线性关系良好。AF和AFG检测的精密度,重复性,稳定性以及回收率的相对标准偏差分别为0.43% & 0.37%,0.43% & 0.55%,0.43% & 0.49%,0.45% & 0.15%。AF和AFG检测的回收率分别为99.5% & 100%,经检测,KRG,CRG和SG中AF含量分别为0.74%,0.91%和1.14%,AFG含量分别为6.69%,5.12%和0.85%。
3 结论经考察,本方法不需要繁琐的前处理,直接利用蒸发光散射检测器完成了定量分析。减小了测定误差,操作简便,所建立的方法经方法学验证,精密度良好、灵敏度高,方法操作简单,检测时间短,提高了检测效率,且检测结果可靠,适用于氨基酸衍生物的检测,为促进氨基酸衍生物的研究做出贡献。但本文涉及的氨基酸衍生物种类较少,考虑同一种氨基酸衍生物因为具有相同的氨基酸,其化学性质类似,当混合物中氨基酸衍生物种类较多时,需进一步摸索条件,增大其分离度。
致谢 感谢吉林农业大学,郑毅男教授、李伟教授在AF、AFG分析方法建立工作中的帮助与指导。
| [1] |
ZHENG Y N. Study on physiologically active substances in medicinal ginseng[J]. Ehime Medicine, 1994, 13(3): 1-7. |
| [2] |
HYUN S H, KIM Y S, LEE J W, et al. Immunomodulatory effects of arginine-fructose-glucose enriched extracts of red ginseng[J]. Journal of the Korean Society of Food Science and Nutrition, 2018, 47(1): 1-6. DOI:10.3746/jkfn.2018.47.1.001 |
| [3] |
周秋秋, 任谓明, 王艳红, 等. 红参的炮制、化学成分及药理活性研究进展[J]. 上海中医药杂志, 2016, 50(2): 97-100. |
| [4] |
邵莹, 孙荣花, 王迪, 等. 精氨酸双糖苷对环磷酰胺致免疫抑制小鼠免疫功能的影响[J]. 营养学报, 2015, 37(3): 265-269. |
| [5] |
宋明铭, 王佳奇, 黄宝亮, 等. 精氨酸单糖苷(AF)对免疫抑制小鼠免疫功能的影响[J]. 中国免疫学杂志, 2017, 33(3): 347-351. |
| [6] |
PARK S E, KIM O H, KWAK J H, et al. Antihyperglycemic effect of short-term arginyl-fructose supplementation in subjects with prediabetes and newly diagnosed type 2 diabetes: Randomized, double-blinded, placebo-controlled trial[J]. Trials, 2015, 16: 521. DOI:10.1186/s13063-015-1036-z |
| [7] |
CHO E J, PIAO X L, JANG M H, et al. The effect of steaming on the free amino acid contents and antioxidant activity of Panax ginseng[J]. Food Chemistry, 2008, 107(2): 876-882. DOI:10.1016/j.foodchem.2007.09.007 |
| [8] |
LEE J, KIM G N, LEE S H, et al. In vitro and cellular antioxidant activity of arginyl-fructose and arginyl-fructosyl-glucose[J]. Food Science and Biotechnology, 2009, 18(6): 1504-1510. |
| [9] |
GAO F F, ZHANG W Y, LIU L M, et al. Detection and distribution of arginine derivatives in Panax quinquefolius L. and investigations of their antioxidant properties[J]. LWT, 2012, 49(1): 34-41. DOI:10.1016/j.lwt.2012.04.022 |
| [10] |
PETRITIS K, ELFAKIR C, DREUX M. A comparative study of commercial liquid chromatographic detectors for the analysis of underivatized amino acids[J]. Journal of Chromatography A, 2002, 961(1): 9-21. DOI:10.1016/S0021-9673(02)00377-1 |
| [11] |
KWON J Y, MOINI M. Analysis of underivatized amino acid mixtures using high performance liquid chromatography/dual oscillating nebulizer atmospheric pressure microwave induced plasma ionization-mass spectrometry[J]. Journal of the American Society for Mass Spectrometry, 2001, 12(1): 117-122. DOI:10.1016/S1044-0305(00)00206-3 |
| [12] |
ZHAO X J, WANG N, ZHANG M J, et al. Simultaneous determination of five amino acid neurotransmitters in rat and porcine blood and brain by two-dimensional liquid chromatography[J]. Journal of Chromatography B, Analytical Technologies in the Biomedical and Life Sciences, 2021, 1163: 122507. DOI:10.1016/j.jchromb.2020.122507 |
| [13] |
JU G M, PARK C U, JUNG H J. Method for simultaneously analyzing more than two kinds of Amadori compounds by using ion chromatography[P]. 2007, KR 2009053325.
|
| [14] |
JOO K M, PARK C W, JEONG H J, et al. Simultaneous determination of two Amadori compounds in Korean red ginseng (Panax ginseng) extracts and rat plasma by high-performance anion-exchange chromatography with pulsed amperometric detection[J]. Journal of Chromatography B, Analytical Technologies in the Biomedical and Life Sciences, 2008, 865(1/2): 159-166. |
| [15] |
金司阳, 刘寒, 郭慧, 等. HPLC-ELSD法同时测定东北岩高兰果肉中17种氨基酸的含量[J]. 中国药房, 2017, 28(9): 1272-1274. |
| [16] |
刘立业. HPLC-ELSD法测定昆仑雪菊中氨基酸种类[J]. 食品研究与开发, 2016, 37(17): 118-120. |
| [17] |
DU Q Q, LIU S Y, XU R F, et al. Studies on structures and activities of initial Maillard reaction products by electrospray ionisation mass spectrometry combined with liquid chromatography in processing of red ginseng[J]. Food Chemi-stry, 2012, 135(2): 832-838. DOI:10.1016/j.foodchem.2012.04.126 |
| [18] |
ZHENG Y N, ZHENG Y N, HAN L K, et al. A new amino acid derivative from red ginseng[J]. Journal of Chinese Phar-maceutical Sciences, 1998, 7(1): 7-10. |
 2024, Vol. 43
2024, Vol. 43