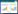文章信息
- 张紫千, 席素曼, 苗小雨, 赵森, 王亚静, 赵鑫
- ZHANG Ziqian, XI Suman, MIAO Xiaoyu, ZHAO Sen, WANG Yajing, ZHAO Xin
- 乌梅木瓜汤对菌群失调小鼠肠道菌群及消化酶活性的影响
- Effects of Wumei Papaya Decoction on the gutmicrobiota and enzyme activity in mice with dysbiosis
- 天津中医药大学学报, 2024, 43(5): 424-433
- Journal of Tianjin University of Traditional Chinese Medicine, 2024, 43(5): 424-433
- http://dx.doi.org/10.11656/j.issn.1673-9043.2024.05.07
-
文章历史
收稿日期: 2023-11-16
2. 天津中医药大学 方剂学教育部重点实验室, 天津 301617
2. Key Laboratory of Pharmacology of Traditional Chinese Medicine Formulae, Ministry of Education, Tianjin University of Traditional Chinese Medicine, Tianjin 301617, China
乌梅木瓜汤出自宋代《三因极一病证方论》,组方为乌梅、木瓜、炒麦芽、甘草及草果各半两,明代《证治准绳·类方》中亦有记载,应用历史悠久[1]。目前该方及方中药味临床常用于预防及治疗多种功能性胃肠疾病(FGIDs)[2-7]。
FGIDs是一组无器质性改变但存在消化功能异常的疾病,包括功能性消化不良,功能性便秘及肠易激综合征等。研究表明肠道菌群已成为预防和治疗各种FGIDs的新治疗靶标[8],肠道微生态平衡在维持健康的胃肠道功能中发挥着关键作用[9-10]。此外,肠道中消化酶与肠道菌群均为肠道微生态的重要组成部分,部分活性酶由肠道菌群分泌,肠道菌群的改变亦可影响肠道中酶活性[11-12],而肠道菌群失调及酶活性变化等因素都能导致肠道微生态失衡[9, 13],故肠道菌群与酶活性的变化可反映肠道微生态的变化。FGIDs的患者常伴有肠道微生态的失衡[14],但乌梅木瓜汤用于防治FGIDs是否与肠道微生态调节相关,目前尚不明确。
采用混合抗生素灌胃诱导肠道菌群失调模型是临床和基础研究中常用的模拟肠道微生态失衡的模型[15]。故本研究以混合抗生素灌胃建立小鼠肠道菌群失调模型,采用16S rRNA高通量测序技术、福林酚法、DNS比色法检测粪便样本,通过研究乌梅木瓜汤对小鼠肠道菌群多样性及消化酶活性的影响,从肠道微生态的角度探讨乌梅木瓜汤防治FGIDs的可能机制,为乌梅木瓜汤古方作为微生态调节剂及其他更加合理的应用提供科学依据。
1 仪器与材料 1.1 仪器Mili-Q超纯水处理器(美国MilliPore公司);调温电热套(北京中兴伟业仪器有限公司);旋转蒸发仪(上海爱朗仪器有限公司);HH-2数显恒温水浴锅(常州越新仪器制造有限公司);高功率数控超声波清洗器(昆山市超声仪器有限公司);多功能酶标仪(瑞士帝肯Tecan公司);涡旋仪(深圳市赛进生物科技有限公司);微量高速离心机(赛默飞世尔科技中国有限公司)。
1.2 药物盐酸万古霉素、甲硝唑、新霉素、氨苄霉素(北京索莱宝科技有限公司,批号分别为716R028、M8061、N8070、A6960);乌梅、木瓜、草果仁、甘草、炒麦芽(北京同仁堂有限责任公司,批号分别为20210801、20211002、210907、201219、210827)、生姜购自天津市团泊农贸综合批发市场;福林试剂、酪蛋白(北京蓝博斯特生物技术有限公司,批号20211025、20211123);氢氧化钠、PBS缓冲液、碳酸钠、DNS试剂(北京索莱宝科技有限公司,批号分别为D2109075,20211124、1208B031、20210423);三氯乙酸、磷酸氢二钠磷酸二氢钠(上海麦克林生化科技有限公司,批号C12668265、C13060885);BCA蛋白浓度测定试剂盒(上海碧云天生物技术有限公司,批号090120201218);纤维素酶试剂盒(南京建成生物工程研究所,批号20220106)。
1.3 动物本次实验使用的小鼠为SPF级BALB/c小鼠,8周龄,均为雄性,由北京华阜康生物科技股份有限公司提供,动物许可证号SCXK(京)2019-0008,饲养于天津中医药大学动物中心。本实验经天津中医药大学实验动物伦理委员会审核批准,伦理审查编号TCM-LAEC2021207,遵循相关规定和要求。
2 实验方法 2.1 药液配制依照乌梅木瓜汤原方,将乌梅、木瓜、甘草饮片进行粉碎,与对应比例的草果仁、炒麦芽及生姜混合后一起装入圆底烧瓶中,加入8倍量纯化水,水回流提取2 h,四层纱布过滤得到滤液,在50 ℃、0.095 MPa条件下浓缩滤液1 g/mL,将浓缩后的药液置于-80 ℃预冻,过夜后使用冻干机冻干,得到乌梅木瓜汤冻干粉,冻干粉密封保存于干燥器内备用。根据所需生药量计算冻干粉的质量,精密称取冻干粉,加入灭菌水超声震荡,配制为混悬液后备用。
2.2 抗生素混合溶液的配制称取抗生素(氨苄霉素100 mg,甲硝唑100 mg,硫酸新霉素100 mg,万古霉素50 mg),用无菌水溶解(混合溶液中各抗生素浓度为氨苄霉素2.5 mg/mL、甲硝唑2.5 mg/mL、硫酸新霉素2.5 mg/mL、万古霉素1.25 mg/mL)。
2.3 造模、分组与给药将购买的小鼠适应性饲养5 d后,随机分为4组,分别为正常组(N)、模型组(M)、乌梅木瓜汤低剂量组(TL)组、乌梅木瓜汤高剂量组(TH),每组8只。除正常组外,其余三组采用混合抗生素灌胃造模8 d,每天观察小鼠的一般情况。
造模成功后,在给药期,乌梅木瓜汤低、高剂量组灌胃乌梅木瓜汤[3.77、7.54 g/(kg·d)]连续给药8 d,正常组与模型组给予等量无菌水,灌胃量按10 mL/(kg·d)体质量计,连续8 d,1次/d,每隔三天称量一次小鼠体质量,依据体质量变化调整药量。全程标准饲料喂养,自由进食、进水。
2.4 指标测定 2.4.1 m一般状态观察每天灌胃前观察小鼠的粪便、毛发及精神状态并进行打分。记录实验第0、8天(造模期结束)及16 d(给药期结束)各组小鼠的体重。
给药期体质量变化率=(第16天体质量-第8天体质量)/第8天体质量×100%
2.4.2 粪便样本收集从各组小鼠的肛门处通过提尾法收集新鲜粪便于无菌的2 mL离心管中,置-80 ℃冰箱保存备用。
2.4.3 肠道菌群测序分析从每组中随机选出6个粪便样本运送至上海美吉生物医药科技有限公司,经粪便样品DNA抽提、设计合成引物接头、PCR扩增与产物纯化、PCR产物定量与均一化、构建PE文库,对小鼠粪便样品中的细菌16S rRNA V3-V4区进行测序分析。所用引物为:338F:5’-ACTCCTACGGGAGGCAGCAG-3’和806R:5’-GGACTACHVGGGTWTCTAAT-3’。
测序结果进行双端序列质控拼接后得到优化序列,优化序列基于silva138/16s_bacteria物种分类数据库按97%相似度进行OTU聚类分析(置信度为0.7),按最小样本序列数(34425)抽平生成OTU物种分类统计表格。在Qiime平台(http://qiime.org),依照OTU表格数据进行物种注释与评估、物种组成分析、物种差异分析、功能预测分析等操作。
2.4.4 肠道酶活性测定小鼠粪便样品中加入PBS缓冲液,涡旋震荡5 min后于1万r/min离心10 min(离心半径5.5 cm),取上清液,参照国家标准(GB/T 23527-2009)、文献[16]及试剂盒说明书,测定蛋白酶、淀粉酶及纤维素酶活性。采用福林酚比色法测定蛋白酶活性,DNS比色法测定淀粉酶、纤维素酶活性。
2.5 数据统计分析所得数据均用均数±标准差(x±s)表示,并采用SPSS23.0软件处理数据,多组间数据差异使用Kruskal-Wallis秩和检验(Kruskal-Wallis H test)和单因素方差分析,单因素方差分析方差齐时以LSD检验方法,方差不齐时采用Dunnett’s检验方法。检验水准α=0.05,P < 0.05,表示有统计学差异。
3 实验结果 3.1 小鼠的一般情况正常组小鼠始终保持毛发光泽柔顺,粪便为深棕色或黑色、干燥呈颗粒状,活泼好动。抗生素造模第6天起,混合抗生素灌胃处理的模型组及乌梅木瓜汤低、高剂量组小鼠精神萎靡,毛发蓬乱且毛色发黄;排便次数明显增多,粪便颜色呈现为黄绿色,部分肛周红肿有污物,连续3天出现大便稀溏现象。
给药8 d后,乌梅木瓜汤低、高剂量组小鼠精神与毛发状态逐渐恢复,腹泻情况好转,粪便逐渐转为棕色、成型状态。模型组小鼠在自然恢复状态下腹泻情况稍有好转,部分由稀溏转为软便,但仍然精神萎靡,毛发蓬乱,粪便颜色较黄。
由表 1可知,各组小鼠给药前后体重无显著差异,但乌梅木瓜汤低、高剂量组小鼠给药期体重增长率与模型组相比已有升高趋势(P < 0.1),与正常组相比差异无统计学意义。
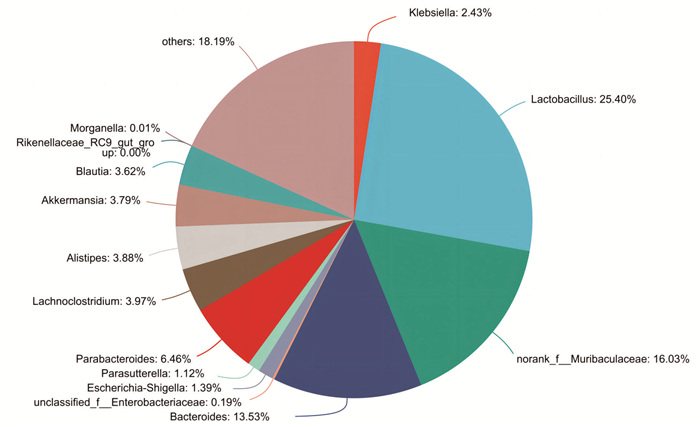
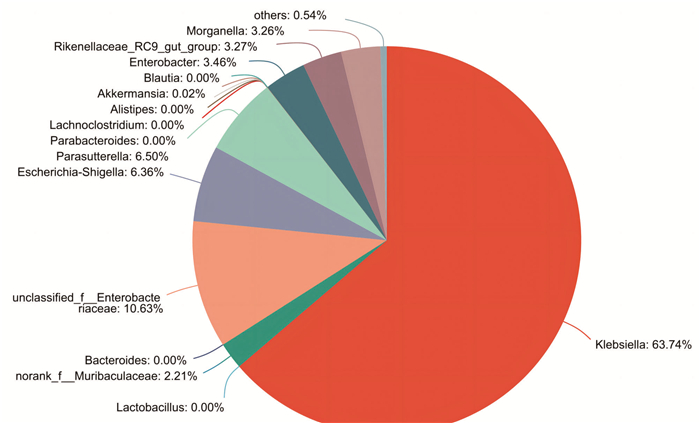
采用混合抗生素连续灌胃8 d后,正常组小鼠与模型组小鼠肠道菌群组成结果见图 1和图 2。由图 1和图 2可知,相比于正常组,混合抗生素灌胃8 d后小鼠肠道菌群属水平物种数显著减少(P<0.05)且单一,结合小鼠粪便及精神状态等一般情况,判断小鼠肠道菌群失调模型造模成功[17-18]。
|
| 图 1 正常组小鼠肠道菌群在属水平上的相对丰度 |
|
| 图 2 造模第8天小鼠肠道菌群在属水平上的相对丰度 |
|
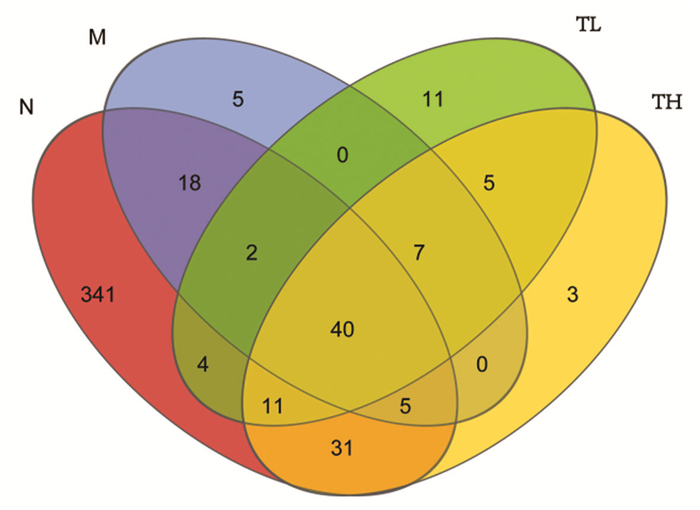
| 图 3 各组小鼠肠道菌群物种数量venn图 |
将相似性高于97%序列定义为一个OTU,将丰度值低于全体样本测序总量0.001%的OTU去除。OTU分析结果显示,正常组有452个OTUs,模型组有77个OTUs,低剂量乌梅木瓜汤组有80个OTUs,高剂量乌梅木瓜汤组有102个OTUs。表明乌梅木瓜汤干预后,菌群失调小鼠肠道菌群的物种数量上升。
3.3.2 Alpha多样性分析Alpha多样性分析反映单个样本的群落丰富度及多样性。通过群落覆盖度指数Coverage,群落丰富度指数Sobs,群落多样性指数Shannon评价乌梅木瓜汤对小鼠肠道微生物多样性的影响。如图 4A所示,菌群测序结果中,各样本Coverage指数均达到99%,表明此次测序样本量充足,各样本序列基本被测出,且测序结果能够反映样本的真实情况。
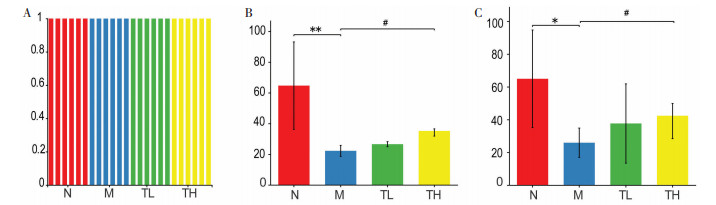
|
| 注:A,coverage指数图;B,Sobs指数图;C,Shannon指数图。与正常组比较,*P<0.05,**P<0.01;与模型组比较:#P<0.05,##P<0.01。 图 4 肠道菌群Alpha多样性分析(x±s,n=6) |
Sobs指数与群落的丰富度呈正相关。由图 4B可知,与正常组相比,模型组的Sobs指数降低,且有极显著差异(P < 0.01);与模型组相比,高剂量乌梅木瓜汤干预后,Sobs指数显著上升(P < 0.05),说明混合抗生素灌胃小鼠可使肠道内的物种丰富度降低,采用乌梅木瓜汤干预可提高菌群失调小鼠肠道菌群物种丰富度。
Shannon指数与群落的多样性呈正相关。由图 4C可知,与正常组相比,模型组的Shannon指数显著降低(P < 0.05);与模型组相比,高剂量乌梅木瓜汤干预后Shannon指数显著上升(P < 0.05),表明混合抗生素灌胃小鼠可使肠道内的物种多样性降低,采用乌梅木瓜汤干预可提高菌群失调小鼠肠道菌群物种多样性。
3.3.3 Beta多样性分析Beta多样性分析反映了不同分组样本间群落组成的相似性或差异性。本实验采用NMDS分析(nonmetric multidimensional scaling,非度量多维尺度分析)进行Beta多样性分析。基于结果作图,组间的物种组成越相似,图上的距离越近。结果显示,四组样本组间重叠度小,门水平上的模型组样本更加分散,其中模型组和正常组小鼠群落分离明显,提示造模成功,菌群失调小鼠的肠道菌群结构已明显改变。其中乌梅木瓜汤高剂量组菌群与正常组菌群距离最近,在属水平上已与正常组物种组成产生交集,提示乌梅木瓜汤在一定程度上可调节菌群失调小鼠的肠道菌群结构变化。
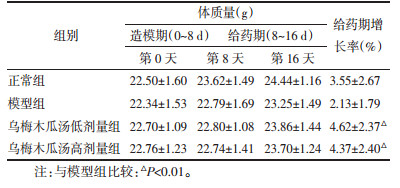
3.3.4 门水平物种组成分析如图 6A所示,在门水平上的优势菌有拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)、和变形菌门(Proteobacteria)、疣微菌门(Verrucomicrobiota)、脱硫杆菌门(Desulfobacterota),其中以拟杆菌门比例最大。由图 6B可知,各组小鼠肠道菌群在门水平群落丰度有显著差异。由图 6C~F可知,在门水平上,与正常组相比,模型组的变形菌门和疣微菌门的丰度显著上升(P < 0.05、P < 0.001),厚壁菌门和脱硫杆菌门丰度显著降低;与模型组相比,乌梅木瓜汤高剂量给药组菌群中厚壁菌门、脱硫杆菌门(P < 0.01)丰度上升,变形菌门(P < 0.05)、疣微菌门的丰度降低,低剂量组菌群也显现了相似的丰度变化趋势。

|
| 注:A,门水平下样本NMSD分析;B,属水平下样本NMSD分析。 图 5 肠道菌群Beta多样性分析(x±s,n=6) |
如图 7A、B所示,在属水平上的优势菌有15种(以群落相对丰度>0.025为筛选条件),其中在拟杆菌属(Bacteroides)、norank_f__Muribaculaceae属、克雷伯氏菌属(Klebsiella)、布劳特氏菌属(Blautia)、norank_f__norank_o__ Rhodospirillales属、大肠杆菌-志贺氏菌属(Escherichia-Shigella)等群落丰度具有显著差异。如图 7C~H所示,与正常组相比,模型组norank_f__ Muribaculaceae属、乳杆菌属(Lactobacillus)群落丰度显著降低(P < 0.05),克雷伯氏菌属、大肠杆菌-志贺氏菌属、副沙门氏菌属和阿克曼氏菌属(Akkermansia)丰度显著升高(P < 0.01)。与模型组相比,高、低剂量乌梅木瓜汤给药组克雷伯氏菌属(P < 0.01)、大肠杆菌-志贺氏菌属(P < 0.01)、副沙门氏菌属和阿克曼菌属(P < 0.05)群落丰度降低,norank_f__Muribaculaceae属(P < 0.05)、乳杆菌属丰度升高。
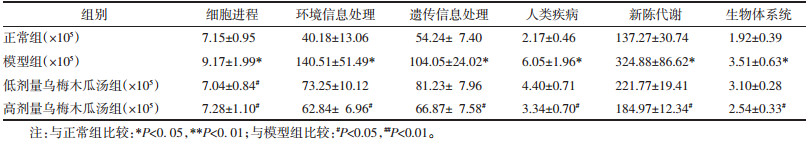
PICRUSt功能预测分析基于Greengenes数据库注释的16S测序数据。肠道菌群预测准确度较高,可以达到85%~90%以上。KEGG将一级代谢通路分为6大类,分别是代谢(Metabolism)、遗传信息处理(Genetic Information Processing)、环境信息处理(Environmental Information Processing)、细胞进程(Cellular Processes)、人类疾病(Human Diseases)和生物体系统(Organismal Systems),变化情况如表 2所示。结果表明,与正常组相比,模型组各代谢通路丰度均显著升高(P < 0.05);与模型组相比,低、高剂量乌梅木瓜汤组的细胞进程基因丰度显著降低(P < 0.05),高剂量乌梅木瓜汤组的环境信息处理、遗传信息处理、人类疾病、代谢、生物体系统代谢基因的总丰度显著下调(P < 0.05)。
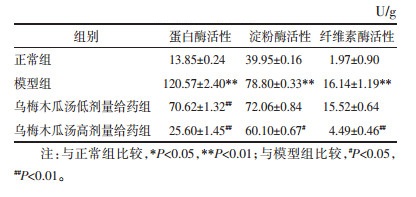
结果表明,乌梅木瓜汤干预第8天,与正常组相比,模型组的蛋白酶、淀粉酶、纤维素酶活性均显著上升(P<0.01);与模型组相比,高、低剂量乌梅木瓜汤给药组蛋白酶活性显著降低(P<0.01),高剂量给药组的淀粉酶及纤维素酶活性显著降低(P<0.01,P<0.05)。
4 讨论乌梅木瓜汤作为古方,应用历史悠久,该方及方中各味药材防治多种FGIDs的作用均已经得到证实[2-7]。随着蛋白和基因技术的发展,研究表明FGIDs的发生、发展与肠道菌群多样性等肠道微生态的变化互为因果[19-20]。肠道菌群失调会导致肠道微生态系统失衡,进而可能导致FGIDs[21-22],某些胃肠疾病也常伴随着酶活性升高及肠道菌的失调[23-24]。通过改善肠道菌群来缓解症状是近年来治疗FGIDs的新方向[25]。胃肠道疾病患者常伴有肠道菌群失调,肠道菌群失调亦会产生消化不良、便秘、腹泻等胃肠功能紊乱现象[14],而采用抗生素灌胃是建立小鼠肠道菌群失调模型的常用方法[15, 26],故本研究通过给小鼠灌胃混合抗生素建立FGIDs患者肠道菌群失调模型,采用16S rRNA高通量测序技术、比色法分析给药后小鼠肠道菌群结构及酶活性。研究表明,乌梅木瓜汤对抗生素诱导的肠道菌群失调小鼠肠道菌群结构及消化酶活性均具有改善作用。
造模8 d后,混合抗生素灌胃处理的模型组及乌梅木瓜汤低、高剂量组小鼠精神、毛发及粪便状态不佳,与正常组相比有明显差异,肠道菌群测序结果显示混合抗生素灌胃8 d后小鼠肠道菌群属水平物种数较正常组显著减少且单一,且出现消化不良、便秘、腹泻等胃肠功能紊乱现象,提示肠道菌群失调模型制备成功[17-18]。模型组、乌梅木瓜汤低、高剂量组小鼠造模前后体重增长较正常组明显减少,表明灌胃混合抗生素干扰了小鼠体质量的正常增长,但采用混合抗生素处理小鼠并未使其体质量显著降低,其原因可能与抗生素改变小鼠食欲、饮水量及糖脂代谢[27],以及提高了肠黏膜的通透性、增加内脏脂肪等有关[28]。
肠道中消化酶与肠道菌群共属肠道微生态系统的重要组成部分。研究发现肠道酶活与肠道菌群稳态之间有密切关系,蛋白酶、淀粉酶属于肠道中内源性消化酶,肠道自身可分泌,可体现肠道的消化功能,而纤维素酶肠道无法分泌,由肠道菌群产生,因此其活性变化可反映肠道菌群的变化[11],过高的肠道消化酶活性会破坏肠黏膜的完整性、损害肠道上皮屏障,进而影响胃肠道功能而产生疾病[29-31]。研究发现,某些胃肠道疾病患者的肠道酶活性相比于健康人显著升高[32-34]。与正常组相比,模型组肠道酶活性均显著上升,而许多胃肠疾病常伴随着酶活性升高及肠道菌的失调[23-24]。可见,乌梅木瓜汤能够下调小鼠肠道菌群失调后升高的消化酶活性,可能是其防治FGIDs的机制之一。
肠道菌群多样性分析显示,与正常组小鼠相比,模型组小鼠的Sobs指数与Shannon指数均显著降低,说明菌群失调小鼠肠道菌群丰富度及多样性均下降。乌梅木瓜汤干预后,菌群失调小鼠肠道菌群的Sobs指数与Shannon指数均显著升高,说明乌梅木瓜汤可在整体水平上改善菌群失调小鼠的肠道菌群结构。
变形菌门为条件致病菌,其丰度上升可以作为肠道功能紊乱的标志[35],肠道菌群失调时常由肠道转移至机体其他组织或器官,从而产生其他疾病[36];疣微菌门常在菌群失调小鼠中丰度上升[37];厚壁菌门可以将纤维素、果胶等不易消化的碳水化合物代谢为短链脂肪酸(SCFAs)等代谢物[38-39],可增强肠黏膜屏障[40-41],且助于消化[42]。脱硫菌门丰度的降低与胃肠道疾病的发生关系密切,在溃疡性结肠炎及慢性胃炎患者肠道中常观察到脱硫菌门丰度显著降低的现象[43-44]。门水平物种分析显示,与正常组相比,模型组变形菌门、疣微菌门丰度显著上升,厚壁菌门、脱硫菌门丰度显著降低;乌梅木瓜汤给药后不同程度上回调了上述菌门的丰度。由此可见,乌梅木瓜汤可在门水平上抑制肠道条件致病菌丰度,增加肠道正常菌及有益菌丰度,可能是其防治FGIDs的机制之一。
大肠杆菌-志贺氏菌属与肠道炎症因子水平具有正相关关系[45];阿克曼氏菌属被认为是功能性消化不良的标志菌,且能加剧肠道炎症[46],当阿克氏曼菌过量定植肠道会过度消耗肠道黏液蛋白,破坏肠道黏膜层进而导致肠道损伤,因此阿克曼氏菌属的高丰度可能会减少机体能量的吸收,并作为消化不良的标志物[47];副沙门氏菌的丰度与肥胖和糖尿病呈正相关。norank_f_Muribaculaceae属已被证实具有改善肠屏障功能并缓解溃疡性结肠炎的作用;研究表明乳杆菌可以维持结肠上皮屏障功能,减轻结肠炎小鼠的结肠炎症反应。此外,乳杆菌能预防肠道病原体感染并保护肠道健康,改善宿主的消化功能。克雷伯氏菌属、大肠杆菌-志贺菌属、阿克曼氏菌均为条件致病菌,norank_f__Muribaculaceae属、乳杆菌均为有益菌。属水平物种分析结果显示,与正常组相比,模型组属水平上克雷伯氏菌属、大肠杆菌-志贺菌属、副沙门氏菌、阿克曼氏菌丰度显著上升,乌梅木瓜汤低、高剂量组从不同程度下调了上述菌属的丰度;模型组norank_f_Muribaculaceae属、乳杆菌属丰度显著降低,而乌梅木瓜汤给药组上调了上述菌属。由此可见,乌梅木瓜汤可在属水平上抑制肠道致病菌丰度,增加肠道有益菌丰度,可能是其防治FGIDs的机制之一。
PICRUSt功能预测发现,高剂量乌梅木瓜汤能明显下调菌群失调小鼠富集过高的细胞进程、人类疾病等6个功能水平,这一结果提示通过改善代谢途径、降低患病概率可能是乌梅木瓜汤防治FGIDs的机制之一。
综上所述,乌梅木瓜汤可通过调节肠道菌群及酶活性而防治FGIDs。
| [1] |
陈无择. 三因极一病证方论[M]. 北京: 中国医药科技出版社, 2011: 18-20.
|
| [2] |
胡月, 胡雅棱. 乌梅木瓜汤加减治疗小儿功能性便秘临床疗效[J]. 内蒙古中医药, 2022, 41(8): 13-14. |
| [3] |
谢丽芬, 查圣华, 许楠, 等. "酸甘化阴"中医理论应用于药食同源食物的探讨[J]. 食品与药品, 2022, 24(3): 290-294. |
| [4] |
杨翠玲, 赵梦洁, 张肖瑾, 等. 酸甘化阴法在小儿脾胃病中的临床应用[J]. 中药与临床, 2022, 13(3): 89-91. |
| [5] |
曹峰, 罗振亮, 秦源, 等. 茯苓甘草汤对功能性消化不良大鼠的调节作用[J]. 中成药, 2019, 41(1): 204-207. |
| [6] |
尚明越, 王嘉乐, 代国娜, 等. 草果化学成分、药理作用、临床应用研究进展及质量标志物预测分析[J]. 中草药, 2022, 53(10): 3251-3268. |
| [7] |
刘飞, 郝婧宇, 赵子夫, 等. 山楂、麦芽及膳食纤维对维生素缺乏幼鼠肠道功能的影响[J]. 食品科学, 2022, 43(19): 118-128. |
| [8] |
唐强, 曹海龙, 王邦茂. 肠道菌群: 功能性胃肠病的防治新靶点[J]. 中国实用内科杂志, 2020, 40(2): 111-114. |
| [9] |
FU Q H, SONG T Y, MA X Q, et al. Research progress on the relationship between intestinal microecology and intestinal bowel disease[J]. Animal Models and Experimental Medicine, 2022, 5(4): 297-310. DOI:10.1002/ame2.12262 |
| [10] |
GOMAA E Z. Human gut microbiota/microbiome in health and diseases: A review[J]. Antonie Van Leeuwenhoek, 2020, 113(12): 2019-2040. DOI:10.1007/s10482-020-01474-7 |
| [11] |
何云山, 谭周进, 李丹丹, 等. 保和丸对食积小鼠的肠道微生物及酶活性的影响[J]. 中国微生态学杂志, 2019, 31(7): 763-767. |
| [12] |
GUINANE C M, COTTER P D. Role of the gut microbiota in health and chronic gastrointestinal disease: Understanding a hidden metabolic organ[J]. Therapeutic Advances in Gastroenterology, 2013, 6(4): 295-308. DOI:10.1177/1756283X13482996 |
| [13] |
周康, 肖嫩群, 谭周进. 保和丸治疗食滞胃肠证泄泻的肠道微生态机制研究进展[J]. 世界华人消化杂志, 2022(005): 030. |
| [14] |
BLACK C J, DROSSMAN D A, TALLEY N J, et al. Functional gastrointestinal disorders: Advances in understanding and management[J]. Lancet, 2020, 396(10263): 1664-1674. DOI:10.1016/S0140-6736(20)32115-2 |
| [15] |
DAHIYA D, NIGAM P S. Antibiotic-therapy-induced gut dysbiosis affecting gut microbiota-brain axis and cognition: Restoration by intake of probiotics and synbiotics[J]. International Journal of Molecular Sciences, 2023, 24(4): 3074. DOI:10.3390/ijms24043074 |
| [16] |
林清华. 免疫学实验[M]. 武汉: 武汉大学出版社, 1999: 185-206.
|
| [17] |
杨斯琴, 王平, 陈静. 阿如拉-7味散对肠道菌群失调小鼠免疫功能及肠道菌群多样性的影响[J]. 中国微生态学杂志, 2021, 33(3): 264-270. |
| [18] |
GUO H, YAN H T, CHENG D, et al. Tributyltin exposure induces gut microbiome dysbiosis with increased body weight gain and dyslipidemia in mice[J]. Environmental Toxicology and Pharmacology, 2018, 60: 202-208. DOI:10.1016/j.etap.2018.04.020 |
| [19] |
AZIZ Q, DORÉ J, EMMANUEL A, et al. Gut microbiota and gastrointestinal health: Current concepts and future directions[J]. Neurogastroenterology and Motility, 2013, 25(1): 4-15. DOI:10.1111/nmo.12046 |
| [20] |
SIMRÉN M, BARBARA G, FLINT H J, et al. Intestinal microbiota in functional bowel disorders: A Rome foundation report[J]. Gut, 2013, 62(1): 159-176. DOI:10.1136/gutjnl-2012-302167 |
| [21] |
SEKIROV I, RUSSELL S L, ANTUNES L C, et al. Gut microbiota in health and disease[J]. Physiological Reviews, 2010, 90(3): 859-904. DOI:10.1152/physrev.00045.2009 |
| [22] |
周丽, 徐派的, 张红星. 肠道菌群与常见功能性胃肠病相关性的研究进展[J]. 华中科技大学学报(医学版), 2020, 49(6): 756-760. |
| [23] |
张丽丽, 代小雨, 马欢, 等. 老年急性胰腺炎与胃肠动力障碍的研究进展[J]. 老年医学与保健, 2021, 27(5): 1109-1112. |
| [24] |
AMADESI S, BUNNETT N. Protease-activated receptors: Protease signaling in the gastrointestinal tract[J]. Current Opinion in Pharmacology, 2004, 4(6): 551-556. DOI:10.1016/j.coph.2004.08.004 |
| [25] |
贾文君, 杜锦辉. 中西医在功能性胃肠病的临床应用与进展[J]. 实用中医内科杂志, 2021, 35(5): 99-102. |
| [26] |
LI J, CHEN C F, YANG H, et al. Tea polyphenols regulate gut microbiota dysbiosis induced by antibiotic in mice[J]. Food Research International, 2021, 141: 110153. DOI:10.1016/j.foodres.2021.110153 |
| [27] |
刘秀, 吕秋兰, 赵鹏, 等. 抗生素短期干预所致肠道菌群紊乱对大鼠食欲和糖脂代谢的影响[J]. 青岛大学学报(医学版), 2021, 57(4): 498-502. |
| [28] |
CHO I, YAMANISHI S, COX L, et al. Antibiotics in early life alter the murine colonic microbiome and adiposity[J]. Nature, 2012, 488: 621-626. DOI:10.1038/nature11400 |
| [29] |
YOON H, SCHAUBECK M, LAGKOUVARDOS I, et al. Increased pancreatic protease activity in response to antibiotics impairs gut barrier and triggers colitis[J]. Cellular and Molecular Gastroenterology and Hepatology, 2018, 6(3): 370-388.e3. DOI:10.1016/j.jcmgh.2018.05.008 |
| [30] |
IGARASHI M, NAKAE H, MATSUOKA T, et al. Alteration in the gastric microbiota and its restoration by probiotics in patients with functional dyspepsia[J]. BMJ Open Gastroenterology, 2017, 4(1): e000144. DOI:10.1136/bmjgast-2017-000144 |
| [31] |
SHULMAN R J, EAKIN M N, CZYZEWSKI D I, et al. Increased gastrointestinal permeability and gut inflammation in children with functional abdominal pain and irritable bowel syndrome[J]. The Journal of Pediatrics, 2008, 153(5): 646-650. DOI:10.1016/j.jpeds.2008.04.062 |
| [32] |
任娟. 肠道菌群失调后小鼠粪便酶活变化、人工干预及其对免疫的影响[D]. 昆明: 云南大学, 2020.
|
| [33] |
ANNAHZI A, GECSE K, DABEK M, et al. Fecal proteases from diarrheic-IBS and ulcerative colitis patients exert opposite effect on visceral sensitivity in mice[J]. Pain, 2009, 144(1/2): 209-217. |
| [34] |
GECSE K, RÓKA R, FERRIER L, et al. Increased faecal serine protease activity in diarrhoeic IBS patients: A colonic lumenal factor impairing colonic permeability and sensitivity[J]. Gut, 2008, 57(5): 591-599. DOI:10.1136/gut.2007.140210 |
| [35] |
RIZZATTI G, LOPETUSO L R, GIBIINO G, et al. Proteobacteria: A common factor in human diseases[J]. BioMed Research International, 2017, 2017: 9351507. |
| [36] |
JIN J, ZHANG H C, LI D M, et al. Effectiveness of Xin Jia Xuan Bai Cheng Qi Decoction in treating acute exacerbation of chronic obstructive pulmonary disease: Study protocol for a multicentre, randomised, controlled trial[J]. BMJ Open, 2019, 9(11): e030249. DOI:10.1136/bmjopen-2019-030249 |
| [37] |
HUANG D R, CHEN Y L, CHEN H Z, et al. Supplementation of Bacillus sp. DU-106 alleviates antibiotic-associated diarrhea in association with the regulation of intestinal microbiota in mice[J]. Probiotics and Antimicrobial Proteins, 2022, 14(2): 372-383. DOI:10.1007/s12602-022-09906-8 |
| [38] |
LIN L, ZHANG J Q. Role of intestinal microbiota and metabolites on gut homeostasis and human diseases[J]. BMC Immunology, 2017, 18(1): 2. DOI:10.1186/s12865-016-0187-3 |
| [39] |
THURSBY E, JUGE N. Introduction to the human gut microbiota[J]. The Biochemical Journal, 2017, 474(11): 1823-1836. DOI:10.1042/BCJ20160510 |
| [40] |
BRON P A, KLEEREBEZEM M, BRUMMER R J, et al. Can probiotics modulate human disease by impacting intestinal barrier function?[J]. The British Journal of Nutrition, 2017, 117(1): 93-107. DOI:10.1017/S0007114516004037 |
| [41] |
SINGH R K, CHANG H W, YAN D, et al. Influence of diet on the gut microbiome and implications for human health[J]. Journal of Translational Medicine, 2017, 15(1): 73. DOI:10.1186/s12967-017-1175-y |
| [42] |
NIWA T, NAKAO M, HOSHI S, et al. Effect of dietary fiber on morphine-induced constipation in rats[J]. Bioscience, Biotechnology, and Biochemistry, 2002, 66(6): 1233-1240. DOI:10.1271/bbb.66.1233 |
| [43] |
ZHU S Y, HAN M Z, LIU S M, et al. Composition and diverse differences of intestinal microbiota in ulcerative colitis patients[J]. Frontiers in Cellular and Infection Microbiology, 2022, 12: 953962. DOI:10.3389/fcimb.2022.953962 |
| [44] |
HUANG W Y, YAU Y, ZHU J R, et al. Effect of electroacupuncture at Zusanli (ST36) on intestinal microbiota in rats with chronic atrophic gastritis[J]. Frontiers in Genetics, 2022, 13: 824739. DOI:10.3389/fgene.2022.824739 |
| [45] |
张博荀. 基于"肠道菌群-黏膜屏障"研究"黄芩-黄连"药对治疗T2DM的疗效机制及配伍效应[D]. 成都: 成都中医药大学, 2020.
|
| [46] |
ZHANG S B, LIN L, LIU W, et al. Shen-Ling-Bai-Zhu-San alleviates functional dyspepsia in rats and modulates the composition of the gut microbiota[J]. Nutrition Research, 2019, 71: 89-99. DOI:10.1016/j.nutres.2019.10.001 |
| [47] |
DERRIEN M, BELZER C, DE VOS W M. Akkermansia muciniphila and its role in regulating host functions[J]. Microbial Pathogenesis, 2017, 106: 171-181. DOI:10.1016/j.micpath.2016.02.005 |
 2024, Vol. 43
2024, Vol. 43