文章信息
- 何家琛, 李佳玮, 刘志东
- HE Jiachen, LI Jiawei, LIU Zhidong
- 中药复方对特发性肺纤维化干预机制的实验研究进展
- Experimental research progress of traditional Chinese medicine compound on the intervention mechanism of idiopathic pulmonary fibrosis
- 天津中医药大学学报, 2024, 43(5): 450-456
- Journal of Tianjin University of Traditional Chinese Medicine, 2024, 43(5): 450-456
- http://dx.doi.org/10.11656/j.issn.1673-9043.2024.05.11
-
文章历史
收稿日期: 2023-11-20
2. 天津中医药大学, 天津中医药大学组分中药国家重点实验室, 天津 301617
2. State Key Laboratory of Component-Based Chinese Medicine, Tianjin University of Traditional Chinese Medicine, Tianjin 301617, China
特发性肺纤维化(IPF)是一种慢性、进行性纤维化的肺部疾病,其病因尚不明确,通常表现为弥漫性肺泡炎、肺泡结构紊乱或细胞外基质异常沉积[1]。IPF早期症状不明显,常呈现咳嗽、咳痰,后期易出现呼吸困难或呼吸衰竭而导致死亡[2],易发于中老年人,且发病率呈逐年上升趋势。除进行肺移植手术外,IPF的治疗常采用药物治疗,包括糖皮质激素、免疫抑制剂、酪氨酸激酶抑制剂或细胞因子抑制剂等[3]。目前,针对IPF的治疗,临床用药指南推荐使用尼达尼布或吡非尼酮。但两者用药剂量大,需长期服用药物,易出现耐药性或多种不良反应,如肝功能损伤、胃肠道不适、皮肤过敏、代谢紊乱、精神障碍等[4]。如今,中医药在防治IPF方面积累了大量的临床经验和研究资料,很多中药复方在临床上已被证明具有改善IPF的作用[5]。文章简要概述了IPF的发病机制,并对中药复方抗IPF的实验研究近况总结归纳,为临床上使用中药复方防治IPF提供依据和参考。
1 IPF的发病机制IPF的发病机制复杂,至今尚未被完全认识,目前主流观点认为,IPF是由肺上皮的反复损伤以及成纤维细胞激活和肌成纤维细胞分化引起的[6]。此过程进一步导致细胞外基质(Extracellular matrix,ECM)过度沉积和肺修复异常,从而造成组织瘢痕的形成、肺泡结构的扭曲和肺功能的不可逆丧失[7]。正常情况下,肺泡上皮细胞的损伤会导致炎症细胞的募集、纤维化和基质沉积,在损伤修复阶段通过激活凋亡通路和巨噬细胞来恢复正常的肺稳态[8]。然而,在IPF中,肺上皮限制性基因如肺表面活性物质相关蛋白C(Surfactant-associated protein C,SFTPC)[9]、肺表面活性物质相关蛋白A2(Surfactant-associated protein A2,SFTPA2)[10]和ATP结合盒转运蛋白A3(ATP-binding cassette protein A3,ABCA3)的突变和黏蛋白(Mucins,MUCs)等异常表达会导致肺上皮黏膜屏障功能障碍[11],微生物、吸烟、胃食管反流和其他因素的反复刺激也会破坏肺上皮细胞的完整性[12]。
肺纤维化过程中,肺组织受损后普遍出现巨噬细胞及中性粒细胞等炎性细胞浸润的情况。炎性细胞受到刺激后,释放大量炎症因子和活性氧(ROS),加重肺组织炎性浸润和组织结构的破坏[13]。研究发现[14],巨噬细胞主要通过影响转化生长因子β1(TGF-β1)、血小板源性生长因子(PDGF)和CC趋化因子配体8(CCL8)等细胞因子的表达可加速IPF发展。中性粒细胞可通过产生中性粒细胞弹性蛋白酶,激活金属蛋白酶(MMP)和TGF-β1的表达,刺激黏液大量分泌,促进成纤维细胞的增殖[15]。而TGF-β、PDGF、结缔组织生长因子(CTGF)、血管内皮生长因子(VEGF)等细胞因子可促进进行性纤维化的发展[16-17]。同时,学者们对一些信号通路的挖掘也取得突破,如TGF-β1/Smad信号通路可调控靶基因转录及蛋白表达,研究表明其在肺纤维化的形成中扮演重要角色[18];Wnt/β-catenin主要通过调节Wnt信号蛋白、糖原合成酶激酶3β(GSK-3β)、β-连环蛋白(β-catenin)、转录因子TCF/LEF家族等,抑制纤维细胞凋亡,促进细胞的增殖与分化,进而刺激ECM的沉积[19];Notch信号通路对于机体正常发育与稳态的维持具有显著作用,其可影响肌成纤维细胞的增殖、分化与凋亡[20]。
此外,氧化应激反应以及内质网(ER)应激在IPF中发挥的作用也被逐渐认识。氧化应激反应由肺泡Ⅱ型细胞产生过量ROS导致,可诱导上皮细胞凋亡,促进促纤维化细胞因子的合成,最终导致组织损伤和纤维化[21]。ER应激可导致未折叠蛋白反应(UPR)的发生,促进肺泡上皮细胞凋亡。然而,IPF肌成纤维细胞和癌细胞则可以逃脱凋亡[22]。
2 中药复方抗特发性肺纤维化随着中医药事业稳步发展,针对中药复方作用机制的研究日益增加,其中不仅包括补阳还五汤、十枣汤等经典古方,也有养肺活血方、肺纤方等经验方、自拟方。本文主要针对近五年研究较为充分的中药复方对IPF干预机制研究的相关文献进行了汇总具体见开放科学(资源服务)标识码(OSID)。
2.1 补阳还五汤补阳还五汤首见于《医林改错》,由黄芪、当归尾、赤芍等7味中药组成,是中医理论指导下益气活血法的代表方。临床常用于治疗脑血管意外后遗症、冠心病、小儿麻痹后遗症者。有研究者[23]通过补阳还五汤对IPF小鼠的m TOR、蛋白核糖体S6蛋白激酶(S6K1)表达水平的影响,认为其防治IPF的机制主要与降低m TOR、S6K1蛋白表达、提高微管相关蛋白1轻链3Ⅱ(MAP1LC3-Ⅱ)表达,从而缓解肺纤维化导致的自噬抑制有关。张喆等[24]使用不同药物干预IPF大鼠模型,发现补阳还五汤可降低IPF大鼠Kelch样环氧氯丙烷相关蛋白1(Keap1)表达水平,同时升高重组与合成蛋白(Nrf2)、血红素氧合酶1(HO-1)表达,并降低丙二醛(MDA)含量,使超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)、过氧化氢酶(CAT)活性升高,推测其可清除氧自由基、从而降低过氧化水平。Yin等[25]对TGF-β1诱导的A549细胞进行不同给药处理,结果显示不同浓度的补阳还五汤均可降低A549细胞中波形纤维蛋白和Ⅰ型胶原蛋白(Col Ⅰ)的含量,并减弱胞内磷脂酰肌醇激酶(PI3K)和蛋白激酶B(Akt)的磷酸化,减缓胶原蛋白积累和EMT进程。此外,研究发现补阳还五汤的抗IPF机制与其抑制IPF大鼠肺组织TGF-β/Smad3信号通路中TGF-β蛋白的表达、降低信号转导分子3(Smad3)磷酸化水平有关[26-27]。杨善军等[28]观察加味补阳还五汤可降低人核转录因子p65(NF-κB p65)表达并抑制成纤维细胞增殖。
2.2 十枣汤十枣汤首见于《伤寒论》,由芫花、大戟、甘遂、大枣4味中药煮制,具有攻逐水饮之功,作用峻猛。临床常用于治疗渗出性胸膜炎、结核性胸膜炎、肝硬化等证者。牛晓等[29]观察十枣汤对IPF大鼠肺组织黏连蛋白和血小板衍生生长因子表达的影响,将96只大鼠分成6组,给药4周观察肺部病变及检测其中的层黏连蛋白(LN)和PDGF表达水平,实验结果表明,各给药组与Blank组相比,LN、PDGF表达水平明显升高,其中吡非尼酮给药组、十枣汤低剂量给药组、中剂量给药组、高剂量给药组分别与模型组比较,LN、PDGF表达水平均降低,认为十枣汤发挥其抗肺纤维化作用的机制与抑制LN和PDGF的表达有关。赵晓婷等[30]发现十枣汤可降低IPF大鼠肺组织中Ⅲ型胶原蛋白(Col Ⅲ)和基质金属蛋白酶抑制剂-1(TIMP-1)的表达从而减缓EMT进程。此外,十枣汤抗IPF机制被认为与其降低血清中TNF-α、TGF-β1和MMP-9、VEGF水平存在紧密关联[31-32]。
2.3 补肺汤补肺汤由熟地黄、桑白皮、人参等6味中药组成,临床常用于治疗慢性支气管炎、肺结核、肺纤维化、肺心病等。刘炜等[33]通过对COPD小鼠进行不同给药处理,探究补肺汤对肺纤维化小鼠血清中羟脯氨酸(Hyp)、透明质酸(HA)、LN的含量的影响,结果显示,补肺汤给药组小鼠的TGF-β/Smad3信号通路受到抑制,且血清中3种指标均下降。文秀华等[34]发现补肺汤可抑制A549、HFL1细胞TLR2、4/My D88/NF-κB信号通路的激活,从而起到保护作用。此外,有相关研究探究了加味补肺汤(茯苓、白术、半夏、甘草、桔梗、地龙、桃仁)作用于IPF大鼠后的影响,发现其能够降低大鼠体内氧化应激损伤程度,并下调炎症水平,以此推断加味补肺汤可能通过调节Nrf2-Keap1信号通路对IPF起到治疗作用[35]。
2.4 麦门冬汤麦门冬汤为治燥剂,具有清养肺胃,降逆下气之功效,由麦冬、半夏、人参、甘草、粳米、大枣组成。临床常用于治疗慢性支气管炎、支气管扩张等属肺胃阴虚,气火上逆者。研究发现其能够使IPF大鼠基质细胞衍生因子(SDF-1)的表达水平提高,促进干细胞向病变部位转移,从而改善肺纤维化[36]。王远敏等[37]采用网络药理学对麦门冬汤的潜在靶点进行了分析,并通过实验对其作用靶点进行验证,结果显示,麦门冬汤可促进MRC-5人胚肺成纤维细胞中AKT1、pAKT蛋白表达,下调VEGF蛋白,从而减缓纤维化进程。赵跃恒等[38]研究了麦门冬汤对间质性肺炎小鼠Ⅱ型肺泡上皮细胞蛋白表达水平的影响,发现其抗IPF机制与抑制α-平滑肌肌动蛋白(α-SMA)、姿势相关蛋白p62、p-PI3K、p-AKT和p-m TOR蛋白表达、升高LC3-Ⅱ蛋白表达相关。研究发现,麦门冬汤能够降低葡萄糖调节蛋白78(GRP78)和CCAAT/增强子结合蛋白同源蛋白(CHOP)的表达,同时增加表面活性物质关联蛋白C(SPC)的分泌以达到对IPF的治疗作用[39]。
2.5 大黄虫丸大黄虫丸由大黄、甘草、黄芩、桃仁、杏仁、水蛭、虻虫、蛴螬、芍药、干地黄、干漆、虫组成,具有祛瘀生新之功,专治虚劳而有瘀血干结之证。蔡松等[40]实验发现大黄虫丸能够降低IPF大鼠Smad3磷酸化程度,从而抑制IPF发展。吴丽娟等[41]以大黄虫丸干预小鼠肺纤维化模型,发现该方剂给药组小鼠的TGF-β1、α-SMA和Smad2/3表达水平显著降低,而肺组织中Smad7水平升高,认为其抑制TGF-β1表达的作用机制与MAPK/NF-κB信号通路有关。此外,有研究表明大黄虫丸可降低A549细胞中α-SMA及Col Ⅲ mRNA的表达,提示其改善A549细胞EMT程度的原因可能在于调节TGF-β1介导的Rho A/ROCK1信号通路[42]。
2.6 血府逐瘀汤血府逐瘀汤由桃仁、红花、当归、生地黄等11味中药组合而成,首见于清代王清任撰写的《医林改错》。临床常用于治疗冠心病心绞痛、风湿性心脏病等属瘀阻气滞者。有研究者[43]用血府逐瘀汤干预IPF大鼠模型,发现大鼠肺组织中钙黏蛋白E(E-cadherin)表达显著升高,而α-SMA、TGF-β1、Smad3表达显著降低,推测其作用机制可能与抑制TGF-β1/Smad3信号通路有关。王祺等[44]将40只Wistar大鼠分成4组给药28天,观察模型大鼠肺组织病理性改变以及Smad-3和MMP-7表达情况,结果显示,该药可降低IPF大鼠肺组织病理化改变程度,并抑制Smad-3和MMP-7表达,从而发挥抗肺纤维化作用。
2.7 升陷汤升陷汤出自《医学衷中参西录》,处方组成为黄芪、知母、柴胡、桔梗、升麻,具有益气升陷之效。临床常用于治疗大气下陷、失音、一氧化碳中毒,以及气胸者。张旭辉等[45]研究升陷汤对博来霉素诱导的IPF大鼠肺组织病理学改变及蛋白表达水平的影响,发现升陷汤给药组大鼠的α-SMA、TGF-β1、Smad2蛋白表达下降,表面活性蛋D(SP-D)、Smad7蛋白表达升高,肺组织炎性细胞浸润程度和胶原纤维异常沉积的状况有所缓解。此外,有研究证明升陷汤的抗IPF活性与增加大鼠体内SP-D表达、降低血清SP-D含量有关[46]。
2.8 当归补血汤当归补血汤出自《内外伤辨惑论》,由黄芪、当归组成,具有补气生血之效。临床常用于治疗冠心病心绞痛等心血瘀阻者。鲁辰希等[47]研究发现其能够下调IPF大鼠肺组织中缺氧诱导因子-1α(HIF-1α)表达,促进内皮抑素表达,增加肺部供氧,从而延缓IPF病理进程。刘娜等[48]对博来霉素诱导的肺纤维化大鼠进行不同给药处理,观察当归补血汤对大鼠多种蛋白活性的影响,试剂盒检测结果显示,与假手术组相比,模型组大鼠血清中MDA含量升高,SOD、CAT及GSH-Px活性受到抑制,实时PCR及蛋白免疫印迹法(Western blot)结果显示,肺纤维化大鼠肺组织中蛋白激酶D1(PKD1)、NF-κB、锰超氧化物歧化酶(MnSOD)mRNA及蛋白表达情况较假手术组有所提高。而当归补血汤给药组大鼠的各理化指标均得到改善,提示该复方可调节PKD1/NF-κB/MnSOD通路,从而减轻肺纤维化程度。
2.9 桃红四物汤桃红四物汤为调经要方之一,由当归、熟地黄、川芎、白芍、桃仁、红花6味中药组合而成,有养血活血之功效,始于见《医宗金鉴》。临床常用于治疗慢性萎缩性胃炎、脑梗死、偏头痛、糖尿病末梢神经炎、面神经麻痹者。周勇等[49]通过实验证实桃红四物汤可改善肺纤维化导致的大鼠肺泡萎缩,肺泡壁增厚增宽,大量炎症细胞浸润,部分细支气管上皮细胞脱等情况,同时,其对TNF-α、IL-1β、IL-6等炎症因子水平起到抑制作用,可通过抗炎作用发挥抗IPF活性。此外,有学者基于肺纤维化“肺虚络瘀”的病理学特点,从“瘀”论治,探究了桃红四物汤对肺纤维化大鼠的干预作用,结果显示,该方剂能够调整模型大鼠生存状态,对大鼠肺泡结构炎症性病变情况起到改善作用,并下调TGF-β1/Smad3信号通路表达,抑制胶原蛋白异常沉积,从而干预肺纤维化发展[50]。
2.10 炙甘草汤炙甘草汤出自《伤寒论》,由甘草(炙)、生姜等9味中药组成,为阴阳气血并补之剂。临床常用于治疗功能性心律不齐、期外收缩、冠心病等属阴血不足,阳气虚弱者。盛春瑞等[51]观察炙甘草汤对博来霉素诱导的肺纤维化ICR小鼠的影响,检测肺组织HYP、MDA、SOD和GSH-Px的活性,同时考察α-SMA、COL1A蛋白和mRNA的表达水平。结果显示,炙甘草汤对IPF引起的小鼠肺组织HYP含量升高,SOD与GSH-Px水平降低,以及α-SMA、COL1A蛋白和mRNA水平升高的情况起到较好的改善作用。提示该汤剂可能通过参与氧化应激,抑制成纤维细胞活化,减少细胞质基质沉积,从而减轻IPF。
2.11 其他方剂养肺活血方是著名中医学家王灿晖教授的经验方,有研究证实COPD大鼠经给药后,巨噬细胞由M1型转化为M2型的比例升高,精氨酸酶1(ARG1)表达明显升高,诱导型一氧化氮合酶(iNOS)表达降低[52]。姜淼等[53]研究发现养肺活血方对肺成纤维细胞的表型转化起到抑制作用,其可下调大鼠肺成纤维细胞α-SMA以及COL Ⅰ的表达,提示该方剂可能以抑制Notch1及Nothc1受体胞内结合域(NICD1)表达的方式改善NICD1与CSL的结合情况,从而抑制成纤维细胞转化。
肺纤方是姜良铎教授针对IPF患者肺间质纤维化痰瘀痹阻、肺肾亏虚创制的经验方。钟昌会等[54]研究发现肺纤方可降低COPD大鼠血清细胞因子PDGF、TGF-β1水平,抑制肺部炎症反应,且药物浓度越高效果越明显,其作用可能与下调HMGB1/TLR2信号通路活性有关。此外,有研究表明其可抑制NIH3T3细胞的增殖,并改善MMPs/TIMPs比例失衡的情况,提示该方剂可能通过抑制成纤维细胞迁移激活的方式,对肺纤维化起到改善作用[55]。
有学者在研究中证实益肺汤可降低肺组织中HYP、纤连蛋白(FN)及Ⅳ型胶原蛋白(Col Ⅳ)的含量,并降低IL-6、IL-1β、TNF-α和MDA水平,降低TGF-β1、尼克酰胺腺嘌呤二核苷酸磷酸氧化酶4(NOX 4)、血小板衍生生长因子受体-β(PDGFR-β)和Rho关联含卷曲螺旋结合蛋白激酶1(ROCK1)的表达[56]。王栋等[57]证实甘草干姜汤可降低小鼠肺组织PD-1以及外周血PD-1+ CD4+ T细胞的数量,进而通过抑制肺组织中p-STAT3含量而减少细胞因子IL-17A、TGF-β1的释放,从而抑制EMT过程,并降低HYP含量、减少ECM沉积。
此外,一些临床经验方如丹贝益肺汤、清痹达金方、补肺理气汤、益肺散结方等,其抗IPF机制均已得到一定验证[58-60]。
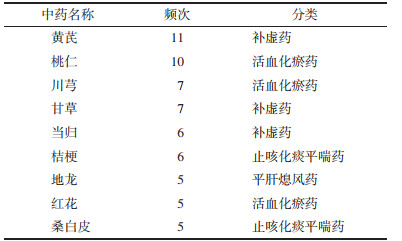
2.12 小结研究得出,以上处方共包含84种中药(排除重复),通过计算其对应频次,筛选出频次≥5的中药,共9味,其中黄芪、桃仁、川芎、甘草频次最高。整体来看,诸多方剂中补虚药、活血化瘀药以及止咳化痰平喘药使用最多,不同中药使用频次及功效分类见表 1。同时发现,不同组方虽均能表现出一定抗IPF活性,但其作用机制不尽相同,进一步印证了中医药配伍理论的多样性及潜在的可行性。
IPF是一种进行性的肺部疾病,中医学认为肺居上焦,为华盖、娇脏,易感外邪,邪气入内,肺气郁滞,痹阻经络,痰湿瘀内生,病程日久伤及肺肾,肺肾亏虚,肺叶失养,痿痹不用。痰、湿、瘀、毒等既是病理产物,又可作为病理因素阻碍五脏气血运行致五脏虚损,进一步影响肺功能。从目前已开展的中药复方研究来看,有大量经典方、自拟方得到了研究者们的广泛关注,也有一些使用频次较高的药味受到研究者们的青睐,可见中医药学者们也在积极将中医药理论与临床需求结合,努力创造出更有效且包含中医药智慧的临床用方。但对于中药复方而言,配伍复杂、靶点繁多、作用机制不明确等问题是研究者们当前面临的主要挑战。
中医药治疗IPF的未来发展,需在中医辨证理论指导下,结合现代研究技术,从多层次、多靶点的角度进行探索。同时,不能局限于动物实验,应深入临床研究,对中药复方的作用机制进行摸索,以寻求中医药现代化的新机遇。
| [1] |
LEDERER D J, MARTINEZ F J. Idiopathic pulmonary fibrosis[J]. The New England Journal of Medicine, 2018, 378(19): 1811-1823. DOI:10.1056/NEJMra1705751 |
| [2] |
RAGHU G, REMY-JARDIN M, MYERS J L, et al. Diagnosis of idiopathic pulmonary fibrosis. an official ATS/ERS/JRS/ALAT clinical practice guideline[J]. American Journal of Respiratory and Critical Care Medicine, 2018, 198(5): e44-e68. DOI:10.1164/rccm.201807-1255ST |
| [3] |
MOSS B J, RYTER S W, ROSAS I O. Pathogenic mechanisms underlying idiopathic pulmonary fibrosis[J]. Annual Review of Pathology, 2022, 17: 515-546. DOI:10.1146/annurev-pathol-042320-030240 |
| [4] |
MATTOO H, PILLAI S. Idiopathic pulmonary fibrosis and systemic sclerosis: Pathogenic mechanisms and therapeutic interventions[J]. Cellular and Molecular Life Sciences, 2021, 78(14): 5527-5542. DOI:10.1007/s00018-021-03874-y |
| [5] |
范锐, 张伟. 从气血关系探讨特发性肺纤维化之弥散功能障碍[J]. 时珍国医国药, 2020, 31(7): 1670-1671. DOI:10.3969/j.issn.1008-0805.2020.07.041 |
| [6] |
TIAN Y C, DUAN C Y, FENG J Y, et al. Roles of lipid metabolism and its regulatory mechanism in idiopathic pulmonary fibrosis: A review[J]. The International Journal of Biochemistry & Cell Biology, 2023, 155: 106361. |
| [7] |
VASARMIDI E, GHANEM M, CRESTANI B. Interstitial lung disease following coronavirus disease 2019[J]. Current Opinion in Pulmonary Medicine, 2022, 28(5): 399-406. DOI:10.1097/MCP.0000000000000900 |
| [8] |
CHANDA D, OTOUPALOVA E, SMITH S R, et al. Developmental pathways in the pathogenesis of lung fibrosis[J]. Molecular Aspects of Medicine, 2019, 65: 56-69. DOI:10.1016/j.mam.2018.08.004 |
| [9] |
SPAGNOLO P, KROPSKI J A, JONES M G, et al. Idiopathic pulmonary fibrosis: Disease mechanisms and drug development[J]. Pharmacology & Therapeutics, 2021, 222: 107798. |
| [10] |
SURI G S, KAUR G, JHA C K, et al. Understanding idiopathic pulmonary fibrosis-Clinical features, molecular mechanism and therapies[J]. Experimental Gerontology, 2021, 153: 111473. DOI:10.1016/j.exger.2021.111473 |
| [11] |
LEE J, KIM J H, HONG S H, et al. Organoid model in idiopathic pulmonary fibrosis[J]. International Journal of Stem Cells, 2021, 14(1): 1-8. DOI:10.15283/ijsc20093 |
| [12] |
ARAN D, LOONEY A P, LIU L Q, et al. Reference-based analysis of lung single-cell sequencing reveals a transitional profibrotic macrophage[J]. Nature Immunology, 2019, 20: 163-172. DOI:10.1038/s41590-018-0276-y |
| [13] |
MCKINNEY E F, LEE J C, JAYNE D R W, et al. T-cell exhaustion, co-stimulation and clinical outcome in autoimmunity and infection[J]. Nature, 2015, 523: 612-616. DOI:10.1038/nature14468 |
| [14] |
TIAN Y C, DUAN C Y, FENG J Y, et al. Roles of lipid metabolism and its regulatory mechanism in idiopathic pulmonary fibrosis: A review[J]. The International Journal of Biochemistry & Cell Biology, 2023, 155: 106361. |
| [15] |
PATRUCCO F, SOLIDORO P, GAVELLI F, et al. Idiopathic pulmonary fibrosis and post-COVID-19 lung fibrosis: Links and risks[J]. Microorganisms, 2023, 11(4): 895. DOI:10.3390/microorganisms11040895 |
| [16] |
SPAGNOLO P, SEMENZATO U. Revealing the pathogenic and ageing-related mechanisms of the enigmatic idiopathic pulmonary fibrosis (and chronic obstructive pulmonary disease)[J]. Current Opinion in Pulmonary Medicine, 2022, 28(4): 296-302. DOI:10.1097/MCP.0000000000000876 |
| [17] |
TU M J, WEI T, JIA Y F, et al. Molecular mechanisms of alveolar epithelial cell senescence and idiopathic pulmonary fibrosis: A narrative review[J]. Journal of Thoracic Disease, 2023, 15(1): 186-203. DOI:10.21037/jtd-22-886 |
| [18] |
ISHIDA Y, KUNINAKA Y, MUKAIDA N, et al. Immune mechanisms of pulmonary fibrosis with bleomycin[J]. International Journal of Molecular Sciences, 2023, 24(4): 3149. DOI:10.3390/ijms24043149 |
| [19] |
QI F, LV Z D, HUANG W D, et al. LncRNA TUG1 promotes pulmonary fibrosis progression via up-regulating CDC27 and activating PI3K/Akt/mTOR pathway[J]. Epigenetics, 2023, 18(1): 2195305. DOI:10.1080/15592294.2023.2195305 |
| [20] |
WEISKIRCHEN R, WEISKIRCHEN S, TACKE F. Organ and tissue fibrosis: Molecular signals, cellular mechanisms and translational implications[J]. Molecular Aspects of Medi-cine, 2019, 65: 2-15. DOI:10.1016/j.mam.2018.06.003 |
| [21] |
ZHAO X, KWAN J Y Y, YIP K, et al. Targeting metabolic dysregulation for fibrosis therapy[J]. Nature Reviews Drug Discovery, 2020, 19: 57-75. DOI:10.1038/s41573-019-0040-5 |
| [22] |
CHEN I C, LIU Y C, WU Y H, et al. Evaluation of proteasome inhibitors in the treatment of idiopathic pulmonary fibrosis[J]. Cells, 2022, 11(9): 1543. DOI:10.3390/cells11091543 |
| [23] |
潘怡, 王振兴, 郭静, 等. 补阳还五汤对肺纤维化小鼠中介导细胞自噬的mTOR蛋白的调控机制探讨[J]. 中国实验方剂学杂志, 2019, 25(6): 23-31. |
| [24] |
张喆, 赵舒, 韩云鹏, 等. 补阳还五汤对特发性肺纤维化大鼠Keap1/Nrf2/HO-1抗氧化信号通路的影响[J]. 中国实验方剂学杂志, 2022, 28(17): 9-16. |
| [25] |
YIN Z F, WEI Y L, WANG X, et al. Buyang Huanwu Tang inhibits cellular epithelial-to-mesenchymal transition by inhibiting TGF-β1 activation of PI3K/Akt signaling pathway in pulmonary fibrosis model in vitro[J]. BMC Complementary Medicine and Therapies, 2020, 20(1): 13. DOI:10.1186/s12906-019-2807-y |
| [26] |
李晓明, 李作盐, 石坷, 等. 补阳还五汤抑制大鼠肺纤维化及对肺组织TGF-β/Smads信号通路的影响[J]. 山东医药, 2021, 61(5): 36-39. |
| [27] |
杨晗, 王飞, 杨昆. 补阳还五汤对博莱霉素所致肺纤维化大鼠肺组织ERK表达的影响[J]. 中华中医药杂志, 2017, 32(4): 1727-1730. |
| [28] |
杨善军, 祝鹏宇, 王玥, 等. 基于NF-κB信号转导通路探讨加味补阳还五汤对肺纤维化小鼠的治疗作用[J]. 新疆医科大学学报, 2020, 43(3): 329-334. DOI:10.3969/j.issn.1009-5551.2020.03.022 |
| [29] |
牛晓, 王燕青, 逄舒婷, 等. 十枣汤对肺纤维化大鼠肺组织层粘连蛋白和血小板衍生生长因子表达的影响[J]. 世界中医药, 2022, 17(5): 699-703. DOI:10.3969/j.issn.1673-7202.2022.05.017 |
| [30] |
赵晓婷, 王燕青, 牛晓, 等. 十枣汤对肺纤维化大鼠肺组织Ⅲ型胶原和基质金属蛋白酶抑制因子1表达的影响[J]. 河北中医, 2020, 42(7): 1054-1059, 1123. DOI:10.3969/j.issn.1002-2619.2020.07.020 |
| [31] |
宋启兰, 王燕青, 王宁. 十枣汤对肺纤维化大鼠血清TNF-α和TGF-β1浓度的影响[J]. 中国中医药现代远程教育, 2014, 12(8): 157-159. DOI:10.3969/j.issn.1672-2779.2014.08.100 |
| [32] |
逄淑婷. 十枣汤治疗特发性肺纤维化的疗效观察及对VEGF、MMP-9表达的影响[D]. 济南: 山东中医药大学, 2019.
|
| [33] |
刘炜, 骆新, 沈静. 补肺汤通过TGF-β/Smad3信号通路抑制小鼠肺纤维化的研究[J]. 医药导报, 2020, 39(6): 747-752. |
| [34] |
文秀华, 杨红军. 补肺汤对IPF相关细胞活性及TLR2、4信号通路的影响[J]. 辽宁中医药大学学报, 2022, 24(6): 37-43. |
| [35] |
赵梦雅, 刘杨, 姜梦笔, 等. 加味补肺汤通过激活Nrf2-Keap1信号通路改善大鼠特发性肺纤维化的实验研究[J]. 中药药理与临床, 2022, 38(3): 48-52. |
| [36] |
何嘉, 周莹, 刘锐, 等. 麦门冬汤上调大鼠纤维化肺组织中SDF-1表达对肺纤维化的影响研究[J]. 时珍国医国药, 2022, 33(6): 1300-1303. |
| [37] |
王远敏, 徐明兴, 罗敏, 等. 基于网络药理学及实验验证初步探讨麦门冬汤治疗肺纤维化的作用机制[J]. 世界科学技术-中医药现代化, 2022, 24(10): 3932-3940. |
| [38] |
赵跃恒, 常姗, 史瑞玲, 等. 麦门冬汤对间质性肺炎小鼠Ⅱ型肺泡上皮细胞自噬及肺水清除的作用机制研究[J]. 浙江中医药大学学报, 2021, 45(2): 116-123. |
| [39] |
SHEN M M, NAN Y N, ZHANG L, et al. Maimendong decoction improves pulmonary function in rats with idiopathic pulmonary fibrosis by inhibiting endoplasmic reticulum stress in AECIIs[J]. Frontiers in Pharmacology, 2020, 11: 1262. |
| [40] |
蔡松, 蒋锋利, 黄茂, 等. 大黄䗪虫丸对博来霉素致肺纤维化大鼠TGF-β1/Smad3信号通路的影响[J]. 环球中医药, 2020, 13(10): 1667-1672. |
| [41] |
吴丽娟, 何晓艳, 梁静涛, 等. 大黄䗪虫丸经p38MAPK/NF-κB/TGF-β1通路抑制小鼠硅肺纤维化的机制探讨[J]. 中国实验方剂学杂志, 2021, 27(11): 27-34. |
| [42] |
蒋锋利, 黄茂, 马洁, 等. 大黄䗪虫丸对TGF-β1诱导A549细胞Rho/ROCK信号通路表达的影响[J]. 中华中医药杂志, 2022, 37(2): 1126-1130. |
| [43] |
武运邦, 谢红, 王金义, 等. 血府逐瘀汤对肺纤维化大鼠肺组织上皮间质转化的影响及其机制研究[J]. 中国民族民间医药, 2020, 29(17): 11-16. |
| [44] |
王祺, 关玉娟, 齐越, 等. 血府逐瘀汤对肺纤维化大鼠肺组织Smad-3、MMP-7蛋白表达的影响[J]. 辽宁中医药大学学报, 2019, 21(9): 36-39. |
| [45] |
张旭辉, 刘喜平, 孙杰, 等. 升陷汤对肺纤维化大鼠肺组织α-平滑肌肌动蛋白、肺表面活性蛋白D及TGF-β1/Smads通路蛋白表达的影响[J]. 中国中医药信息杂志, 2021, 28(4): 63-68. |
| [46] |
张旭辉, 刘喜平, 孙杰, 等. 升陷汤对肺纤维化大鼠肺功能及肺组织、血清肺表面活性物质相关蛋白D表达的影响[J]. 中华中医药杂志, 2021, 36(11): 6714-6718. |
| [47] |
鲁辰希, 王杰鹏, 刘娜, 等. 当归补血汤对特发性肺纤维化大鼠血管新生因子HIF-1α和endostatin的影响[J]. 中华中医药杂志, 2021, 36(3): 1683-1687. |
| [48] |
刘娜, 王杰鹏, 鲁辰希, 等. 当归补血汤对博莱霉素致肺纤维化大鼠PKD1/NF-κB/MnSOD信号通路的影响[J]. 中国实验方剂学杂志, 2020, 26(13): 66-72. |
| [49] |
周勇, 范伏元, 柳玉佳, 等. 桃红四物汤对肺纤维化大鼠血清炎症因子的影响[J]. 亚太传统医药, 2022, 18(4): 31-34. |
| [50] |
于小寒. 基于TGF-β1/Smad3信号通路探讨桃红四物汤对肺纤维化大鼠模型的干预作用机制[D]. 长沙: 湖南中医药大学, 2022.
|
| [51] |
盛春瑞, 刘珊珊, 陈以文, 等. 炙甘草汤通过抗氧化抑制博莱霉素诱导的小鼠肺纤维化[J]. 现代生物医学进展, 2022, 22(21): 4014-4019. |
| [52] |
徐慕鸽. 养肺活血方调控巨噬细胞极化防治肺纤维化机制研究[D]. 南京: 南京中医药大学, 2022.
|
| [53] |
姜淼, 陈惠, 董伟, 等. 养肺活血方含药血清对TGF-β1诱导的肺成纤维细胞表型转化的作用[J]. 中药药理与临床, 2019, 35(2): 119-123. |
| [54] |
钟昌会, 冼丽娜, 钱进, 等. 肺纤方通过调控HMGB1/TLR2信号通路抑制特发性肺纤维化的实验研究[J]. 中华中医药学刊, 2023, 41(4): 55-59, 263. |
| [55] |
谢纬, 唐明文, 郭竹英, 等. 肺纤方对小鼠肺纤维化模型及NIH3T3成纤维细胞作用机制的研究[J]. 现代医院, 2021, 21(5): 792-797. |
| [56] |
CHEN L J, LAN C Z, XIAO H, et al. Mechanism of yifei decoction combined with MitoQ on inhibition of TGF β1/NOX4 and PDGF/ROCK signal pathway in idiopathic pulmonary fibrosis[J]. Evidence-Based Complementary and Alternative Medicine: ECAM, 2021, 2021: 6615615. |
| [57] |
王栋. 甘草干姜汤治疗特发性肺纤维化的PD-1/IL-17A/TGF-β1分子免疫机理研究[D]. 济南: 山东中医药大学, 2021.
|
| [58] |
李强, 杨雅婷, 程娜, 等. 丹贝益肺汤对博来霉素诱导肺纤维化大鼠肺纤维化及肺血管重塑的影响[J]. 中国中医药科技, 2022, 29(6): 952-955. |
| [59] |
杨静, 吴沅皞. 基于TGF-β1信号通路探讨清痹达金方对胶原诱导性关节炎-肺纤维化大鼠的影响[J]. 现代中西医结合杂志, 2022, 31(21): 2921-2928, 3014. |
| [60] |
郑旭旭, 李丽燕, 方燕, 等. TGF-β1、α-SMA、Smad7在中药复方补肺理气汤治疗肺纤维化小鼠模型中的表达研究[J]. 全科医学临床与教育, 2022, 20(8): 697-701, 712, 668. |
 2024, Vol. 43
2024, Vol. 43