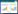文章信息
- 张卓, 张阳, 谢静怡, 尹佳鑫, 别松涛, 宋新波, 余河水, 李正
- ZHANG Zhuo, ZHANG Yang, XIE Jingyi, YIN Jiaxin, BIE Songtao, SONG Xinbo, YU Heshui, LI Zheng
- 四逆散药理作用研究进展及质量标志物(Q-marker)预测分析
- Research progress on pharmacological effects of Sini San and predictive analysis of its quality markers
- 天津中医药大学学报, 2024, 43(5): 457-463
- Journal of Tianjin University of Traditional Chinese Medicine, 2024, 43(5): 457-463
- http://dx.doi.org/10.11656/j.issn.1673-9043.2024.05.12
-
文章历史
收稿日期: 2023-10-29
2. 省部共建组分中药国家重点实验室, 天津 301617;
3. 现代中医药海河实验室, 天津 301617
2. State Key Laboratory of Component-based Chinese Medicine, Tianjin 301617, China;
3. Modern Traditional Chinese Medicine Haihe Laboratory, Tianjin 301617, China
四逆散始载于汉代张仲景的《伤寒论》,现收于卫生部药品标准中药成方制剂第九册(WS3-B-1724-94)。该方由炙甘草、柴胡、白芍、枳实等比例配伍而成,方中柴胡疏肝解郁、调畅气机,为君药;芍药与其相使配伍为臣药;枳实为佐药;甘草调和诸药,为使药。全方配伍严谨、散收结合,具有透邪解郁、疏肝理脾的功效[1]。质量标志物(Q-marker)由刘昌孝院士提出,主要包括质量传递与溯源、成分特有性、成分有效性、复方配伍环境及成分可测性五个方面[2]。本文对近年来四逆散药理作用进行综述,并对其Q-marker进行预测分析,以期为四逆散质量控制研究提供参考。
1 药理作用研究 1.1 抗抑郁四逆散治疗抑郁症的机制可能与调节神经递质、抑制炎症反应、保护神经元等有关。研究表明四逆散可上调海马组织神经递质去甲肾上腺素(NE)、多巴胺(DA)、5-羟色胺(5-HT)的含量,调节血清神经肽水平,促进ERK1/2-CREB-BDNF通路关键蛋白磷酸化,上调通路活性,从而发挥改善大鼠抑郁样行为的作用[3]。王威等[4]研究发现四逆散可通过抑制慢性温和不可预知应激(CUMS)大鼠海马中NLRP3炎症小体通路和小胶质细胞激活,降低神经炎症反应,从而改善抑郁样行为。Zhang等[5]研究表明四逆散通过激活PI3K/AKT/mTOR通路,防止过度自噬,保护初级海马神经元免受皮质酮诱导的神经毒性,发挥抗抑郁作用。Deng等[6]发现四逆散能够降低海马ATP的减少,逆转PSD-95、SYN、Mfn2、Drp1和Fis1蛋白的表达水平,改善突触和线粒体的损伤,减轻抑郁样行为。
1.2 保肝作用四逆散对不同病因引起的脂肪肝、肝损伤、肝纤维化等均有治疗作用。宋琳等[7]通过高脂饮食制备非酒精性脂肪性肝炎大鼠模型,以大鼠血清中总胆固醇(TC)、低密度脂蛋白胆固醇(LDL)、葡萄糖(GLU)、胰岛素抵抗指数(IR)、谷丙转氨酶(ALT)、谷草转氨酶(AST)等为检测指标,结果显示四逆散能降低血清TC、LDL、GLU、IR水平、ALT、AST活性和肝指数,改善肝组织内炎症和脂肪变性,表明四逆散对高脂饮食诱导的非酒精性脂肪性肝炎发挥治疗作用。赵家荣等[8]采用体外培养的人肝癌HepG2细胞作为材料,研究四逆散对肝癌细胞增殖和凋亡的影响及其机制,发现含四逆散药液血清通过阻滞肿瘤细胞于G1期而抑制人肝癌HepG2细胞增殖,并通过线粒体途径诱导人肝癌HepG2细胞凋亡。Xu等[9]研究发现四逆散能够治疗四氯化碳诱导的小鼠急性肝损伤和酒精诱导的小鼠慢性肝损伤,并证明四逆散含药血清能激活Wnt/β-catenin信号调节肝干细胞向肝细胞分化,从而促进了肝脏的再生。陈若男[10]以CCl4诱导肝纤维化小鼠为模型,研究四逆散对肝纤维化小鼠的治疗作用,发现四逆散能明显降低小鼠ALT、AST和透明质酸酶(HA)的血清含量,并能显著抑制Collagen Ⅰ和α-SMA的蛋白水平,从而抑制肝纤维化。
1.3 治疗功能性消化不良Wu等[11]研究显示四逆散通过调节脊髓背角中的NO/cGMP/PKG通路来缓解功能性消化不良(FD)模型大鼠的内脏超敏反应。朱春洋[12]基于CRF通路研究四逆散治疗FD的机制,发现四逆散通过调控中枢神经系统和外周十二指肠的CRF通路,恢复FD模型大鼠的胃顺应性和敏感性,缓解十二指肠黏膜屏障功能损伤和微炎症状态。严子兴[13]基于脑肠轴理论,研究发现四逆散加味可提高FD大鼠血清中Ghrelin含量水平,降低血清中血管活性肠肽(VIP)、5-HT和P物质(SP)的含量水平,并通过该脑肠肽的信号传导机制从而改善FD大鼠胃肠道功能,促进胃肠道蠕动,改善胃排空率及小肠推进率,通过下调FD大鼠胃窦组织的CNP蛋白的表达,从而通过抑制CNP-pGC-cGMP信号通路的传导达到改善胃肠功能的作用,上调FD大鼠胃窦组织Ghrelin蛋白的表达,从而通过脑肠轴达到改善胃肠功能的作用。
1.4 其他据文献报道,四逆散还具有改善动脉硬化、镇静催眠、抗溃疡等药理作用。范慧婕等[14]研究表明四逆散能保护脂多糖(LPS)诱导的小鼠Raw264.7细胞炎症,进而抑制LPS诱导的MAPKs/NF-κB通路磷酸化,从而发挥抗动脉粥样硬化的作用。李越峰等[15]构建多导睡眠描记术(PSG)和电刺激诱导的失眠大鼠模型,研究发现四逆散冻干粉通过延长失眠大鼠睡眠时相中慢波睡眠第二期和快速眼球运动睡眠,进而起到镇静催眠作用。李冀[16]发现四逆散通过促进6-酮-前列腺素F1α(6-Keto-PGF1α)合成、提高超氧化物歧化酶(SOD)活性、降低胃液总酸度、抑制丙二醛(MDA)水平发挥抗溃疡作用。
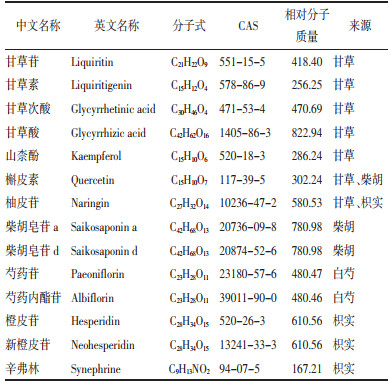
2 四逆散Q-Marker预测分析质量标志物(Q-Marker)是刘昌孝院士[2]提出的新概念,主要包括质量传递与溯源、成分特有性、成分有效性、复方配伍环境及成分可测性五个方面。Q-Marker的建立有利于完善中药质量控制及质量溯源体系。基于“五原则”的四逆散Q-Marker发现的研究路径见图 1。
|
| 图 1 基于“五原则”预测四逆散Q-Marker的研究路径 |
郑秋霞等[17]以四逆散中的四味中药甘草、柴胡、白芍、枳实为关键词在中药系统药理数据库TCMSP(http://tcmspw.com/tcmsp.php)检索,获得四逆散化学成分共779个,其中甘草280个,柴胡349个,白芍85个,枳实65个。根据口服生物利用度(OB)≥30%和类药性(DL)≥0.18筛选出144个活性成分,其中92个活性成分来自甘草,17个活性成分来自柴胡,13个活性成分来自白芍,22个活性成分来自枳实,将4味中药中重复活性成分和无对应靶点蛋白的活性成分删除后,最终获得133个活性成分。
中药化学成分复杂,药物一般在体内经过吸收、入血、代谢、分布等生物途径来发挥其疗效。从质量传递与溯源的角度,血中的有效成分是确定中药Q-Marker的重要依据[18]。马颖等[19]基于UHPLC-QTOF-MS技术分析四逆散在大鼠血浆和肝脏中原型成分和代谢产物,在血浆中检测到14个原型成分和26个代谢物,肝脏中检测到5个原型成分和16个代谢物。温静[1]通过UPLC-MS/MS技术检测四逆散的入血成分,从含药血浆中检测出23个入血成分,包括芍药苷、甘草苷、柚皮苷、柴胡皂苷等12个原型成分和11个代谢产物。乔颖等[20]采用UPLC-PDA-MS/MS技术分析四逆散水煎液体外化学成分及血中移行成分,结果在四逆散水煎液中鉴定出柚皮苷、芍药苷、甘草酸等20个化学成分,在大鼠含药血浆中发现芍药苷、柚皮苷、柚皮素等8个原型成分和6个代谢物。
2.2 基于成分特有性的四逆散Q-Marker预测分析 2.2.1 甘草成分的特有性分析甘草为豆科植物甘草(Glycyrrhiza uralensis Fisch.)、胀果甘草(Glycyrrhiza inflata Bat.)或光果甘草(Glycyrrhiza glabra L.)的干燥根和根茎[21]。其主要活性成分为三萜类和黄酮类,其中甘草酸、甘草次酸、甘草苷、甘草素、异甘草素具有抗病毒、抗炎、抗氧化、抗肿瘤等药理作用是甘草的特征性成分[22-23]。因此以甘草酸、甘草次酸、甘草苷、甘草素作为甘草的特有性成分。
2.2.2 柴胡成分的特有性分析柴胡为伞形科植物柴胡(Bupleurum chinense DC.)或狭叶柴胡(Bupleurum scorzonerifolium Willd.)的干燥根[24]。柴胡皂苷是其主要活性成分,具有多种药理作用,其中柴胡皂苷a、柴胡皂苷d在柴胡中含量较高,柴胡皂苷d被认为是最具有生物活性[25]、柴胡皂苷c被鉴定出是具有抗HBV复制活性的皂苷,具有特征性[26]。因此,以柴胡皂苷a、柴胡皂苷c、柴胡皂苷d作为柴胡的特有性成分。
2.2.3 白芍成分的特有性分析白芍为毛茛科植物芍药(Paeonia lactiflora Pall.)的干燥根[21]。单萜及其苷类以及多元酚类成分是白芍的主要活性成分,其中芍药苷、氧化芍药苷、芍药内酯苷、苯甲酰芍药苷、没食子酰芍药苷5种单萜苷类成分具有保肝、抗抑郁、神经保护等药理作用是白芍的特征性成分[27]。因此,以芍药苷、氧化芍药苷、芍药内酯苷、苯甲酰芍药苷、没食子酰芍药苷作为白芍的特有性成分。
2.2.4 枳实成分的特有性分析枳实为芸香科植物酸橙(Citrus aurantium L.)及其栽培变种或甜橙(Citrus sinensis Osbeck)的干燥幼果。枳实的主要有效成分为黄酮类和生物碱类,其中新橙皮苷、芸香柚皮苷、柚皮苷、辛弗林不仅含量较高,还具有促进胃肠动力、保肝等药理作用为枳实的特征性成分[28-29]。因此,以新橙皮苷、芸香柚皮苷、柚皮苷、辛弗林作为枳实的特有性成分。
分析单味药材可供参考的Q-Marker,基于成分特有性,总结可得四逆散Q-Marker的中药候选物有:甘草酸、甘草次酸、甘草苷、甘草素、柴胡皂苷a、柴胡皂苷c、柴胡皂苷d、芍药苷、氧化芍药苷、芍药内酯苷、苯甲酰芍药苷、没食子酰芍药苷、新橙皮苷、芸香柚皮苷、柚皮苷、辛弗林。
2.3 基于成分有效性的四逆散Q-Marker预测分析对中药有效性的控制是质量控制的基础,有效性是Q-Marker的核心要素。现代药理学研究表明,四逆散具有抗抑郁、镇静催眠、治疗功能性消化不良、保护肝脏等药理作用。
2.3.1 抗抑郁作用郭旭彤等[30]研究发现柴胡皂苷a通过改善抑郁大鼠Th17/Treg细胞的失衡、降低炎性细胞因子分泌发挥抗抑郁作用。张云等[31]发现柴胡皂苷d基于PI3K/AKT/FOXO1信号通路下调TLR4蛋白表达,改善炎症因子表达,缓解大鼠抑郁样行为。吴丽等[32]研究发现白芍中芍药苷、芍药内酯苷可通过降低nNOS、GluR1mRNA的表达而下调NO/cGMP通路从而达到抗抑郁作用。王秀云等[33]研究发现甘草苷通过上调前额叶皮质组织BDNF、Bcl-2蛋白表达及下调Bax蛋白表达,抑制神经细胞凋亡,促进神经细胞存活,改善神经突触可塑性,从而减轻脑卒中后抑郁。谢杞等[34]运用GC-MS/MS代谢组学方法,发现辛弗林通过调节模型大鼠血清中抑郁相关氨基酸代谢和其生物合成代谢途径达到抗抑郁作用。
2.3.2 镇静催眠作用李越峰等[35]发现四逆散中主要活性成分芍药苷能明显提高阈剂量戊巴比妥钠所致小鼠的睡眠时间,这表明芍药苷是四逆散治疗失眠的主要物质基础。张乔[36]研究发现四逆散有效组分通过影响小鼠脑内不同脑区5-HT合成、5-HT限速酶、5-HT的回吸收、5-HT代谢的产物和5-HT受体等途径来发挥其改善小鼠睡眠的作用。
2.3.3 对功能性消化不良的作用何娟[37]基于UPLC-MS-MS技术,研究发现甘草素、柚皮素、橙皮素是功能性消化不良的病人口服四逆散后的吸收入血成分,这些成分混合后具有明显的促胃肠动力作用,可能是四逆散治疗功能性消化不良的药效物质基础。王惠临等[38]基于网络药理学研究四逆散治疗功能性消化不良的作用机制,发现山柰酚、槲皮素、木犀草素是四逆散治疗功能性消化不良的主要物质基础,通过AKT1、IL-6、MARK等靶点调节MARK、TNF等多条信号通路发挥药理作用。
2.3.4 保肝作用温静[1]基于全方-药对-单味药材-化学成分单体水平,探究了四逆散抗肝损伤药效物质基础,研究发现芍药苷、柴胡皂苷a、甘草次酸可明显降低急性肝损伤大鼠血清中丙氨酸氨基转移酶(ALT)和天门冬氨酸氨基转移酶(AST)水平保护肝细胞,柴胡皂苷a能显著降低肝损伤大鼠血清中总胆红素(TB)的水平,具有保护肝脏的摄取、结合和排泄功能,甘草次酸能增强细胞合成蛋白质的能力,增加自由基清除酶的活性,提高肝细胞的抗氧化能力;芍药苷、柚皮苷、柴胡皂苷a、甘草次酸与药效有很大的相关性,可作为四逆散抗肝损伤的药效物质基础。李菁等[39]采用网络药理学和分子对接技术对四逆散治疗肝癌的作用机制进行探究,结果表明四逆散中的槲皮素和山柰酚主要通过TP53、HSP90AA1等相关靶点,主要涉及抗氧化反应、细胞应激反应等多个生物过程,并作用于乙型肝炎通路、PI3K-Akt信号通路从而发挥防治肝癌的作用,是四逆散治疗肝癌的重要活性成分。
综上所述,柴胡皂苷a、芍药苷、芍药内酯苷、甘草苷、辛弗林、甘草素、柚皮素、橙皮素、山柰酚、槲皮素、木犀草素、甘草次酸、柚皮苷有效成分可作为四逆散Q-Marker的预测参考。
2.4 基于网络药理学对复方配伍环境的Q-Marker预测分析复方是中药临床应用的主要形式,同样中药在不同复方中的作用和药效也不尽相同。需根据病因病机,从中药复方配伍环境出发,基于网络药理学,预测四逆散中特有性的Q-Marker。
侯磊等[40]基于网络药理学,建立四逆散的“药物-成分-靶点-疾病”网络,预测四逆散干预焦虑症的Q-Marker。选取四逆散中主要活性成分,基于TCMSP、Drugbank等数据库挖掘四逆散干预焦虑症的核心靶点基因286个,预测四逆散干预焦虑症主要通过AKT1、EGFR、FYN、CBL、CRK等靶点有关的ErBB2信号通路、EGFRv Ⅲ信号通路、CGR受体依赖性信号通路等协调发挥作用。发现四逆散中槲皮素、山柰酚、芍药苷作用于SRC、EGFR等多个靶点,是四逆散干预焦虑症的重要活性成分,可作为四逆散的Q-Marker。陈逸菲等[41]基于网络药理学,预测四逆散对肿瘤血管新生调节作用的Q-Marker。选取四逆散复方中的108个高活性成分,利用TCMSP、DrugBank、Uniprot、TTD、Metascape等数据库挖掘出92个和四逆散调节肿瘤血管新生有关的潜在靶点,发现四逆散主要通过PI3K-Akt信号通路、ER通路、HIF-1信号通路发挥调节肿瘤血管新生的作用,预测槲皮素、新橙皮苷、甘草查尔酮a、β-谷甾醇是四逆散调节肿瘤血管新生的核心成分,可作为四逆散的Q-Marker。
因此,基于复方配伍环境,四逆散可能的Q-Marker有槲皮素、山柰酚、芍药苷、新橙皮苷、甘草查尔酮α、β-谷甾醇。
2.5 基于化学成分可测性的四逆散Q-Marker预测分析化学成分的可测性是确定中药Q-Marker重要的筛选原则之一。本研究从含量测定和指纹图谱2个方面预测四逆散中具有可测性的Q-Marker。2020年版《中国药典》规定甘草中的甘草苷的含量不得低于0.50%,甘草酸的含量不得低于1.0%。柴胡中的柴胡皂苷a、柴胡皂苷d的含量不得低于0.30%。白芍中的芍药苷的含量不得低于1.2%。枳实中的辛弗林的含量不得低于0.30%[21]。贾可可等[42]运用HPLC测定四逆散中没食子酸、芍药内酯苷、芍药苷、橙皮苷、槲皮素、甘草酸、柠檬苦素、川陈皮素8种化学成分的含量,结果显示8种成分在一定范围内线性关系良好,平均加样回收率均在94.21%~100.12%,表明方法准确可靠,可用于四逆散的质量控制。李延利等[43]采用HPLC法建立10批四逆散水煎物的指纹图谱,在240 nm下标定20个共有峰,210 nm下标定24个共有峰,经与对照品比对,初步定性了指纹图中的4个主要色谱峰,分别为芍药苷、柚皮苷、橙皮苷、甘草酸。
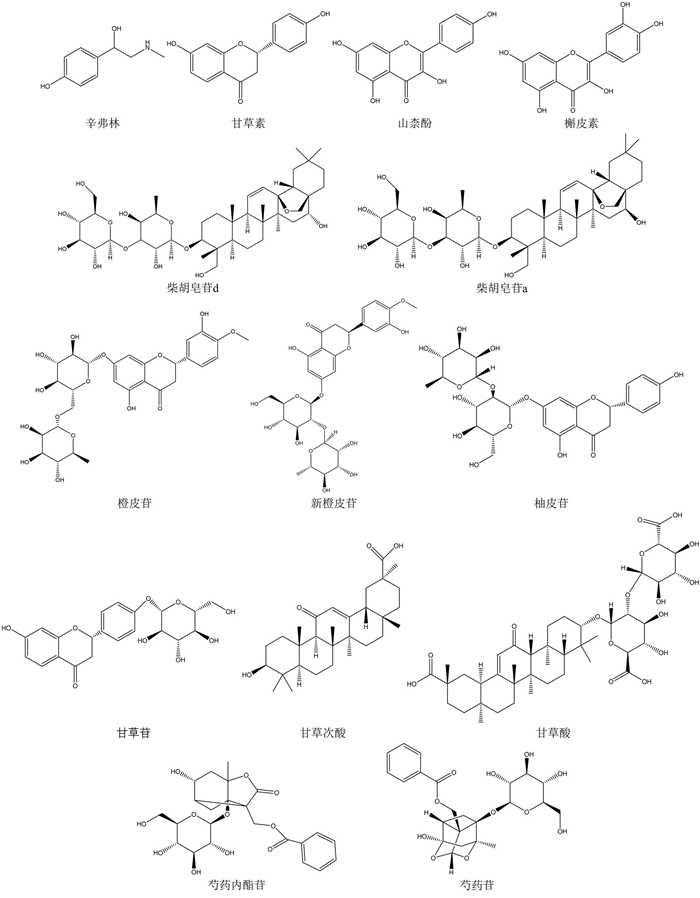
综上所述,根据Q-Marker预测分析的“五原则”,甘草苷、甘草素、甘草次酸、甘草酸、山柰酚、槲皮素、柚皮苷、柴胡皂苷a、柴胡皂苷d、芍药苷、芍药内酯苷、橙皮苷、新橙皮苷、辛弗林可作为四逆散的Q-Marker,详细信息见图 2和表 2。
|
| 图 2 四逆散Q-Marker分子结构 |
| [1] |
温静. 四逆散抗肝损伤药效物质基础与配伍机理研究[D]. 沈阳: 沈阳药科大学, 2012.
|
| [2] |
刘昌孝, 陈士林, 肖小河, 等. 中药质量标志物(Q-Marker): 中药产品质量控制的新概念[J]. 中草药, 2016, 47(9): 1443-1457. |
| [3] |
方足兵, 余雪丹, 胡红涛, 等. 四逆散对抑郁症大鼠的治疗效果及机制探究[J]. 天津中医药大学学报, 2023, 42(2): 206-211. DOI:10.11656/j.issn.1673-9043.2023.02.14 |
| [4] |
王威, 周艳艳, 喻小明, 等. 四逆散对抑郁大鼠NLRP3炎症小体及抑郁样行为的作用[J]. 中国实验方剂学杂志, 2022, 28(12): 22-30. |
| [5] |
ZHANG M J, ZHANG Y, SUN H T, et al. Sinisan protects primary hippocampal neurons against corticosterone by inhibiting autophagy via the PI3K/akt/mTOR pathway[J]. Frontiers in Psychiatry, 2021, 12: 627056. DOI:10.3389/fpsyt.2021.627056 |
| [6] |
DENG D, CUI Y F, GAN S, et al. Sinisan alleviates depression-like behaviors by regulating mitochondrial function and synaptic plasticity in maternal separation rats[J]. Phytome-dicine: International Journal of Phytotherapy and Phytopharmacology, 2022, 106: 154395. DOI:10.1016/j.phymed.2022.154395 |
| [7] |
宋琳, 陈策, 李承潇, 等. 四逆散对非酒精性脂肪性肝炎大鼠的肝保护作用研究[J]. 河北中医药学报, 2019, 34(3): 1-4. |
| [8] |
赵家荣, 冯雪松, 李宏, 等. 四逆散对人肝癌HepG2细胞增殖、凋亡的影响及其机制[J]. 中国应用生理学杂志, 2020, 36(5): 489-493. |
| [9] |
XU W D, DU X, LI J Y, et al. SiNiSan alleviates liver injury by promoting hepatic stem cell differentiation via Wnt/β-catenin signaling pathway[J]. Phytomedicine: International Journal of Phytotherapy and Phytopharmacology, 2022, 99: 153969. DOI:10.1016/j.phymed.2022.153969 |
| [10] |
陈若男. 四逆散对肝纤维化小鼠的治疗作用及其主要成分的吸收特点和相互作用研究[D]. 合肥: 安徽医科大学, 2018.
|
| [11] |
WU Z Y, LU X F, ZHANG S S, et al. Sini-San regulates the NO-cGMP-PKG pathway in the spinal dorsal horn in a modified rat model of functional dyspepsia[J]. Evidence-Based Complementary and Alternative Medicine: ECAM, 2020, 2020: 3575231. |
| [12] |
朱春洋. 基于CRF通路探讨四逆散治疗功能性消化不良的机制研究[D]. 北京: 北京中医药大学, 2020.
|
| [13] |
严子兴. 基于脑肠肽理论研究四逆散加味对功能性消化不良肝胃不和型大鼠的影响[D]. 福建中医药大学, 2022.
|
| [14] |
范慧婕, 谭章斌, 赵晓山, 等. 四逆散通过MAPKs/NF-κB途径保护脂多糖致Raw264.7的细胞炎症[J]. 暨南大学学报(自然科学与医学版), 2019, 40(1): 10-18. |
| [15] |
李越峰, 牛江涛, 曹瑞, 等. 四逆散镇静催眠作用的药理学实验研究[J]. 中国临床药理学杂志, 2016, 32(1): 62-64. |
| [16] |
李冀, 毕珺辉, 孙宇峰. 四逆散抗实验性胃溃疡的药效学及作用机理研究[J]. 中华中医药学刊, 2007, 25(7): 1317-1319. |
| [17] |
郑秋霞, 陈艳红, 林远茂, 等. 基于网络药理学-分子对接探讨四逆散治疗溃疡性结肠炎的作用机制[J]. 江西中医药, 2022, 53(9): 35-40. |
| [18] |
张铁军, 白钢, 陈常青, 等. 基于"五原则"的复方中药质量标志物(Q-marker)研究路径[J]. 中草药, 2018, 49(1): 1-13. |
| [19] |
马颖, 方方, 冯有龙, 等. 四逆散化学成分及其在大鼠血浆和肝脏中原型成分和代谢产物分析[J]. 中国医院药学杂志, 2022, 42(11): 1085-1093. |
| [20] |
乔颖, 温静, 宋洋, 等. 基于UPLC-PDA-MS/MS技术的四逆散水煎液体内外物质基础研究[J]. 中国中药杂志, 2012, 37(11): 1672-1676. |
| [21] |
国家药典委员会. 中华人民共和国药典[M]. 北京: 中国医药科技出版社, 2020: 88.
|
| [22] |
孙琛. 甘草的化学成分研究进展[J]. 科技资讯, 2020, 18(2): 64-65. |
| [23] |
邓桃妹, 彭灿, 彭代银, 等. 甘草化学成分和药理作用研究进展及质量标志物的探讨[J]. 中国中药杂志, 2021, 46(11): 2660-2676. |
| [24] |
李力恒, 陈丽萍, 胡晓阳, 等. 柴胡的化学成分及药理作用研究进展[J]. 中医药学报, 2023, 51(2): 109-112. |
| [25] |
WONG V K W, ZHOU H, CHEUNG S S F, et al. Mechanistic study of saikosaponin-d (Ssd) on suppression of murine T lymphocyte activation[J]. Journal of Cellular Biochemistry, 2009, 107(2): 303-315. DOI:10.1002/jcb.22126 |
| [26] |
PAN Y C, KE Z Y, YE H, et al. Saikosaponin C exerts anti-HBV effects by attenuating HNF1α and HNF4α expression to suppress HBV pgRNA synthesis[J]. Inflammation Research, 2019, 68(12): 1025-1034. DOI:10.1007/s00011-019-01284-2 |
| [27] |
岳倩侠, 孙叶芬, 杨爽, 等. 基于药材-饮片-标准汤剂质量传递过程的白芍质量标志物研究[J]. 中草药, 2023, 54(2): 553-560. |
| [28] |
陈思琦, 沈震亚, 罗跃华, 等. 中药枳实化学成分及药理学研究进展[J]. 药品评价, 2022, 19(14): 887-891. |
| [29] |
许姗姗, 许浚, 张笑敏, 等. 常用中药陈皮、枳实和枳壳的研究进展及质量标志物的预测分析[J]. 中草药, 2018, 49(1): 35-44. |
| [30] |
郭旭彤, 安继东, 梅建强. 柴胡皂苷A对抑郁症大鼠Treg和Th17免疫平衡的影响[J]. 海南医学院学报, 2020, 26(22): 1686-1690. |
| [31] |
张云, 高博, 许海军. 柴胡皂苷D基于PI3K/AKT/FoxO1调节神经炎症发挥抗抑郁作用[J]. 实用药物与临床, 2021, 24(5): 395-399. |
| [32] |
吴丽, 王丽丽, 李伟, 等. 芍药苷和芍药内酯苷的抗抑郁作用与NO/cGMP信号转导通路的相关性[J]. 世界中医药, 2018, 13(7): 1714-1717, 1722. |
| [33] |
王秀云, 李云, 朱含笑, 等. 甘草苷对脑卒中后抑郁大鼠额前皮质脑源性神经营养因子及Bax和Bcl-2蛋白表达的影响[J]. 中华老年心脑血管病杂志, 2021, 23(6): 647-650. |
| [34] |
谢杞, 王云, 徐秋月, 等. 辛弗林对CUMS大鼠抑郁样行为和血清代谢组学的影响[J]. 南京中医药大学学报, 2019, 35(5): 590-595. |
| [35] |
李越峰, 李廷利. 四逆散中主要有效成分芍药苷对睡眠影响的实验研究[J]. 中成药, 2011, 33(4): 690-692. |
| [36] |
张乔. 四逆散的有效组分改善睡眠作用的5-HT机制研究[D]. 哈尔滨: 黑龙江中医药大学, 2012.
|
| [37] |
何娟. 四逆散促胃肠动力成分的药物动力学研究[D]. 长沙: 中南大学, 2013.
|
| [38] |
王惠临, 张立平. 基于网络药理学探讨四逆散治疗功能性消化不良的作用机制[J]. 世界中医药, 2021, 16(10): 1507-1513. |
| [39] |
李菁, 莫嘉浩, 许洪彬, 等. 基于网络药理学与分子对接研究四逆散治疗肝癌的作用机制[J]. 临床肝胆病杂志, 2020, 36(9): 1998-2004. |
| [40] |
侯磊, 李晓宇, 黄娜娜, 等. 四逆散干预焦虑症作用机制的网络药理学分析[J]. 中草药, 2019, 50(21): 5154-5161. |
| [41] |
陈逸菲, 李笑. 基于网络药理学分析四逆散活性成分对肿瘤血管新生调节作用的分子机制探析[J]. 沈阳药科大学学报, 2022, 39(3): 306-317, 332. |
| [42] |
贾可可, 陈闪闪, 许美娟, 等. HPLC法同时测定四逆散中8种成分[J]. 中成药, 2022, 44(2): 372-375. |
| [43] |
李廷利, 黄玉新, 都晓伟. 中药复方四逆散水煎物HPLC指纹图谱研究[J]. 世界科学技术, 2005, 7(S1): 48-52. |
 2024, Vol. 43
2024, Vol. 43