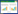文章信息
- 商丹丹, 周鸿, 黄蔓如, 江永萍, 刘彩艳, 刘锐, 张思祺, 于海洋, 王涛
- SHANG Dandan, ZHOU Hong, HUANG Manru, JIANG Yongping, LIU Caiyan, LIU Rui, ZHANG Siqi, YU Haiyang, WANG Tao
- 华山参通过TGF-β1/Smad3通路对体外纤维化的调节作用
- Study on the in vitro mechanism of Physochlaina infundibularis Kuang in intervening pulmonary fibrosis
- 天津中医药大学学报, 2024, 43(6): 523-530
- Journal of Tianjin University of Traditional Chinese Medicine, 2024, 43(6): 523-530
- http://dx.doi.org/10.11656/j.issn.1673-9043.2024.06.09
-
文章历史
收稿日期: 2024-01-28
2. 津药达仁堂集团股份有限公司第六中药厂, 天津 300401;
3. 津药达仁堂集团股份有限公司中药研究院 植化研究室, 天津 300457
2. The Sixth Chinese Medicine Factory of Tianjin Darentang Group Co., Tianjin 300401, China;
3. Phytochemical Research Department, Research Institute of Traditional Chinese Medicine, Tianjin 300457, China
肺纤维化是一种严重的进行性慢性肺部疾病,其特征是外周肺中的细胞组成和稳态发生改变,导致细胞外基质过度积累,最终使肺功能丧失[1]。目前对于肺纤维化暂无彻底的治疗方法,延长寿命最有效的方法是肺移植,但是肺移植存在着找不到合适的供体来源和免疫排斥的问题[2]。近年来,随着大家对肺纤维化研究的不断深入,同时也发现了很多中药成分对于肺纤维化有较好的治疗效果。临床上也越来越多使用中药复方结合西药治疗肺纤维化,其治疗效果优于单一疗法[3]。其中TGF-β/Smads信号通路是肺纤维化的主要通路之一,TGF-β/Smads信号通路的激活可促进Smad2/3蛋白的磷酸化,并且从TGF-β受体转移至细胞核,进而促进肺纤维化的进展[4]。TGF-β/Smads通路上调会促进细胞增殖从而抑制细胞凋亡,尤其对成纤维细胞的“上皮-间质转移”过程有显著的诱导作用。另外肺纤维化的主要通路还有PI3K/Akt、Nrf2/ARE、SphK1/S1P等,各个通路之间相互联系相互干扰使肺纤维化的过程变得更加复杂[5-7]。
华山参,为茄科植物漏斗泡囊草(Physochlaina infundibularis Kuang.)的干燥根,具有止咳祛痰、安神镇静的作用[8]。研究表明华山参滴丸能够通过减轻小鼠肺部炎症来改善过敏性小鼠的哮喘[9]。在临床实验中,认为华山参在治疗慢性支气管炎中发挥平喘作用[10]。华山参中有效成分具有似β受体兴奋和抗胆碱能药的作用,降低机体敏感性抑制组织胺等介质的释放,使平滑肌松弛而平喘[11]。肺纤维化早期肺部炎性因子会不断累积,会导致患者出现不间断的咳嗽。但目前缺少对于华山参抗肺纤维化的研究,因此在本研究中,使用小鼠胚胎成纤维细胞(NIH-3T3)、人源支气管上皮细胞(BEAS-2B)探索华山参是否具有抗肺纤维化的潜力,并对其可能机制进行探讨。
1 实验材料与方法 1.1 材料小鼠胚胎成纤维细胞(NIH/3T3)以及人源支气管上皮细胞(BEAS-2B)购于北京索莱宝科技有限公司。华山参生物碱、华山参非生物碱、华山参提取物由津药达仁堂集团第六中药厂提供,尼达尼布乙磺酸盐购于上海研生实业有限公司,高效液相色谱法鉴定纯度大于99.5%。D-山莨菪碱、L-山莨菪碱、东莨菪碱、莨菪碱、去水阿托品、脱水东莨菪碱、东莨菪内酯等7个单体成分由津药达仁堂集团中药研究院自制,纯度90%以上。DMEM高糖培养基和胎牛血清购于以色列Biological Industries公司;胰蛋白酶、青霉素/链霉素双抗溶液、BCA蛋白定量试剂盒、Lipopolysaccharides from Escherichia coil O111:B4、噻唑蓝(MTT)、二甲亚砜(DMSO)、蛋白酶抑制剂(PMFS)购于美国ThermoFisher SCIENTIFIC公司;天狼猩红、重组小鼠转化生长因子β1、β-半乳糖苷酶(β-Gal)染色试剂盒购于北京索莱宝科技有限公司;兔抗人Actin、TGF-β1、Smad3、NLRP3抗体购于美国Affinity公司。
二氧化碳(CO2)恒温箱、SORVALL ST 16R低温高速离心机(离心半径为250 mm)、MuATiskan MK3酶标仪购于美国ThermoFisher SCIENTIFIC公司;NIKON ECLIPSE CI正置荧光显微镜购于日本尼康公司;DC300F倒置相差显微镜购于德国Leica公司。
1.2 方法 1.2.1 细胞培养将NIH/3T3和BEAS-2B细胞分别接种在含10% 胎牛血清,1% 双抗(含100 U/mL青霉素,10 μg/mL链霉素)的DMEM培养基中,置于37 ℃、5% CO2的恒温培养箱中,至细胞密度为80%~90%时进行传代,弃去瓶中培养基,加入1mL胰蛋白酶进行细胞消化,当看到瓶底大片细胞脱落时加入3倍体积的DMEM培养基终止消化。以1 000 rpm/min、4 ℃离心5 min,弃去上清液,弹匀底部细胞,加入DMEM完全培养基将细胞吹匀,转移至新的培养瓶中,每3天传代1次,培养至细胞对数生长期将用于细胞实验。
1.2.2 细胞生存活力检测——华山参生物碱、华山参非生物碱和华山参提取物对NIH/3T3细胞活力的影响在这部分实验中,华山参生物碱分组为:0、50、100、150、200、250、300、350、400 μg/mL;华山参非生物碱分组为:0、10、20、30、40、50、60、70 μg/mL;华山参提取物分组为:0、25、50、75、100、125、150、175、200 μg/mL。取对数生长期的NIH/3T3和BEAS-2B细胞,以1×104 cells/孔接种于96孔板中,每孔体积100 μL,置于37 ℃、5% CO2的恒温培养箱中培养,待细胞贴壁并且状态良好后,给药处理。NIH-3T3细胞给予华山参生物碱、华山参非生物碱、华山参提取物;BEAS-2B细胞给予D-山莨菪碱、L-山莨菪碱、东莨菪碱、莨菪碱、去水阿托品、脱水东莨菪碱、东莨菪内酯单体。给药处理48 h后,将配置好的MTT溶液(1 mg/mL)添加到96孔板中,置于培养箱中孵育4 h后,弃去上清液,随后加入DMSO,使用酶标仪在450 nm处检测吸光度。
1.2.3 天狼猩红法检测胶原沉积模型具体分组为空白组、模型组、阳性对照组、华山参生物碱组(50、100、150、200、250 μg/mL)、华山参非生物碱组(10、20、30、40 μg/mL)、华山参提取物组(25、50、75、100 μg/mL)。空白组在DMEM培养基条件下培养24 h,模型组在含重组小鼠转化生长因子β1(5 ng/mL)的DMEM培养基中培养24 h,阳性对照组在含重组小鼠转化生长因子β1(5 ng/mL)和尼达尼布乙磺酸盐(终浓度2 μmol/L)的DMEM培养基中培养24 h,华山参生物碱组、华山参非生物碱组以及华山参提取物组分别在含有重组小鼠转化生长因子β1(5 ng/mL)和对应浓度药物的DMEM培养基中培养24 h。分组造模给药24 h后,弃去孔中培养基,加入冰甲醇,每孔100 μL,在-20 ℃下固定细胞4~5 h。再弃去孔中冰甲醇,每孔加入200 μL的天狼猩红染液(0.1 g天狼猩红溶于100 mL饱和苦味酸),室温避光放置4 h。弃去孔中天狼猩红染液,磷酸盐缓冲液(PBS)清洗2次后用显微镜在20倍镜视野下观察拍照。拍照结束后弃去孔中PBS,每孔中加入200 μL的0.01%乙酸溶液,洗涤3次后风干,然后在每孔中加入200 μL的0.1 mol/L氢氧化钠溶液,在振板机上振荡20 min,使其底部结晶充分溶解后,用多功能酶标仪在550 nm处检测各组吸光度值(A550 nm)。相对胶原沉积率=A550 nm(给药组)/A550 nm(阳性对照组)。
1.2.4 香烟提取物(CSE)制备及毒性试验CSE制备参考文献中的方法[9]。取12支红塔山牌香烟,去过滤嘴点燃,其烟雾溶入15 mL不含血清的DMEM培养液中制成悬液,经0.22 μm微孔滤膜过滤去除细菌和大颗粒备用,由此制备的CSE浓度视为100%。制备完成后分装CSE,并保存于-80 ℃冰箱中。
1.2.5 细胞生存活力检测——华山参生物碱单体和CSE对BEAS-2B细胞生存活力的影响参照1.2.2中方法进行该实验,具体分组为:D-山莨菪碱组、L-山莨菪碱组、东莨菪碱组、莨菪碱组、去水阿托品组、脱水东莨菪碱组、东莨菪内酯组(以上7种华山参生物碱单体给药浓度均为0、2.5、5、10、20、40、80、160 μg/mL)和CSE组,CSE组的处理方法为每孔加入100μL含有不同体积浓度的CSE(0%、0.031 25%、0.062 5%、0.125%、0.25%、0.5%、1%、2%),每个浓度设置8个复孔。
1.2.6 β-Gal检测将处于对数生长期的BEAS-2B细胞以2×105接种在六孔板中,待细胞贴壁且生长状况良好情况下分组给药进行处理,分组情况为:空白组、模型组、阳性对照组、D-山莨菪碱组、L-山莨菪碱组、东莨菪碱、莨菪碱、去水阿托品、脱水东莨菪碱和东莨菪内酯组。空白组在DMEM培养基条件下培养24 h,模型组在含CSE(2%)的DMEM培养基中培养24 h,阳性对照组在含CSE(2%)和尼达尼布乙磺酸盐(终浓度2 μmol/L)的DMEM培养基中培养24 h,D-山莨菪碱组、L-山莨菪碱组、东莨菪碱、莨菪碱、去水阿托品、脱水东莨菪碱和东莨菪内酯组分别在含有CSE(2%)和对应浓度药物的DMEM培养基中培养24 h。培养结束后,吸除每孔中的培养基,用PBS洗涤1次,每孔中加入1 mL β-Gal固定液,室温固定15 min。吸除固定液后,用PBS洗涤细胞3次,每次3 min。根据比例配制染色工作液,吸除PBS后,每孔中加入1 mL染色工作液,在37 ℃条件下孵育过夜,孵育结束后在普通光学显微镜下进行观察。
1.2.7 蛋白免疫印迹法(Western Blot)检测细胞中TGF-β1、Smad3、NLRP3蛋白表达情况将处于对数生长期的BEAS-2B细胞以2×105接种在六孔板中,待细胞贴壁且生长状况良好情况下分组给药进行处理,分组情况为:空白组、模型组、阳性对照组、东莨菪碱组(低、中、高浓度分别为20、30、40 μmol/L)、去水阿托品组(低、中、高浓度分别为2.5、5、10 μmol/L)。空白组在DMEM培养基条件下培养24 h,模型组在含CSE(2%)的DMEM培养基中培养24 h,阳性对照组在含CSE(2%)和尼达尼布乙磺酸盐(终浓度2 μmol/L)的DMEM培养基中培养24 h,东莨菪碱组和去水阿托品组分别在含有CSE(2%)和对应浓度药物的DMEM培养基中培养24 h。培养结束后取出6孔板,用胰酶消化BEAS-2B细胞,在12 000 g,4 ℃的条件下离心5 min,离心后吸出上清液,加入预先准备好的裂解液(RIPA裂解液∶PMFS∶磷酸酶抑制剂=100∶1∶1),液氮冻融5次,置于预冷的离心机中,在12 000 g,4 ℃的条件下离心5 min,取上清液至新的1.5 mL离心管中,采用BCA试剂盒(A液∶B液=50∶1)测定蛋白质浓度,加入4×上样缓冲液,置于100 ℃,5 min,室温冷却后置于-20 ℃保存。制备10% SDS-聚丙烯酰胺凝胶,取20 μg蛋白上样,进行电泳后,再进行转膜,最后用5% 脱脂牛奶封闭2 h后分别加入对应的TGF-β1、Smad3、NLRP3(1∶1 000)一抗中,4 ℃孵育过夜。经过磷酸盐吐温缓冲液(PBST)洗膜,孵育二抗后,用化学发光液进行显色和曝光,使用Image J软件分析得出目的蛋白灰度值(A),目的蛋白表达水平=A目的蛋白/AACTIN。以上实验重复3次。
1.2.8 统计学方法实验结果采用Graghpad Prim6统计学软件分析,实验数据用均数±标准差(x±s)表示样本比较应用单因素方差分析(one-way ANOVA),检测水准α=0.05,*表示P<0.05,差异具有统计学意义,**表示P<0.01,差异具有统计学显著性意义,***表示P<0.001,差异具有统计学极显著性意义。
2 实验结果 2.1 华山参生物碱、非生物碱、提取物对NIH-3T3细胞活力的影响细胞活力统计图横坐标分别为华山参生物碱、华山参非生物碱以及华山参提取物的给药浓度,纵坐标为细胞活力值(%)。细胞活力统计图显示,华山参生物碱、非生物碱以及提取物作用于NIH-3T3细胞48 h后,经过细胞活力检测,选取250、40、100 μg/mL作为华山参生物碱、非生物碱和提取物干预NIH/3T3细胞的安全浓度,并分别以这3个浓度进行天狼猩红染色实验。见图 1。
|
| 注:与0 μg/mL组比较,**P < 0.01,***P < 0.001。 图 1 华山参生物碱、非生物碱、提取物对NIH-3T3细胞活力的影响 |
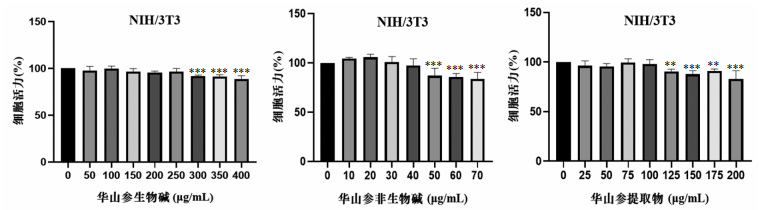
如图 2所示,NIH/3T3细胞贴壁且生长状态良好后,饥饿处理12 h,再通过重组小鼠转化生长因子β1(5 ng/mL)诱导24 h,经天狼猩红染色,镜下可见明显胶原沉积。阳性对照药,尼达尼布乙磺酸盐(终浓度2 μmol/L)可有效降低NIH-3T3细胞胶原沉积。
|
| 注:标尺为100 μm,×20。 图 2 NIH-3T3细胞胶原沉积模型构建 |
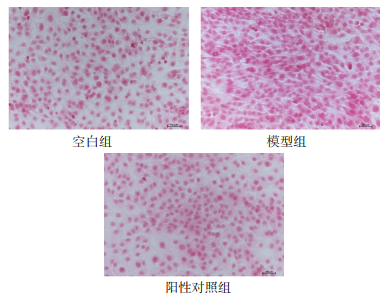
如图 3所示,经过华山参提取物25、50、75、100 μg/mL;华山参生物碱50、100、150、200、250 μg/mL;华山参非生物碱10、20、30、40 μg/mL处理24 h后,在镜像下观察到NIH-3T3细胞胶原沉积的现象有所改善。如图 4所示,横坐标为相对胶原沉积率(%),纵坐标为分组情况,计算相对胶原沉积率发现华山参生物碱、非生物碱以及提取物都能显著抑制胶原的产生,并且对胶原的抑制作用呈剂量递增趋势。
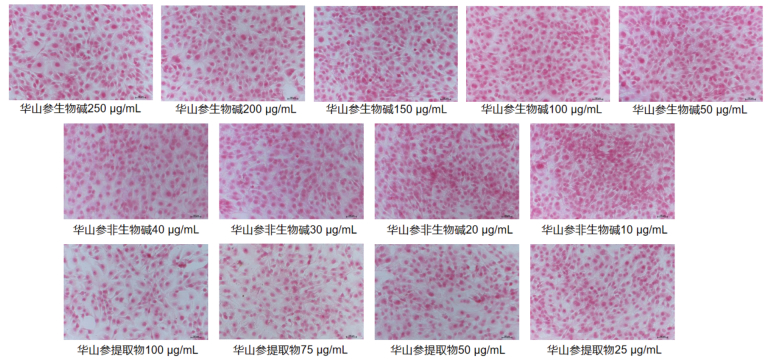
|
| 注:标尺为 100 μm。 图 3 华山参生物碱、非生物碱及提取物对NIH-3T3细胞胶原沉积的影响 |
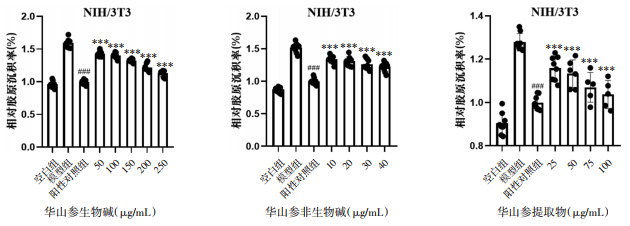
|
| 注:与空白组比较,###P < 0.001;与模型组比较,***P < 0.001。 图 4 华山参生物碱、非生物碱及提取物干预后NIH-3T3细胞相对胶原沉积率 |
根据2.1中的细胞活力检测发现,华山参提取物部分和非生物碱部分相比较于华山参生物碱部分,对NIH/3T3细胞的细胞毒性较强,因此华山参生物碱是相对安全的成分之一。在这一部分实验中,笔者选取了几种典型的华山参生物碱单体进行实验。
如图 5所示,7种华山参生物碱单体作用于NIH-3T3细胞48 h后,分别选取20、40、40、20、10、10、40 μmol/L作为D-山莨菪碱、L-山莨菪碱、东莨菪碱、莨菪碱、去水阿托品、脱水东莨菪碱、东莨菪碱内酯的细胞实验浓度;CSE干预BEAS-2B细胞24 h后,对BEAS-2B细胞的生长具有一定的抑制作用,选择2% CSE浓度作为诱导浓度。如图 6所示,横坐标为分组情况,纵坐标为β-Gal阳性百分比,模型组中β-Gal染色最明显,且能观察到细胞形态变得更长更大,甚至有部分细胞形态变得不规则,证明CSE能够促进BEAS-2B细胞发生衰老。阳性对照组较模型组染色效果显著降低;在给药组中,东莨菪碱和去水阿托品显著抑制了BEAS-2B细胞的衰老,其中去水阿托品的作用最明显。
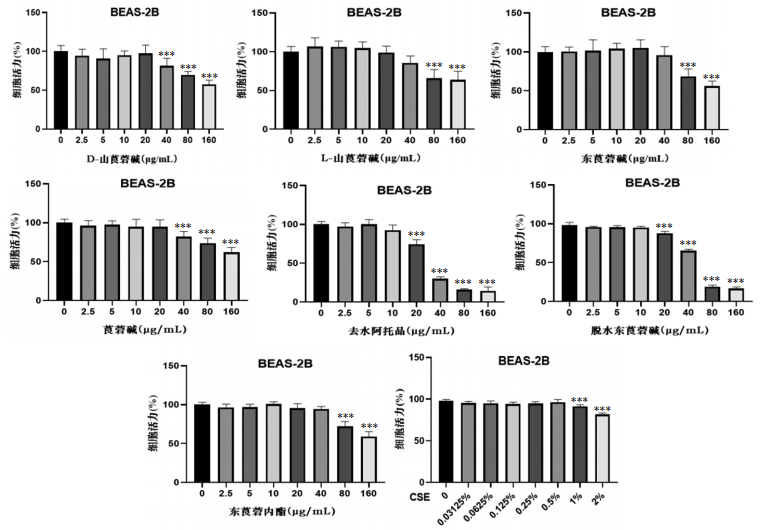
|
| 注:与0 μg/mL组比较,***P < 0.001。 图 5 华山参生物碱单体、CSE对BEAS-2B细胞活力的影响 |
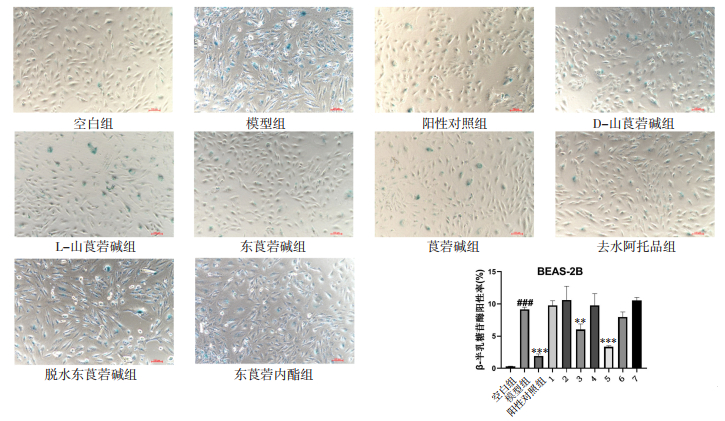
|
| 注:标尺为100 μm。与空白组比较,###P<0.001;与模型组比较,**P<0.01,***P<0.001。1,D-山莨菪碱20 μmol/L;2,L-山莨菪碱40 μmol/L;3,东莨菪碱40 μmol/L;4,莨菪碱20 μmol/L;5,去水阿托品10 μmol/L;6,脱水东莨菪碱10 μmol/L;7,东莨菪内酯40 μmol/L。 图 6 华山参生物碱单体对CSE诱导的BEAS-2B细胞衰老的影响 |
如图 7所示,在CSE诱导的BEAS-2B细胞中,TGF-β1/Smad3信号通路被激活,表现在TGF-β1和Smad3蛋白的上调。TGF-β1/Smad3通路的激活会引起多种炎性蛋白激活,而东莨菪碱和去水阿托品可以下调TGF-β1和Smad3蛋白的表达,并且在抑制TGF-β1的作用上呈剂量依赖性。NLRP3是一种典型的炎性小体,是炎性反应中重要的组成部分,CSE诱导导致NLRP3蛋白上调,东莨菪碱和去水阿托品干预后,NLRP3明显下调。
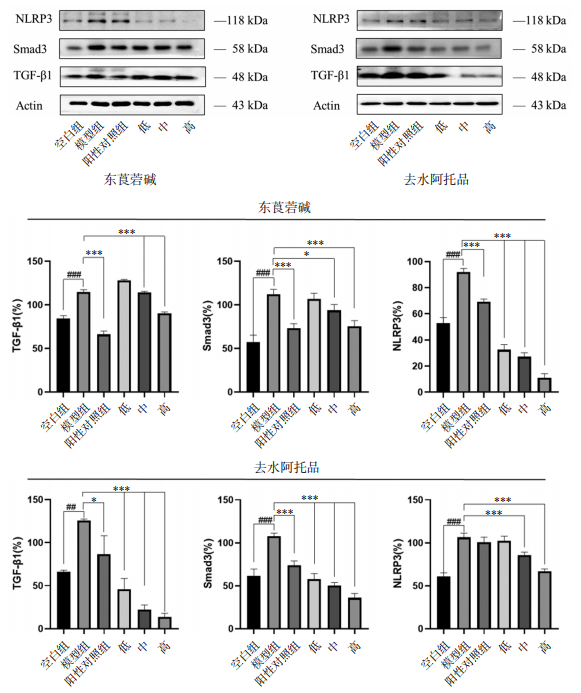
|
| 注:与空白组比较,##P<0.01,###P<0.001;与模型组比较,*P<0.05,**P<0.01,***P<0.001。东莨菪碱的低、中、高浓度分别为20、30、40 μmol/L;去水阿托品的低、中、高浓度分别为2.5、5、10 μmol/L。 图 7 华山参生物碱单体对TGF-β1、Smad3、NLRP3蛋白的影响 |
肺纤维化的进程伴随着慢性进行性瘢痕的形成,严重情况下会导致呼吸衰竭[12]。肺纤维化可以大致分为两大类,一类是发病机制尚不明确的特发性肺纤维化,一类是病因明确的继发性肺纤维化。特发性肺纤维化的进展会更迅速,并且在临床用药上只能做到缓解症状,不能根治[13]。临床上常用的治疗特发性肺纤维化的药物有吡非尼酮和尼达尼布,但是这两种药物并没有起到改善和稳定肺功能的作用,同时还存在着耐受性的问题[14-16]。吡非尼酮和尼达尼布最常见的不良反应是胃肠道反应,据统计,大约有60%的患者在服用尼达尼布的前3个月具有腹泻和恶心的症状[17]。随着中医药的潜在价值被不断挖掘,其在治疗肺纤维化中具有连续性强、毒性低、多靶点等优点。同时,越来越多的有效中药在临床上被用于治疗肺纤维化,例如复方鳖甲软肝片、金匮肾气丸、大黄虫丸以及丹红注射液等等[18-21]。华山参作为一味归肺、心经的中药,具有温肺祛痰、平喘止咳、安神镇惊的功效,已有研究证明华山参滴丸能够改善哮喘小鼠肺部炎症细胞的浸润,气道结构改变和气管收缩现象[9]。在研究中,结果表明,无论是华山参的生物碱部位,还是非生物碱部位,还是总提取物部位均可以抑制重组小鼠转化生长因子β1诱导的NIH-3T3细胞胶原沉积,并且呈剂量依赖性。
关于特发性肺纤维化的机制,大多都离不开炎性浸润和细胞间充质,由于肺泡上皮细胞不断进行异常的损伤后修复的这一进程,导致上皮-成纤维细胞之间的串扰失调,从而促进细胞外基质(ECM)沉积[22]。实际上肺纤维化的发病机制远不止以上两点,例如细胞的衰老、异常的免疫反应、相关激酶的过度激活等[22]。在肺纤维化进展的过程中,有多种代表性分子的功能被放大,非常具有代表性的是与ECM以及成纤维细胞增殖相关的TGF-β和PDGF,与内皮细胞增殖相关的FGF和TGF-α,与肺损伤后血管生成相关的VEGF[23]。在本研究中,结果表明华山参中的东莨菪碱和去水阿托品成分能够抑制CSE诱导的支气管上皮细胞BEAS-2B细胞发生衰老,同时能够降低TGF-β1、Smad3、NLRP3蛋白的表达。表示其作用机制与TGF-β1/Smad3信号通路相关。
综上所述,华山参能够抑制重组小鼠转化生长因子β1诱导的胶原蛋白沉积,其有效成分东莨菪碱和去水阿托品能够通过调节TGF-β1/Smad3信号通路抑制细胞衰老。研究为华山参治疗肺纤维化提供了实验理论依据,但是还缺乏更加详细的分子作用机制研究,因此还需进一步探索其更加具体的作用机制。
| [1] |
吕凌燕, 李瑞琴, 孙春霞, 等. 肺纤维化中的关键细胞及细胞外基质研究进展[J]. 当代医学, 2020, 26(12): 192-194. |
| [2] |
TENG M A, RYU J H. Obstacles to early treatment of idiopathic pulmonary fibrosis: Current perspectives[J]. Therapeutics and Clinical Risk Management, 2019, 15: 73-81. DOI:10.2147/TCRM.S160248 |
| [3] |
丁大力, 沈学彬, 姚佳慧, 等. 中药治疗肺纤维化的研究进展[J]. 中草药, 2021, 52(22): 7006-7024. |
| [4] |
黄莺, 徐芳. 虎杖总蒽醌对肺间质纤维化大鼠上皮间质转化过程中TGFβ1-smad信号通路的影响[J]. 中成药, 2021, 43(1): 204-207. |
| [5] |
陈则圣, 吴一鸣, 周婷, 等. PD-1分子调控肺纤维化的机制进展及其在矽肺病研究中的展望[J]. 公共卫生与预防医学, 2022, 33(4): 118-123. |
| [6] |
孙晓伟, 肖华, 宋学术, 等. 萝卜硫素通过Nrf2/ARE通路缓解矽肺模型大鼠肺组织纤维化及氧化应激的实验研究[J]. 临床和实验医学杂志, 2020, 19(6): 586-589. |
| [7] |
刘利娟, 李傲. SphK1/S1P信号通路在肺纤维化发生中的作用[J]. 济宁医学院学报, 2019, 42(6): 424-427. |
| [8] |
娄永, 许睿珠, 张丽萍, 等. 华山参中2个新酰胺类化合物[J]. 中草药, 2021, 52(2): 331-334. |
| [9] |
崔妮娜. 华山参滴丸对哮喘的作用机制研究[D]. 天津: 天津科技大学, 2020.
|
| [10] |
张霁生, 薛蕾, 谢椿霞. 华山参滴丸治疗支气管哮喘的临床观察[J]. 天津药学, 2001, 13(3): 61-62. |
| [11] |
OJO O, LAGAN A L, RAJENDRAN V, et al. Pathological changes in the COPD lung mesenchyme-Novel lessons learned from in vitro and in vivo studies[J]. Pulmonary Pharmacology & Therapeutics, 2014, 29(2): 121-128. |
| [12] |
SGALLA G, KULKARNI T, ANTIN-OZERKIS D, et al. Update in pulmonary fibrosis 2018[J]. American Journal of Respiratory and Critical Care Medicine, 2019, 200(3): 292-300. DOI:10.1164/rccm.201903-0542UP |
| [13] |
LEÓN-ROMÁN F, VALENZUELA C, MOLINA-MOLINA M. Idiopathic pulmonary fibrosis[J]. Medicina Clínica (English Edition), 2022, 159(4): 189-194. DOI:10.1016/j.medcle.2022.02.023 |
| [14] |
KREUTER M, BONELLA F, WIJSENBEEK M, et al. Pharmacological treatment of idiopathic pulmonary fibrosis: Current approaches, unsolved issues, and future perspectives[J]. BioMed Research International, 2015, 2015: 329481. |
| [15] |
NOBLE P W, ALBERA C, BRADFORD W Z, et al. Pirfenidone in patients with idiopathic pulmonary fibrosis (CAPACITY): Two randomised trials[J]. The Lancet, 2011, 377(9779): 1760-1769. DOI:10.1016/S0140-6736(11)60405-4 |
| [16] |
CANESTARO W J, FORRESTER S H, RAGHU G, et al. Drug treatment of idiopathic pulmonary fibrosis: Systematic review and network meta-analysis[J]. Chest, 2016, 149(3): 756-766. DOI:10.1016/j.chest.2015.11.013 |
| [17] |
SPAGNOLO P, KROPSKI J A, JONES M G, et al. Idiopathic pulmonary fibrosis: Disease mechanisms and drug development[J]. Pharmacology & Therapeutics, 2021, 222: 107798. |
| [18] |
ZHANG Y, MAO X, CHEN W, et al. A discovery of clinically approved formula FBRP for repositioning to treat HCC by inhibiting PI3K/AKT/NF-κB activation[J]. Mol Ther Nucleic Acids, 2020, 19: 890-904. DOI:10.1016/j.omtn.2019.12.023 |
| [19] |
宋建平, 李伟, 李瑞琴, 等. 金匮要略》不同方药对肺纤维化模型早期阶段(7天)肺、脑组织NE、DA、5-HT含量的影响[J]. 中华中医药杂志, 2009, 24(5): 568-571. |
| [20] |
宋建平, 谢忠礼, 李伟, 等. 大黄虫丸对大鼠肺纤维化形成阶段肺与脑组织中神经递质的影响[J]. 中医杂志, 2011, 52(19): 1676-1678. |
| [21] |
辛丽丽, 姜淼, 张赓, 等. 丹红注射液治疗特发性肺纤维化临床疗效及安全性的Meta分析[J]. 中国中药杂志, 2016, 41(20): 3859-3865. |
| [22] |
RICHELDI L, COLLARD H R, JONES M G. Idiopathic pulmonary fibrosis[J]. The Lancet, 2017, 389(10082): 1941-1952. DOI:10.1016/S0140-6736(17)30866-8 |
| [23] |
KINOSHITA T, GOTO T. Molecular mechanisms of pulmonary fibrogenesis and its progression to lung cancer: A review[J]. International Journal of Molecular Sciences, 2019, 20(6): 1461. DOI:10.3390/ijms20061461 |
 2024, Vol. 43
2024, Vol. 43