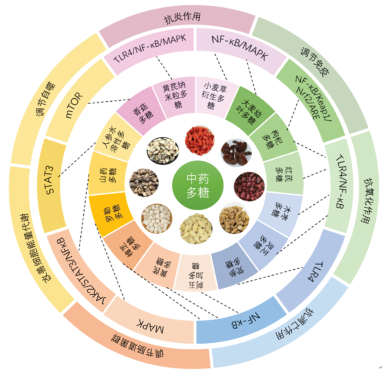
| [1] |
FLEISCHMANN-STRUZEK C, MELLHAMMAR L, ROSE N, et al. Incidence and mortality of hospitaland ICU-treated sepsis: Results from an updated and expanded systematic review and meta-analysis[J]. Intensive Care Medicine, 2020, 46(8): 1552-1562. DOI:10.1007/s00134-020-06151-x |
|
| [2] | |
|
| [3] | |
|
| [4] |
HOU C Y, CHEN L L, YANG L Z, et al. An insight into anti-inflammatory effects of natural polysaccharides[J]. International Journal of Biological Macromolecules, 2020, 153: 248-255. DOI:10.1016/j.ijbiomac.2020.02.315 |
|
| [5] |
ZENG P J, LI J, CHEN Y L, et al. The structures and biological functions of polysaccharides from traditional Chinese herbs[J]. Progress in Molecular Biology and Translational Science, 2019, 163: 423-444. |
|
| [6] |
HUANG M, CAI S L, SU J Q. The pathogenesis of sepsis and potential therapeutic targets[J]. International Journal of Molecular Sciences, 2019, 20(21): 5376. DOI:10.3390/ijms20215376 |
|
| [7] |
ZHANG Y Y, NING B T. Signaling pathways and intervention therapies in sepsis[J]. Signal Transduction and Targeted Therapy, 2021, 6(1): 407. DOI:10.1038/s41392-021-00816-9 |
|
| [8] | |
|
| [9] | |
|
| [10] |
ZHENG Y, BAI L, ZHOU Y P, et al. Polysaccharides from Chinese herbal medicine for anti-diabetes recent advances[J]. International Journal of Biological Macromolecules, 2019, 121: 1240-1253. DOI:10.1016/j.ijbiomac.2018.10.072 |
|
| [11] | |
|
| [12] |
XUE H K, LI P C, BIAN J Y, et al. Extraction, purification, structure, modification, and biological activity of traditional Chinese medicine polysaccharides: A review[J]. Frontiers in Nutrition, 2022, 9: 1005181. DOI:10.3389/fnut.2022.1005181 |
|
| [13] | |
|
| [14] |
CHATURVEDI V, MARSH R A, ZOREF-LORENZ A, et al. T-cell activation profiles distinguish hemophagocytic lymphohistiocytosis and early sepsis[J]. Blood, 2021, 137(17): 2337-2346. DOI:10.1182/blood.2020009499 |
|
| [15] |
JOSE R J, MANUEL A. COVID-19 cytokine storm: The interplay between inflammation and coagulation[J]. The Lancet Respiratory Medicine, 2020, 8(6): e46-e47. DOI:10.1016/S2213-2600(20)30216-2 |
|
| [16] |
GUSTINE J N, JONES D. Immunopathology of hyperinflammation in COVID-19[J]. The American Journal of Pathology, 2021, 191(1): 4-17. DOI:10.1016/j.ajpath.2020.08.009 |
|
| [17] |
SUN J, WEI S Z, ZHANG Y L, et al. Protective effects of Astragalus polysaccharide on sepsis-induced acute kidney injury[J]. Analytical Cellular Pathology (Amsterdam), 2021, 2021: 7178253. |
|
| [18] | |
|
| [19] | |
|
| [20] | |
|
| [21] | |
|
| [22] |
XU Z H, SU X, YANG G, et al. Ganoderma lucidum polysaccharides protect against sepsis-induced cardiac dysfunction by activating SIRT1[J]. The Journal of Pharmacy and Pharmacology, 2022, 74(1): 124-130. DOI:10.1093/jpp/rgab142 |
|
| [23] | |
|
| [24] |
刘志昌. 枸杞多糖对脓毒症致肠上皮屏障损伤中的保护作用研究[D]. 兰州: 兰州大学, 2022.
|
|
| [25] | |
|
| [26] |
WU Q, LIU L T, WANG X Y, et al. Lycium barbarum polysaccharides attenuate kidney injury in septic rats by regulating Keap1-Nrf2/ARE pathway[J]. Life Sciences, 2020, 242: 117240. DOI:10.1016/j.lfs.2019.117240 |
|
| [27] |
DING H, YANG P, ZHANG X H, et al. Efficacy of pretreatment with Lycium barbarum polysaccharide in various doses in influencing splenic immunity and prognosis of sepsis in rats[J]. Evidence-Based Complementary and Alternative Medicine: ECAM, 2022, 2022: 9508603. |
|
| [28] |
KUANG Z S, JIN T T, WU C Y, et al. Lentinan attenuates damage of the small intestinal mucosa, liver, and lung in mice with gut-origin sepsis[J]. Journal of Immunology Research, 2021, 2021: 2052757. |
|
| [29] | |
|
| [30] |
WU Y, LI D, WANG H, et al. Protective effect of Poria cocos polysaccharides on fecal peritonitis-induced sepsis in mice through inhibition of oxidative stress, inflammation, apoptosis, and reduction of Treg cells[J]. Frontiers in Microbiology, 2022, 13: 887949. DOI:10.3389/fmicb.2022.887949 |
|
| [31] | |
|
| [32] |
USMANI J, KHAN T, AHMAD R, et al. Potential role of herbal medicines as a novel approach in sepsis treatment[J]. Biomedicine & Pharmacotherapy, 2021, 144: 112337. |
|
| [33] |
SU L J, ZHANG J H, GOMEZ H, et al. Reactive oxygen species-induced lipid peroxidation in apoptosis, autophagy, and ferroptosis[J]. Oxidative Medicine and Cellular Longevity, 2019, 2019: 5080843. |
|
| [34] |
XU S Q, LI L L, WU J, et al. Melatonin attenuates sepsisinduced small-intestine injury by upregulating SIRT3-mediated oxidative-stress inhibition, mitochondrial protection, and autophagy induction[J]. Frontiers in Immunology, 2021, 12: 625627. DOI:10.3389/fimmu.2021.625627 |
|
| [35] |
NEPALI S, KI H H, LEE J H, et al. Wheatgrass-derived polysaccharide has antiinflammatory, anti-oxidative and antiapoptotic effects on LPS-induced hepatic injury in mice[J]. Phytotherapy Research, 2017, 31(7): 1107-1116. DOI:10.1002/ptr.5835 |
|
| [36] |
REN Z Z, LIU W B, SONG X L, et al. Antioxidant and antiinflammation of enzymatic-hydrolysis residue polysaccharides by Lentinula edodes[J]. International Journal of Biological Macromolecules, 2018, 120(Pt A): 811-822. |
|
| [37] |
HAN H S, KIM S Y, SHIN J S, et al. Polysaccharide fraction isolated from the leaves of Hordeum vulgare L. protects against colonic inflammation of systemic immune responses[J]. Journal of Functional Foods, 2021, 87: 104765. DOI:10.1016/j.jff.2021.104765 |
|
| [38] | |
|
| [39] |
LIU D, HUANG S Y, SUN J H, et al. Sepsis-induced immunosuppression: Mechanisms, diagnosis and current treatment options[J]. Military Medical Research, 2022, 9(1): 56. |
|
| [40] |
ZHENG Y S, WU Z S, NI H B, et al. Codonopsis pilosula polysaccharide attenuates cecal ligation and puncture sepsis via circuiting regulatory T cells in mice[J]. Shock, 2014, 41(3): 250-255. |
|
| [41] | |
|
| [42] |
KIM S Y, SHIN J S, CHUNG K S, et al. Immunostimulatory effects of live Lactobacillus sakei K040706 on the CYPinduced immunosuppression mouse model[J]. Nutrients, 2020, 12(11): 3573. |
|
| [43] |
CAO C, YU M M, CHAI Y F. Pathological alteration and therapeutic implications of sepsis-induced immune cell apoptosis[J]. Cell Death & Disease, 2019, 10(10): 782. |
|
| [44] |
ZHOU H C, GUO C A, YU W W, et al. Zizyphus jujuba cv. Muzao polysaccharides enhance intestinal barrier function and improve the survival of septic mice[J]. Journal of Food Biochemistry, 2021, 45(5): e13722. |
|
| [45] | |
|
| [46] |
BURDETTE B E, ESPARZA A N, ZHU H, et al. Gasdermin D in pyroptosis[J]. Acta Pharmaceutica Sinica B, 2021, 11(9): 2768-2782. |
|
| [47] |
RATHINAM V A, VANAJA S K, WAGGONER L, et al. TRIF licenses caspase-11-dependent NLRP3 inflammasome activation by gram-negative bacteria[J]. Cell, 2012, 150(3): 606-619. |
|
| [48] |
YANG Y, WANG H N, KOUADIR M, et al. Recent advances in the mechanisms of NLRP3 inflammasome activation and its inhibitors[J]. Cell Death & Disease, 2019, 10(2): 128. |
|
| [49] |
XIAO L X, QI L, ZHANG G Z, et al. Polygonatum sibiricum polysaccharides attenuate lipopoly-saccharide-induced septic liver injury by suppression of pyroptosis via NLRP3/GSDMD signals[J]. Molecules, 2022, 27(18): 5999. |
|
| [50] | |
|
| [51] | |
|
| [52] |
JIMI E, FEI H, NAKATOMI C. NF-κB signaling regulates physiological and pathological chondrogenesis[J]. International Journal of Molecular Sciences, 2019, 20(24): 6275. |
|
| [53] |
ZHONG H Y, ZHANG H X, HU Y W, et al. Self-assembled micelle derived from pterostilbene ameliorate acute inflammatory bowel disease[J]. International Journal of Pharmaceutics, 2023, 630: 122420. |
|
| [54] |
XU X Y, RUI S Z, CHEN C, et al. Protective effects of astragalus polysaccharide nanoparticles on septic cardiac dysfunction through inhibition of TLR4/NF-κB signaling pathway[J]. International Journal of Biological Macromolecules, 2020, 153: 977-985. |
|
| [55] | |
|
| [56] | |
|
| [57] |
HAN J, LI J H, BAI G, et al. Acanthopanax senticosus polysaccharides-induced intestinal tight junction injury alleviation via inhibition of NF-κB/MLCK pathway in a mouse endotoxemia model[J]. World Journal of Gastroenterology, 2017, 23(12): 2175-2184. |
|
| [58] | |
|
| [59] |
MENG L M, PAI M H, LIU J J, et al. Polysaccharides from extracts of Antrodia camphorata mycelia and fruiting bodies modulate inflammatory mediator expression in mice with polymicrobial sepsis[J]. Nutrition, 2012, 28(9): 942-949. |
|
| [60] | |
|
| [61] | |
|
| [62] |
QIN C, FAN W H, LIU Q, et al. Fingolimod protects against ischemic white matter damage by modulating microglia toward M2 polarization via STAT3 pathway[J]. Stroke, 2017, 48(12): 3336-3346. |
|
| [63] |
LI Q, LI Q, HAO Z H, et al. A novel polysaccharide from Rhizoma panacis japonica exerts anti-inflammatory effects via STAT3 signal pathway[J]. RSC Advances, 2018, 8(46): 26371-26376. |
|
| [64] | |
|
| [65] |
CHEN X S, WANG S H, LIU C Y, et al. Losartan attenuates sepsis-induced cardiomyopathy by regulating macrophage polarization via TLR4-mediated NF-κB and MAPK signaling[J]. Pharmacological Research, 2022, 185: 106473. |
|
| [66] |
CHEN X, HE Y, WEI Q, et al. Basil polysaccharide reverses development of experimental model of sepsis-induced secondary Staphylococcus aureus pneumonia[J]. Mediators of Inflammation, 2021, 2021: 5596339. |
|
| [67] |
SCIARRETTA S, FORTE M, FRATI G, et al. New insights into the role of mTOR signaling in the cardiovascular system[J]. Circulation Research, 2018, 122(3): 489-505. |
|
| [68] |
LI G M, LIU S S, WANG H L, et al. Ligustrazine ameliorates lipopolysaccharide-induced neurocognitive impairment by activating autophagy via the PI3K/AKT/mTOR pathway[J]. International Journal of Molecular Medicine, 2020, 45(6): 1711-1720. |
|
| [69] | |
|
| [70] | |
|
| [71] |
MONTES F O, VÁQUEZ-HERNÁDEZ A, FENTON-NAVARRO B. Active compounds of medicinal plants, mechanism for antioxidant and beneficial effects[J]. Phyton, 2019, 88(1): 1-10. |
|
 2024, Vol. 43
2024, Vol. 43