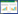文章信息
- 郭梦笑, 格丁佐, 王睿瑞, 刘保成, 张磊
- GUO Mengxiao, GE Dingzuo, WANG Ruirui, LIU Baocheng, ZHANG Lei
- 熊胆粉对2型糖尿病小鼠胆汁酸-肠道菌群轴的影响
- Effects of bear bile powder on bile acids and intestinal flora in type 2 diabetic mice
- 天津中医药大学学报, 2024, 43(7): 600-609
- Journal of Tianjin University of Traditional Chinese Medicine, 2024, 43(7): 600-609
- http://dx.doi.org/10.11656/j.issn.1673-9043.2024.07.06
-
文章历史
收稿日期: 2024-03-22
2型糖尿病(T2D)是一种常见的以胰岛素抵抗为主要特征,或伴有胰岛素分泌相对不足的慢性代谢性疾病,临床主要表现为多饮、多食、多尿和血糖升高[1]。近年来,T2D的发病率逐年上升,已经对公众健康造成严重威胁。中医药在防治糖尿病领域因其多成分、多靶点、不良反应小等优势日益受到重视[2]。因此,开发能够有效降低血糖且不良反应相对较小的中药对于提升国民健康水平具有重要意义。
熊胆粉是黑熊胆汁干燥而成的粉末状天然中药,具有清热解毒、平肝明目的功效,用于治疗肝火旺盛引起的疾病,如惊风抽搐、咽喉肿痛等,其主要化学成分是牛磺酸去氧胆酸(TUDCA)和熊去氧胆酸(UDCA)等[3]。TUDCA已经被发现具有缓解脂质代谢紊乱、降低氧化应激和肠道炎症、改善血糖稳态和胰岛素敏感性的作用[4]。UDCA对胰腺β细胞具有直接保护作用,可以缓解糖尿病患者内质网应激和促炎反应的表达[5]。然而,目前熊胆粉在临床上多用于清热护肝,对于其治疗T2D的作用机制尚不明确。药理学研究表明,熊胆粉除了具有保护肝肾[6-7]、治疗眼病[8]、抗炎[9]等作用外,还可能通过调节代谢谱、肠道菌群和短链脂肪酸等途径来改善T2D[10]。因此,本文研究熊胆粉对T2D小鼠的防治作用,并对其作用机制进行分析,以期为临床应用提供新的参考。
人体的肠道菌群大约由1013~1014个细菌组成,具有高度的遗传潜力,极大地提升了身体的代谢能力[11]。胆汁酸是肠道菌群的重要代谢产物之一,胆汁酸和肠道菌群之间存在着动态的相互作用。胆汁酸是由胆固醇合成并储存在胆囊中的初级胆汁酸与作为细菌代谢产物的次级胆汁酸组成[12]。在胆汁酸的肠肝循环过程中,其通过在小肠中形成微胶粒来促进膳食脂质的吸收或排泄,调控肠道菌群稳态,激活法尼醇X受体(FXR)和G蛋白偶联胆汁酸受体5(TGR5),从而诱导胰高血糖素样肽-1(GLP-1)的分泌,改善葡萄糖稳态,而肠道菌群也可以通过调节胆汁酸池的大小以及各胆汁酸成分的比例治疗T2D[13]。脂多糖(LPS)结合蛋白(LBP)是LPS的配体,与胰岛素抵抗[14]和肠道菌群[15]密切相关,因此选择LBP作为检测指标。本研究拟从胆汁酸-肠道菌群轴变化角度,探究熊胆粉改善T2D小鼠的作用机制,为临床治疗T2D提供实验依据。
1 材料与方法 1.1 药物熊胆粉(福建归真堂药业股份有限公司,规格0.1 g/瓶,批号20210901),盐酸二甲双胍片(默克制药有限公司,规格0.5 g/片,批号ACD0048)。
1.2 动物SPF级雄性C57BL/6小鼠30只,7~8周龄,体质量(24±1) g,购自浙江维通利华实验动物技术有限公司[合格证号:SCXK(浙)2019-0001]。饲养于上海市南方模式生物科技股份有限公司SPF级动物实验室,室温(22±2) ℃,12 h光照/12 h昼夜交替,自由饮水。本文涉及的动物实验经上海中医药大学实验动物伦理会批准(伦理批号:PZSHUTCM2305040004)。
1.3 试剂链脲佐菌素(STZ,美国MP公司,货号:100557),柠檬酸-柠檬酸钠缓冲液(0.1 mol/L,pH 4.5,南京森贝伽生物科技有限公司,货号:BL-S031),磷酸缓冲盐溶液(PBS,美国Adamas公司,货号:C8020),优泌林胰岛素注射液(美国礼来公司,生产批号:D386919A),小鼠总胆固醇(TC)、三酰甘油(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、丙氨酸转氨酶(ALT)及天冬氨酸转氨酶(AST)检测试剂盒(南京建成生物研究所,货号分别为:A111-1-1、A110-1-1、A112-1-1、A113-1-1、C009-2-1、C010-2-1),血清空腹胰岛素(FINS)酶联免疫吸附(ELISA)试剂盒(美国Crystal Chem公司,货号:90080),血清LBP ELISA试剂盒(美国Abcam公司,货号:ab269542),Q5?誖High-Fidelity DNA Polymerase(NEB公司,货号:M0491L),Quant-iT PicoGreen dsDNA Assay Kit(Invitrogen公司,货号:P7589),Agarose琼脂糖凝胶试剂(Invitrogen公司,货号:75510-019),Marker(Takara公司,货号:DL2000),TAE琼脂糖凝胶电泳缓冲液(Invitrogen公司,货号:AM9870),甲醇、乙腈、乙酸及乙酸铵均为色谱醇,其余试剂均为分析纯。
1.4 仪器血糖仪(罗氏,型号:ACCU-CHEK Performa)及试纸,Z216MK冷冻离心机(Hermle,型号:Z216MK),电子天平(Sartorius,型号:GL323i-1SCN0),超声清洗仪(Titan,型号:UC-10),恒温培养箱(Santn,型号:BOI-800),恒温摇床(Bluepard,型号:THZ-1000),全自动酶标仪(杭州奥盛,型号:AMR-100),超高效液相色谱-串联质谱系统(UPLC-MS/MS,SCIEX,型号:QTRAP 6500+),离心机(Eppendorf,型号:5424R),离心浓缩仪(LABCONCO,型号CentriVap),电子天平(RADWAG,型号:AS60/220R2),球磨仪(Retsch,型号:MM400),超声清洗仪(昆山舒美,型号:KQ5200E),多管涡旋振荡器(上海净信,型号:MIX-200),聚合酶链反应(PCR)扩增仪(ABI,型号:2720),酶标仪(BioTek,型号:FLX800T),电泳仪(北京六一,型号:DYY-6C),凝胶成像系统(北京百晶,型号:BG-gdsAUTO(130)),Nanodrop紫外定量设备(Thermo,型号:NC2000),冷冻离心机(Hermle,型号:Z216MK),高通量研磨仪(QIAGEN,型号:TissuelyserⅡ),恒温摇床(Bluepard,型号:THZ-1000)。
1.5 方法 1.5.1 动物分组、造模及给药30只SPF级雄性C57BL/6小鼠,普通饲料适应性喂养1周后,尾尖取血检测空腹血糖(FBG)。根据FBG与体质量分层随机法分为5组:正常对照组、高脂饮食组、模型组、二甲双胍组及熊胆粉组,每组6只。根据小鼠与成人的体表面积换算公式,熊胆粉组给予0.123 g/(kg·d)灌胃,二甲双胍组给予0.2 g/(kg·d)灌胃,其余各组给予同等体积生理盐水,每日1次,连续8周。正常对照组普通饲料喂养,其余各组给予高脂饲料(美国Research Diets,D12492,批号:22090102)。小鼠喂养6周后,禁食6 h,模型组、二甲双胍组、熊胆粉组腹腔注射低剂量STZ(40 mg/kg),正常对照组、高脂饮食组腹腔注射同等体积柠檬酸钠缓冲液。STZ注射后10 d,进行小鼠FBG水平等相关指标检测。
1.5.2 血糖及一般指标实验期间,每周固定时间测量1次体质量,观察并记录小鼠精神状态、活动情况、饮食、饮水及毛色等情况。每2周固定时间尾尖静脉取血测量FBG,记录数值。
1.5.3 口服葡萄糖耐量实验(OGTT)小鼠禁食、不禁水6 h,尾尖采血测量FBG水平(0 min),然后每只小鼠给予2 g/kg葡萄糖溶液灌胃,在灌胃后分别在15、30、60、90、120 min再次经尾尖采血,测定并记录血糖值,计算OGTT曲线下面积(AUC)。
1.5.4 血脂、肝功能、FINS及LBP指标检测给药结束后,各组小鼠禁食12 h,取粪便,摘眼球取血,室温静置30 min,4 ℃、3 000 r/min离心20 min,离心半径10 cm,吸取上清液,-80 ℃冰箱保存备用。按照试剂盒说明书测定血清TG、TC、HDL-C、LDL-C、ALT及AST含量。ELISA法检测FINS及LBP含量,计算胰岛素抵抗指数(HOMA-IR)。
1.5.5 肝脏组织UPLC-MS/MS分析条件液相条件如下:Waters ACQUITY UPLC HSST3 C18色谱柱(1.8 μm,100 mm×2.1 mm)。流动相A相为超纯水(含0.01%乙酸和5 mmol/L乙酸铵),B相为乙腈(含0.01%乙酸)。色谱分析流速设定为0.35 mL/min,柱温40 ℃,进样量3 μL。梯度洗脱程序设定如下:0 min时A相与B相的比例为95:5(V/V),0.5 min时调整为60:40,4.5 min时为50:50,7.5 min时为25:75,10 min时为5:95,至12 min时回到初始条件95:5。
质谱分析条件如下:采用电喷雾离子源,温度为550 ℃,质谱电压为-4 500 V。气帘气的压力设定为35 psi。定量分析采用三重四级杆质谱的多反应监测模式完成。采用Analyst 1.6.3和MultiQuant 3.0.3软件处理质谱数据。为准确测定样本中特定物质的含量,根据标准品溶液的定量信号色谱峰强度数据绘制标准曲线。将样本的积分峰面积比值代入标准曲线进行计算,得到该物质含量。
为深入解析这些数据,采用代谢组学数据处理平台(https://cloud.metware.cn/)进行主成分分析(PCA)和正交偏最小二乘法-判别分析(OPLS-DA),对数据进行更加深入的挖掘。根据OPLS-DA模型结果,确定各代谢物的重要性投影(VIP),再结合t检验结果,筛选出VIP值> 1且P < 0.05的代谢物作为差异代谢物,采用z-score标准化法对其进行处理,根据Complete-Link参数进行聚类分析,筛选共同代谢物。
1.5.6 肠道菌群16S rRNA基因扩增子测序收集各组小鼠粪便,采用OMEGA soil DNA Kit,按照说明书对小鼠粪便样本进行DNA提取,用紫外分光光度计和琼脂糖凝胶电泳分别测量所提取DNA的数量与质量。对16S rRNA基因V3~V4区进行扩增,引物序列为上游引物F(ACTCCTACGGGAGGCAGCA),下游引物R(GGACTACHVGGGTWTCTAAT)。扩增体系(25 μL):5×reaction buffer 5 μL,5×GC buffer 5 μL,dNTP(2.5 mmol/L)2 μL,Forwardprimer(10 μmol/L) 1 μL,Reverseprimer(10 μmol/L)1 μL,DNA Template 2 μL,双蒸水8.75 μL,Q5 DNA Polymerase 0.25 μL,确保所有成分均按照上述剂量混合。PCR扩增条件设定如下:98 ℃预变性2 min,98 ℃变性15 s、55 ℃退火30 s、72 ℃延伸30 s,最后,以72 ℃延伸5 min结束扩增。整个扩增过程循环25~30次(退火温度会进行调整以确定最佳温度,循环次数根据样品情况进行微调,以确保使用最少的循环次数扩增出合格的目标条带,确保PCR扩增的准确性和效率)。
Vazymedna VAHTSTM DNA Clean Beads纯化扩增产物,Quant-iT PicoGreen dsDNA Assay Kit定量。使用Illlumina NovaSeq 6000 SP Reagent Kit进行双端2×250 bp测序。利用demux插件解码处理原始序列数据,利用cutadapt插件切除引物序列。随后,通过DADA2插件对处理后的序列进行质量过滤、降噪、序列拼接及嵌合体剔除。在100%相似度阈值基础上,进行操作分类单元的聚类分析。最后,应用QIIME2软件进行微生物组生物学信息分析。
序列数据分析主要使用QIIME2和R软件包(v3.2.0)进行。使用QIIME2中的ASV表和R软件“ggplot2”包进行Alpha多样性分析。主坐标分析(PCoA)、非量度多维尺度分析(NMDS)和层次聚类分析使用R软件“ape”包、“vegan”包和“ggtree”包等进行。线性判别分析效应量(LEfSe)分析运用线性判别分析(LDA)方法,对各个差异组分的丰度进行效应量评估,以揭示其对组间差异的贡献程度。利用qiime2进行随机森林分析及巢式分层交叉验证。
1.6 统计学方法采用GraphPad Prism 9.0、IBM SPSS Statistics 25.0对所有数据进行处理。若满足正态分布和方差齐性,选用单因素方差分析进行统计,数据以均数±标准差(x±s)表示;若不满足,选用Mann-Whitney U检验。采用斯皮尔曼相关性分析方法研究糖代谢相关指标、差异胆汁酸及比值、属水平丰度排名前20位的肠道菌群之间的相关性。以P < 0.05表示差异具有统计学意义。
2 结果 2.1 熊胆粉对T2D小鼠糖代谢水平的影响与正常对照组比较,高脂饮食组和模型组小鼠的FBG、OGTT AUC、FINS及HOMA-IR升高(P < 0.05)。同时,模型组小鼠FBG≥11.1 mmol/L,说明模型建立成功[16]。与模型组比较,二甲双胍组和熊胆粉组小鼠的FBG、OGTT AUC、FINS及HOMA-IR降低(P < 0.05)。见图 1。
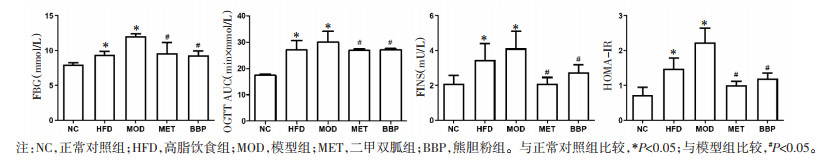
|
| 图 1 熊胆粉对T2D小鼠糖代谢水平的影响(x±s,n=6) |
与正常对照组比较,高脂饮食组和模型组小鼠TC、HDL-C、LDL-C升高(P < 0.05);与模型组比较,熊胆粉组TC、HDL-C及LDL-C降低(P < 0.05)。与模型组比较,正常对照组和各给药组小鼠ALT及AST差异无统计学意义(P>0.05)。提示熊胆粉可以降低血脂水平,且对小鼠肝功能无明显影响。见图 2。
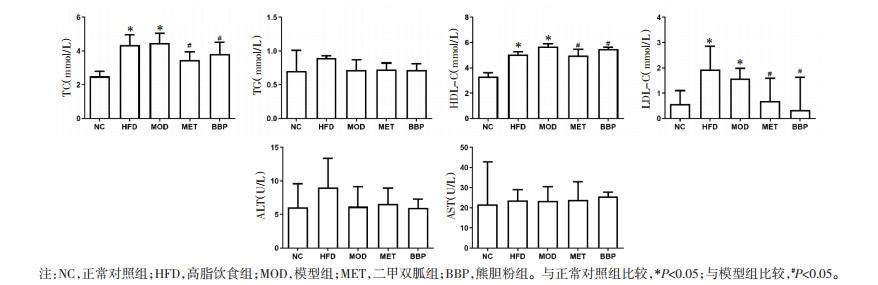
|
| 图 2 熊胆粉对T2D小鼠脂质代谢水平及肝功能酶的影响(x±s,n=6) |
PCA和OPLS-DA结果显示,正常对照组与模型组、熊胆粉组与模型组的组内样本聚集度良好,组间区分明显。见图 3。
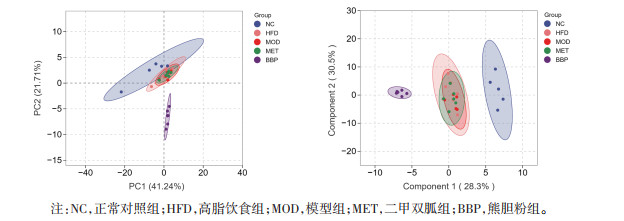
|
| 图 3 熊胆粉对T2D小鼠肝脏胆汁酸含量的影响 |
根据P < 0.05筛选正常对照组与模型组、模型组与熊胆粉组之间的差异胆汁酸,共有4种。其中,与正常对照组比较,脱氢石胆酸(DLCA)、牛磺石胆酸-3-硫酸盐(TLCA-3S)、猪胆酸(HCA)和23-脱甲脱氧胆酸(23-DCA)含量在模型组中降低,但在熊胆粉组中升高(P < 0.05)。另外,还发现模型组未结合次级胆汁酸与总胆汁酸比值(Unconjugated SBAs/Total BAs)较正常对照组升高,而在熊胆粉组中降低(P < 0.05)。见表 1。
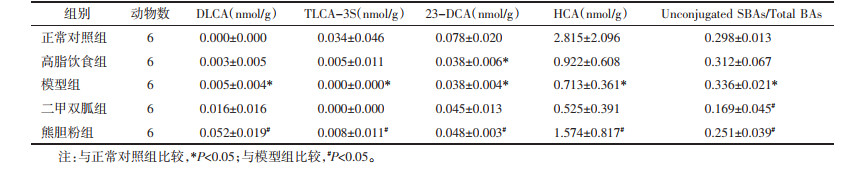
与正常对照组比较,模型组小鼠肠道菌群丰富度指数Chao1、Observed species数值及多样性指数Faith pd数值升高(P < 0.05);与模型组比较,熊胆粉组小鼠肠道菌群丰富度指数Chao1、Observed species数值及多样性指数Faith pd数值降低(P < 0.05)。见表 2。
门水平上,各组小鼠菌群主要由厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、疣微菌门(Verrucomicrobia)、放线菌门(Actinobacteria)及变形菌门(Proteobacteria)等组成。模型组的变形菌门相对丰度较正常对照组增加;与模型组比较,熊胆粉组的拟杆菌门和变形菌门丰度降低(P < 0.05)。属水平上,小鼠肠道优势菌群主要为拟杆菌属(Bacteroides)、狄氏副拟杆菌(Parabacteroides)、乳杆菌属(Lactobacillus)、嗜黏蛋白阿克曼菌属(Akkermansia)等。熊胆粉可以提高模型组降低的乳球菌属(Lactococcus)、嗜黏蛋白阿克曼菌属和乳杆菌属的相对丰度,但差异无统计学意义(P>0.05)。另外,与正常对照组比较,模型组拟杆菌属、安德克氏菌属(Adlercreutzia)、毛螺菌科_梭状芽孢杆菌属(Lachnospiraceae_Clostridium)、梭状芽孢杆菌属(Clostridium)的相对丰度升高,而熊胆粉组逆转了这一趋势,但未见统计学差异(P>0.05)。见图 4。
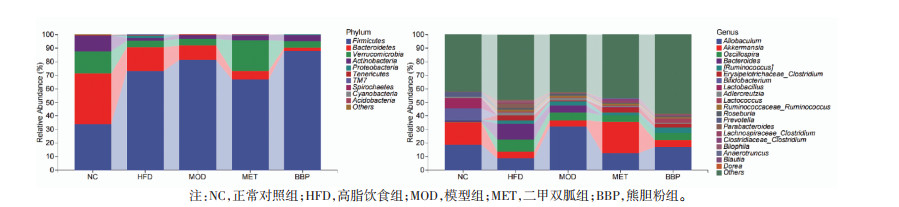
|
| 图 4 熊胆粉对T2D小鼠肠道菌群结构的影响 |
LEfSe是一种将非参数Krusal-Wallis及Wilcoxon秩和检验,与LDA效应量相结合的分析方法。它不仅可以对所有分类水平同时进行差异分析,还能寻找分组之间稳健的差异物种。LEfSe分析结果见图 5,物种的LDA值为横坐标,LDA值> 3的物种为具有统计学差异的物种。正常对照组中对群落结构影响较大的物种有拟杆菌目(Bacteroidales)、拟杆菌门(Bacteroidetes)、拟杆菌纲(Bacteroidia)及S24_7等。模型组中对群落结构影响较大的物种是颤螺旋菌属(Oscillospira)、拟杆菌属、拟杆菌科(Bacteroidaceae)、瘤胃球菌属(Ruminococcus)及罗斯氏菌属(Roseburia)等。熊胆粉组中对群落结构影响较大的物种有厚壁菌门、梭状芽胞杆菌(Clostridia)、毛螺菌科(Lachnospiraceae)、胃链球菌科(Peptostreptococcaceae)、梭菌科(Clostridiaceae)、链球菌科(Streptococcaceae)、乳球菌属等。
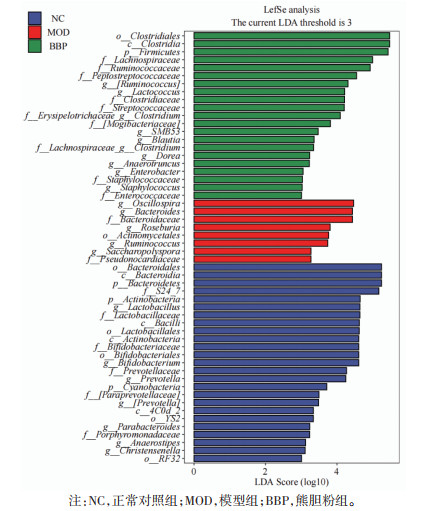
|
| 图 5 熊胆粉对T2D小鼠肠道菌群的影响 |
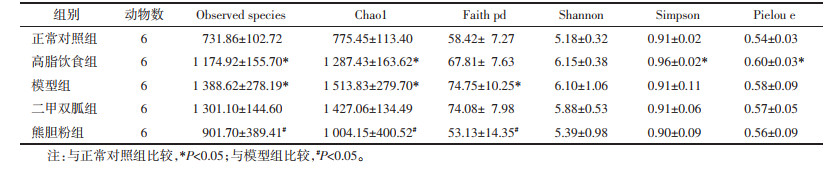
模型组小鼠血清LBP水平较正常对照组升高,熊胆粉组、二甲双胍组小鼠血清LBP水平较模型组降低(P < 0.05)。见表 3。
将4种糖代谢相关指标(FBG、OGTT AUC、FINS、HOMA-IR)、4种筛选出的差异胆汁酸及1种差异胆汁酸比值、属水平丰度排名前20位的肠道菌群进行斯皮尔曼相关性分析。结果表明,T2D小鼠的胆汁酸和肠道菌群之间存在动态相互作用,且均与糖代谢指标相关。FBG与普雷沃氏菌属(Prevotalla)、狄氏副拟杆菌呈负相关(P < 0.05)。同时,23-脱甲脱氧胆酸和乳杆菌属呈正相关(P < 0.05),乳杆菌属与OGTT AUC、FINS、HOMA-IR呈负相关(P < 0.05)。HOMA-IR与嗜黏蛋白阿克曼菌属负相关(P < 0.05)。另外,OGTT AUC还与颤螺旋菌属(Oscillospira)、罗斯氏菌属(Roseburia)呈正相关(P < 0.05),而这2种菌属均与差异胆汁酸23-DCA呈负相关(P < 0.05)。当DLCA含量升高时,肠道内狄氏副拟杆菌属、普氏菌属、嗜胆菌属(Bilophila)相对丰度降低(P < 0.05)。同时研究表明HCA及TLCA-3S均与毛螺菌科_梭状芽孢杆菌属呈负相关(P < 0.05)。Unconjugated SBAs/Total BAs还与拟杆菌属呈正相关(P < 0.05),与丹毒丝菌科_梭状芽孢杆菌属(Erysipelotrichaceae_ Clostridium)呈负相关(P < 0.05)。见图 6。
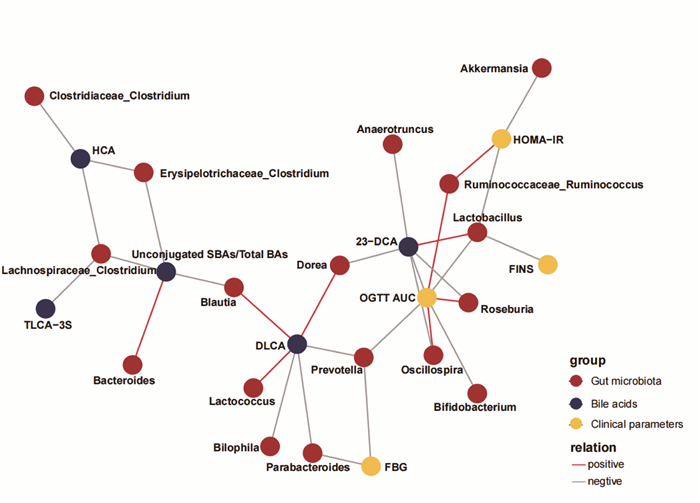
|
| 图 6 糖代谢指标、差异胆汁酸、肠道菌群之间斯皮尔曼相关性分析网络图 |
本研究利用UPLC-MS/MS技术与16S rRNA基因扩增子测序法从胆汁酸-肠道菌群轴层面阐释熊胆粉对T2D小鼠发挥疗效的作用机制变化,通过筛选差异胆汁酸和菌属,分析糖代谢相关指标、胆汁酸及肠道菌群之间的相关性,以此来解释熊胆粉影响血糖水平的作用机制。经过8周的预防性给药,发现熊胆粉可以显著改善T2D小鼠的糖脂代谢水平,提高肝脏中部分胆汁酸的含量,包括DLCA、23-DCA、HCA和TLCA-3S。此外,熊胆粉还可以降低小鼠肠道菌群丰富度指数、多样性指数和LBP含量,并增加乳球菌属、嗜黏蛋白阿克曼菌属和乳杆菌属的相对丰度。斯皮尔曼相关性分析发现,23-DCA和乳杆菌属之间存在正相关,且乳杆菌属与OGTT AUC、FINS和HOMA-IR呈负相关。另外,OGTT AUC还与颤螺旋菌属、罗斯氏菌属呈正相关,而这些菌属与差异胆汁酸23-DCA呈负相关。因此,小鼠喂食熊胆粉后的糖脂代谢水平、胆汁酸、肠道菌群的变化及其之间的共代谢关系值得进一步深入研究。
本研究通过分析FBG、FINS、OGTT AUC等糖代谢相关指标来判定T2D小鼠模型是否建立成功及熊胆粉的预防性降糖疗效。大剂量的STZ被广泛应用于诱导小鼠发生1型糖尿病,而小剂量STZ可以引起胰岛素分泌的轻度损伤,这与人类T2D晚期阶段特征相似。鉴于上述特征,实施高脂饮食饲养能够诱发高胰岛素血症及胰岛素抵抗,进而结合腹腔注射小剂量STZ,可以引起胰岛β细胞受损及血糖升高,从而构建出一个与人类T2D病程高度相仿的啮齿类糖尿病模型[16]。经8周的高脂饮食联合小剂量腹腔注射STZ后的模型组小鼠表现出了T2D的典型特征,FBG、FINS、HOMA-IR、OGTT AUC与空白对照组比较差异显著。同时,熊胆粉与二甲双胍均能够降低模型小鼠的FBG、FINS、HOMA-IR和OGTT AUC。二甲双胍是治疗T2D的一线药物[17],相关研究表明,二甲双胍可能通过抑制肝脏葡萄糖生成[18]、提高胰岛素敏感性[19]和调节肠道菌群[20]等途径改善糖代谢。熊胆粉组小鼠的糖代谢相关指标上述结果表明,熊胆粉能够有效预防性改善T2D小鼠的FBG和糖耐量水平,并可以降低T2D小鼠的FINS、HOMA-IR水平,改善糖代谢这也与现有的熊胆粉治疗T2D的动物实验结果相符,但其具体的作用机制仍然需要进一步研究。。
实验研究还发现熊胆粉可以在不影响肝功能酶的情况下降低模型组升高的TC、HDL-C和LDL-C,差异有统计学意义。值得注意的是,在本实验中,可以抗动脉粥样硬化的脂蛋白HDL-C在高脂饮食组和模型组中的水平却是显著上升的。同样的研究结果出现在王一成等[21]不同配方益生菌对高脂饮食诱导的肥胖小鼠的差异作用研究中,且该研究与本研究使用了同样的D12492饲料。在标准配比为773.85 g的D12492配方中,脂肪的主要提供者为25 g的大豆油和245 g的猪油。大豆油富含多不饱和脂肪酸[22],有些猪油含有较高比例的单不饱和脂肪酸与多不饱和脂肪酸[23]。研究表明,与饱和脂肪酸相比,单不饱和脂肪酸与多不饱和脂肪酸会提高脂蛋白脂肪酶的活性,升高血液中的HDL-C水平[24-25],所以在本研究中高脂饮食组、模型组会出现HDL-C升高的现象,而服用熊胆粉后出现与正常对照组相近的HDL-C水平也说明了熊胆粉良好的降脂效果。
胆汁酸是胆汁的重要组成部分,在营养物质的消化和吸收中起着至关重要的作用[13]。此外,胆汁酸还可以作为信号分子调节糖脂代谢水平[12]。本研究发现熊胆粉可以显著升高模型组降低的DLCA、TLCA-3S和HCA水平。其中,DLCA和TLCA-3S均为石胆酸类胆汁酸。临床研究表明T2D患者石胆酸的水平明显低于健康人群[26]。石胆酸还可以通过促进肝脏中胆汁酸-7-硫酸盐(CA-7S)的合成来促进代谢,进而导致肠道内分泌细胞分泌GLP-1,以维持葡萄糖稳态[27-28]。HCA已经在研究中被证实可以通过作用于肠道内分泌L细胞,激活TGR5受体并抑制FXR受体,上调胰高血糖素原基因表达,促进GLP-1的生成与分泌,从而有效调控血糖稳态[29]。胆汁酸通路是治疗T2D的关键靶向通路之一,熊胆粉可能通过增加差异胆汁酸种类的方式调节糖代谢紊乱,从而改善T2D。
肠道菌群对宿主健康具有至关重要的调节作用,并与糖尿病等多种慢性疾病密切关联[30]。然而,关于肠道菌群对糖尿病患者的具体作用机制和特定靶向益生菌的价值,目前尚未形成明确共识。因此,对肠道菌群及其代谢物如何影响糖代谢机制进行深入研究,可能会为糖尿病的治疗提供新的方向与策略。本研究发现了熊胆粉干预后下调的小鼠肠道菌群丰富度及多样性指数和富集的乳球菌属、嗜黏蛋白阿克曼菌属、乳杆菌属。相关研究表明,乳球菌属可以预防糖尿病模型小鼠的高血糖并减少胰岛破坏[31]。相关性分析发现,嗜黏蛋白阿克曼菌属和乳杆菌属均与FINS、HOMA-IR呈负相关。嗜黏蛋白阿克曼菌属作为下一代预防饮食导致的肥胖、T2D和炎症的有益微生物,在T2D患者中的丰度较低,且已经被证实有降糖、降脂效果[32-33]。乳杆菌属则可以通过下调糖原合酶激酶3β、上调蛋白激酶B等与葡萄糖代谢相关的基因表达,增加产短链脂肪酸细菌和短链脂肪酸的水平以及降低革兰氏阴性菌的相对丰度等途径治疗糖尿病[34]。这与本实验的研究结果一致。上述发现表明,熊胆粉可能通过调节益生菌的丰度重塑肠道菌群结构,改善葡萄糖稳态。
肠道菌群结构改变和肠道屏障功能受损导致LPS易位入血,进而诱导释放炎症因子,对T2D的发生、发展具有重要影响[15, 35]。LPS需要与配体LBP结合才能激活固有免疫反应,引发炎症[36]。相关研究表明,LBP是胰岛素抵抗的独立危险因素,可以用于评估胰岛素抵抗水平[14]。在本研究中,熊胆粉可以显著降低模型组升高的LBP含量,进一步证明了熊胆粉降低胰岛素抵抗的能力。此外,相关研究表明,普氏菌属在LBP基因敲除小鼠中的相对丰度显著升高[15, 35]。而本研究发现普氏菌属与FBG、OGTT AUC和DLCA呈负相关。普氏菌是一种不产芽孢、严格厌氧的革兰氏阴性菌,与肠道黏蛋白合成关系密切,可以影响肠道的屏障功能。
胆汁酸-肠道菌群轴是维持机体稳态的重要因素之一,其紊乱会导致机体稳态失衡,引发多种疾病[37]。本研究将糖代谢相关指标、差异性胆汁酸、属水平丰度排名前20位的肠道菌群进行斯皮尔曼相关性分析,发现后两者在T2D中具有密切的互作关系,影响T2D进程。本研究发现乳杆菌属不仅与23-DCA呈正相关,而且乳杆菌属与糖代谢相关指标OGTT AUC、FINS、HOMA-IR呈负相关。如前文所述,熊胆粉富集的乳杆菌属与23-DCA相互促进,可以预防T2D小鼠血糖升高并减少胰岛破坏,与T2D密切相关[34]。另外,OGTT AUC还与颤螺旋菌属呈正相关,与差异胆汁酸23-DCA呈负相关。动物实验研究发现,颤螺旋菌属促进T2D进展与肥胖及T2D小鼠的肝脏脂肪变性、低度炎症、脂肪量减少相关[38]。当HCA及TLCA-3S含量升高时,毛螺菌科_梭状芽孢杆菌属相对丰度会降低。在利拉鲁肽治疗糖尿病小鼠的实验研究中,研究者发现其同样可以降低毛螺菌科及其菌属的丰度,改善胰岛素抵抗[39]。上述结果表明,胆汁酸-肠道菌群轴是防治T2D的重要途径之一。熊胆粉可以通过调节差异胆汁酸和富集的肠道菌群及其两者之间的相互作用,对糖代谢紊乱进行调节,这可能为防治T2D提供新的治疗策略。
4 结论本实验通过检测小鼠糖脂代谢水平、肝功能、肝组织的胆汁酸含量、粪便16S rRNA基因扩增子测序和血清LBP含量,发现T2D模型小鼠糖代谢受损,熊胆粉可以改善T2D小鼠的糖代谢水平,调节胆汁酸含量,重塑肠道菌群并降低LBP含量,进而发挥对T2D的防治作用,其机制可能与胆汁酸-肠道菌群轴有关。本研究为熊胆粉防治T2D提供了实验依据。在后期研究中,需要通过增加动物数量、考虑性别因素等方法完善实验设计,并进一步探索其降糖的分子作用机制,为开发熊胆粉的药用价值打下坚实基础。
| [1] |
Diagnosis and classification of diabetes mellitus[J]. Diabetes Care, 2014, 37(Suppl 1): S81-S90.
|
| [2] |
中华医学会糖尿病学分会. 中国2型糖尿病防治指南(2020年版)(上)[J]. 中国实用内科杂志, 2021, 41(8): 668-695. |
| [3] |
国家药典委员会. 中华人民共和国药典[M]. 北京: 中国医药科技出版社, 2020: 1902.
|
| [4] |
ZHANG Y, CHENG Y, LIU J, et al. Tauroursodeoxycholic acid functions as a critical effector mediating insulin sensitization of metformin in obese mice[J]. Redox Biology, 2022, 57(10): 1024-1031. |
| [5] |
CHUNG J, AN S H, KANG S W, et al. Ursodeoxycholic acid(UDCA) exerts anti-atherogenic effects by inhibiting RAGE signaling in diabetic atherosclerosis[J]. PLoS One, 2016, 11(1): 478-489. |
| [6] |
王喜军, 闫广利, 张爱华, 等. 基于代谢组学和蛋白组学技术的熊胆蛋白大分子物质对丙型肝炎治疗作用的研究[J]. 中国天然药物, 2013, 11(6): 653-665. |
| [7] |
周长升, 尹震宇, 赵文秀, 等. 熊胆对肝星状细胞免疫学特性影响的研究[J]. 中华中医药杂志, 2011, 26(10): 2251-2254. |
| [8] |
迟新建, 王静, 李晓楠, 等. 熊胆粉滴眼液联合他克莫司治疗卡他性结膜炎临床研究[J]. 新中医, 2022, 54(20): 127-130. |
| [9] |
RUAN W H, HUANG M L, HE X L, et al. Effects of Huangqi and bear bile on recurrent parotitis in children: a new clinical approach[J]. Journal of Zhejiang University Science B, 2013, 14(3): 253-258. DOI:10.1631/jzus.B1200072 |
| [10] |
CHEN X L, CAI K, ZHANG W, et al. Bear bile powder ameliorates type 2 diabetes via modulation of metabolic profiles, gut microbiota, and metabolites[J]. Frontiers in Pharmacology, 2023, 13(6): 1090-1099. |
| [11] |
TURNBAUGH P J, LEY R E, HAMADY M, et al. The human microbiome project[J]. Nature, 2007, 449(7164): 804-810. DOI:10.1038/nature06244 |
| [12] |
JIA W, WEI M L, RAJANI C, et al. Targeting the alternative bile acid synthetic pathway for metabolic diseases[J]. Protein & Cell, 2021, 12(5): 411-425. |
| [13] |
COLLINS S L, STINE J G, BISANZ J E, et al. Bile acids and the gut microbiota: metabolic interactions and impacts on disease[J]. Nature Reviews Microbiology, 2023, 21(4): 236-247. DOI:10.1038/s41579-022-00805-x |
| [14] |
周艳君. 新诊断2型糖尿病患者血清脂多糖结合蛋白(lbp)水平与胰岛素抵抗的相关性研究[D]. 沈阳: 中国医科大学, 2021.
|
| [15] |
张振宇, 米传靓, 李思迪, 等. 基于16S rRNA测序分析脂多糖结合蛋白基因敲除对小鼠肠道菌群的影响[J]. 中国医药生物技术, 2023, 18(2): 110-115. DOI:10.3969/j.issn.1673-713X.2023.02.003 |
| [16] |
KLEINERT M, CLEMMENSEN C, HOFMANN S M, et al. Animal models of obesity and diabetes mellitus[J]. Nature Reviews Endocrinology, 2018, 14(3): 140-162. DOI:10.1038/nrendo.2017.161 |
| [17] |
American Diabetes Association. Pharmacologic approaches to glycemic treatment: standards of medical care in diabetes-2020[J]. Diabetes Care, 2020, 43(Suppl 1): S98-S110. |
| [18] |
HUNDAL R S, KRSSAK M, DUFOUR S, et al. Mechanism by which metformin reduces glucose production in type 2 diabetes[J]. Diabetes, 2000, 49(12): 2063-2069. DOI:10.2337/diabetes.49.12.2063 |
| [19] |
CREE-GREEN M, BERGMAN B C, CENGIZ E, et al. Metformin improves peripheral insulin sensitivity in youth with type 1 diabetes[J]. Journal of Clinical Endocrinology & Metabolism, 2019, 104(8): 3265-3278. |
| [20] |
FORSLUND K, HILDEBRAND F, NIELSEN T, et al. Disentangling type 2 diabetes and metformin treatment signatures in the human gut microbiota[J]. Nature, 2015, 528(7581): 262-266. DOI:10.1038/nature15766 |
| [21] |
王一成, 李燕, 张晶, 等. 不同配方益生菌在高脂饮食诱导小鼠肥胖发生中的差异化作用[J]. 微生物学报, 2018, 58(7): 1287-1297. |
| [22] |
倪江枫, 姜碧若, 杨静媚, 等. 未成熟与成熟大豆油的成分及低温结晶特性分析[J]. 中国油脂, 2023, 48(6): 32-38, 66. |
| [23] |
周炎冰. 猪不同部位脂肪组织中脂质组成差异及关键差异脂质调控动物糖脂代谢的机制研究[D]. 杭州: 浙江大学, 2023.
|
| [24] |
LIMA ROCHA J É, MENDES FURTADO M, MELLO NETO R S, et al. Effects of fish oil supplementation on oxidative stress biomarkers and liver damage in hypercholesterolemic rats[J]. Nutrients, 2022, 14(3): 426-438. DOI:10.3390/nu14030426 |
| [25] |
HE X X, WU X L, CHEN R P, et al. Effectiveness of omega-3 polyunsaturated fatty acids in non-alcoholic fatty liver disease: a meta-analysis of randomized controlled trials[J]. PLoS One, 2016, 11(10): 1623-1628. |
| [26] |
LU J L, WANG S Y, LI M, et al. Association of serum bile acids profile and pathway dysregulation with the risk of developing diabetes among normoglycemic Chinese adults: findings from the 4C study[J]. Diabetes Care, 2021, 44(2): 499-510. DOI:10.2337/dc20-0884 |
| [27] |
CHAUDHARI S N, LUO J N, HARRIS D A, et al. A microbial metabolite remodels the gut-liver axis following bariatric surgery[J]. Cell Host & Microbe, 2021, 29(3): 408-424. |
| [28] |
CHAUDHARI S N, HARRIS D A, ALIAKBARIAN H, et al. Bariatric surgery reveals a gut-restricted TGR5 agonist with anti-diabetic effects[J]. Nature Chemical Biology, 2021, 17(1): 20-29. DOI:10.1038/s41589-020-0604-z |
| [29] |
ZHENG X J, CHEN T L, JIANG R Q, et al. Hyocholic acid species improve glucose homeostasis through a distinct TGR5 and FXR signaling mechanism[J]. Cell Metabolism, 2021, 33(4): 791-803. DOI:10.1016/j.cmet.2020.11.017 |
| [30] |
JIA W P, PANAGIOTOU G. Recent advances in diabetes and microbiota[J]. Science Bulletin, 2022, 67(17): 1720-1723. DOI:10.1016/j.scib.2022.07.027 |
| [31] |
PREISSER T M, DA CUNHA V P, SANTANA M P, et al. Recombinant Lactococcus lactis carrying IL-4 and IL-10 coding vectors protects against type 1 diabetes in NOD mice and attenuates insulitis in the STZ-induced model[J]. Journal of Diabetes Research, 2021, 192(8): 669-679. |
| [32] |
YASSOUR M, LIM M Y, YUN H S, et al. Sub-clinical detection of gut microbial biomarkers of obesity and type 2 diabetes[J]. Genome Medicine, 2016, 8(1): 17. DOI:10.1186/s13073-016-0271-6 |
| [33] |
CANI P D, DEPOMMIER C, DERRIEN M, et al. Akkermansia muciniphila: paradigm for next-generation beneficial microorganisms[J]. Nature Reviews Gastroenterology & Hepatology, 2022, 19(10): 625-637. |
| [34] |
YAN F F, LI N, SHI J L, et al. Lactobacillus acidophilus alleviates type 2 diabetes by regulating hepatic glucose, lipid metabolism and gut microbiota in mice[J]. Food & Function, 2019, 10(9): 5804-5815. |
| [35] |
CHI M X, MA K, WANG J, et al. The immunomodulatory effect of the gut microbiota in kidney disease[J]. Journal of Immunology Research, 2021, 18(16): 551-563. |
| [36] |
TOBIAS P S, SOLDAU K, ULEVITCH R J. Identification of a lipid A binding site in the acute phase reactant lipopolysaccharide binding protein[J]. Journal of Biological Chemistry, 1989, 264(18): 10867-10871. DOI:10.1016/S0021-9258(18)81700-8 |
| [37] |
陈冰婷, 杨建, 谭惠文, 等. 胆汁酸-肠道菌群轴在2型糖尿病中的作用[J]. 中国现代应用药学, 2023, 40(9): 1235-1239. |
| [38] |
EVERARD A, MATAMOROS S, GEURTS L, et al. Saccharomyces boulardii administration changes gut microbiota and reduces hepatic steatosis, low-grade inflammation, and fat mass in obese and type 2 diabetic db/db mice[J]. mBio, 2014, 5(3): e01011-e01014. |
| [39] |
LIU Q, CAI B Y, ZHU L X, et al. Liraglutide modulates gut microbiome and attenuates nonalcoholic fatty liver in db/db mice[J]. Life Sciences, 2020, 261(13): 1184-1197. |
 2024, Vol. 43
2024, Vol. 43