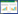文章信息
- 周芳芳, 刘宇, 马双玲, 李晓倩, 张新宁, 李辞妹, 毕晶晶, 李国芸
- ZHOU Fangfang, LIU Yu, MA Shuangling, LI Xiaoqian, ZHANG Xinning, LI Cimei, BI Jingjing, LI Guoyun
- 基于Nrf2/HO-1通路探究虎杖苷对妊娠期糖尿病大鼠的治疗效果及作用机制
- Exploring the therapeutic effects and action mechanism of polydatin on gestational diabetes mellitus rats based on Nrf2/HO-1 pathway
- 天津中医药大学学报, 2024, 43(7): 610-616
- Journal of Tianjin University of Traditional Chinese Medicine, 2024, 43(7): 610-616
- http://dx.doi.org/10.11656/j.issn.1673-9043.2024.07.07
-
文章历史
收稿日期: 2024-04-03
妊娠糖尿病(GDM)是在妊娠期间出现的自发性慢性高血糖症,是一种由多种因素诱发的疾病。遗传因素是该疾病的主要决定因素,同时也是妊娠并发症的一种。随着GDM发病率的逐年增加,GDM已经成为主要公共卫生问题之一[1-2]。常规的药物疗法常常伴随孕产妇低血糖和巨大胎儿等不良结局,因此,继续研究治疗GDM的药物具有重要意义[3]。虎杖苷(PD)又称白藜芦醇苷,具有多种生理活性,如抗肿瘤、抗炎、抗氧化、抗糖尿病以及对心脏、胃、肝脏、神经等保护作用[4]。近年来,PD因为具有良好的抗糖尿病作用而备受关注。研究发现,PD可以降低糖尿病大鼠脂质过氧化,通过抗氧化活性减轻胰腺β细胞损伤,抑制胰腺炎症。PD可以通过调节丝苏氨酸蛋白激酶B(Akt)、连接蛋白32(Cx32)-NADPH氧化酶4(Nox4)通路,改善实验性糖尿病的糖脂代谢和肾脏纤维化。PD有可能成为治疗糖尿病患者的潜在药物[5-7]。核转录因子E2相关因子2(Nrf2)/血红素加氧酶-1(HO-1)通路在抗氧化、抗炎调节途径中发挥重要作用[8]。Nrf2、HO-1在GDM动物模型胎盘组织中表达下降,能够激活Nrf2/HO-1信号通路,对GDM产生治疗作用[9-10]。研究表明,石斛合剂通过上调Nrf2/HO-1信号通路,抑制氧化应激,降低炎症因子与血糖、血脂水平,从而起到改善GDM的效果[11]。PD可以通过激活Nrf2/HO-1信号通路减轻氧化应激反应,保护大鼠免受脑出血和脊髓损伤[12-13]。但PD能否通过调控Nrf2/HO-1信号通路进而缓解GDM大鼠症状尚不清楚。因此,本研究通过复制GDM大鼠模型,从体内探讨PD对GDM大鼠的影响及作用机制。
1 材料 1.1 动物SPF级SD大鼠,由武汉云克隆动物有限公司提供,动物许可证编号:SCXK(鄂)2023-0021。其中雄性(280±20) g,雌性(200±20) g。适应性喂养1周,昼夜循环为12 h,室温22 ℃,相对湿度50%。不禁水、食。本研究经新乡市中心医院动物伦理委员会审批通过(审批号:ZZU-LAC20220616)。
1.2 主要试剂与设备PD(货号:P816149,深圳市康初源有限公司),链脲佐菌素(货号:SS26505,上海三抒生物科技有限公司),蛋白提取试剂盒(货号:D16790,北京沃凯生物科技有限公司),ML385(货号:EY-20157,上海一研生物科技有限公司),苏木精-伊红(HE)染色液[货号:HS1001,福来德生物科技(武汉)有限公司],空腹胰岛素(FINS)试剂盒(货号:FY-A014648,上海富雨生物科技有限公司),大鼠白细胞介素(IL)-6、IL-1β、肿瘤坏死因子(TNF)-α酶联免疫吸附(ELISA)试剂盒(货号:XGH4741、XG-E99293、XG-E99826,上海西格生物科技有限公司),兔抗Nrf2、HO-1、GAPDH一抗抗体(货号:ab62352、ab68477、ab9485,美国Abcam公司)。卓越快速血糖仪(型号:ACCU-CHEK Performa,美国罗氏公司),全自动生化分析仪(型号:BS-240,武汉盛世达医疗设备有限公司),冷冻高速离心机(型号:H1-16K,湖南可成仪器设备有限公司),光学显微镜(型号:DM500,德国Lecia公司)。
2 方法 2.1 动物建模、分组和给药80只雌性大鼠在妊娠前高脂、高糖喂食8周,将雌鼠与雄鼠按照2:1的比例合笼,每日观察雌鼠阴道栓,将发现精子的日期记作妊娠1 d,妊娠5 d时一次性腹腔注射35 mg/kg的链脲佐菌素,注射后2、3 d尾静脉取血测量大鼠空腹血糖(FBG)均≥13.5 mmol/L,即视为GDM造模成功[14]。将造模成功的72只大鼠随机分为6组(12只/组):模型组、PD低、中、高剂量组、阳性对照组、抑制剂组(给予Nrf2/HO-1通路抑制剂ML385)。PD低、中、高剂量组大鼠根据参考文献[6]和预实验结果分别灌胃给予30、75、150 mg/kg的PD,阳性对照组大鼠灌胃给予200 mg/kg的盐酸二甲双胍[14],抑制剂组大鼠灌胃给予150 mg/kg的PD与30 mg/kg的ML385[15],同时取12只同批妊娠5 d大鼠作为空白组,空白组大鼠灌胃给予等量生理盐水,每日1次,连续2周。
2.2 各组大鼠体质量及FBG测量药物处理结束后,称取各组大鼠体质量,剪尾取血,采用罗氏血糖仪测定大鼠FBG。
2.3 ELISA法检测大鼠FINS、IL-6、IL-1β、TNF-α水平药物处理结束后,每组随机选取6只大鼠,腹腔注射3%戊巴比妥钠以麻醉大鼠,随后腹主动脉取血,室温离心(3 000 r/min,离心半径15 cm)10 min后,得到血清并置于-20 ℃保存备用。按照FINS、IL-6、IL-1β及TNF-α ELISA试剂盒说明书检测大鼠的FINS、IL-6、IL-1β、TNF-α,计算胰岛素抵抗指数(HOMA-IR)、胰岛β细胞功能指数(HOMA-β)、胰岛素敏感指数(ISI)。HOMA-IR=(FBG×FINS)÷22.5;HOMA-β=20×FINS÷(FBG-3.5);ISI=1÷(FBG×FINS)。ISI为非正态分布,故分析时取其自然对数。
2.4 大鼠血清中生化指标的检测采用全自动生化分析仪检测各组大鼠血清总胆固醇(TC)、三酰甘油(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、游离脂肪酸(FFA)含量。
2.5 HE染色每组剩余6只大鼠,腹腔注射3%戊巴比妥钠以麻醉大鼠,分离大鼠胰腺组织。胰腺组织经4%多聚甲醛固定,石蜡包埋后切片(3 μm)。切片经二甲苯、乙醇脱蜡和水化,随后进行HE染色,最后在光学显微镜下观察染色结果并计算胰岛个数。
2.6 蛋白免疫印迹(Western Blot)法检测大鼠胰腺组织中Nrf2/HO-1通路蛋白提取各组大鼠胰腺组织总蛋白,二喹啉甲酸(BCA)法测定蛋白浓度。通过电泳在10%的SDS-聚丙烯酰胺凝胶上分离30 μg的蛋白样品,并转移至PVDF膜中。封闭后在4 ℃条件下分别以1:1 000的比例与Nrf2、HO-1、GAPDH一抗孵育过夜,加入二抗(1:2 000),37 ℃孵育1 h。通过Image J 6.0软件对条带进行分析。
2.7 统计学分析实验数据采用GraphPad Prism 9.0软件进行分析。符合正态分布的计量资料以均数±标准差(x±s)表示,多组间比较采用单因素方差分析,SNK-q检验用于两组间进一步比较。P < 0.05为差异具有统计学意义。
3 结果 3.1 PD对大鼠体质量和FBG的影响与空白组比较,模型组大鼠体质量、FBG升高(P < 0.05);与模型组比较,PD低、中、高剂量组体质量、FBG降低(P < 0.05);阳性对照组与PD高剂量组大鼠体质量、FBG比较,差异无统计学意义(P>0.05);与PD高剂量组比较,抑制剂组大鼠体质量、FBG升高(P < 0.05)。见表 1。
与空白组比较,模型组大鼠FINS、HOMA-IR升高,ISI、HOMA-β降低(P < 0.05);与模型组比较,PD低、中、高剂量组大鼠FINS、HOMA-IR降低,ISI、HOMA-β升高(P < 0.05);阳性对照组与PD高剂量组大鼠FINS、HOMA-IR、ISI、HOMA-β比较,差异无统计学意义(P>0.05);与PD高剂量组比较,抑制剂组大鼠FINS、HOMA-IR升高,ISI、HOMA-β降低(P < 0.05)。见表 2。
与空白组比较,模型组大鼠血清中IL-6、IL-1β、TNF-α水平升高(P < 0.05);与模型组比较,PD低、中、高剂量组大鼠血清中IL-6、IL-1β、TNF-α水平降低(P < 0.05);阳性对照组与PD高剂量组大鼠血清中IL-6、IL-1β、TNF-α水平比较,差异无统计学意义(P>0.05);与PD高剂量组比较,抑制剂组大鼠血清中IL-6、IL-1β、TNF-α水平升高(P < 0.05)。见表 3。
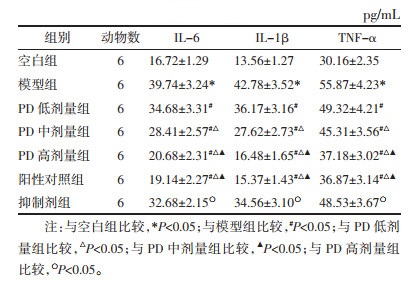
与空白组比较,模型组大鼠血清中TC、TG、LDL-C、FFA含量升高,HDL-C含量降低(P < 0.05);与模型组比较,PD低、中、高剂量组大鼠血清中TC、TG、LDL-C、FFA含量降低,HDL-C含量升高(P < 0.05);阳性对照组与PD高剂量组大鼠血清中TC、TG、HDL-C、LDL-C、FFA含量比较,差异无统计学意义(P>0.05);与PD高剂量组比较,抑制剂组大鼠血清中TC、TG、LDL-C、FFA含量升高,HDL-C含量降低(P < 0.05)。见表 4。
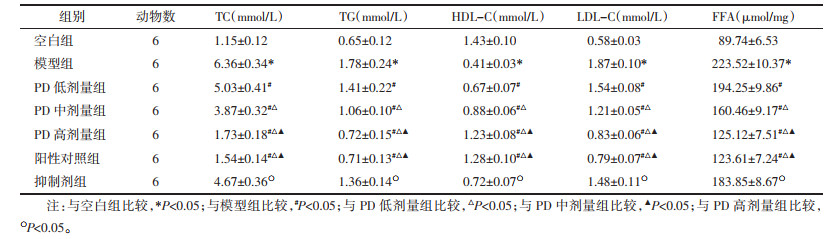
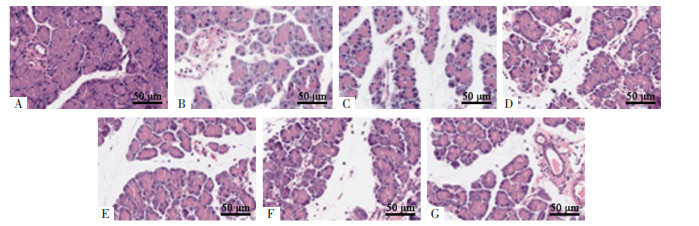
空白组大鼠胰腺组织中胰岛边界清晰且数量较多,细胞排列整齐;与空白组比较,模型组大鼠胰腺组织中胰岛边界模糊,胰岛数量减少(P < 0.05),呈萎缩状,细胞排列松散且固缩明显;与模型组比较,PD低、中、高剂量组大鼠胰腺组织中胰岛数量增加(P < 0.05),细胞结构逐渐正常;阳性对照组与PD高剂量组大鼠胰岛数量比较,差异无统计学意义(P>0.05);与PD高剂量组比较,抑制剂组大鼠胰腺组织中的胰岛数量减少(P < 0.05),萎缩情况加重,细胞固缩明显。见图 1、表 5。
|
| 注:A,空白组;B,模型组;C,PD低剂量组;D,PD中剂量组;E,PD高剂量组;F,阳性对照组;G,抑制剂组。 图 1 各组大鼠胰腺组织病理改变情况(HE染色,×200) |
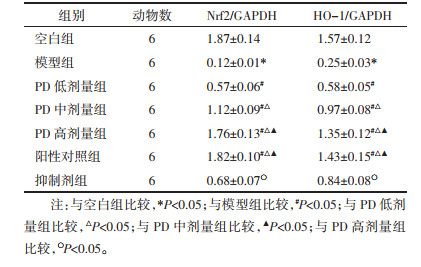
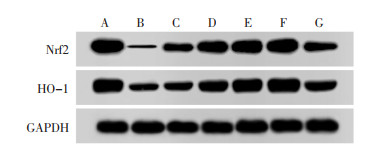
与空白组比较,模型组大鼠Nrf2、HO-1表达降低(P < 0.05);与模型组比较,PD低、中、高剂量组大鼠Nrf2、HO-1表达升高(P < 0.05);阳性对照组与PD高剂量组大鼠Nrf2、HO-1比较,差异无统计学意义(P>0.05);与PD高剂量组比较,抑制剂组大鼠Nrf2、HO-1表达降低(P < 0.05)。见图 2、表 6。
|
| 注:A,空白组;B,模型组;C,PD低剂量组;D,PD中剂量组;E,PD高剂量组;F,阳性对照组;G,抑制剂组。 图 2 Western Blot法检测各组大鼠胰腺组织中Nrf2、HO-1蛋白表达条带图 |
GDM由胰岛素抵抗和胰腺β细胞功能障碍引起。GDM患者由于体内血糖水平较高,引起机体血脂代谢紊乱,增加母婴不良妊娠结局,严重威胁孕产妇及幼儿的生命健康[16-17]。GDM致病因素较多(肥胖、糖尿病家族史等)。随着生活方式改变,肥胖人数增多,GDM及其相关的围产期并发症的发生率也在上升[18-19]。然而,目前可用的治疗方法有限。因此,还需要探索新的GDM治疗药物。
PD是白藜芦醇的糖苷形式,是从传统中药虎杖中提取的单体化合物,具有广泛的生理活性。PD是一种有效的抗糖尿病物质。研究发现PD通过调节2型糖尿病小鼠的抗糖化活性,减轻糖尿病诱导的唾液分泌不足[20]。PD在临床试验中可以促进胰岛素分泌,缓解胰岛素抵抗,调节糖脂代谢[21]。同时,PD能够降低糖尿病小鼠的血糖水平,改善心功能与心肌纤维化[22]。以上研究提示PD具有治疗GDM的潜力。本研究采用妊娠期注射链脲佐菌素的方法构建GDM大鼠模型,结果显示,造模后大鼠体质量明显升高,FBG升高,血脂水平异常(TC、TG、LDL-C、FFA含量增加,HDL-C含量降低),且表现出明显的胰岛素抵抗,同时胰腺组织切片经HE染色可以观察到胰岛数量减少,这与GDM的临床症状相似,说明GDM造模成功。采用不同浓度的PD灌胃GDM大鼠,发现PD能够有效降低大鼠体质量、FBG、FINS、HOMA-IR、TC、TG、LDL-C、FFA含量,同时增加ISI、HOMA-β、HDL-C含量与胰岛数量,提示PD具有降低GDM大鼠血糖、血脂以及改善胰岛功能的作用。
炎症在胰岛素抵抗和胰腺β细胞衰竭中起到关键作用,参与GDM的发生与发展[23]。许多研究表明,炎症因子是胰岛素抵抗发展的起始因素[24-25]。炎症因子可以引起胰岛β细胞损伤,促进细胞凋亡。IL-6可以刺激多种淋巴和炎症细胞,加重炎症反应。有研究报道IL-6能够促进T细胞活化,从而加速胰岛β细胞凋亡,还可以引起抗原释放,使胰岛素分泌不足[26]。TNF-α因其阻断胰岛素信号传递和葡萄糖转运的功能而被认为是GDM的独立危险因素[27-28]。本研究发现,GDM大鼠血清中IL-6、IL-1β、TNF-α炎症因子显著升高,HOMA-IR指数升高,并且胰岛数量和HOMA-β显著降低。但经PD处理后,炎症因子含量明显受到抑制,提示PD可能通过抑制炎症反应,从而缓解胰岛素抵抗,改善胰岛功能。HO-1是一种重要的抗炎和抗氧化酶,可以保护机体免受氧化应激和炎症反应,而Nrf2是HO-1表达的关键调制器[29]。研究表明,Nrf2/HO-1信号通路是重要的抗氧化应激通路,在GDM的预防中起着至关重要的作用。例如,N-乙酰半胱氨酸可以增强肝脏中Nrf2/HO-1的表达,改善GDM小鼠的血糖耐量,缓解GDM引起的高脂血症症状,从而恢复氧化还原稳态[30]。妊娠期给予虾青素治疗,可以通过Nrf2/HO-1信号通路显著缓解GDM小鼠的葡萄糖耐受不良和β细胞功能不全,抑制体内氧化应激,增强抗氧化酶活性,改善生殖结局[31]。小豆蔻素能够使Nrf2/HO-1活化,抑制炎症因子IL-6、IL-1β、TNF-α分泌和丙二醛、超氧化物歧化酶等氧化应激指标的表达,从而改善GDM小鼠炎症和氧化损伤[32]。上调Nrf2/HO-1信号通路表达,可以显著降低GDM大鼠的氧化应激与炎症反应,从而起到改善GDM的作用[11]。以上研究均说明Nrf2/HO-1信号通路是药物治疗GDM的潜在靶点。此外,研究发现PD可以通过调控Nrf2/HO-1信号通路,抑制氧化应激与炎症反应,从而起到治疗急性心肌梗死大鼠[33]和结肠炎小鼠[34]的作用。本研究发现,PD可以显著增加GDM大鼠胰腺组织中Nrf2、HO-1蛋白的表达水平,提示PD可以通过激活Nrf2/HO-1信号通路,抑制炎症反应,从而起到缓解GDM大鼠症状的作用。而在使用Nrf2/HO-1通路抑制剂后,显著降低了GDM大鼠胰腺组织中Nrf2、HO-1蛋白的表达水平,并且削弱了PD对GDM大鼠症状的改善作用。再次说明PD可能通过激活Nrf2/HO-1信号通路,抑制炎症反应,改善胰岛功能,缓解GDM大鼠症状。
综上所述,PD通过降低血糖、血脂和抑制炎症反应来改善GDM,其作用机制可能与激活Nrf2/HO-1信号通路有关。这些发现为PD在GDM治疗中的潜在应用提供了证据。但PD药理作用复杂,治疗GDM大鼠的作用是否涉及其他通路仍有待阐明。
| [1] |
RASMUSSEN L, POULSEN C W, KAMPMANN U, et al. Diet and healthy lifestyle in the management of gestational diabetes mellitus[J]. Nutrients, 2020, 12(10): 3050. DOI:10.3390/nu12103050 |
| [2] |
SZMUILOWICZ E D, JOSEFSON J L, METZGER B E. Gestational diabetes mellitus[J]. Endocrinology and Metabolism Clinics of North America, 2019, 48(3): 479-493. DOI:10.1016/j.ecl.2019.05.001 |
| [3] |
GUO L L, MA J, TANG J, et al. Comparative efficacy and safety of metformin, glyburide, and insulin in treating gestational diabetes mellitus: a meta-analysis[J]. Journal of Diabetes Research, 2019, 152(6): 980-988. |
| [4] |
KARAMI A, FAKHRI S, KOOSHKI L, et al. Polydatin: pharmacological mechanisms, therapeutic targets, biological activities, and health benefits[J]. Molecules, 2022, 27(19): 6474-6484. DOI:10.3390/molecules27196474 |
| [5] |
YOUSEF A I, SHAWKI H H, EL-SHAHAWY A A, et al. Polydatin mitigates pancreatic β-cell damage through its antioxidant activity[J]. Biomedecine & Pharmacotherapie, 2021, 133(12): 1110-1127. |
| [6] |
HAO J, CHEN C, HUANG K P, et al. Polydatin improves glucose and lipid metabolism in experimental diabetes through activating the Akt signaling pathway[J]. European Journal of Pharmacology, 2014, 745(2): 152-165. |
| [7] |
CHEN Z Q, SUN X H, LI X J, et al. Polydatin attenuates renal fibrosis in diabetic mice through regulating the Cx32-Nox4 signaling pathway[J]. Acta Pharmacologica Sinica, 2020, 41(12): 1587-1596. DOI:10.1038/s41401-020-0475-6 |
| [8] |
MO E, EBEDY Y A, IBRAHIM M A, et al. Newly synthesized chitosan-nanoparticles attenuate carbendazim hepatorenal toxicity in rats via activation of Nrf2/HO1 signalling pathway[J]. Scientific Reports, 2022, 12(1): 99-106. DOI:10.1038/s41598-021-04089-8 |
| [9] |
LIN B Z, ZHANG X R. Vitamin E supplement protects against gestational diabetes mellitus in mice through nuclear factor-erythroid factor 2-related factor 2/heme oxygenase-1 signaling pathway[J]. Diabetes Metabolic Syndrome and Obesity-targets and Therapy, 2023, 16(5): 565-574. |
| [10] |
田亚静, 杨雪, 汪静, 等. 芒柄花素对妊娠期糖尿病大鼠氧化应激损伤的影响[J]. 天津医药, 2023, 51(7): 734-739. |
| [11] |
WANG H R, CHEN X Z, MIAO X Q, et al. Dendrobium mixture improves gestational diabetes mellitus through regulating Nrf2/HO1 signaling pathway[J]. Biomedecine & Pharmacotherapie, 2022, 155(11): 1136-1150. |
| [12] |
ZHAO X M, QIN J X, LI H T, et al. Effect of polydatin on neurological function and the Nrf2 pathway during intracerebral hemorrhage[J]. Journal of Molecular Neuroscience, 2020, 70(9): 1332-1337. DOI:10.1007/s12031-020-01546-3 |
| [13] |
LYU R X, DU L L, ZHANG L X, et al. Polydatin attenuates spinal cord injury in rats by inhibiting oxidative stress and microglia apoptosis via Nrf2/HO-1 pathway[J]. Life Sciences, 2019, 217(1): 119-127. |
| [14] |
许梦丽, 徐琼, 崔翠, 等. 灵芝多糖对妊娠期糖尿病大鼠肝脏损伤的保护作用[J]. 中国临床药理学杂志, 2020, 36(20): 3242-3245. |
| [15] |
鲁荣华, 杨群, 赵玲. 金银花提取物通过激活Nrf2通路对急性肝损伤模型大鼠肝功能的保护作用[J]. 中国老年学杂志, 2022, 42(19): 4811-4815. DOI:10.3969/j.issn.1005-9202.2022.19.043 |
| [16] |
ALEJANDRO E U, MAMERTO T P, CHUNG G, et al. Gestational diabetes mellitus: a harbinger of the vicious cycle of diabetes[J]. International Journal of Molecular Sciences, 2020, 21(14): 5003-5012. DOI:10.3390/ijms21145003 |
| [17] |
DALFRA M G, BURLINA S, DEL VESCOVO G G, et al. Genetics and epigenetics: new insight on gestational diabetes mellitus[J]. Frontiers in Endocrinology, 2020, 11(4): 602-614. |
| [18] |
LENDE M, RIJHSINGHANI A. Gestational diabetes: overview with emphasis on medical management[J]. International Journal of Environmental Research and Public Health, 2020, 17(24): 9573-9581. DOI:10.3390/ijerph17249573 |
| [19] |
FARAHVAR S, WALFISCH A, SHEINER E. Gestational diabetes risk factors and long-term consequences for both mother and offspring: a literature review[J]. Expert Review of Endocrinology & Metabolism, 2019, 14(1): 63-74. |
| [20] |
KIM H R, JUNG W K, PARK S B, et al. Polydatin alleviates diabetes-induced hyposalivation through anti-glycation activity in db/db mouse[J]. Pharmaceutics, 2021, 14(1): 51-59. DOI:10.3390/pharmaceutics14010051 |
| [21] |
LUO J L, CHEN S, WANG L, et al. Pharmacological effects of polydatin in the treatment of metabolic diseases: a review[J]. International Journal of Phytotherapy and Phytopharmacology, 2022, 102(12): 1541-1556. |
| [22] |
陈瑞敏, 陈伟, 李建耿, 等. 虎杖苷对糖尿病小鼠心肌纤维化的保护作用及机制[J]. 山东医药, 2021, 61(22): 47-50. DOI:10.3969/j.issn.1002-266X.2021.22.011 |
| [23] |
PAN X, JIN X, WANG J, et al. Placenta inflammation is closely associated with gestational diabetes mellitus[J]. American Journal of Translational Research, 2021, 13(5): 4068-4079. |
| [24] |
HEO Y J, CHOI S E, JEON J Y, et al. Visfatin induces inflammation and insulin resistance via the NF-κB and STAT3 signaling pathways in hepatocytes[J]. Journal of Diabetes Research, 2019, 20(32): 4021-4033. |
| [25] |
LI H, MENG Y, HE S W, et al. Macrophages, chronic inflammation, and insulin resistance[J]. Cells, 2022, 11(19): 3001-3011. DOI:10.3390/cells11193001 |
| [26] |
AKBARI M, HASSAN-ZADEH V. IL-6 signalling pathways and the development of type 2 diabetes[J]. Inflammopharmacology, 2018, 26(3): 685-698. DOI:10.1007/s10787-018-0458-0 |
| [27] |
WEI W G, ZHANG X P. Expression of ADP and TNF-α in patients with gestational diabetes mellitus and its relationship with pregnancy outcomes[J]. Experimental and Therapeutic Medicine, 2020, 20(3): 2184-2190. |
| [28] |
LIU Y, SUN R F, LIN X P, et al. Procyanidins and its metabolites by gut microbiome improves insulin resistance in gestational diabetes mellitus mice model via regulating NF-κB and NLRP3 inflammasome pathway[J]. Biomedecine & Pharmacotherapie, 2022, 151(9): 1130-1137. |
| [29] |
TAIRA J, OGI T. Induction of antioxidant protein HO-1 through Nrf2-ARE signaling due to pteryxin in Peucedanum japonicum thunb in RAW264.7 macrophage cells[J]. Antioxidants, 2019, 8(12): 621-628. DOI:10.3390/antiox8120621 |
| [30] |
XING S, GUO Z, LANG J, et al. N-Acetyl-l-cysteine ameliorates gestational diabetes mellitus by inhibiting oxidative stress[J]. Gynecological Endocrinology, 2023, 39(1): 21-28. |
| [31] |
CHEN Y, TANG J, ZHANG Y, et al. Astaxanthin alleviates gestational diabetes mellitus in mice through suppression of oxidative stress[J]. Naunyn-schmiedebergs Archives of Pharmacology, 2020, 393(12): 2517-2527. DOI:10.1007/s00210-020-01861-x |
| [32] |
孙芙林, 岳涛, 刘海燕, 等. 小豆蔻素调节Nrf2/HO-1/NF-κB信号通路对妊娠糖尿病大鼠氧化应激损伤的影响[J]. 中国优生与遗传杂志, 2023, 31(2): 269-274. |
| [33] |
CHEN G, LIU G R, CAO D W, et al. Polydatin protects against acute myocardial infarction-induced cardiac damage by activation of Nrf2/HO-1 signaling[J]. Journal of Natural Medicines, 2019, 73(1): 85-92. DOI:10.1007/s11418-018-1241-7 |
| [34] |
CHEN G X, YANG Z Y, WEN D, et al. Polydatin has anti-inflammatory and antioxidant effects in LPS-induced macrophages and improves DSS-induced mice colitis[J]. Immunity, Inflammation and Disease, 2021, 9(3): 959-970. DOI:10.1002/iid3.455 |
 2024, Vol. 43
2024, Vol. 43