文章信息
- 黄丽娜, 何程, 殷丽, 王三凤, 纪文雯, 朱恩惠, 陈炜
- HUANG Lina, HE Cheng, YIN Li, WANG Sanfeng, JI Wenwen, ZHU Enhui, CHEN Wei
- 基于MAPK/ERK信号通路探究参七虫草方对特发性肺纤维化炎症反应的影响
- Exploring effects of Shenqi Chongcao Recipe on the inflammatory reaction of idiopathic pulmonary fibrosis based on MAPK/ERK signal pathway
- 天津中医药大学学报, 2024, 43(7): 617-624
- Journal of Tianjin University of Traditional Chinese Medicine, 2024, 43(7): 617-624
- http://dx.doi.org/10.11656/j.issn.1673-9043.2024.07.08
-
文章历史
收稿日期: 2024-04-08
2. 安徽中医药大学第一附属医院,合肥 230000
2. The First Affiliated Hospital of Anhui University of Chinese Medicine, Hefei 230000, China
特发性肺纤维化(IPF)是一种病因未明的慢性、进行性、纤维化性间质性肺炎,以呼吸困难进行性加重和肺功能进行性恶化为主要临床特征,好发于60岁以上的老年人[1]。研究发现,炎症反应在IPF的早期损伤阶段发挥重要作用。丝裂原活化蛋白激酶(MAPK)/细胞外信号调节激酶(ERK)信号通路参与调控炎症反应,损伤肺泡上皮细胞,使血管内皮通透性增加,导致肺组织中内皮功能障碍与细胞微管结构损伤,引起肺组织异常重塑,还能够促进下游核转录因子-κB p65(NF-κB p65)、活化蛋白酶-1(AP-1)等蛋白表达,介导以巨噬细胞为代表的炎症细胞定向迁移,以及成纤维细胞增殖、分化,造成肺组织局部炎性、纤维性持续,肺异常重构,向IPF进展[2-5]。因此,早期干预IPF的炎症反应至关重要。
本课题组认为,IPF是一种慢性、虚损性、进展性疾患,其本为肺肾气阴两虚,标为瘀阻肺络,由虚致实,肺失治节,虚瘀互结,出现异常肺组织重塑。前期大量实验研究证实参七虫草方可以抑制血管新生,减轻炎症反应,从而发挥抗纤维化作用[6-7]。本研究在既往研究基础上,以MAPK/ERK信号通路为切入点,探究参七虫草方对模型大鼠血清和肺组织中转化生长因子-β1(TGF-β1)、白细胞介素-10(IL-10)、磷酸化丝裂原活化蛋白激酶(P-MEK)、磷酸化ERK(P-ERK)、NF-κB p65及AP-1表达的影响,揭示参七虫草方干预IPF炎症反应、延缓肺纤维化的机制,为临床治疗提供理论依据。
1 实验材料与方法 1.1 实验动物SPF级雄性SD大鼠140只,体质量(190±20) g,由辽宁长生生物技术股份有限公司提供[动物合格证书号:SCXK(辽)2020-0001],饲养于安徽省中医院动物实验中心。动物房环境适宜,定时喂食、喂水、更换垫料,喂养7 d后开始造模实验。
1.2 实验药物参七虫草方(西洋参15 g,三七10 g,黄精10 g,虎杖9 g,冬虫夏草3 g)的所有中药均购自安徽省中医院草药房,由制剂室制备参七虫草方水剂备用。博来霉素(批号:1935037,规格:100 mg/支),Invitrogen公司生产。吡非尼酮胶囊(批号:H20133376,规格:100 mg/粒),购自北京康蒂尼药业有限公司。精氨酸脱亚胺酶(规格:20 μg/支),美国PeproTech公司生产。戊巴比妥钠(批号:WS20051129),购自国药集团化学试剂有限公司。实验过程中采用生理盐水配制所需浓度的混合物。
1.3 主要试剂与仪器IL-10(JYM0651Ra&GR2022-11,武汉基因美科技有限公司)、TGF-β1(JYM0636Ra& GR2022-1,武汉基因美科技有限公司)、GAPDH(TA-08&200040908,Zsbio)、P-MEK(bs-3722R&AD 19526602,Bioss)、P-ERK(4370s&11,CST)、NF-κB p65(66535-1-Ig&10017763,Proteintech)、AP-1(bs-0670R&AG19526310,Bioss)。酶标仪(RT-6100,雷杜)、离心机(JW3021HR,安徽嘉文)、电泳仪(EPS300,上海天能科技有限公司)、转膜仪(VE-186,上海天能科技有限公司)、生物组织包埋机(YB-7LF,湖北亚光)、徕卡切片机(RM2016,Leica)、流式细胞仪(CytoFLEX,BECKMAN)。
1.4 实验方法 1.4.1 动物分组、造模及给药将140只雄性SD大鼠,随机分成5组:空白组、模型组、参七虫草方组(SCF组)、吡非尼酮组(PFD组)、精氨酸脱亚胺酶组(ADI组),每组28只。除空白组外,其余各组均使用气管内滴注博来霉素法制备IPF大鼠模型。用1%戊巴比妥钠(40 mg/kg)腹腔注射进行麻醉,固定大鼠后将灌胃针置于其咽后部,待回抽无阻力后,经气管向近心端缓慢注入浓度为5 mg/mL的博来霉素生理盐水混合液(5 mg/kg),后迅速提起大鼠保持其直立,旋转8~10次。空白组向气管内滴注同等体积的生理盐水,方法同前。IPF大鼠造模成功标志:肺组织可见明显的肺泡结构破坏、肺泡壁增厚、炎性细胞浸润、胶原沉积及大量纤维条索,表现出明显的肺泡炎症和纤维化[8]。除空白组外,其余4组均于博来霉素造模1 d后给药,SCF组予参七虫草方汤剂灌胃(每次0.423 g/kg,相当于成人剂量的6.3倍),每日1次;PFD组予生理盐水溶解的吡非尼酮胶囊粉末灌胃(每次50 mg/只),每日2次;ADI组予精氨酸脱亚胺酶腹腔注射(每次2.25 mg/kg),每3日1次;空白组、模型组均以10 mL/kg生理盐水灌胃,每日1次。给药疗程为28 d。
1.4.2 动物取材与标本采集分别于药物干预的第7、14、21、28天分4批处死大鼠。大鼠麻醉后(麻醉方法同前)腹主动脉采血,收集大鼠动脉血,用于后续酶联免疫吸附(ELISA)实验。采血后迅速打开胸腔,分离肺脏,生理盐水洗去肺组织上的血液。取右肺组织置于4%多聚甲醛溶液中固定,制备病理切片;取左肺组织置于EP管中,后迅速转移至液氮中,用于后续实验。
1.4.3 病理学检查大鼠右肺组织以4%多聚甲醛溶液固定,石蜡包埋,制作切片,行苏木精-伊红(HE)、Masson染色。光学显微镜下观察肺纤维化组织的病理学改变,评价炎症细胞浸润及肺纤维化程度。
1.4.4 流式细胞术检测肺组织单细胞悬液中调节性T淋巴细胞(Th)1/Th2、自然杀伤T细胞(NKT细胞)阳性率采集各组大鼠肺组织,制备单细胞悬液,加入适量CD3、CD4、CD8、CD49抗体,用磷酸缓冲盐溶液(PBS)洗涤并重悬细胞,使用流式细胞仪检测各组大鼠单细胞悬液中Th1、Th2、NKT细胞阳性率,计算Th1/Th2,评价各组大鼠免疫反应程度。
1.4.5 ELISA法检测血清中TGF-β1及IL-10的相对表达水平采集各组大鼠动脉血,室温下自然凝固10~20 min,离心20 min(2 000~3 000 r/min,离心半径10 cm),收集上清液,并按照试剂盒说明检测TGF-β1及IL-10的表达水平。
1.4.6 蛋白免疫印迹(Western Blot)法检测肺组织中P-MEK、P-ERK、NF-κB p65及AP-1的相对表达水平采集各组大鼠肺组织,加入RIPA细胞裂解液600 μL(内含0.6 mmol/L苯甲基磺酰氟)进行裂解,12 000×g离心15 min后收集上清液,并按照试剂盒说明检测P-MEK、P-ERK、NF-κB p65及AP-1的表达水平。
1.5 统计学方法实验结果采用SPSS 25.0统计学软件进行分析,满足正态分布且方差齐的计量资料以均数±标准差(x±s)表示,多组间比较采用单因素方差分析,两两比较采用LSD法;若数据为非正态分布或方差不齐,采用非参数检验。P < 0.05为差异有统计学意义。
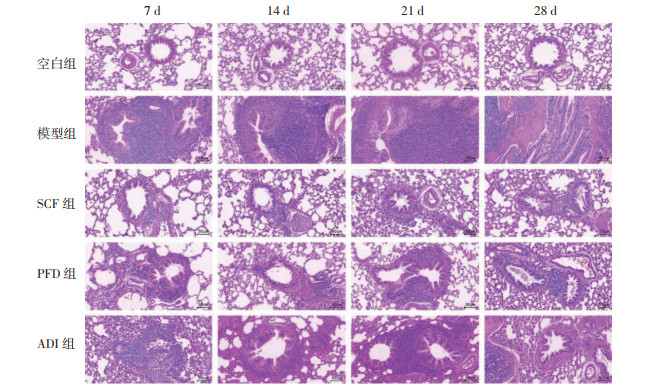
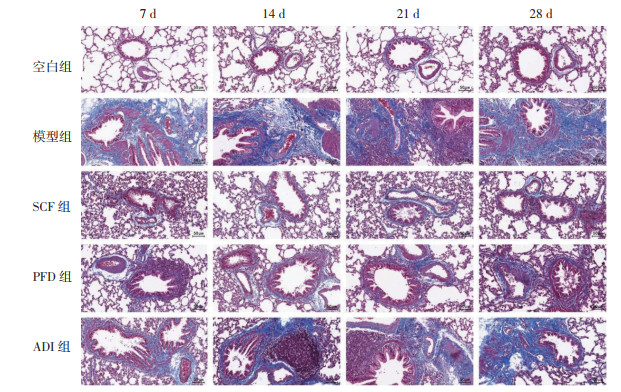
2 结果 2.1 参七虫草方对IPF大鼠肺组织病理损伤的影响为探究参七虫草方干预IPF大鼠肺组织病理改变情况,对大鼠肺组织切片行HE、Masson染色,显微镜下观察肺组织形态。结果发现,空白组大鼠在各时间点均有清晰的肺结构,无明显水肿、炎症及纤维化,并且在肺泡腔内没有明显的细胞外基质渗出。模型组大鼠肺组织内部肺泡结构损坏,可见淋巴细胞、巨噬细胞等炎症细胞浸润,还可见较多淡蓝色胶原纤维及成纤维细胞增生,肺泡间隔轻度增宽,说明造模成功。随着时间推移,大鼠肺组织形态紊乱,结构排列模糊,部分肺泡塌陷并融合,蓝色胶原纤维逐渐增加,呈现弥漫性肺纤维化。与模型组大鼠相比,各治疗组大鼠的炎症及纤维化程度在每个时间点显著降低,但肺纤维化的进展仍然可见。结果提示,参七虫草方能够改善IPF大鼠肺组织的病理损伤程度。见图 1及图 2。
|
| 图 1 各组大鼠不同时间点肺组织HE染色结果(×200) |
|
| 图 2 各组大鼠不同时间点肺组织Masson染色结果(×200) |
为探究参七虫草方对IPF免疫炎症的影响,采用流式细胞术检测各组大鼠肺组织单细胞悬液中Th1/Th2、NKT细胞阳性率。结果显示,与空白组大鼠比较,其余4组大鼠相同时点肺组织单细胞悬液中Th1/Th2降低(P<0.05),NKT细胞阳性率升高(P < 0.01)。与模型组大鼠比较,各治疗组大鼠相同时点Th1/Th2无明显差异(P>0.05),NKT细胞阳性率降低(P < 0.01)。说明IPF的发病过程存在Th1/Th2向Th2“漂移”,参七虫草方可能通过抑制NKT细胞活化,从而对肺纤维化起到改善作用。见图 3及图 4。
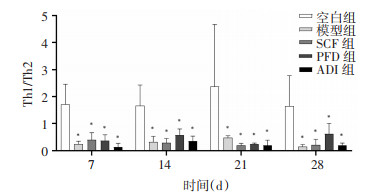
|
| 注:与空白组比较,*P < 0.05。 图 3 各组大鼠不同时间点肺组织单细胞悬液中Th1/Th2(x±s,n=6或7) |
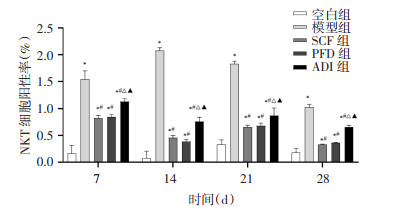
|
| 注:与空白组比较,*P < 0.01;与模型组比较,#P < 0.01;与SCF组比较,△P < 0.01;与PFD组比较,▲P < 0.01。 图 4 各组大鼠不同时间点肺组织单细胞悬液中NKT细胞阳性率(x±s,n=6或7) |
为探究参七虫草方对IPF炎症反应的影响,采用ELISA法检测各组大鼠血清中TGF-β1及IL-10的相对表达水平。结果显示,与空白组比较,其余4组大鼠相同时点血清中TGF-β1表达水平上升,IL-10表达水平下降(P < 0.01)。与模型组比较,各治疗组大鼠相同时点TGF-β1表达水平下降,IL-10表达水平上升(P < 0.01)。与SCF组比较,PFD组大鼠相同时点TGF-β1及IL-10表达水平无显著差异(P>0.05),ADI组大鼠相同时点TGF-β1表达水平上升,IL-10表达水平下降(P < 0.01)。与PFD组比较,ADI组大鼠相同时点TGF-β1表达水平上升,IL-10表达水平下降(P < 0.01)。说明参七虫草方可能通过下调TGF-β1的表达水平,同时上调IL-10的表达水平,改善炎症反应,减轻肺纤维化程度。见表 1及表 2。
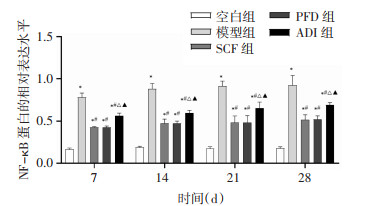
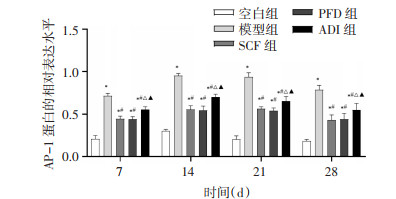
为探究参七虫草方对MAPK/ERK信号通路的影响,采用Western Blot法检测各组大鼠肺组织中P-MEK、P-ERK、NF-κB p65及AP-1的相对表达水平。结果显示,与空白组比较,其余4组大鼠相同时点肺组织中P-MEK、P-ERK、NF-κB p65及AP-1的表达水平增加(P < 0.01)。与模型组比较,各治疗组大鼠相同时点肺组织中P-MEK、P-ERK、NF-κB p65及AP-1的表达水平降低(P < 0.01)。与SCF组比较,PFD组大鼠相同时点肺组织中P-MEK、P-ERK、NF-κB p65及AP-1的表达水平无显著差异(P>0.05),ADI组大鼠相同时点肺组织中P-MEK、P-ERK、NF-κB p65及AP-1的表达水平增加(P < 0.01)。与PFD组比较,ADI组大鼠相同时点肺组织中P-MEK、P-ERK、NF-κB p65及AP-1的表达水平增加(P < 0.01)。说明参七虫草方可能通过抑制MAPK/ERK信号通路,降低P-MEK、P-ERK、NF-κB p65及AP-1的表达水平来延缓肺纤维化进展。见图 5-12。

|
|
注:1,空白组;2,模型组;3,SCF组;4,PFD组;5,ADI组。 A,7 d;B,14 d;C,21 d;D,28 d。 图 5 各组大鼠不同时间点肺组织中P-MEK蛋白条带 |
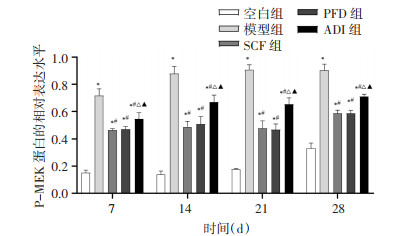
|
| 注:与空白组比较,*P < 0.01;与模型组比较,#P < 0.01;与SCF组比较,△P < 0.01;与PFD组比较,▲P < 0.01。 图 6 各组大鼠不同时间点肺组织中P-MEK蛋白的相对表达水平(x±s,n=6或7) |

|
|
注:1,空白组;2,模型组;3,SCF组;4,PFD组;5,ADI组。 A,7 d;B,14 d;C,21 d;D,28 d。 图 7 各组大鼠不同时间点肺组织中P-ERK的蛋白条带 |
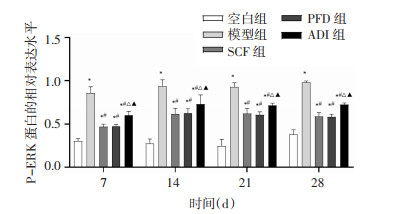
|
| 注:与空白组比较,*P < 0.01;与模型组比较,#P < 0.01;与SCF组比较,△P < 0.01;与PFD组比较,▲P < 0.01。 图 8 各组大鼠不同时间点肺组织中P-ERK蛋白的相对表达水平(x±s,n=6或7) |

|
|
注:1,空白组;2,模型组;3,SCF组;4,PFD组;5,ADI组。 A,7 d;B,14 d;C,21 d;D,28 d。 图 9 各组大鼠不同时间点肺组织中NF-κB p65的蛋白条带 |
|
| 注:与空白组比较,*P < 0.01;与模型组比较,#P < 0.01;与SCF组比较,△P < 0.01;与PFD组比较,▲P < 0.01。 图 10 各组大鼠不同时间点肺组织中NF-κB p65蛋白的相对表达水平(x±s,n=6或7) |

|
|
注:1,空白组;2,模型组;3,SCF组;4,PFD组;5,ADI组。 A,7 d;B,14 d;C,21 d;D,28 d。 图 11 各组大鼠不同时间点肺组织中AP-1的蛋白条带 |
|
| 注:与空白组比较,*P < 0.01;与模型组比较,#P < 0.01;与SCF组比较,△P < 0.01;与PFD组比较,▲P < 0.01。 图 12 各组大鼠不同时间点肺组织中AP-1蛋白的相对表达水平(x±s,n=6或7) |
IPF是一种进行性肺部疾病,其特征是成纤维细胞积聚和胶原沉积,导致肺部瘢痕形成及气体交换受损。吡非尼酮是目前临床上常用的抗纤维化药物,研究表明,吡非尼酮可以通过减少转化生长因子-β(TGF-β)、肿瘤坏死因子-α(TNF-α)等多种炎症细胞因子的生成,同时发挥抗炎、抗氧化作用实现抗纤维化[9]。有研究从IPF患者分离的原代肺成纤维细胞的成纤维细胞灶中发现精氨酸琥珀酸合酶-1(ASS1)转录下调,而缺乏ASS1表达的细胞需要摄取细胞外精氨酸才能存活[10]。精氨酸脱亚胺酶是一种精氨酸降解酶,可以直接阻断细胞外精氨酸被细胞吸收至细胞中,损害IPF中成纤维细胞活力,减少整体组织学纤维化和细胞外基质沉积,同时可以使正常细胞相对不受伤害。故选用吡非尼酮及精氨酸脱亚胺酶作为本次实验的阳性对照物。
MAPK/ERK信号通路可以诱导不同炎症介质和促炎细胞因子表达,被认为是一种经典且重要的抗炎通路[11]。毕研蒙等[12]研究发现,岗稔根正丁醇提取物具有改善四氯化碳(CCl4)诱导的小鼠肝纤维化作用,其机制可能与抑制MAPK/ERK信号通路的激活有关。在本实验中,模型组大鼠肺组织中P-MEK、P-ERK的表达水平均较空白组增加,而药物干预后P-MEK、P-ERK的表达水平均较给药前下降,表明参七虫草方能够抑制MAPK/ERK信号通路,具有抗肺纤维化作用。
近年来,IL-10在治疗纤维化领域占据重要地位,是一种具有强效抗炎和抗纤维化作用的细胞因子。马丽娜等[13]研究发现,肝纤维化模型大鼠血清中IL-10的表达水平随大鼠肝纤维化程度加重而逐渐降低。TGF-β是肺纤维化发生的关键环节,从多个角度使机体内促纤维化基因表达增加,引起炎症介质如白细胞介素、趋化因子水平升高,从而导致肺组织发生纤维化改变[14-15]。有研究发现抑制TGF-β1蛋白的表达可以改善糖尿病心肌病大鼠心肌纤维化和心肌结构紊乱[16]。本研究结果提示,模型组大鼠血清中TGF-β1表达水平较空白组升高,IL-10的表达水平较空白组降低,而药物干预后TGF-β1的表达水平较给药前下降,IL-10的表达水平较给药前增加,提示参七虫草方能够改善大鼠的炎症反应,延缓肺纤维化进程。
MAPK/ERK信号通路可以激活核转录因子-κB(NF-κB),促进多种炎症因子大量释放,刺激成纤维细胞增生和胶原纤维沉积,从而促进器官纤维化的发生发展[17]。彭艳芳等[18]研究发现,降低NF-κB、TGF-β1浓度,能够改善肺泡炎症,减轻博来霉素导致的大鼠纤维化程度。此外,MAPK已经被证实是AP-1转录因子的调节因子,并与促炎基因表达有关。AP-1能够影响促炎细胞因子的产生,过度表达则会导致炎症扩大,损伤肺组织[19]。有研究发现,抑制NF-κB、AP-1转录因子活化,能够减少下游炎症因子生成,缓解炎症因子对肝组织造成的损伤,从而达到抗肝纤维化作用[20]。本实验结果表明,与空白组比较,模型组大鼠肺组织中NF-κB p65及AP-1表达水平上升;与模型组比较,药物干预后NF-κB p65及AP-1的表达水平下降,说明参七虫草方可以减轻肺组织炎症和胶原纤维沉积,缓解肺组织纤维化损伤。
参七虫草方是国医大师韩明向教授基于“虚瘀”病机理论创制的临床经验方,由西洋参、三七、虎杖、冬虫夏草、黄精组成。方中西洋参、黄精补气养阴,冬虫夏草补肾益肺,三七活血化瘀,虎杖止咳化痰,全方意在补益肺肾、益气养阴活血。现代药理研究表明,西洋参成分20(S)-人参皂苷Rg3与20(R)-人参皂苷Rg3可以调节Th1/Th2免疫失衡,增强机体免疫力;全三七片可以通过抑制血管活性物质改善氧化应激水平,降低炎症反应,缓解血管内皮细胞损伤,干预肺组织及血管修复、重构;虫草素可以通过抑制NF-κB p65炎症通路及MAPK/AP-1信号通路改善炎症反应和氧化刺激,减轻大鼠肺组织病理损伤;黄精多糖可以通过抑制Toll样受体4(TLR4)/髓样分化因子88(MyD88)/NF-κB信号通路调节肝脏炎症因子和细胞因子α-平滑肌肌动蛋白(α-SMA)、TGF-β1的表达,实现对小鼠慢性肝纤维化的预防及保护作用;虎杖苷可以抑制TGF-β1诱导的肺泡上皮细胞-间充质转化,发挥抗肺纤维化作用[21-25]。结合本研究结果,从一定程度上能够证实参七虫草方具有抗炎、抗纤维化作用,对于IPF的发展具有延缓作用。
综上所述,参七虫草方可能通过抑制MAPK/ERK信号通路,降低IPF模型大鼠TGF-β1、NF-κB p65及AP-1的表达水平,提高IL-10的表达水平,从而减轻炎症反应及胶原沉积,改善肺纤维化程度,为临床治疗IPF提供新思路。
| [1] |
于娜, 周家为, 李霞, 等. 成人特发性肺纤维化(更新)和进行性肺纤维化临床实践指南(2022版)解读[J]. 中国现代医学杂志, 2023, 33(14): 1-8. DOI:10.3969/j.issn.1005-8982.2023.14.001 |
| [2] |
蔡强, 于婷, 唐海姣, 等. 人参皂苷Rh2调节TNF/MAPK和NF-κB信号通路抑制TGF-β1诱导的LX-2细胞活化[J]. 中药新药与临床药理, 2022, 33(8): 1047-1054. |
| [3] |
WANG J, HE F, CHEN L Q, et al. Resveratrol inhibits pulmonary fibrosis by regulating miR-21 through MAPK/AP-1 pathways[J]. Biomedecine & Pharmacotherapie, 2018, 105(1): 37-44. |
| [4] |
WANG L Q, ZHANG W T, CEN R Y, et al. ALA-PDT regulates macrophage M1 polarization via ERK/MAPK-NLRP3 pathway to promote the early inflammatory response[J]. Lasers in Surgery and Medicine, 2022, 54(10): 1309-1320. DOI:10.1002/lsm.23618 |
| [5] |
LIU H M, ZHANG X Y, SHAO Y M, et al. Danshensu alleviates bleomycin-induced pulmonary fibrosis by inhibiting lung fibroblast-to-myofibroblast transition via the MEK/ERK signaling pathway[J]. Bioengineered, 2021, 12(1): 3113-3124. DOI:10.1080/21655979.2021.1944020 |
| [6] |
陈炜, 袁平凡, 张念志. 益气养阴活血法对博来霉素诱导IPF的大鼠PI3K/AKT/HIF-1α信号通路的影响[J]. 时珍国医国药, 2021, 32(7): 1577-1581. DOI:10.3969/j.issn.1008-0805.2021.07.10 |
| [7] |
何程, 陈炜, 张念志. 参七虫草方通过抑制促血管生成因子表达改善大鼠肺组织纤维化实验研究[J]. 陕西中医, 2022, 43(10): 1332-1336. DOI:10.3969/j.issn.1000-7369.2022.10.003 |
| [8] |
燕苗苗, 赵亚昆, 王搏, 等. 博来霉素诱导大鼠与小鼠肺纤维化模型的评价[J]. 中国实验动物学报, 2023, 31(2): 179-186. |
| [9] |
白子娜, 李幸彬. 吡非尼酮治疗特发性肺纤维化的研究进展[J]. 中国新药与临床杂志, 2023, 42(9): 560-565. |
| [10] |
LI J M, YANG D C, OLDHAM J, et al. Therapeutic targeting of argininosuccinate synthase 1(ASS1)-deficient pulmonary fibrosis[J]. Molecular Therapy, 2021, 29(4): 1487-1500. DOI:10.1016/j.ymthe.2021.01.028 |
| [11] |
HE S, CHEN Z Y, XUE C J, et al. MiR-9a-5p alleviates ventilator-induced lung injury in rats by inhibiting the activation of the MAPK signaling pathway via CXCR4 expression downregulation[J]. International Immunopharmacology, 2022, 112(6): 109-118. |
| [12] |
毕研蒙, 胡正进, 王荣, 等. 岗稔根正丁醇提取物对CCl4诱导小鼠肝纤维化中ERK/MAPK通路的影响[J]. 华中科技大学学报(医学版), 2023, 52(2): 187-194. |
| [13] |
马丽娜, 马莲环, 乔卫卫, 等. IL-10、TNF-α、IFN-γ、IL-4在大鼠肝纤维化早期诊断中的意义[J]. 滨州医学院学报, 2023, 46(5): 332-336. |
| [14] |
YANG C C, LIU M J, LI Y Z, et al. 17β-estradiol inhibits TGF-β-induced collagen gel contraction mediated by human Tenon fibroblasts via Smads and MAPK signaling pathways[J]. International Journal of Ophthalmology, 2023, 16(9): 1441-1449. |
| [15] |
李红梅, 张旭辉, 武妍琳, 等. TGF-β1/Smad信号通路在肺纤维化中的作用及中医药调控研究进展[J]. 中药药理与临床, 2024, 40(1): 123-128. |
| [16] |
闫文瑞, 张常喜, 张晓晋, 等. 通心络胶囊调控转化生长因子-β1表达改善糖尿病心肌病大鼠心肌纤维化损伤机制研究[J]. 陕西中医, 2023, 44(12): 1683-1687, 1697. |
| [17] |
黄茹妍, 张鹏飞, 罗湘蓉, 等. 银杏叶提取物对肺纤维化大鼠Th1/Th2细胞因子和NF-κB p65信号通路的影响[J]. 现代中西医结合杂志, 2022, 31(15): 2045-2050, 2079. |
| [18] |
彭艳芳, 张莹雯, 赵映前, 等. 紫檀芪对肺纤维化大鼠NF-κB/TGF-β1/smad3信号通路的影响[J]. 天津中医药大学学报, 2019, 38(1): 53-58. |
| [19] |
MITRA A, RAHMAWATI L, LEE H P, et al. Korean Red Ginseng water extract inhibits cadmium-induced lung injury via suppressing MAPK/ERK1/2/AP-1 pathway[J]. Journal of Ginseng Research, 2022, 46(5): 690-699. |
| [20] |
莫晓晖, 梁韬. 葛根素对四氯化碳所诱导肝纤维化大鼠的干预作用及对TLR-4、NF-κB、AP-1的影响[J]. 中国医院药学杂志, 2017, 37(14): 1348-1351. |
| [21] |
刘迎, 陈妍心, 吴谦, 等. 20(S/R)-人参皂苷Rg3的制备及调节Th1/Th2免疫失衡活性[J]. 高等学校化学学报, 2018, 39(11): 2419-2424. |
| [22] |
郭琰, 杨庆, 李琦, 等. 全三七片对血管内皮细胞损伤的保护作用研究[J]. 中国中医基础医学杂志, 2023, 29(8): 1352-1357. |
| [23] |
陈才伟, 陈家亮, 李华娟, 等. 虫草素调节MAPK/AP-1信号通路对慢性阻塞性肺疾病大鼠肺组织损伤的影响[J]. 临床肺科杂志, 2023, 28(11): 1656-1661. |
| [24] |
刘政祥. 基于TLR4/MyD88/NF-κB通路研究黄精水提物对CCl4诱导的小鼠慢性肝纤维化的保护作用[D]. 合肥: 安徽医科大学, 2023.
|
| [25] |
赵光辉. 虎杖苷对博来霉素诱导的大鼠肺纤维的保护作用及机制研究[D]. 广州: 广州中医药大学, 2018.
|
 2024, Vol. 43
2024, Vol. 43