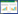文章信息
- 董礼, 陈晓婷, 张辉, 潘保朝, 苏秀海, 王庆海, 吕树泉
- DONG Li, CHEN Xiaoting, ZHANG Hui, PAN Baochao, SU Xiuhai, WANG Qinghai, LYU Shuquan
- 基于SIRT1/TGF-β1/Smad通路研究健脾固肾化瘀方治疗糖尿病肾病机制
- The mechanism of Jianpi Gushen Huayu Decoction in the treatment of diabetic kidney disease based on SIRT1/TGF-β1/Smad pathway
- 天津中医药大学学报, 2024, 43(7): 625-631
- Journal of Tianjin University of Traditional Chinese Medicine, 2024, 43(7): 625-631
- http://dx.doi.org/10.11656/j.issn.1673-9043.2024.07.09
-
文章历史
收稿日期: 2024-03-01
糖尿病肾病(DKD)是糖尿病患者常见的慢性并发症之一,具有较高的发病率和隐匿性。这种并发症会逐渐破坏肾脏的结构和功能,早期可能不易察觉,但随着时间推移,病情会逐渐加重,最终导致终末期肾病的发生,对患者的生命健康构成严重威胁[1]。控制血糖、血压、血脂以及改善微循环是目前治疗DKD的主要手段[1],通常采用西药治疗,但可能会对患者产生不良反应[2]。随着发病率逐年升高,DKD造成的社会负担逐渐加重。因此,研发能够干预并延缓DKD进展的药物是当前的研究热点之一。
在DKD的基础实验研究中,中药展现出了显著的治疗潜力[3-4],补阳还五汤可能通过抑制核转录因子-κb(NF-κB)信号通路改善DKD大鼠肾组织氧化应激状态和炎症损伤[5]。另外,临床研究发现,益气养阴通络方可以改善DKD患者糖脂代谢水平,提高肾功能[6];益气固肾通络方可能通过改善机体的氧化应激状态,改善早期DKD患者的临床症状[7];肾衰宁胶囊可以改善DKD慢性肾功能衰竭3、4期患者的微炎症状态[8]。
健脾固肾化瘀方(JPGS)由黄芪、人参、熟地黄、山茱萸、山药、芡实、金樱子、白术、当归、丹参、川芎、水蛭、酒大黄组成,具有健脾固肾、化瘀通络之功,与DKD病机相符,临床应用取得良好疗效[9]。然而,JPGS治疗DKD的作用机制仍需进一步研究明确。本研究首先运用高脂饮食(HFD)联合链脲佐菌素(STZ)诱导DKD小鼠模型,评估JPGS对DKD小鼠的治疗作用。然后,运用实时荧光定量聚合酶链反应(RT-qPCR)及蛋白免疫印迹(Western Blot)法检测上皮间质转化(EMT)相关因子表达情况,评估JPGS对EMT的影响。最后,采用Western Blot法检测去乙酰化酶1(SIRT1)/转化生长因子-β1(TGF-β1)/Smad通路相关蛋白表达,评估JPGS对该通路的影响。
1 材料 1.1 动物SFP级健康雄性C57BL/6小鼠,购自北京华阜康生物科技股份有限公司[动物许可证号:SCXK(京)2019-0008],体质量(22±2)g。饲养环境:12/12 h明暗循环,温度25 ℃,湿度50%,食物和水均可自由获取。
1.2 药品与试剂SRT1720购自MedChemExpress(货号:HY-10532,);JPGS由沧州中西医结合医院药剂科配制,所用中药材均采购自河北省安国中药材专业市场;自南京建成生物工程研究所购买二喹啉甲酸(BCA)试剂盒(货号:W041-1-1)、尿素氮(BUN)试剂盒(货号:C013-2-1)、Masson染液(货号:D026-1-3)、肌酐(Cr)试剂盒(货号:C011-2-1)、苏木素-伊红(HE)染液(货号:D006-1-4)、尿蛋白定量(UPQ)试剂盒(货号:C035-2-1);自Cell Signaling Technology购买一抗:β-肌动蛋白(β-actin,货号:3700)、α-平滑肌肌动蛋白(α-SMA,货号:69319)、E-钙黏蛋白(E-cad,货号:14472)、转化生长因子-β(TGF-β,货号:3711)、波形蛋白(VIM,货号:3932);自Abcam购买一抗:SIRT1(货号:ab189494)、紧密连接蛋白-1(ZO-1,货号:ab307799)、Smad2(货号:ab33875)、磷酸化Smad2(P-Smad2,货号:ab280888)、Smad3(货号:ab208182)、磷酸化Smad3(P-Smad3货号:ab52903);自北京索莱宝科技有限公司购买羊抗兔免疫球蛋白G(IgG)-辣根过氧化物酶(HRP)二抗(货号:SE134);自天根生化科技(北京)有限公司购买总RNA提取试剂盒(货号:#DP419)、cDNA反转录试剂盒(货号:#KR116-02)、SYBR扩增试剂盒(货号:#P205-02)。
1.3 仪器全自动酶标仪(货号:STSTFAX2011,Awareness Technology,美国);PowerPac Basic电泳仪、ChemiDoc XRS凝胶成像自动分析仪(Bio-Rad,美国);高速冷冻离心机(湖南可成);荧光定量PCR仪(北京乐普)。
2 方法 2.1 造模、分组与给药采用HFD联合STZ建立DKD小鼠模型。具体方法为:64只小鼠适应性喂养1周后,随机选取10只作为正常组(C)继续以常规饲料喂养,剩余54只采用HFD喂养,持续8周。禁食、不禁水12 h后,54只小鼠腹腔注射30 mg/kg的STZ,C腹腔注射等体积的1%柠檬酸钠缓冲液。3 d后尾静脉采血测定随机血糖,随机血糖≥16.7 mmol/L提示2型糖尿病模型建立成功。54只小鼠中有4只小鼠未达到2型糖尿病模型标准,故剔除,2型糖尿病模型成功率为92.6%。继续喂养,每周检测小鼠24 h尿蛋白定量(24 h-UPQ)。随机血糖≥16.7 mmol/L且24 h-UPQ≥20 mg提示DKD模型建立成功。2型糖尿病造模成功后继续喂养2周,剩余50只小鼠均符合DKD模型标准。
造模结束后,除C外,DKD造模成功的50只小鼠随机平均分为模型组(M)、SIRT1激动剂组(S)、低剂量JPGS组(JL)、中剂量JPGS组(JM)、高剂量JPGS组(JH)。
C与M每日灌胃200 μL生理盐水,S每日灌胃50 mg/kg的SRT1720,JL、JM、JH每日分别灌胃2.4、4.8、9.6 g/kg的JPGS。JPGS剂量根据人与动物体表面积折算的等效剂量比值计算得出,将中剂量设置为人的等效剂量。药物干预时间持续8周,之后收集各组小鼠24 h尿液样本、血液样本。处死后收集左侧肾脏并用4%多聚甲醛固定,收集右侧肾脏冷冻保存。
2.2 肾功能指标分析24 h尿液样本在4 ℃条件下4 000 r/min离心10 min(离心半径10 cm),取上清液,根据24 h-UPQ试剂盒说明书测定各组小鼠24 h-UPQ水平。血液样本在4 ℃条件下3 000 r/min离心15 min(离心半径10 cm),收集血清,根据Cr与BUN试剂盒说明书检测各组小鼠Cr与BUN水平。
2.3 病理学染色将固定好的肾脏组织脱水、包埋,制备4 μm的石蜡切片,HE与Masson染色后,在显微镜下观察肾脏组织病理形态与纤维化情况,并用相机拍摄病理图片。
2.4 RT-qPCR分析按照总RNA提取试剂盒的标准操作流程,从肾组织中提取总RNA。根据反转录试剂盒说明书反转录获得cDNA。使用荧光定量聚合酶链反应(qPCR)法测定目的基因的mRNA表达量。目标mRNA相对于β-actin的表达量基于2-ΔΔCT法进行计算。引物序列见表 1。
提取肾组织样本的总蛋白,使用BCA试剂盒测定其浓度,后使用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离肾组织总蛋白,并将其转移到PVDF膜。为减少非特异性结合,使用5%脱脂奶粉溶液对PVDF膜进行封闭处理1 h,随后用目的蛋白抗体4 ℃孵育12 h以上,以确保抗体与目标蛋白充分结合。多次清洗后用HRP标记的二抗在室温下孵育1 h,完成孵育后对膜进行多次清洗,以去除多余试剂与未结合抗体。清洗后采用电化学发光法(ECL)显影技术对膜上的蛋白条带进行可视化处理,并通过Image J软件对结果进行定量分析。
2.6 统计学分析采用SPSS Pro在线数据分析平台进行统计分析。所有数据均以均数±标准差(x±s)表示。采用Shapiro-Wilk检验评估数据分布的正态性。组间比较采用Student’s非配对t检验及单因素或双因素方差分析(使用Tukey’s和Bonferroni’s post-hoc检验进行多重比较)。组间方差不相等时,应用Welch校正。P<0.05为差异有统计学意义。
3 结果 3.1 JPGS对DKD小鼠的治疗作用肾功能检测结果显示,与C比较,DKD小鼠血清中Cr、BUN水平及24 h-UPQ水平升高;SRT1720与JPGS干预后,DKD小鼠血清中Cr、BUN及24 h-UPQ水平降低(图 1a、1b、1c)。HE、Masson染色结果显示,与C比较,DKD小鼠肾小管结构损伤、肾小球肥大增生、肾间质出现纤维样病变,而SRT1720与不同剂量的JPGS干预后,DKD小鼠肾脏病理损伤出现不同程度改善(图 1d、1e)。
|
| 注:a,Cr(x±s);b,BUN(x±s);c,24 h-UPQ(x±s);d,HE染色;e,Masson染色。与C比较,*P<0.01;与M比较,#P<0.05,##P<0.01。 图 1 JPGS对DKD小鼠的治疗作用(n=10) |
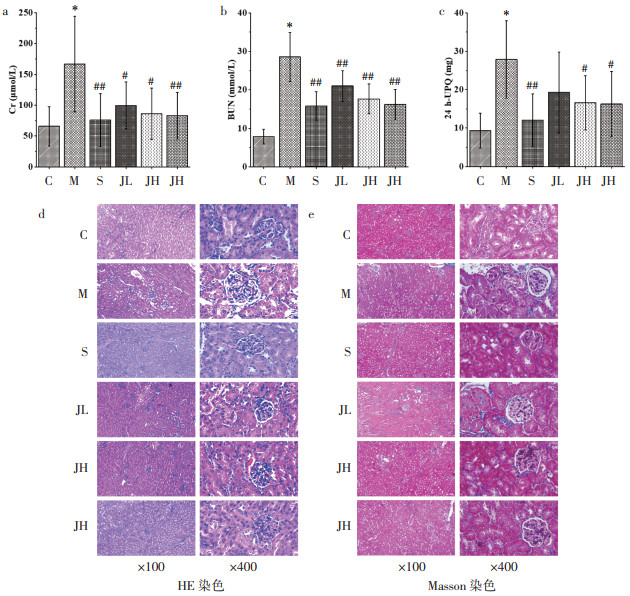
RT-qPCR与Western Blot检测结果显示,与C比较,DKD小鼠肾组织E-cad、ZO-1基因与蛋白表达降低,VIM与α-SMA基因与蛋白表达升高;SRT1720与JPGS干预后,DKD小鼠的上述基因与蛋白表达水平得到改善。见图 2。
|
| 注:a,RT-qPCR结果(x±s);b,Western Blot条带图;c,Western Blot量化结果(x±s)。与C比较,*P<0.01;与M比较,#P<0.05,##P<0.01。 图 2 JPGS对DKD小鼠EMT的影响(n=3) |
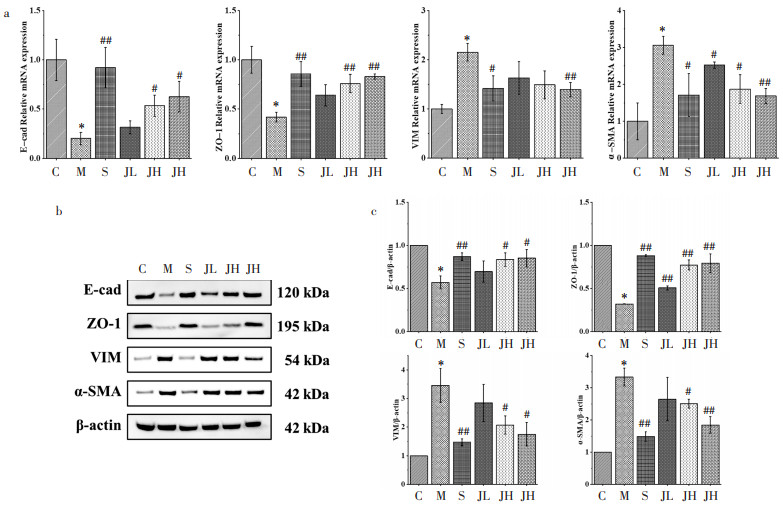
Western Blot检测结果显示,与C比较,DKD小鼠肾组织中SIRT1表达降低,TGF-β1、P-Smad2/Smad2、P-Smad3/Smad3升高;SRT1720与JPGS干预不同程度地逆转了上述指标。见图 3。
|
| 注:a,Western Blot条带图;b,Western Blot量化结果(x±s)。与C比较,*P<0.01;与M比较,#P<0.05,##P<0.01。 图 3 JPGS对DKD小鼠SIRT1/TGF-β1/Smad通路的影响(n=3) |
DKD多归属于中医“下消”范畴,也可以根据临床症状将其归为“水肿”“尿浊”“关格”等。本病病位在脾、肾。《诸病源候论》曰:“水病无不由脾肾虚所为……周身肿满。”脾虚不能输布水谷精微,水湿内停;肾虚而开阖不利,水液泛滥肌肤,封藏失司,固摄无权,精微下泄,从而形成水肿、蛋白尿。国医大师邹燕勤教授认为,DKD的核心病机以脾肾亏虚为本,湿瘀阻络为标,强调DKD的发生、发展与脾、肾关系最为密切,湿、瘀贯穿病程始终[10]。国医大师吕仁和教授提出“微型症瘕”病理学说,认为热、湿、痰、瘀等病理产物出现并相互胶结沉积于肾脏,阻于肾络,形成“微型症瘕”,而“微型症瘕”可以类比于细胞外基质沉积,导致肾纤维化,从而使肾脏的固摄封藏功能出现障碍,精微漏出[11]。黄文政教授认为DKD病程较长,患者精气虚耗、精微亏虚,则血流不充,气虚而无力推动血液循环,容易形成瘀血[12]。南征教授常从脾肾阳虚兼瘀毒论治DKD,认为消渴病阴虚日久,阴损及阳,脾肾阳虚,致脾不化湿,肾不化气,痰湿内停,久则血脉瘀阻,毒邪内生,毒损肾络[13]。可见,“脾肾亏虚,瘀血阻滞”是DKD的核心病机。基于此,课题组根据名老中医经验创制健脾固肾化瘀方,广泛应用于临床,疗效显著[14]。多项临床研究表明,该药可以明显改善DKD患者中医症状评分,降低尿蛋白,改善肾功能,延缓DKD进展[15]。
DKD患者的死亡风险较未合并肾病的糖尿病患者显著增加,严重危害患者的生命健康与生活质量。肾小球系膜扩张、基底膜增厚、肾小管间质纤维化是DKD的主要病理变化[16]。HFD联合STZ注射诱导是一种经典的DKD模型建立方法,因其能够有效地模拟DKD患者症状已经被广泛用于DKD的基础研究[17]。在HFD诱导小鼠产生胰岛素抵抗后,对小鼠注射STZ,使其胰腺β细胞受损而坏死,进而引起肾脏损伤,模拟DKD的病理过程[17]。24 h-UPQ、Cr、BUN是评估肾脏滤过功能的重要指标,当其升高时,意味肾脏滤过功能严重减退[18-19]。在本研究中,DKD小鼠的肾脏病变显著,上述指标均出现异常升高,进一步证实了DKD模型建立成功。JPGS治疗后上述症状得到不同程度改善,且高剂量JPGS干预与SRT1720干预效果相近,提示JPGS是治疗DKD的潜在药物。此外,DKD小鼠肾脏表现出纤维化特征,所以本研究还就JPGS对EMT的影响进行了评估。
EMT促进DKD进程已经被广泛证实[20]。本研究通过检测EMT相关因子(E-cad、ZO-1、VIM、α-SMA)表达以评估JPGS对DKD小鼠EMT的影响。肾纤维化是DKD后期的特征性病理改变,主要表现为细胞外基质沉积、肌成纤维细胞激活、促炎因子分泌增加、炎性细胞浸润[21]。在EMT过程中,上皮细胞逐渐向间质细胞转化。E-cad、ZO-1是上皮细胞的主要标记物,在此过程中表达逐渐减少;VIM、α-SMA是间质细胞的主要标记物,在此过程中表达逐渐增加[22]。本研究发现,JPGS可以上调E-cad、ZO-1表达,下调VIM、α-SMA表达,提示JPGS可以有效促进上皮细胞分化,抑制间质细胞分化,发挥抑制EMT的作用。有研究表明,黄芪的主要活性成分黄芪甲苷可以有效抑制EMT发生[23]。丹参的主要活性成分丹酚酸A、丹酚酸B及隐丹参酮均被证实对EMT具有显著的抑制作用[24-25]。这些有效成分的抗EMT作用可能是JPGS抑制DKD过程中EMT发展的重要靶点,而探究JPGS中其他成分的抗EMT作用及其在抑制EMT过程中的作用机制将是未来的研究重点。
有研究发现,SIRT1/TGF-β1/Smad通路在调控EMT过程中发挥重要作用[26]。因此,本研究检测了SIRT1/TGF-β1/Smad通路相关因子(SIRT1、TGF-β1、P-Smad2/Smad2、P-Smad3/Smad3)表达以研究JPGS对此通路的影响。SIRT1作为组蛋白去乙酰化酶在机体代谢平衡及稳态调节中发挥重要作用[27]。有研究表明,SIRT1是TGF-β/Smad信号转导的关键调节因子,上调SIRT1可以减轻TGF-β1诱导的EMT与纤维化[28]。TGF-β1被证明是EMT最有效的诱导剂,其通过Smad信号通路导致细胞外基质沉积、肌成纤维细胞激活、促炎因子分泌,最终造成纤维化。Smad2和Smad3是TGF-β1最为重要的下游介质[29]。高糖条件促进了TGF-β1活化[30],进而促进Smad2、Smad3磷酸化,使其转入细胞核以促进纤维化相关基因转录,最终导致肾纤维化[31]。本研究发现,JPGS可以上调SIRT1表达,下调TGF-β1、P-Smad2/Smad2、P-Smad3/Smad3水平,提示JPGS可以通过SIRT1/TGF-β1/Smad通路抑制EMT从而缓解DKD肾损伤。此外,本研究采用SRT1720作为阳性对照,结果表明,JPGS发挥了与SRT1720相近的作用。有研究表明,丹酚酸A、白术内酯Ⅲ可以激活SIRT1[32-33],川芎嗪、隐丹参酮可以抑制TGF-β1/Smad信号通路激活[34-35]。这些有效成分对SIRT1的激活以及对TGF-β1/Smad的抑制可能是JPGS调节SIRT1/TGF-β1/Smad通路的关键,而探索其他成分对该通路的影响将是进一步深入研究JPGS治疗DKD机制的关键。
综上所述,JPGS可以抑制SIRT1/TGF-β1/Smad通路介导的EMT,从而缓解DKD肾损伤。
| [1] |
QI C Y, MAO X, ZHANG Z G, et al. Classification and differential diagnosis of diabetic nephropathy[J]. Journal of Diabetes Research, 2017, 201(17): 8637-8648. |
| [2] |
GROSS J L, DE AZEVEDO M J, SILVEIRO S P, et al. Diabetic nephropathy: diagnosis, prevention, and treatment[J]. Diabetes Care, 2005, 28(1): 164-176. DOI:10.2337/diacare.28.1.164 |
| [3] |
MUTHUBHARATHI B C, GOWRIPRIYA T, BALAMURU-GAN K. Metabolomics: small molecules that matter more[J]. Molecular Omics, 2021, 17(2): 210-229. DOI:10.1039/D0MO00176G |
| [4] |
NIE Q X, CHEN H H, HU J L, et al. Dietary compounds and traditional Chinese medicine ameliorate type 2 diabetes by modulating gut microbiota[J]. Critical Reviews in Food Science and Nutrition, 2019, 59(6): 848-863. DOI:10.1080/10408398.2018.1536646 |
| [5] |
杨柳, 马伟, 王业秋, 等. 补阳还五汤对糖尿病肾病大鼠肾脏氧化应激及NF-κB通路的影响[J]. 国际中医中药杂志, 2022, 44(9): 1012-1016. |
| [6] |
王永军, 石良静, 范正超, 等. 益气养阴通络方对糖尿病肾病患者肾功能的影响[J]. 中国处方药, 2018, 16(4): 99-100. |
| [7] |
吴冰杰, 孟元, 张涛静, 等. 益气固肾通络方治疗早期糖尿病肾脏病临床观察及机制研究[J]. 北京中医药, 2020, 39(5): 431-435. |
| [8] |
蔡旭东, 伍云洲. 肾衰宁胶囊对糖尿病肾病慢性肾衰竭微炎症状态的影响[J]. 中国中西医结合肾病杂志, 2018, 19(8): 686-688. |
| [9] |
贾彩霞, 吕树泉. 健脾固肾化瘀组方治疗临床期脾肾两虚夹瘀型糖尿病肾病疗效观察[J]. 现代中西医结合杂志, 2020, 29(17): 1851-1855. |
| [10] |
严倩华, 邹燕勤. 国医大师邹燕勤教授从脾肾论治糖尿病肾病[J]. 南京中医药大学学报, 2018, 34(2): 109-111. |
| [11] |
王耀献, 刘尚建, 付天昊, 等. 肾络微型症瘕探微[J]. 中医杂志, 2006, 47(4): 247-249. |
| [12] |
尹绍峰, 田虎, 林燕, 等. 黄文政治疗糖尿病性肾病经验[J]. 辽宁中医杂志, 2007, 34(10): 1366. |
| [13] |
杨虎虎, 何泽, 南征. 从"瘀毒"论治消渴肾病机制探析[J]. 中医药学报, 2024, 52(2): 48-52. |
| [14] |
苏秀海, 孙文娟, 姚彬, 等. 健脾固肾化瘀方治疗脾肾两虚夹瘀型糖尿病肾脏病的疗效及对相关生物标志物的影响[J]. 天津中医药, 2024, 41(5): 565-570. |
| [15] |
陈晓婷, 潘保朝, 张辉, 等. 健脾固肾化瘀汤对糖尿病肾脏病大鼠肾脏保护及IGF-1 mRNA、MCp-1 mRNA和Nephrin mRNA表达的影响[J]. 河北中医药学报, 2022, 37(6): 1-6, 10. |
| [16] |
LI K X, JI M J, SUN H J. An updated pharmacological insight of resveratrol in the treatment of diabetic nephropathy[J]. Gene, 2021, 780(12): 1455-1463. |
| [17] |
GLASTRAS S J, CHEN H, TEH R, et al. Mouse models of diabetes, obesity and related kidney disease[J]. PLoS One, 2016, 11(8): 162-169. |
| [18] |
AZARKISH F, HASHEMI K, TALEBI A, et al. Effect of the administration of Solanum nigrum fruit on prevention of diabetic nephropathy in Streptozotocin-induced diabetic rats[J]. Pharmacognosy Research, 2017, 9(4): 325-332. DOI:10.4103/pr.pr_47_17 |
| [19] |
ZHAO J, AI J, MO C, et al. Comparative efficacy of seven Chinese patent medicines for early diabetic kidney disease: a Bayesian network meta-analysis[J]. Complementary Therapies in Medicine, 2022, 67(3): 102-113. |
| [20] |
XU Y, OUYANG C H, LYU D Y, et al. Diabetic nephropathy execrates epithelial-to-mesenchymal transition(EMT) via miR-2467-3p/Twist1 pathway[J]. Biomedecine & Pharmacotherapie, 2020, 125(12): 109-120. |
| [21] |
宁小娅, 丁涵露. 糖尿病肾病肾小管上皮细胞上皮-间充质转化的机制研究进展[J]. 实用医院临床杂志, 2023, 20(4): 177-181. |
| [22] |
LAMOUILLE S, XU J, DERYNCK R. Molecular mechanisms of epithelial-mesenchymal transition[J]. Nature Reviews Mole- cular Cell Biology, 2014, 15(3): 178-196. DOI:10.1038/nrm3758 |
| [23] |
韩佳, 徐昌君, 黄霂晗, 等. 黄芪甲苷和黄芪总皂苷对特发性肺纤维化小鼠治疗作用的对比研究[J]. 辽宁中医杂志, 2019, 46(10): 2198-2201, 2242. |
| [24] |
李金莲, 张海静, 高云航, 等. 丹参有效成分对TGF-β1诱导的肺上皮细胞间质转化的影响[J]. 中国实验方剂学杂志, 2020, 26(5): 54-59. |
| [25] |
张人子, 李晟, 王导新. 隐丹参酮减轻LPS诱导的ARDS小鼠早期肺纤维化及机制研究[J]. 陆军军医大学学报, 2022, 44(18): 1819-1825, 1834. |
| [26] |
SONG L, CHEN T Y, ZHAO X J, et al. Pterostilbene prevents hepatocyte epithelial-mesenchymal transition in fructose-induced liver fibrosis through suppressing miR-34a/Sirt1/p53 and TGF-β1/Smads signalling[J]. British Journal of Pharmacology, 2019, 176(11): 1619-1634. DOI:10.1111/bph.14573 |
| [27] |
CHEN B, ZANG W W, WANG J, et al. The chemical biology of sirtuins[J]. Chemical Society Reviews, 2015, 44(15): 5246-5264. DOI:10.1039/C4CS00373J |
| [28] |
MA J Q, SUN Y Z, MING Q L, et al. Ampelopsin attenuates carbon tetrachloride-induced mouse liver fibrosis and hepatic stellate cell activation associated with the SIRT1/TGF-β1/Smad3 and autophagy pathway[J]. International Immuno- pharmacology, 2019, 77(8): 105-118. |
| [29] |
YAO Y, CHEN R, WANG G W, et al. Exosomes derived from mesenchymal stem cells reverse EMT via TGF-β1/Smad pathway and promote repair of damaged endometrium[J]. Stem Cell Research & Therapy, 2019, 10(1): 225. |
| [30] |
MENG X M, TANG P M K, LI J, et al. TGF-β/Smad signaling in renal fibrosis[J]. Frontiers in Physiology, 2015, 6(2): 82-92. |
| [31] |
QI C Y, HU Y, ZENG M Y, et al. Verteporfin inhibits the dedifferentiation of tubular epithelial cells via TGF-β1/Smad pathway but induces podocyte loss in diabetic nephropathy[J]. Life Sciences, 2022, 311(6): 121-136. |
| [32] |
LI S T, QIAN Q Y, YING N, et al. Activation of the AMPK-SIRT1 pathway contributes to protective effects of Salvianolic acid A against lipotoxicity in hepatocytes and NAFLD in mice[J]. Frontiers in Pharmacology, 2020, 11(9): 560-569. |
| [33] |
LI Q, TAN J X, HE Y, et al. Atractylenolide iii ameliorates Non-alcoholic fatty liver disease by activating hepatic adiponectin receptor 1-Mediated ampk pathway[J]. International Journal of Biological Sciences, 2022, 18(4): 1594-1611. DOI:10.7150/ijbs.68873 |
| [34] |
史雅旭, 戴曦, 王丽娇, 等. 川芎嗪调节TGF-β/Smad信号通路对哮喘小鼠气道炎症和气道重塑的影响[J]. 现代药物与临床, 2019, 34(1): 20-26. |
| [35] |
王重阳, 姜京植, 李俊峰, 等. 隐丹参酮通过TWEAK/Fn14和TGF-β1/Smads信号通路缓解OVA诱导哮喘小鼠气道炎症[J]. 中国药理学通报, 2019, 35(8): 1149-1154. |
 2024, Vol. 43
2024, Vol. 43