文章信息
- 和振杰, 时晓迟, 赵英强
- HE Zhenjie, SHI Xiaochi, ZHAO Yingqiang
- 基于虚、痰、瘀、毒理论浅析射血分数保留的心力衰竭炎症状态与中医药干预策略
- Inflammatory state of heart failure with preserved ejection fraction and intervention strategies of traditional Chinese medicine based on "deficiency, phlegm, blood stasis and toxin" theory
- 天津中医药大学学报, 2024, 43(7): 637-649
- Journal of Tianjin University of Traditional Chinese Medicine, 2024, 43(7): 637-649
- http://dx.doi.org/10.11656/j.issn.1673-9043.2024.07.11
-
文章历史
收稿日期: 2024-03-07
2. 天津中医药大学第二附属医院, 天津 300250
2. The Second Affiliated Hospital of Tianjin University of Traditional Chinese Medicine, Tianjin 300250, China
射血分数保留的心力衰竭(HFpEF)是一组临床综合征,其特征为有心力衰竭症状和体征、有心脏结构和(或)功能异常和(或)利钠肽(NPs)升高且左心室射血分数(LVEF)≥50%[1-2]。HFpEF是心力衰竭的主要类型之一,占全部心力衰竭的50%,具有较高的发病率和病死率,是严重的临床和公共卫生问题[3-8]。HFpEF是一组高度异质性的以左心室舒张功能受损为主的疾病[9],病因复杂多样,发病机制不同于传统的射血分数降低的心力衰竭(HFrEF)[10]。目前对HFpEF的发病机制尚缺乏明确阐释,认为HFpEF的发病机制更为复杂,包括血流动力学机制和细胞分子学机制等。由于目前对HFpEF的病因、病机、治疗、预后等尚缺乏充分认识[11],制约了HFpEF相关的有效治疗方案的临床应用[9, 12-14],使HFpEF成为心血管疾病领域中“最大的未得到满足的医疗需求”[15]。
1 炎症与HfpEF的关联性越来越多的研究认为HFpEF发展过程中的合并症(与原发疾病同时存在且相互独立的一种或多种疾病或临床状态),如超质量或肥胖、糖尿病、慢性阻塞性肺疾病和盐敏感性高血压病等均可诱发全身性促炎状态与氧化应激,致使冠状动脉微血管内皮炎症驱动心肌功能障碍与结构重塑、心肌细胞和间质纤维化、舒张功能障碍、心室重构等一系列事件发生,最终导致并推动HFpEF的进展与加重[16-20]。在HFpEF的发病过程中,上述合并症诱导的系统性促炎状态为心肌结构和功能改变的始动原因,同时心肌内的信号通路亦发生了特异性改变[16]。HFpEF的发病机制包括血流动力学机制和细胞分子机制。微血管炎症和内皮细胞炎症是HFpEF的关键分子机制,涉及环磷酸鸟苷(cGMP)-蛋白激酶G(PKG)、一氧化氮(NO)-cGMP-PKG、转化生长因子-β1(TGF-β1)/Smads、血管紧张素Ⅱ(AngⅡ)/TGF-β1/Smad2/3、白细胞介素-33(IL-33)/跨膜型ST2(ST2L)等信号通路。HFpEF相关的合并症通过其所致的微血管炎症和内皮活化,造成促炎细胞因子受到刺激释放如TGF-β1、肿瘤坏死因子-α(TNF-α)、白细胞介素-1(IL-1)、白细胞介素-6(IL-6)等炎性介质,引起全身系统性炎症激活活性氧(ROS),从而增加心脏内皮细胞中ROS的产生[21],导致NO生物利用度降低,激活NO-cGMP-PKG信号通路,降低邻近心肌细胞中cGMP的可用性,导致PKG低表达,抑制肌动蛋白磷酸化,还可以使环磷酸腺苷(cAMP)或蛋白激酶A(PKA)增加,细胞内钙离子(Ca2+)失衡,触发内皮细胞和心肌细胞功能障碍,导致心肌细胞异常僵硬与肥大[22],心肌顺应性降低,加速HFpEF进展。
心肌纤维化是一种在心肌损伤后以细胞外基质(ECM)过度沉积和胶原成分失衡为特征的病理过程[23-24],是心脏重构的核心病理改变,是HFpEF发生的重要原因和主要病理机制之一。研究表明,TGF-β1是心力衰竭过程中最重要的纤维性生长因子[25-27],是一种能够促进细胞增殖和分化的多效应细胞因子[28],引导成纤维细胞向成肌纤维细胞分化,还可以促进胶原蛋白合成,抑制胶原蛋白降解,促进心肌纤维化细胞分泌,造成ECM过度沉积,上调烟酰胺腺嘌呤核苷酸磷酸(NADPH)氧化酶的表达,刺激胶原合成和肌成纤维细胞分化[29],通过调节心肌成纤维细胞功能和ECM的代谢平衡,促进心肌纤维化及HFpEF的发生与进展[30]。TGF-β1主要通过与其受体结合后磷酸化并激活TGF-β1/Smads信号通路中、下游的主要效应分子Smads蛋白来调控相关基因表达,TGF-β1/Smads信号通路的激活可以促进成纤维细胞增殖和胶原合成,引起心肌纤维化及重塑[31-33],促进HFpEF发展。
AngⅡ作为心力衰竭的关键中介因子,通过与血管紧张素Ⅱ受体1(AT1R)结合,上调TGF-β1表达,进而诱导心肌细胞肥大与成纤维细胞增殖[34-35],导致心室壁重构[36]。ECM成分合成与降解代谢紊乱是心肌重构的主要原因[37]。基质金属蛋白酶-9(MMP-9)和基质金属蛋白酶抑制剂-1(TIMP-1)分别是心肌中最丰富的基质金属蛋白酶(MMPs)与基质金属蛋白酶组织抑制剂(TIMPs)。MMP-9主要通过降解Ⅰ型与Ⅳ型胶原、增加Ⅲ型胶原来破坏胶原网络结构,造成心肌细胞肥大、协同能力下降,从而导致心脏收缩功能下降、心室重构而表现为心力衰竭[38-39]。TIMP-1与MMP-9酶原或活化后酶的催化区羧基末端特异性结合,形成复合物,特异性抑制MMP-9活性,减轻ECM胶原降解,从而改善心力衰竭。MMPs和TIMPs之间的表达在维护ECM降解与重塑动态平衡中起关键作用[40]。MMP-9具有与血管紧张素转换酶(ACE)相似的结构位点,可以降解AngⅠ为AngⅡ。实验研究提示,MMP-9可以上调体内AngⅡ的表达水平,而AngⅡ上调可能通过促进内源性MMP-9的合成加剧MMP-9的致心室重构作用[41]。此外,MMP-9结合CD44可以释放储存的TGF-β1。
生长刺激表达基因2蛋白(ST2)属于IL-1受体家族,具有跨膜型ST2(ST2L)与可溶性亚型(sST2)两种异构体。sST2是一种机械诱导的心肌细胞蛋白,心肌细胞受到机械牵拉时被释放,血清sST2水平可以预测慢性心力衰竭患者的预后情况。ST2L的功能性配体IL-33是一种主要由心脏成纤维细胞合成的生物力学诱导蛋白。ROS与核转录因子-κB(NF-κB)之间存在正反馈调节,ROS的生成可以激活NF-κB,而NF-κB又可以促进ROS生成。NF-κB能够调节炎症反应和细胞凋亡等,在心肌肥厚的各个阶段均发挥重要作用。IL-33可以抑制AngⅡ或去氧肾上腺素生成ROS,使NF-κB活性降低导致凋亡因子表达下调、抗炎因子表达增加,进而减轻心肌肥厚程度。ST2L与配体IL-33结合成IL-33/ST2L信号通路是一个机械激活的、具有心肌保护的成纤维细胞-心肌细胞旁分泌系统,起到抑制心肌肥厚及纤维化、拮抗心肌重构作用[42-43]。半乳糖凝集素3(Gal-3)是一种炎性信号分子,可以诱导成纤维细胞增殖、Ⅰ型胶原沉积,在炎症和纤维化过程中发挥关键作用。实验研究证实,Gal-3的药理抑制能够减少肌成纤维细胞数量,延缓心肌纤维化,延缓小鼠、大鼠心力衰竭模型中心脏重构进展[44]。研究显示,在老年HFpEF患者中Gal-3的表达与脑钠肽(BNP)呈正相关,两者联合检测可以优化HFpEF诊断的准确性并评估预后[45]。
2 虚、痰、瘀、毒与HFpEF炎症状态HFpEF的主症以胸闷憋气、活动后加重为主,严重时可伴有下肢水肿,属中医“胸痹”“心水”“支饮”“水肿”范畴[46]。HFpEF总属本虚标实,本虚主要有气虚、阴虚及阳虚[47-48]。HFpEF的发生多因久患胸痹、真心痛或合并病,如糖尿病、高血压病等,日久不复,引起气虚、阴虚及阳虚。HFpEF多发于中老年人,《黄帝内经》云:“年四十而阴气自半。”且治疗过程多施利水之剂,伤阴耗液。阴虚生内热,伤津耗液,煎熬血液则成瘀,热炼阴液则为痰,而痰热灼阴,亦致阴虚日重,故阴虚亦可见血瘀、痰浊、热蕴之证。“心生血”,阴血为物质基础,心气亏虚,无以奉心化赤,则新血难生,脏腑失荣。心气内虚,血行无力,瘀滞在心,而气虚甚则阳虚,心之阳气亏虚,心失温煦致血脉不通,内而气血郁阻,则见气滞、寒凝。研究显示,HFpEF以肺脏瘀血为主,本虚以气虚、阴虚为主,标实主要以痰饮、血瘀为主[49]。现代研究表明,心肌细胞能量代谢的主要部位是线粒体,在生理或病理应激反应过程中,线粒体自噬可以维持健康线粒体体系,从而调节心肌能量代谢,若超过线粒体自噬阈值,其功能受损导致能量代谢紊乱,心肌损伤,进而造成心功能障碍、心室重构[50]。中医所述之气与西医讲的能量具有高度相似性,气虚与能量代谢关系密切,气虚贯穿心力衰竭发病始终,心气虚能够导致以能量为主导的物质代谢障碍,使机体免疫调节功能失常,导致心血管区域免疫炎症微环境紊乱,引发持续性炎症免疫反应,凝聚成痰久郁成“痰毒”,气虚不运或加之痰浊壅塞而血脉不畅,瘀血沉积,形成“瘀毒”,即所谓“气虚生毒”,使心肌能量代谢失代偿,心肌进行性重构,从而加速HFpEF进程[51-52]。线粒体是心肌细胞能量产生的主要场所,研究显示,通过调节线粒体自噬水平介导心肌细胞能量代谢,可以恢复心肌细胞的能量需求和供给间“平衡”,从而改善心脏功能[53]。心脏是高能量消耗器官,通过不断产生ATP完成心肌收缩与舒张。心肌能量消耗(MEE)与LVEF独立相关,心肌能量代谢相关研究结果显示,血瘀水停证HFpEF患者心肌能量消耗最大[54]。实验研究显示,通过增加心力衰竭大鼠心肌线粒体肌酸激酶(mit-CK)mRNA及蛋白表达,改善ATP转运穿梭效率,可以使细胞内能量流增加,改善慢性心力衰竭心肌能量代谢[55]。
痰、瘀、毒在HFpEF疾病进程中发挥重要作用,是炎症状态的关键病理因素。痰饮是津液异常代谢形成的病理产物,是炎症细胞、炎症因子等一系列异常蓄积的致炎物质。在生理状态下,致炎物质处于正常水平,发挥调控炎症和免疫的作用;在病理状态下行于脉中,激活、促进局部血管炎症反应,造成经脉持续性、渐进性损伤[56-57]。脾虚气血化源不足,心气亏虚,心脉搏动乏力,无力运血;脾虚失运,聚湿生痰,痰浊阻遏气机,气血不畅成瘀,瘀滞于脉内、脉外,均可影响及心,致痰瘀互结,心脉痹阻。痰浊属实邪,会使血液黏稠度、凝固性增加,心肌胶原纤维增加,ECM过度沉积,血小板凝聚性增加[58],导致气血不畅,瘀滞于内则影响脏腑功能。脏腑气化功能失调,津液代谢失调,又可以导致痰饮形成。久病则脾肾阳虚,水液运化失司,水湿内阻,瘀水交结,化而为毒,痹阻心脉。彭菊琴等[59]对170例HFpEF患者进行研究,显示HFpEF与心、脾关系最为密切,HFpEF的基本病机特点为因虚致实、虚实夹杂,大部分无明显阴阳偏胜,病性证素主要为气虚证,其次为水停证、血瘀证、痰浊证。汪磊等[60]基于“心脾相关理论”以健脾益气温阳、活血化痰利水为法,拟调脾护心方治疗慢性心力衰竭(气虚血瘀兼痰饮证),发现其可以抑制促炎因子表达,改善心室重构。
《金匮要略心典》云:“毒者,邪气蕴蓄不解之谓也。”邪气久积蕴结不解则为毒邪,有内毒、外毒之分,六淫久积蕴结不解则为外毒。若邪毒内犯,脏腑功能受损,则会导致津液代谢障碍成痰,或毒邪久郁亦可炼津生痰。同时,毒邪亦可致瘀,毒邪损伤脉络,血不循脉道而为瘀,或毒邪伤及气机,气滞则血瘀。正如《温热论》云:“温邪上受,首先犯肺,逆传心包。”而心力衰竭本虚,常因外感诱发或加重。心气内虚,复感六淫、疫毒之邪,趁虚内犯于心,心气虚无以驱邪外出,日久心体受损,心气愈虚不复,加之外邪首犯肺卫,肺主治节失司,则进一步加重心血瘀阻,而致脏腑失养,水津外泄;各种致病因素导致脏腑功能减退,气化失常,机体产生的各种代谢物质难以排出体外,积聚于内日久郁积化成痰毒、瘀毒、水毒等内生之毒,痰瘀蕴久,可化热毒。正如《素问·痹论》云“风寒湿三气杂至,合而为痹”“脉痹不已,复感于邪,内舍于心”“心痹者,脉不通,烦则心下鼓,暴上气而喘”。有研究认为,内、外毒邪为慢性心力衰竭发病的主要原因,内毒主要包括促炎细胞因子,如IL-1、IL-6、TNF-α、Gal-3等,根据其疾病特征主要为瘀毒、热毒、水毒交结或单独存在,针对病机对应采用清热解毒法治热毒、活血化瘀法治瘀毒、化气利水法治水毒[61-62]。可见,心力衰竭致病毒邪有内外之分,多为内外合邪发病。痰、瘀为机体内生病邪,邪伏日久郁积化成痰毒、瘀毒等,其性暴戾,若病发则易损伤脉络,损脏伤形,多病势危重,发为慢性心力衰竭急性加重期[63-65]。研究显示,“痰瘀毒”与“炎症反应”联系紧密[66]。袁天慧等[67]根据“心血管事件链”发病规律,研究发现高血压病、动脉粥样硬化及冠状动脉粥样硬化性心脏病、糖尿病性心脏病及病毒性心肌炎等慢性心力衰竭基础疾病均与“毒邪”关系密切,认为慢性心力衰竭的发生、发展均有“毒邪”存在。柳金英等[68]从炎性反应角度探讨心力衰竭的病因病机,指出心力衰竭的病机为本虚标实,以气(阳)虚为本,血瘀毒热为标,主要病机是内生毒热损心,认为“清热解毒”在心力衰竭的治疗中具有重要意义。杜金辉等[69]认为瘀热日久成毒是慢性心力衰竭久治不愈、病情缠绵的重要原因和特征。
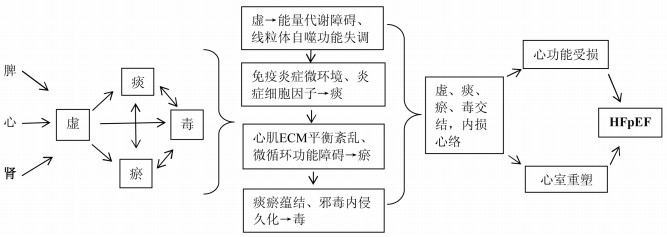
HFpEF发病过程中虚、痰、瘀、毒相互交结,且相互影响,随着病程日久,则可因正气虚损,心体失养,虚气留滞,痰瘀毒互结,痰瘀毒阻滞心络,病理产物积聚,造成炎症因子持续升高,症积由生,深伏浮络、孙络,导致毒损心络、心功能受损,进而导致心肌重塑、心室重构而成“络积”[70]。见图 1。
|
| 图 1 HFpEF“虚、痰、瘀、毒”病机演变规律示意图 |
就HFpEF发病过程而言,疾病的基本病机为本虚标实、虚实夹杂,中医药防治应扶正兼顾祛邪。目前,相关研究认为中医药治疗以益气温阳、化痰祛瘀、清热解毒等为主,研究主要集中于动物实验,检测指标包括氨基末端脑钠肽前体(NT-proBNP)、TGF-β1、Smads、sST2、Gal-3、TNF-α、IL-6、MMP-9、超声心动图、心肌组织病理等,干预机制多为通过抑制炎症反应,调节糖脂代谢,涉及NO-cGMP-PKG、TGF-β1/Smads及IL-33/ST2L等心血管相关信号通路[71-108]。见表 1。
NO-cGMP-PKG信号通路在心脏保护过程中发挥关键作用[71],特别是在心肌PKG活性降低的HFpEF患者中,NO-cGMP-PKG通路受到抑制,心肌被动舒张张力增加,导致心肌肥厚及僵硬,引起舒张功能障碍。芪参益气滴丸由黄芪、丹参、三七、降香组成,具有益气通脉、活血止痛的功效。实验研究显示,芪参益气滴丸可以通过抑制HFpEF小鼠的微血管内皮炎症并激活NO-cGMP-PKG通路,使TNF-α、单核细胞趋化蛋白-1(MCP-1)、NF-κB、核苷酸结合寡聚化结构域样受体蛋白3(NLRP3)炎症因子水平明显降低,减轻微血管内皮炎症,显著减弱小鼠的向心性心脏重构,同时改善舒张功能和左心室顺应性[72-73]。网络药理学研究显示,芪参益气滴丸能够参与多个靶点、多条通路发挥治疗作用,通过调控炎性反应、氧化应激激活cGMP-PKG信号通路,改善心肌顺应性[74]。另有研究结果显示,芪参益气滴丸联合尼可地尔能够显著降低经皮冠状动脉介入治疗(PCI)术后HFpEF患者的NT-proBNP、超敏C反应蛋白(hs-CRP)、同型半胱氨酸(Hcy)、胱抑素C(CysC),且效果优于对照组(P<0.05),提示芪参益气滴丸可以改善左心室舒张功能,抑制心脏重构,改善患者临床症状,提高其生活质量,减少主要心脏不良事件(MACE)总发生率[75]。芪苈强心胶囊具有益气温阳、活血化瘀作用,具有抑制心肌炎症反应、改善内皮功能、抑制心肌纤维化等功能,从而改善HFpEF患者的心脏舒张功能、临床症状,提高生活质量[76-77]。HFpEF大鼠实验证实,芪苈强心胶囊可以通过调控cGMP-PKG信号通路相关基因,调节炎症水平,增强内皮功能,从而抑制HFpEF中的心肌肥大、心肌纤维化,改善心室重构[78]。顺心汤可以增加心肌细胞cGMP-PKG信号通路中钠尿肽受体A(NPRA)、鸟苷酸环化酶(GC)、内皮型一氧化氮合酶(eNOS)的表达,上调cGMP表达,降低磷酸二酯酶5A(PDE5A)表达,减少cGMP降解,逆转HFpEF大鼠心肌肥厚,从而改善HFpEF大鼠的心脏舒张功能,改善心肌顺应性[79]。
《金匮要略·痰饮咳嗽病脉证并治》云:“夫短气有微饮,当从小便去之,苓桂术甘汤主之。”由苓桂术甘汤基于气化学说化裁而来的苓桂气化方,具有调畅三焦、助阳化气功效,能够治疗HFpEF大鼠,通过降低炎性因子、改善糖脂代谢及内皮功能,改善心脏舒张功能,抑制心房结构性重构[80]。实验研究证实,苓桂气化方可以调控TGF-β1/Smads的关键靶点,阻断HFpEF大鼠TGF-β1/Smads信号通路,从而抑制信号转导及其下游纤维化相关基因的表达,发挥抗纤维化作用,显著抑制左心室结构性重构和舒张功能障碍[81]。苓桂气化方还可以调节TIMP-1 mRNA、MMP-9 mRNA表达,抑制AngⅡ mRNA、血管紧张素Ⅱ 1型受体(AT1)mRNA、TGF-β1 mRNA、Smad2/3 mRNA在HFpEF大鼠心肌组织的表达,从而通过调控TGF-β1/Smad2/3通路来抑制HFpEF的发展[82]。此外,苓桂气化方还能够显著下调miRNA21及Smad2与Smad3 mRNA表达及P-Smad2/3蛋白表达,上调Smad7 mRNA及其蛋白表达,进而调控TGF-β1/Smads信号通路,抑制心肌纤维化,减轻HFpEF大鼠的心室重塑和舒张功能障碍[83-84]。网络药理学研究显示,苓桂气化方能够通过多个靶点和信号通路(如脂质和动脉粥样硬化信号通路等)治疗HFpEF[85]。康达心口服液可以抑制HFpEF大鼠血清MMP-9、TNF-α、IL-6、TGF-β1,发挥对HFpEF大鼠心肌纤维化和舒张功能的保护作用,改善心室重塑[86]。实验研究显示,复方芪丹方可以调节AngⅡ/TGF-β1/Smad2/3信号通路,显著降低高血压病、糖尿病所致HFpEF大鼠心肌组织中AngⅡ、AT1R、TGF-β1、Smad2、Smad3、MMP-9 mRNA和蛋白表达量,升高TIMP-1 mRNA表达量,调节糖脂代谢,从而显著改善舒张功能、心室重塑,预防心肌纤维化与心肌肥厚[87-88]。
气虚、血瘀是HFpEF极为常见的证候要素。心气亏虚,推动无力,导致血脉瘀滞,郁久化毒犯心,伤及心阳,从而加重HFpEF。心衰合剂具有益气活血、泻肺利水功效,可以用于治疗HFpEF气虚血瘀、痰饮阻肺证,能够提高心脏泵功能,明显改善血流动力学状态,改善心排血量[89-90],降低HFpEF患者血清sST2、NT-proBNP水平,抑制心肌细胞外基质的增生及过度积聚,改善甚至逆转心肌纤维化进程[91],从而使心肌顺应性增加,心室室壁张力降低,改善心肌舒张功能,进而发挥心脏保护作用。有研究者认为“百病皆生于气”,HFpEF伴胰岛素抵抗(IR)的基本病机为阴阳失衡,致心气血阴阳不足,内生痰浊瘀血,痹阻心脉,为本虚标实之证,以气虚为本、血瘀为标,采用益气活血法拟加味参芪益心方治疗HFpEF-IR患者8周,结果显示观察组患者NT-proBNP、TNF-α、C反应蛋白(CRP)、内皮素-1(ET-1)、空腹血糖(FPG)、空腹胰岛素(FINS)、胰岛素抵抗指数(HOMA-IR)及三酰甘油与高密度脂蛋白比值(TG/HDL)、三酰甘油葡萄糖乘积指数(TYG)均低于对照组(P<0.05),6 min步行试验(6MWT)距离延长(P<0.05),NO水平高于对照组(P<0.05),提示加味参芪益心方能够减轻炎症,改善血管内皮功能,缓解HFpEF-IR患者临床症状[92]。防己黄芪汤加减治疗HFpEF心肺气虚证,结果显示观察组患者血清sST2和Gal-3水平低于对照组,症状评分、血清BNP水平低于对照组,6MWT高于对照组(P<0.01)[93]。有研究采用黄芪保心汤联合比索洛尔治疗HFpEF患者,结果显示BNP、CRP、sST2和Gal-3均显著降低,且观察组低于对照组(P<0.05)[94]。温阳益气活血汤可以通过温阳益气、化瘀活血,有效改善HFpEF患者机体氧化应激与心肌功能,抑制心肌重塑[95]。降浊通络颗粒治疗痰瘀互结型HFpEF,能够显著改善患者临床症状、心脏舒张功能及提高其生活质量[96]。细胞实验及网络药理学研究显示,芪参益心颗粒可能主要通过作用于TNF、AKT丝氨酸/苏氨酸激酶(AKT1)、IL-6、P53及激活子蛋白c-Jun(JUN)等靶点,调节磷脂酰肌醇3激酶(PI3K)/蛋白激酶B(Akt)、晚期糖基化终末产物(AGE)-糖基化终末产物受体(RAGE)等信号通路治疗HFpEF[97]。
张伯礼教授认为“阳微阴弦”是HFpEF的核心病机,心气(阳)虚为“阳微”,是HFpEF起病之始;“阴弦”是“阳微”所化生的湿、浊、痰、饮、瘀等阴邪,其治疗应以“祛阴邪以护阳气”为法[98]。魏小棋等[99]基于代谢组学和实验研究,认为鸡鸣散可以通过行气降浊、化湿通络,调节HFpEF小鼠相关代谢通路,恢复心脏能量代谢平衡,改善心肌纤维化,逆转心脏向心性肥厚。另有研究显示,加味鸡鸣散联合中药热奄包可以降低HFpEF患者炎性因子水平,改善心功能[100]。
3.2 单味中药及中药注射剂干预HFpEF炎症状态清热解毒类、益气活血祛瘀类中药或注射剂多具有降低炎性反应、降低血脂、抗氧化、清除自由基、保护内皮细胞功能、改善血液流变学等作用,可以干预HFpEF炎症状态,从而改善心肌纤维化、心功能,抑制心肌重塑。黄芪的主要活性成分黄芪甲苷可以通过抑制心肌炎症反应、改善心肌微血管功能、抑制心肌纤维化等多种途径改善HFpEF大鼠心功能[101]。网络药理学研究显示,黄芪、丹参中的槲皮素、山柰酚、木犀草素、丹参酮ⅡA等有效成分,通过作用于AKT1、丝裂原活化蛋白激酶(MAPK)、信号转导子和转录激活子3(STAT3)和JUN等靶点,调节AGE-RAGE、脂质和动脉粥样硬化等信号通路治疗HFpEF[102]。细胞实验研究显示,丹皮酚联合三七总皂苷通过抑制TGF-β/Smads信号通路的传导作用,发挥抑制AngⅡ诱导新生大鼠的心脏成纤维细胞(CFs)增殖,改善心室重构后的心肌纤维化和心肌肥大,呈现明显协同作用,且具有一定剂量依赖性[103]。网络药理学研究显示,党参通过作用于MAPK1、酪氨酸激酶C(SRC)、AKT1、MAPK3等靶点,作用于肿瘤、cGMP/PKG及内分泌抵抗等信号通路,抑制炎症反应,改善代谢,治疗HFpEF[104]。
心脉隆注射液具有益气活血、通阳利水作用,临床用于气阳两虚、瘀血内阻所致HFpEF,可以通过抑制氧化应激及炎症反应等多个途径与靶点有效地干预和治疗HFpEF[105]。参附注射液通过益气活血、回阳救逆,抑制心肌细胞炎症因子水平,减轻体内炎症反应而改善HFpEF患者心肌微循环,从而促进心功能恢复[106]。
3.3 运动康复干预HFpEF炎症状态西医在治疗HFpEF时越来越重视提高患者的生存质量,在多学科共同参与研究药物治疗的同时,又安排运动疗法以减缓或逆转心脏重构、提升运动耐力,达到促进心脏康复、提升生活质量的目的,使HFpEF患者获益。HFpEF的特点是运动耐量降低与组织充血[107],王骥等[108]研究显示,太极拳等运动疗法可以对HFpEF的危险因素如高血压病、糖尿病及高脂血症等产生积极影响,改善全身血管内皮细胞炎症与心功能,增加运动耐量,提高生活质量。
4 小结综上所述,HFpEF是多种心血管疾病进展至终末期阶段心力衰竭的主要临床类型,其发病率仍在持续上升,严重影响患者生活质量,再住院率、病死率极高。由于HFpEF的发病机制较其他类型心力衰竭更为复杂,故其临床表现呈现出高度异质性。近年来,除对HFpEF血流动力学的发病机制进行研究外,关于其细胞分子学的发病机制也在逐渐深入研究。研究表明,微血管炎症和内皮细胞炎症是HFpEF的关键分子机制。HFpEF合并症诱导系统性炎症状态,引起心脏免疫炎症微循环状态,致使细胞线粒体介导的心肌能量代谢障碍、线粒体自噬、心肌细胞凋亡等,引起代谢产物及炎症因子释放,出现氧化应激,导致细胞凋亡,刺激心肌成纤维细胞合成、心肌外基质降解沉积等,使心肌细胞僵硬、心肌细胞肥大、心肌纤维化,进而改变心肌结构与功能,引起心室重构,使得心力衰竭恶化及进展,而心室重构贯穿于心力衰竭病程始终,是HFpEF的基本病理基础。
中医所述之虚实与西医认为的能量具有相似性,HFpEF多属本虚标实之证。合并症通过诱导系统性炎症,引起心脏免疫炎症微循环状态,使线粒体自噬功能受损,进而线粒体介导的心肌出现能量代谢障碍,导致代谢产物及炎症因子释放,造成微循环障碍。痰浊内聚成邪,痹阻心脉成瘀,痰瘀久蕴成毒,刺激心肌成纤维细胞合成、心肌外基质降解沉积等出现毒损心络,导致心肌细胞僵硬、心肌细胞肥大、心肌纤维化,进而导致心肌结构和功能改变,引起心室重构而成“络积”,使心力衰竭恶化、进展,而心室重构贯穿于心力衰竭病程始终,是HFpEF的基本病理基础。基于前述HFpEF病程中虚→痰→瘀→毒及其交互影响,虚实夹杂,恶性循环的病机演变,在HFpEF辨证治疗基础上,尤应重视补虚、化痰、祛瘀、解毒类治法的应用,并结合太极拳等运动疗法,以求改善线粒体功能,调整能量代谢,从而抑制炎症反应,减轻心肌纤维化,逆转心肌肥厚,进而保护心肌细胞,抑制心室重构,延缓HFpEF病理进程,使患者临床症状减轻,生活质量提高。
| [1] |
MCDONAGH T A, METRA M, ADAMO M, et al. 2021 ESC guidelines for the diagnosis and treatment of acute and chronic heart failure[J]. European Heart Journal, 2021, 42(36): 3599-3726. DOI:10.1093/eurheartj/ehab368 |
| [2] |
廖玉华, 杨杰孚, 张健, 等. 舒张性心力衰竭诊断和治疗专家共识[J]. 临床心血管病杂志, 2020, 36(1): 1-10. |
| [3] |
GROENEWEGEN A, RUTTEN F H, MOSTERD A, et al. Epidemiology of heart failure[J]. Eur J Heart Fail, 2020, 22(8): 1342-1356. DOI:10.1002/ejhf.1858 |
| [4] |
王华, 刘宇佳, 杨杰孚. 心力衰竭流行病学[J]. 临床心血管病杂志, 2023, 39(4): 243-247. |
| [5] |
PFEFFER M A, SHAH A M, BORLAUG B A. Heart failure with preserved ejection fraction in perspective[J]. Circulation Research, 2019, 124(11): 1598-1617. DOI:10.1161/CIRCRESAHA.119.313572 |
| [6] |
DUNLAY S M, ROGER V L, REDFIELD M M. Epidemiology of heart failure with preserved ejection fraction[J]. Nature Reviews Cardiology, 2017, 14(10): 591-602. DOI:10.1038/nrcardio.2017.65 |
| [7] |
REDFIELD M M. Heart failure with preserved ejection fraction[J]. The New England Journal of Medicine, 2016, 375(19): 1868-1877. DOI:10.1056/NEJMcp1511175 |
| [8] |
NAING P, FORRESTER D, KANGAHARAN N, et al. Heart failure with preserved ejection fraction: a growing global epidemic[J]. Australian Journal of General Practice, 2019, 48(7): 465-471. DOI:10.31128/AJGP-03-19-4873 |
| [9] |
周京敏, 王华, 黎励文. 射血分数保留的心力衰竭诊断与治疗中国专家共识2023[J]. 中国循环杂志, 2023, 38(4): 375-393. |
| [10] |
TSIGKOU V, OIKONOMOU E, ANASTASIOU A, et al. Molecular mechanisms and therapeutic implications of endothelial dysfunction in patients with heart failure[J]. International Journal of Molecular Sciences, 2023, 24(5): 4321-4328. DOI:10.3390/ijms24054321 |
| [11] |
董国菊. 《2022AHA/ACC/HFSA心衰管理指南》中关于射血分数保留的心力衰竭的要点解读[J]. 中国循证医学杂志, 2022, 22(10): 1117-1124. |
| [12] |
BORLAUG B A. Evaluation and management of heart failure with preserved ejection fraction[J]. Nature Reviews Cardiology, 2020, 17(9): 559-573. DOI:10.1038/s41569-020-0363-2 |
| [13] |
GEVAERT A B, KATARIA R, ZANNAD F, et al. Heart failure with preserved ejection fraction: recent concepts in diagnosis, mechanisms and management[J]. Heart, 2022, 108(17): 1342-1350. DOI:10.1136/heartjnl-2021-319605 |
| [14] |
BORLAUG B A, SHARMA K, SHAH S J, et al. Heart failure with preserved ejection fraction: JACC scientific statement[J]. Journal of the American College of Cardiology, 2023, 81(18): 1810-1834. DOI:10.1016/j.jacc.2023.01.049 |
| [15] |
MISHRA S, KASS D A. Cellular and molecular pathobiology of heart failure with preserved ejection fraction[J]. Nature Reviews Cardiology, 2021, 18(6): 400-423. DOI:10.1038/s41569-020-00480-6 |
| [16] |
PAULUS W J, TSCHÖPE C. A novel paradigm for heart failure with preserved ejection fraction comorbidities drive myocardial dysfunction and remodeling through coronary microvascular endothelial inflammation[J]. Journal of the American College of Cardiology, 2013, 62(4): 263-271. DOI:10.1016/j.jacc.2013.02.092 |
| [17] |
LINDMAN B R. The diabetic heart failure with preserved ejection fraction phenotype: is it real and is it worth targeting therapeutically?[J]. Circulation, 2017, 135(8): 736-740. DOI:10.1161/CIRCULATIONAHA.116.025957 |
| [18] |
SCHIATTARELLA G G, RODOLICO D, HILL J A. Metabolic inflammation in heart failure with preserved ejection fraction[J]. Cardiovascular Research, 2021, 117(2): 423-434. DOI:10.1093/cvr/cvaa217 |
| [19] |
黄鈺婷, 张恺, 苏菁, 等. 射血分数保留型心力衰竭与微血管内皮炎症[J]. 临床心血管病杂志, 2021, 37(6): 512-515. |
| [20] |
PAULUS W J, ZILE M R. From systemic inflammation to myocardial fibrosis: the heart failure with preserved ejection fraction paradigm revisited[J]. Circulation Research, 2021, 128(10): 1451-1467. DOI:10.1161/CIRCRESAHA.121.318159 |
| [21] |
RIEHLE C, BAUERSACHS J. Key inflammatory mechanisms underlying heart failure[J]. Herz, 2019, 44(2): 96-106. DOI:10.1007/s00059-019-4785-8 |
| [22] |
FRANSSEN C, CHEN S, UNGER A, et al. Myocardial microvascular inflammatory endothelial activation in heart failure with preserved ejection fraction[J]. JACC Heart Failure, 2016, 4(4): 312-324. DOI:10.1016/j.jchf.2015.10.007 |
| [23] |
YUE Y Y, MENG K, PU Y J, et al. Transforming growth factor beta(TGF-β) mediates cardiac fibrosis and induces diabetic cardiomyopathy[J]. Diabetes Research and Clinical Practice, 2017, 133(2): 124-130. |
| [24] |
WONG C K S, FALKENHAM A, MYERS T, et al. Connective tissue growth factor expression after angiotensin Ⅱ exposure is dependent on transforming growth factor-β signaling via the canonical Smad-dependent pathway in hypertensive induced myocardial fibrosis[J]. Journal of the Renin-Angiotensin-Aldosterone System, 2018, 19(1): 1470-1482. |
| [25] |
KHAN S A, DONG H L, JOYCE J, et al. Fibulin-2 is essential for angiotensin Ⅱ-induced myocardial fibrosis mediated by transforming growth factor(TGF)-Β[J]. Laboratory Investigation, 2016, 96(7): 773-783. DOI:10.1038/labinvest.2016.52 |
| [26] |
YAO Y F, HU C Q, SONG Q X, et al. ADAMTS16 activates latent TGF-β, accentuating fibrosis and dysfunction of the pressure-overloaded heart[J]. Cardiovascular Research, 2020, 116(5): 956-969. DOI:10.1093/cvr/cvz187 |
| [27] |
MA Z G, YUAN Y P, WU H M, et al. Cardiac fibrosis: new insights into the pathogenesis[J]. International Journal of Biological Sciences, 2018, 14(12): 1645-1657. DOI:10.7150/ijbs.28103 |
| [28] |
MAITY S, MUHAMED J, SARIKHANI M, et al. Sirtuin 6 deficiency transcriptionally up-regulates TGF-β signaling and induces fibrosis in mice[J]. The Journal of Biological Chemistry, 2020, 295(2): 415-434. DOI:10.1074/jbc.RA118.007212 |
| [29] |
JIANG F, LIU G S, DUSTING G J, et al. NADPH oxidase-dependent redox signaling in TGF-β-mediated fibrotic responses[J]. Redox Biology, 2014, 2(4): 267-272. |
| [30] |
BHANDARY B, MENG Q H, JAMES J, et al. Cardiac fibrosis in proteotoxic cardiac disease is dependent upon myofibroblast TGF-β signaling[J]. Journal of the American Heart Association, 2018, 7(20): 1001-1013. |
| [31] |
KHALIL H, KANISICAK O, PRASAD V, et al. Fibroblast-specific TGF-β-Smad2/3 signaling underlies cardiac fibrosis[J]. The Journal of Clinical Investigation, 2017, 127(10): 3770-3783. DOI:10.1172/JCI94753 |
| [32] |
KONG J C, MIAO W Q, WANG Y, et al. ANO1 relieves pressure overload-induced myocardial fibrosis in mice by inhibiting TGF-β/Smad3 signaling pathway[J]. European Review for Medical and Pharmacological Sciences, 2020, 24(16): 8493-8501. |
| [33] |
MUN J H, KIM Y M, KIM B S, et al. Simvastatin inhibits transforming growth factor-β1-induced expression of type I collagen, CTGF, and α-SMA in keloid fibroblasts[J]. Wound Repair and Regeneration, 2014, 22(1): 125-133. DOI:10.1111/wrr.12136 |
| [34] |
KAMO T, AKAZAWA H, KOMURO I. Cardiac nonmyocytes in the hub of cardiac hypertrophy[J]. Circulation Research, 2015, 117(1): 89-98. DOI:10.1161/CIRCRESAHA.117.305349 |
| [35] |
FORRESTER S J, BOOZ G W, SIGMUND C D, et al. Angiotensin Ⅱsignal transduction: an update on mechanisms of physiology and pathophysiology[J]. Physiological Reviews, 2018, 98(3): 1627-1738. DOI:10.1152/physrev.00038.2017 |
| [36] |
REN C Z, LIU K, ZHAO X K, et al. Research progress of traditional Chinese medicine in treatment of myocardial fibrosis[J]. Frontiers in Pharmacology, 2022, 13(5): 853-862. |
| [37] |
卢玉俊, 赵信科, 代晶晶. 参桂保心方对慢性心力衰竭大鼠基质金属蛋白酶2、基质金属蛋白酶抑制剂1、B型脑钠肽及心室重构的影响[J]. 中国医科大学学报, 2018, 47(3): 231-236. |
| [38] |
RAMIREZ T A, IYER R P, GHASEMI O, et al. Aliskiren and valsartan mediate left ventricular remodeling post-myocardial infarction in mice through MMP-9 effects[J]. Journal of Molecular and Cellular Cardiology, 2014, 72(3): 326-335. |
| [39] |
HEYMANS S, LUTTUN A, NUYENS D, et al. Inhibition of plasminogen activators or matrix metalloproteinases prevents cardiac rupture but impairs therapeutic angiogenesis and causes cardiac failure[J]. Nature Medicine, 1999, 5(10): 1135-1142. DOI:10.1038/13459 |
| [40] |
甄宇治, 宋适恒, 邢军. 芪苈强心胶囊联合托伐普坦片对冠心病慢性心力衰竭MMPs/TIMPs调节作用的研究[J]. 中华中医药学刊, 2021, 39(9): 165-168. |
| [41] |
骆露媛, 古思奇, 周万兴, 等. 基质金属蛋白酶9通过上调血管紧张素Ⅱ加剧其致心室重构作用[J]. 中华高血压杂志, 2019, 27(9): 859-866. |
| [42] |
SANADA S, HAKUNO D, HIGGINS L J, et al. IL-33 and ST2 comprise a critical biomechanically induced and cardioprotective signaling system[J]. The Journal of Clinical Investigation, 2007, 117(6): 1538-1549. DOI:10.1172/JCI30634 |
| [43] |
SCHMITZ J, OWYANG A, OLDHAM E, et al. IL-33, an interleukin-1-like cytokine that signals via the IL-1 receptor-related protein ST2 and induces T helper type 2-associated cytokines[J]. Immunity, 2005, 23(5): 479-490. DOI:10.1016/j.immuni.2005.09.015 |
| [44] |
YU L L, RUIFROK W P, MEISSNER M, et al. Genetic and pharmacological inhibition of galectin-3 prevents cardiac remodeling by interfering with myocardial fibrogenesis[J]. Circulation Heart Failure, 2013, 6(1): 107-117. DOI:10.1161/CIRCHEARTFAILURE.112.971168 |
| [45] |
施冰, 薛大卫. 血浆半乳糖凝集素3对老年射血分数保留的心力衰竭诊断和预后价值[J]. 中华老年心脑血管病杂志, 2015, 17(9): 980-982. |
| [46] |
董国菊. 基于"通阳不在温而在利小便"从气化不利论射血分数保留的心力衰竭治疗思路[J]. 中华中医药学刊, 2022, 40(11): 5-7. |
| [47] |
赵志强, 李达, 王贤良, 等. 射血分数正常心力衰竭中医证候分布特点的文献分析[J]. 中华中医药杂志, 2019, 34(9): 4047-4050. |
| [48] |
赵志强, 王贤良, 张萍, 等. 基于前瞻性临床流行病学调查的射血分数正常心力衰竭中医证候特征分析[J]. 中医杂志, 2019, 60(9): 773-778. |
| [49] |
努力帕尔·再丁, 熊双, 董国菊. 射血分数保留的心力衰竭病人中医证候特征初探[J]. 中西医结合心脑血管病杂志, 2020, 18(23): 4014-4017. |
| [50] |
宋玉莹, 崔琳, 何玉凤, 等. 参附益心颗粒对心肌梗死后心力衰竭大鼠线粒体动力学的影响[J]. 中国实验方剂学杂志, 2024, 30(11): 87-94. |
| [51] |
张倩, 李彬, 邢冬梅, 等. 慢性心力衰竭心气虚证与心肌能量代谢障碍关系的探讨[J]. 中西医结合心脑血管病杂志, 2016, 14(3): 313-315. |
| [52] |
杨婵, 谢子妍, 杨嫱妃, 等. 基于"气虚生毒"学说论糖尿病大血管区域免疫炎症微环境紊乱[J]. 中华中医药学刊, 2019, 37(2): 351-353. |
| [53] |
李渊芳, 谢盈彧, 徐士欣, 等. 线粒体自噬与心脏能量代谢研究进展[J]. 中华老年心脑血管病杂志, 2019, 21(3): 320-323. |
| [54] |
韩宇博, 金娟, 邹国良, 等. 射血分数保留的心力衰竭患者中医证型与心肌能量消耗相关性分析[J]. 辽宁中医药大学学报, 2018, 20(9): 192-195. |
| [55] |
廖佳丹, 王鹏程, 张艳, 等. 益气活血复方对慢性心衰大鼠心肌能量代谢mi-CK mRNA及蛋白的影响[J]. 中华中医药学刊, 2016, 34(8): 1968-1971. |
| [56] |
刘培, 俞赟丰, 杨欣雨, 等. 基于"痰、瘀、毒"理论探讨冠心病炎症机制和中药干预策略[J]. 中国实验方剂学杂志, 2023, 29(12): 185-191. |
| [57] |
袁泉英, 甘翔, 鲍火庚, 等. 枳实薤白桂枝汤对冠心病不稳定型心绞痛痰浊痹阻型患者血清炎性因子及血管内皮功能的影响[J]. 中华中医药杂志, 2021, 36(11): 6893-6897. |
| [58] |
吴玉婷, 周迎春. 冠心病从痰论治的现代理论研究[J]. 中国中医基础医学杂志, 2017, 23(7): 1029-1031. |
| [59] |
彭菊琴, 侯丕华, 彭娴, 等. 射血分数保留心力衰竭中医证素分布规律研究[J]. 中华中医药杂志, 2020, 35(7): 3660-3664. |
| [60] |
汪磊, 陈炜. 基于"心脾相关理论"的调脾护心方对慢性心力衰竭心室重构和预后的影响[J]. 中国实验方剂学杂志, 2020, 26(13): 144-149. |
| [61] |
王旨引, 刘俊杰, 杨双杰, 等. 探析"毒"与慢性心力衰竭的关系[J]. 中医学报, 2021, 36(6): 1143-1146. |
| [62] |
张伟, 张艳, 康伊, 等. 心力衰竭的"虚瘀水毒"理论内涵[J]. 时珍国医国药, 2020, 31(6): 1432-1434. |
| [63] |
张洋, 张艳, 张红, 等. 从虚痰瘀毒论治顽固性心力衰竭[J]. 长春中医药大学学报, 2016, 32(1): 61-64. |
| [64] |
刘俊杰, 赵慧辉, 张建, 等. 基于"虚、毒、瘀"浅述芪参颗粒治疗慢性心力衰竭气虚血瘀证中医理论依据[J]. 世界中医药, 2019, 14(6): 1447-1449. |
| [65] |
樊佳溶, 王子涵, 张高钰, 等. 从"阴虚-痰瘀-热毒"轴探讨射血分数保留的心力衰竭的中医病机及治疗要点[J]. 中西医结合心脑血管病杂志, 2023, 21(11): 2103-2106. |
| [66] |
杨荣来, 王凤荣, 史海蛟, 等. 以"痰瘀毒"立论探讨大柴胡汤防治动脉粥样硬化的炎症反应[J]. 辽宁中医药大学学报, 2020, 22(8): 94-96. |
| [67] |
袁天慧, 冼绍祥, 杨忠奇, 等. "毒"邪致慢性心力衰竭理论依据初探[J]. 中华中医药杂志, 2014, 29(6): 1785-1790. |
| [68] |
柳金英, 任莹璐, 任卫全, 等. 从炎性反应角度探讨清热解毒法治疗心力衰竭的意义[J]. 中华中医药杂志, 2017, 32(11): 4901-4905. |
| [69] |
杜金辉, 郭辉栋, 李晓. 益气温阳、清热解毒法治疗慢性心力衰竭的临床研究[J]. 中华中医药杂志, 2016, 31(2): 723-725. |
| [70] |
杨梦, 苏丽清, 胡志希. 基于毒邪与络病学说探讨免疫炎症在慢性心力衰竭中作用[J]. 辽宁中医药大学学报, 2024, 26(6): 60-65. |
| [71] |
SINHA A, YANCY C W, SHAH S J, et al. Heart failure with preserved ejection fraction and obesity: syndrome of cGMP-PKG deficiency in post-menopausal women[J]. JACC Case Reports, 2020, 2(1): 28-32. DOI:10.1016/j.jaccas.2019.11.065 |
| [72] |
HUANG Y T, ZHANG K, LIU M, et al. An herbal preparation ameliorates heart failure with preserved ejection fraction by alleviating microvascular endothelial inflammation and activating NO-cGMP-PKG pathway[J]. International Journal of Phytotherapy and Phytopharmacology, 2021, 91(5): 536-543. |
| [73] |
HUANG Y T, ZHANG K, WANG X, et al. Multi-omics approach for identification of molecular alterations of QiShenYiQi Dripping Pills in heart failure with preserved ejection fraction[J]. Journal of Ethnopharmacology, 2023, 315(10): 1166-1173. |
| [74] |
张杰, 赖润民, 鞠建庆, 等. 芪参益气滴丸治疗射血分数保留心力衰竭的网络药理学研究[J]. 中国医药导报, 2020, 17(1): 21-24, 198. |
| [75] |
宋思洋. 芪参益气滴丸联合尼可地尔对急诊PCI术后左室射血分数保留性心力衰竭患者血清NT-proBNP、hs-CRP、Hcy和CysC的影响[J]. 现代中西医结合杂志, 2020, 29(5): 514-518. |
| [76] |
曹雅雯, 毕颖斐, 王贤良, 等. 芪苈强心胶囊对射血分数保留心力衰竭患者心功能影响的系统评价[J]. 中国循证医学杂志, 2020, 20(12): 1427-1433. |
| [77] |
葛昭, 刘春香, 林姗姗, 等. 芪苈强心胶囊对射血分数保留心力衰竭患者生活质量影响的Meta分析[J]. 天津中医药, 2022, 39(3): 335-346. |
| [78] |
郝佳梦, 常丽萍, 王璐, 等. 基于网络药理学及实验验证探究芪苈强心胶囊治疗射血分数保留型心衰的作用机制[J]. 中草药, 2022, 53(14): 4365-4375. |
| [79] |
ZHANG J Y, WEI X X, XUE F L, et al. Shunxin decoction improves diastolic function in rats with heart failure with preserved ejection fraction induced by abdominal aorta constriction through cyclic guanosine monophosphate-dependent protein kinase signaling pathway[J]. Chung i Tsa Chih Ying Wen Pan, 2022, 42(5): 764-772. |
| [80] |
熊双, 刘剑刚, 董国菊, 等. 苓桂气化方对射血分数保留性心力衰竭模型大鼠心脏功能及糖脂代谢的影响[J]. 天津中医药, 2021, 38(7): 909-916. |
| [81] |
SHI Y J, LIU C Q, XIONG S, et al. Ling-Gui-Qi-Hua formula alleviates left ventricular myocardial fibrosis in rats with heart failure with preserved ejection fraction by blocking the transforming growth factor-β1/Smads signaling pathway[J]. Journal of Ethnopharmacology, 2023, 317(2): 116-124. |
| [82] |
XIONG S, SHI Y J, LIU J G, et al. Linggui qihua decoction inhibits atrial fibrosis by regulating TGF-β1/Smad2/3 signal pathway[J]. Evidence-Based Complementary and Alternative Medicine, 2023, 38(19): 3764-3773. |
| [83] |
董国菊, 石玉姣, 刘春秋, 等. 基于miRNA21-5p调控TGF-β1/Smads信号通路探讨苓桂气化方抗射血分数保留心力衰竭心肌纤维化的机制[J]. 中华中医药学刊, 2024, 42(4): 1-6. |
| [84] |
石玉姣, 杨琳, 刘春秋, 等. 苓桂气化方干预射血分数保留心力衰竭心肌纤维化的物质基础及分子机制[J]. 中国实验方剂学杂志, 2023, 29(20): 20-29. |
| [85] |
刘春秋, 刘剑刚, 石玉姣, 等. 基于网络药理学和分子对接探讨苓桂剂治疗射血分数保留的心力衰竭的机制和优势[J]. 中国中医基础医学杂志, 2023, 29(5): 808-815. |
| [86] |
WU X, ZHANG T T, QIAO J F, et al. Effects of Kangdaxin on myocardial fibrosis in heart failure with preserved ejection fraction rats[J]. Journal of Thoracic Disease, 2022, 14(4): 1157-1163. DOI:10.21037/jtd-22-198 |
| [87] |
YUAN P, LIU J G, XIONG S, et al. Effects and mechanism of Compound Qidan Formula on rats with HFpEF induced by hypertension and diabetes mellitus based on Ang Ⅱ/TGF-β1/Smads signaling pathway[J]. Journal of Ethnopharmacology, 2023, 313(11): 1165-1175. |
| [88] |
袁娉, 刘剑刚, 熊双, 等. 复方芪丹方对高血压和糖尿病导致射血分数保留心力衰竭模型大鼠心脏功能及糖脂代谢的影响[J]. 中国中西医结合急救杂志, 2023, 30(4): 439-445. |
| [89] |
杨雪卿, 王巍, 周琦. 心衰合剂对射血分数保留心衰患者无创血流动力学参数的影响[J]. 北京中医药, 2018, 37(6): 496-499. |
| [90] |
巩德成, 冯少彬, 宁宇, 等. 心衰合剂联合阿托伐他汀钙对射血分数保留心力衰竭患者临床疗效观察及对无创血流动力学参数的影响[J]. 中国老年学杂志, 2020, 40(24): 5168-5170. |
| [91] |
杨雪卿, 王巍, 周琦. 心衰合剂对射血分数保留心力衰竭患者心肌纤维化的影响[J]. 北京中医药, 2020, 39(7): 731-734. |
| [92] |
董新禹, 邹国良, 韩宇博, 等. 加味参芪益心方对射血分数保留型心力衰竭伴胰岛素抵抗患者心血管危险因素的影响[J]. 中国实验方剂学杂志, 2023, 29(13): 104-111. |
| [93] |
方晓江, 钱宝庆, 魏丽萍, 等. 防己黄芪汤加减用于射血分数保留型心衰的临床研究[J]. 辽宁中医杂志, 2018, 45(12): 2591-2593. |
| [94] |
李幼萍, 肖忠英, 倪卫. 黄芪保心汤联合比索洛尔治疗射血分数保留型心力衰竭疗效及对患者心功能的影响[J]. 陕西中医, 2020, 41(10): 1399-1402. |
| [95] |
安敬芝, 步玮, 杨劼, 等. 温阳益气活血汤治疗射血分数保留性心力衰竭患者微血管内皮的影响[J]. 内蒙古医科大学学报, 2023, 45(4): 354-356, 373. |
| [96] |
尹嘉, 牛天福, 刘婷, 等. 降浊通络颗粒联合西药治疗痰瘀互结型射血分数保留性心力衰竭36例临床观察[J]. 中医杂志, 2019, 60(21): 1832-1836. |
| [97] |
陈玉林, 蒋虎刚, 王新强, 等. 基于网络药理学和分子对接探讨芪参益心颗粒治疗射血分数保留型心力衰竭的作用机制[J]. 中国临床药理学与治疗学, 2023, 28(10): 1081-1092. |
| [98] |
秦广宁, 金鑫瑶, 刘耀远, 等. 基于张伯礼"湿浊痰饮类病"学说浅析射血分数保留的心力衰竭治疗策略[J]. 中医杂志, 2024, 65(1): 35-38, 43. |
| [99] |
魏小棋, 范昕怡, 普海崟, 等. 基于代谢组学探究鸡鸣散改善射血分数保留的心力衰竭的作用机制[J]. 中国中药杂志, 2023, 48(17): 4747-4760. |
| [100] |
杨金星, 李长远, 张敦憨, 等. 加味鸡鸣散联合中药热奄包治疗射血分数保留性心力衰竭临床疗效观察[J]. 四川中医, 2023, 41(8): 105-108. |
| [101] |
崔梁瑜, 马静, 张学学, 等. 黄芪甲苷对射血分数保留型心力衰竭大鼠心脏功能保护及心肌微血管炎症因子的影响[J]. 中国中医急症, 2022, 31(1): 53-57. |
| [102] |
郭红鑫, 王建茹, 王新陆, 等. 中药治疗射血分数保留心衰的核心用药及其作用机制研究[J]. 中草药, 2023, 54(18): 6017-6028. |
| [103] |
孙红丹, 聂丹, 周晓慧, 等. 丹皮酚联合三七总皂苷对AngⅡ诱导的心脏成纤维细胞增殖及TGF-β/Smads信号通路的影响[J]. 中成药, 2016, 38(4): 729-735. |
| [104] |
纪翔, 林谦, 徐江林, 等. 基于网络药理学及分子对接探究党参治疗射血分数保留性心力衰竭的分子机制[J]. 中西医结合心脑血管病杂志, 2023, 21(7): 1161-1168. |
| [105] |
林姗姗, 王贤良, 杨颖, 等. 心脉隆注射液治疗不同类型射血分数心力衰竭的系统评价[J]. 中国循证医学杂志, 2021, 21(4): 423-430. |
| [106] |
王宇, 赵勇, 陶红杰, 等. 参附注射液对射血分数保留型心力衰竭患者心肌微循环的影响[J]. 中国中医急症, 2022, 31(11): 1990-1992. |
| [107] |
BORLAUG B A. The pathophysiology of heart failure with preserved ejection fraction[J]. Nature Reviews Cardiology, 2014, 11(9): 507-515. DOI:10.1038/nrcardio.2014.83 |
| [108] |
王骥, 沈玉芹. 射血分数保留的心力衰竭运动康复研究进展[J]. 中华高血压杂志(中英文), 2024, 32(4): 337-343. |
 2024, Vol. 43
2024, Vol. 43