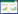文章信息
- 钟云峰, 肖愉洁, 夏淦, 袁思敏
- ZHONG Yun-feng, XIAO Yujie, XIA Gan, YUAN Simin
- 姜黄素调节PI3K/AKT/mTOR信号通路对胃癌细胞增殖、凋亡和化疗耐药性的影响
- Effect of curcumin on proliferation, apoptosis, and chemotherapy resistance of gastric cancer cells by regulating the PI3K/AKT/mTOR signaling pathway
- 天津中医药大学学报, 2024, 43(8): 701-707
- Journal of Tianjin University of Traditional Chinese Medicine, 2024, 43(8): 701-707
- http://dx.doi.org/10.11656/j.issn.1673-9043.2024.08.06
-
文章历史
收稿日期: 2024-03-01
胃癌是一种常见的恶性肿瘤,也是全球肿瘤相关死亡的主要原因。据估计,2020年胃癌新发病例103万,死亡病例76.9万[1]。目前,内镜治疗是早期胃癌的首选治疗方法,晚期胃癌的治疗通常以化疗和靶向治疗为主[2]。以顺铂(DDP)为基础的联合化疗方案是中国临床肿瘤学会胃癌诊疗指南推荐的晚期胃癌患者首选治疗方案[3]。DDP通过干扰癌细胞中的DNA复制并诱导其凋亡来诱导细胞毒性。然而,大多数胃癌患者会出现DDP耐药,这已被证明与癌症转移和复发相关[4]。化疗耐药性已成为临床胃癌治疗效率的重大挑战[5]。因此,开发针对肿瘤耐药的新型逆转剂是提高化疗药物疗效、改善胃癌患者预后的关键。姜黄素(Cur)是姜黄根茎的最重要成分,其具有抗菌、抗炎、抗氧化和抗肿瘤等作用[6]。已有研究报道,Cur可抑制胃癌细胞增殖与转移[7]。但关于Cur对胃癌细胞化疗耐药性的影响鲜有报道。相关研究显示,Cur可能通过抑制磷脂酰肌醇3激酶/蛋白激酶B/哺乳动物雷帕霉素靶蛋白(phosphatidylinositol 3 kinases/protein kinase B/mammalian target of rapamycin,PI3K/AKT/mTOR)信号通路对胃癌细胞发挥抗癌作用[8]。但Cur能否通过调控PI3K/AKT/mTOR信号通路影响胃癌细胞化疗耐药性尚不可知。基于此,本研究旨在探究Cur对胃癌细胞增殖、凋亡和化疗耐药性的影响以及其作用的机制,旨在为胃癌的治疗提供新的理论依据。
1 材料与方法 1.1 细胞来源人胃癌细胞株MGC-803及DDP耐药胃癌细胞株MGC-803/DDP均购自军事医学科学院。
1.2 主要试剂姜黄素(纯度≥98%)购自上海纯优生物科技有限公司;PI3K激活剂740Y-P购自美国MCE公司;CCK-8试剂盒、Annexin V-FITC/PI细胞凋亡检测试剂盒购自上海泽叶生物科技有限公司;兔源一抗抗增殖细胞核抗原(PCNA)、Bcl2关联X蛋白(Bax)、多药耐药关联蛋白1(MRP1)、PI3K、AKT、mTOR、p-PI3K、p-AKT、p-mTOR、GAPDH及辣根过氧化物酶标记的羊抗兔二抗均购自英国Abcam公司。
1.3 细胞培养及分组将MGC-803、MGC-803/DDP细胞在补充有10 % 胎牛血清的DMEM培养基中培养。取对数生长期的MGC-803细胞分为对照组、Cur低剂量组、Cur中剂量组、Cur高剂量组、Cur高剂量+740Y-P组。对照组MGC-803细胞不做任何处理;Cur低剂量组、Cur中剂量组、Cur高剂量组[9]MGC-803细胞分别用10 μmol/L、20 μmol/L、40 μmol/L Cur处理;Cur高剂量+740Y-P组[10]MGC-803细胞用40 μmol/L Cur和10μmol/L 740Y-P同时处理。处理48 h后,收集各组细胞用于MGC-803细胞增殖、凋亡行为的检测。
取对数生长期的MGC-803/DDP细胞分为空白组、Cur组、DDP组、Cur+DDP组、Cur+DDP+740Y-P组。空白组MGC-803/DDP细胞不做任何处理;Cur组MGC-803/DDP细胞用40 μmol/L Cur处理;DDP组[11]MGC-803/DDP细胞用30 μg/mL处理;Cur+DDP组MGC-803/DDP细胞用40 μmol/L Cur和30 μg/mL同时处理;Cur+DDP+740Y-P组MGC-803/DDP细胞用40 μmol/L Cur、30 μg/mL和10μmol/L 740Y-P同时处理。处理48 h后,收集各组细胞用于MGC-803/DDP细胞化疗耐药性的检测。
1.4 克隆形成实验检测细胞增殖将MGC-803或MGC-803/DDP细胞(500个细胞)接种到细胞培养板中。常规培养14 d后,将形成的细胞集落用甲醇固定,结晶紫染色。最后对菌落进行计数,并计算克隆形成率。
1.5 CCK-8法检测细胞增殖将MGC-803或MGC-803/DDP细胞分别接种在96孔板中(1×104个细胞/孔)。再将CCK-8溶液添加到每个孔中。用CCK-8溶液培养细胞1 h后,测量450 nm波长下每个孔的吸光度。
1.6 流式细胞术检测细胞凋亡将MGC-803或MGC-803/DDP细胞制成1×106个/mL的细胞悬浮液。取5 μL Annexin V-FITC和5 μL碘化丙啶添加到细胞悬浮液中,在室温下避光孵15 min。再将400 mL 1×结合缓冲液添加到每个管中,并立即通过流式细胞术分析细胞凋亡情况。
1.7 Western blot检测PCNA、Bax、MRP1、p-PI3K、p-AKT、p-mTOR蛋白表达MGC-803和MGC-803/DDP细胞中的蛋白质是通过RIPA裂解缓冲液裂解获得的。蛋白经定量、凝胶电泳、转移到PVDF膜、5%脱脂牛奶封闭后,在4 ℃下将膜与一抗PCNA(1∶2 000)、Bax(1∶5 000)、MRP1(1∶4 000)、p-PI3K(1∶5 000)、p-AKT(1∶3 000)、p-mTOR(1∶5 000)、PI3K(1∶2 000)、AKT(1∶5 000)、mTOR(1∶3 000)、GAPDH(1∶3 000)孵育过夜,再与二抗(1∶4 000)一起孵育1 h,使用ECL试剂观察蛋白条带,ImageJ软件分析蛋白条带灰度值。
1.8 统计学分析数据表示为均数±标准差(x ± s),通过SPSS 25.0中的单因素方差分析分析多组间的差异,进一步两组间的比较采用SNK-q检验。P < 0.05表示具有统计学意义。
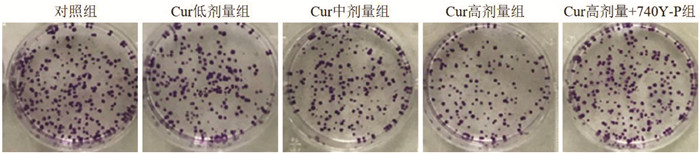
2 结果 2.1 Cur对MGC-803细胞增殖的影响与对照组比较,Cur低剂量组、Cur中剂量组、Cur高剂量组MGC-803细胞克隆形成率及OD450值降低,且呈剂量依赖性(P<0.05);与Cur高剂量组比较,Cur高剂量+740Y-P组MGC-803细胞克隆形成率及OD450值升高(P<0.05),见图 1和表 1。表明Cur可抑制MGC-803细胞增殖。
|
| 图 1 克隆形成实验检测MGC-803细胞克隆形成情况 |
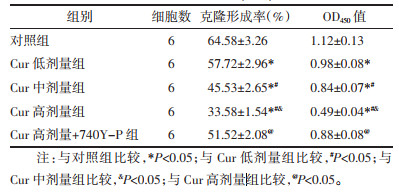
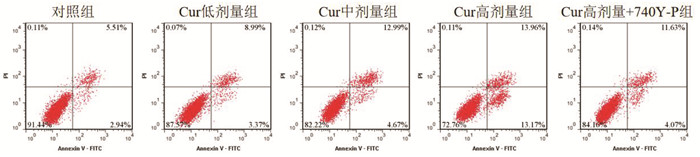
与对照组比较,Cur低剂量组、Cur中剂量组、Cur高剂量组MGC-803细胞凋亡率升高,且呈剂量依赖性(P<0.05);与Cur高剂量组比较,Cur高剂量+740Y-P组MGC-803细胞凋亡率降低(P<0.05),见图 2和表 2。表明Cur可诱导MGC-803细胞凋亡。
|
| 图 2 MGC-803细胞凋亡的流式细胞术检测结果 |
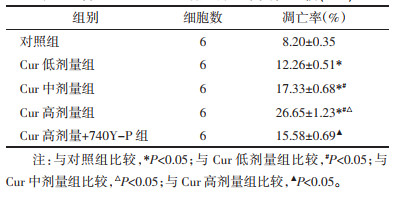
与对照组比较,Cur低剂量组、Cur中剂量组、Cur高剂量组MGC-803细胞中PCNA、p-PI3K、p-AKT、p-mTOR蛋白表达降低,Bax蛋白表达升高,且呈剂量依赖性(P<0.05);与Cur高剂量组比较,Cur高剂量+740Y-P组MGC-803细胞中PCNA、p-PI3K、p-AKT、p-mTOR蛋白表达升高,Bax蛋白表达降低(P<0.05),见图 3和表 3。表明Cur可能通过抑制PI3K/AKT/mTOR通路抑制MGC-803细胞增殖,诱导细胞凋亡。
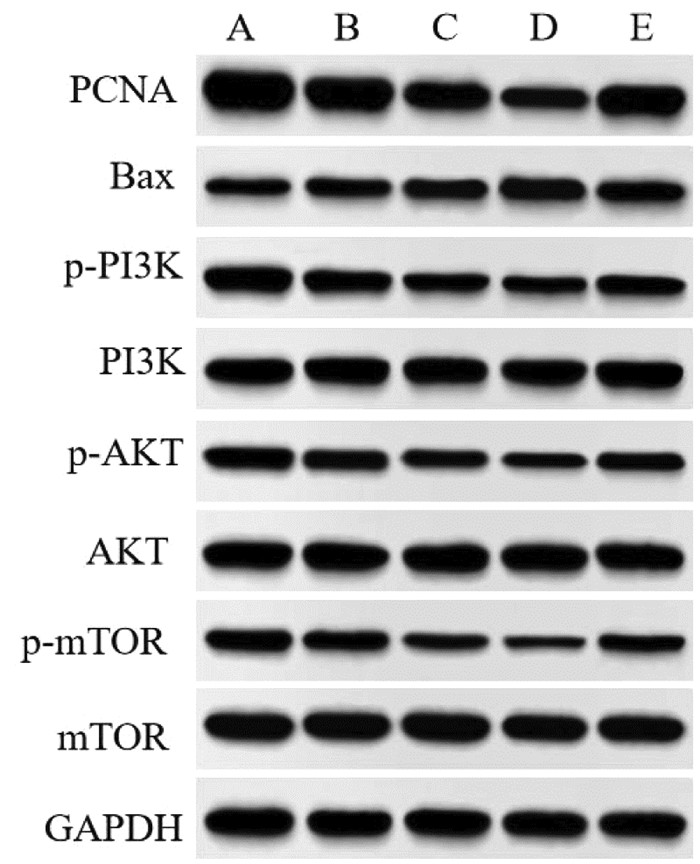
|
| 注:A,对照组;B,Cur低剂量组;C,Cur中剂量组;D,Cur高剂量组;E,Cur高剂量+740Y-P组。 图 3 MGC-803细胞中PCNA、Bax、p-PI3K、p-AKT、p-mTOR蛋白表达的Western blot检测结果 |
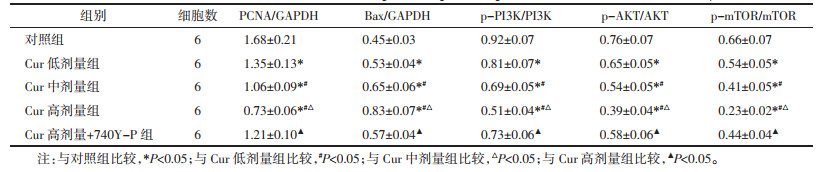
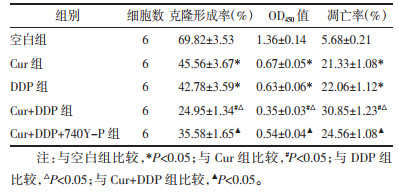
与空白组比较,Cur组、DDP组MGC-803/DDP细胞克隆形成率、OD450值降低,凋亡率升高(P<0.05);与Cur组、DDP组比较,Cur+DDP组MGC-803/DDP细胞克隆形成率、OD450值降低,凋亡率升高(P<0.05);与Cur+DDP组比较,Cur+DDP+740Y-P组MGC-803/DDP细胞克隆形成率、OD450值升高,凋亡率降低(P<0.05),见图 4、5和表 4。表明Cur可降低MGC-803/DDP细胞化疗耐药性。
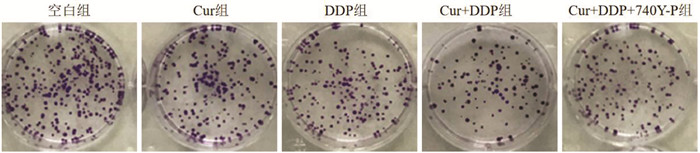
|
| 图 4 MGC-803/DDP细胞的克隆形成实验结果 |
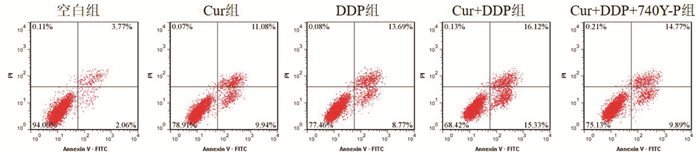
|
| 图 5 MGC-803/DDP细胞凋亡的流式细胞术检测结果 |
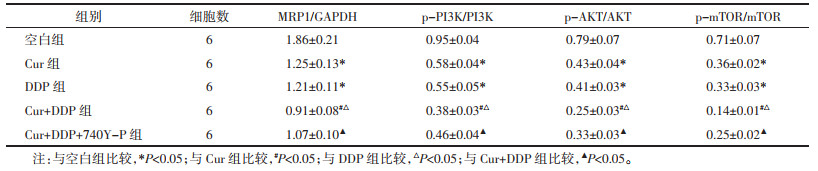
与空白组比较,Cur组、DDP组MGC-803/DDP细胞中MRP1、p-PI3K、p-AKT、p-mTOR蛋白表达降低(P<0.05);与Cur组、DDP组比较,Cur+DDP组MGC-803/DDP细胞中MRP1、p-PI3K、p-AKT、p-mTOR蛋白表达降低(P<0.05);与Cur+DDP组比较,Cur+DDP+740Y-P组MGC-803/DDP细胞中MRP1、p-PI3K、p-AKT、p-mTOR蛋白表达升高(P<0.05),见图 6和表 5。表明Cur可能通过抑制PI3K/AKT/mTOR通路降低MGC-803/DDP细胞化疗耐药性。
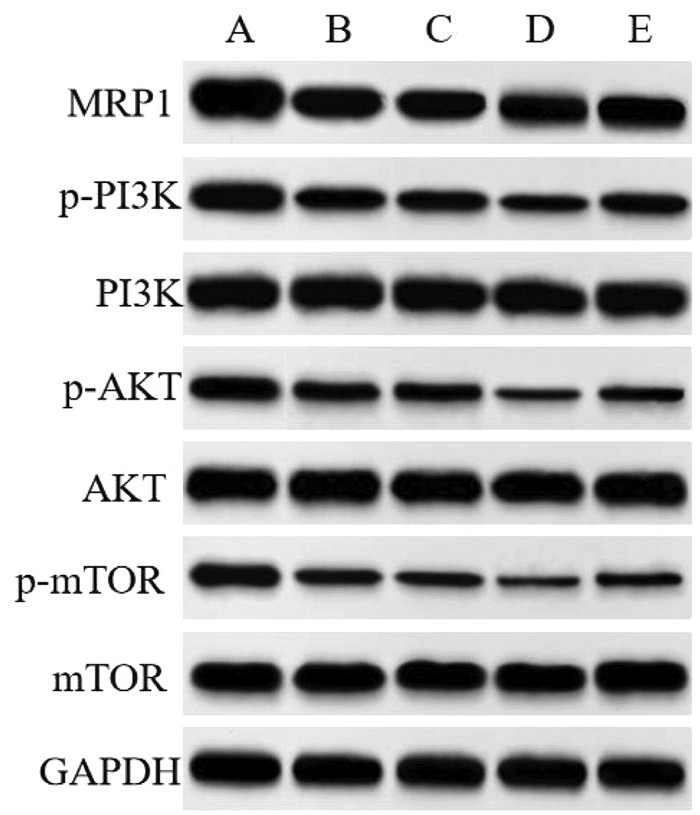
|
| 注:A,空白组;B,Cur组;C,DDP组;D,Cur+DDP组;E,Cur+DDP+740Y-P组。 图 6 MGC-803/DDP细胞中MRP1、p-PI3K、p-AKT、p-mTOR蛋白表达的Western blot检测结果 |
近年来,随着中国经济的快速发展,人民生活水平的不断提高,以及环境和饮食的变化,胃癌的发病率逐年上升,严重威胁着人类的健康。因此,胃癌已成为一个不可否认的社会健康问题。经过几十年的医学研究和治疗发展,几种基于不同抗癌药物的化疗方案提高了许多胃癌患者的生存率。然而,胃癌患者的化疗往往因肿瘤细胞产生多药耐药而失败[12]。因此,最近越来越多的研究开始关注能够逆转或减少肿瘤耐药的高效低毒药物。
Cur属于酸性多酚类化合物,近年来由于其潜在的抗癌特性而备受关注[13]。已有研究报道,Cur能够抑制胃癌SGC-7901细胞增殖和迁移[14];Cur可促进人胃癌SGC7901细胞凋亡[15]。表明Cur可通过促凋亡、抗增殖的方式来发挥抗胃癌的作用。本研究结果与其是一致的,本研究以MGC-803细胞为对象来研究细胞增殖、凋亡的变化,发现Cur可呈剂量依赖性地抑制胃癌MGC-803细胞增殖,促进细胞凋亡。PCNA是DNA代谢的关键调节因子,其水平与细胞增殖能力成正比[16];Bax是调节线粒体凋亡通路中细胞凋亡的重要信号分子,具有促凋亡作用[17]。本研究发现Cur可呈剂量依赖性地抑制MGC-803细胞中PCNA蛋白表达,上调Bax蛋白表达,再次从蛋白质层面上证实了Cur对MGC-803细胞增殖的抑制以及细胞凋亡的促进作用。
肿瘤耐药细胞的发展是影响化疗疗效的重要因素,因此肿瘤耐药是当前研究的热点。已有研究表明,肿瘤细胞耐药的分子机制涉及药物代谢改变、增强DNA损伤修复、抑制细胞凋亡等多个过程,但具体机制尚不清楚[18]。本研究以MGC-803/DDP细胞为对象来研究化疗耐药性的变化,结果发现Cur或DDP单独处理均可抑制MGC-803/DDP细胞增殖,促进细胞凋亡,但Cur和DDP联合对MGC-803/DDP细胞增殖的抑制以及细胞凋亡的促进作用明显优于DDP单独处理,表明Cur可通过抑制细胞增殖,促进细胞凋亡的方式降低MGC-803/DDP化疗耐药性。耐药基因的表达是影响化疗敏感性的重要因素,MRP1作为一种外排转运体,负责挤压内源性物质和外源性物质及其各自的代谢物,进而促进肿瘤细胞的化疗耐药[19]。本实验结果中Cur和DDP联合对MGC-803/DDP细胞中MRP1蛋白的抑制作用明显优于DDP单独处理,再次表明了Cur可降低MGC-803/DDP化疗耐药性。以上结果提示Cur可能成为降低胃癌DDP耐药性的潜在有效药物。此外,未设置阳性对照药进一步证明Cur的药效是本研究的不足之一。
PI3K/AKT/mTOR通路在癌症中起关键作用,该通路中p-PI3K、p-AKT、p-mTOR蛋白的激活可通过诱导不受控制的生长、增加耐药性来驱动癌变[20]。据报道,阻抑PI3K/AKT/mTOR信号通路可抑制胃癌HGC-27细胞增殖并促进其凋亡[10];PI3K/AKT/mTOR通路的激活增加了胃癌的化疗耐药性[21-22]。本研究显示,Cur可呈剂量依赖性地抑制MGC-803细胞中p-PI3K、p-AKT、p-mTOR蛋白表达,Cur和DDP联合对MGC-803/DDP细胞中p-PI3K、p-AKT、p-mTOR蛋白表达的抑制作用明显优于DDP单独处理,推测Cur可能通过抑制PI3K/AKT/mTOR通路抑制MGC-803细胞增殖,促进细胞凋亡并降低DDP耐药性。为了验证该猜想是否合理,本研究在高剂量Cur作用的基础上再用PI3K激活剂740Y-P干预MGC-803细胞,或在Cur和DDP联合处理的基础上再用740Y-P干预MGC-803/DDP细胞,结果发现,740Y-P减弱了高剂量Cur对MGC-803细胞增殖的抑制以及对细胞凋亡的促进作用,也减弱了Cur对MGC-803细胞DDP耐药性的降低作用。证实了猜想是合乎情理的。
综上所述,Cur可能通过抑制PI3K/AKT/mTOR通路抑制MGC-803细胞增殖,促进细胞凋亡并降低DDP耐药性。Cur抑制MGC-803细胞增殖,促进细胞凋亡并降低DDP耐药性的机制较为复杂,具体通过PI3K/AKT/mTOR通路下游的哪些蛋白来发挥作用有待后续实验进一步验证。
| [1] |
SUNG H, FERLAY J, SIEGEL R L, et al. Global cancer statistics 2020:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA: a Cancer Journal for Clinicians, 2021, 71(3): 209-249. DOI:10.3322/caac.21660 |
| [2] |
SEXTON R E, AL HALLAK M N, DIAB M, et al. Gastric cancer: A comprehensive review of current and future treatment strategies[J]. Cancer Metastasis Reviews, 2020, 39(4): 1179-1203. DOI:10.1007/s10555-020-09925-3 |
| [3] |
WANG F H, ZHANG X T, TANG L, et al. The Chinese Society of Clinical Oncology(CSCO): Clinical guidelines for the diagnosis and treatment of gastric cancer, 2023[J]. Cancer Communications(London, England), 2024, 44(1): 127-172. |
| [4] |
ZANGOUEI A S, MOGHBELI M. MicroRNAs as the critical regulators of cisplatin resistance in gastric tumor cells[J]. Genes and Environment, 2021, 43(1): 21. DOI:10.1186/s41021-021-00192-4 |
| [5] |
DENG P, SUN M, ZHAO W Y, et al. Circular RNA circVAPA promotes chemotherapy drug resistance in gastric cancer progression by regulating miR-125b-5p/STAT3 axis[J]. World Journal of Gastroenterology, 2021, 27(6): 487-500. DOI:10.3748/wjg.v27.i6.487 |
| [6] |
FAN Y Y, ZHANG X Q, TONG Y X, et al. Curcumin against gastrointestinal cancer: A review of the pharmacological mechanisms underlying its antitumor activity[J]. Frontiers in Pharmacology, 2022, 13: 990475. DOI:10.3389/fphar.2022.990475 |
| [7] |
苏娜娜, 崔敏, 李兰兰, 等. 姜黄素作用于miR-539对胃癌细胞生物学行为影响的研究[J]. 胃肠病学, 2021, 26(11): 656-662. |
| [8] |
XI G, DONG Q T, YANG B, et al. Curcumin's dose-dependent attenuation of gastric cancer cell progression via the PI3K pathway blockade[J]. Dose-Response: a Publication of International Hormesis Society, 2023, 21(4): 15593258231203585. DOI:10.1177/15593258231203585 |
| [9] |
孙逸飞, 李迪诺, 王玉彬. 姜黄素通过下调PI3K/Akt/mTOR信号通路蛋白表达对胃癌MGC-803细胞增殖和侵袭的抑制作用[J]. 吉林大学学报(医学版), 2023, 49(2): 332-340. |
| [10] |
何锋, 狐鸣, 冯世林, 等. 银杏内酯B通过阻抑PI3K/Akt/mTOR信号通路抑制胃癌HGC-27细胞的恶性生物学行为[J]. 中国肿瘤生物治疗杂志, 2023, 30(10): 874-880. |
| [11] |
ZHANG X M, GU G F, LI X F, et al. Lidocaine alleviates cisplatin resistance and inhibits migration of MGC-803/DDP cells through decreasing miR-10b[J]. Cell Cycle, 2020, 19(19): 2530-2537. DOI:10.1080/15384101.2020.1809914 |
| [12] |
ZHAO J Y, LAN W L, PENG J, et al. Babao Dan reverses multiple-drug resistance in gastric cancer cells via triggering apoptosis and autophagy and inhibiting PI3K/AKT/mTOR signaling[J]. Evidence-Based Complementary and Alternative Medicine, 2021, 5631942. |
| [13] |
HE Q M, LIU C, WANG X H, et al. Exploring the mechanism of curcumin in the treatment of colon cancer based on network pharmacology and molecular docking[J]. Frontiers in Pharmacology, 2023, 14: 1102581. DOI:10.3389/fphar.2023.1102581 |
| [14] |
薛倩, 刘鹏, 李洪波, 等. 不同浓度姜黄素对胃癌SGC-7901细胞增殖、自噬性凋亡和TGF-β/Smad信号通路的影响[J]. 现代生物医学进展, 2022, 22(8): 1424-1428. |
| [15] |
包亚芳, 陈定伟, 王鸿. 姜黄素对人胃癌SGC7901细胞的抑制作用及其作用机制探讨[J]. 全科医学临床与教育, 2021, 19(5): 393-396, 402, 481. |
| [16] |
HARDEBECK S, SCHREIBER S, ADICK A, et al. A FRET-based assay for the identification of PCNA inhibitors[J]. International Journal of Molecular Sciences, 2023, 24(14): 11858. DOI:10.3390/ijms241411858 |
| [17] |
陈海燕, 曾雪莉. 花旗松素通过PI3K/AKT/mTOR通路对宫颈癌SiHa细胞自噬、凋亡和衰老的影响[J]. 天津中医药大学学报, 2022, 41(6): 789-796. DOI:10.11656/j.issn.1673-9043.2022.06.20 |
| [18] |
FENG X, XUE F, HE G H, et al. Banxia Xiexin Decoction affects drug sensitivity in gastric cancer cells by regulating MGMT expression via IL-6/JAK/STAT3-mediated PD-L1 activity[J]. International Journal of Molecular Medicine, 2021, 48(2): 165. DOI:10.3892/ijmm.2021.4998 |
| [19] |
SAKE J A, SELO M A, BURTNYAK L, et al. Knockout of ABCC1 in NCI-H441 cells reveals CF to be a suboptimal substrate to study MRP1 activity in organotypic in vitro models[J]. Official Journal of the European Federation for Pharmaceutical Sciences, 2023, 181: 106364. DOI:10.1016/j.ejps.2022.106364 |
| [20] |
WIESE W, BARCZUK J, RACINSKA O, et al. PI3K/Akt/mTOR signaling pathway in blood malignancies-new therapeutic possibilities[J]. Cancers, 2023, 15(21): 5297. DOI:10.3390/cancers15215297 |
| [21] |
刘宏根, 杨佩颖, 李小江, 等. 姜黄素抑制胃癌淋巴管生成相关因子的机制研究[J]. 天津中医药, 2021, 38(6): 794-798. |
| [22] |
易志荣, 林倚莉, 王煜姣, 等. 莪连颗粒对胃癌大鼠胃组织自噬及PI3K/Akt/mTOR信号通路的影响[J]. 中国实验方剂学杂志, 2021, 27(22): 84-91. |
 2024, Vol. 43
2024, Vol. 43