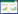文章信息
- 阳莉萍
- YANG Liping
- 基于NLRP3/Caspase-1信号通路探讨异甘草素对自身免疫性甲状腺炎小鼠的保护作用
- Protective effect of isoliquiritigenin on autoimmune thyroiditis in mice based on NLRP3/Caspase-1 signaling pathway
- 天津中医药大学学报, 2024, 43(8): 708-712
- Journal of Tianjin University of Traditional Chinese Medicine, 2024, 43(8): 708-712
- http://dx.doi.org/10.11656/j.issn.1673-9043.2024.08.07
-
文章历史
收稿日期: 2024-03-03
自身免疫性甲状腺炎(AIT)是一种典型的自身免疫性甲状腺疾病。临床上的AIT病人主要症状有甲状腺功能减退、甲状腺肿和甲状腺纤维化[1]。AIT有5种类型,分别为桥本甲状腺炎、萎缩性甲状腺炎、无痛性甲状腺炎、甲状腺功能正常的甲状腺炎和桥本甲亢,其中桥本甲状腺炎(HT)临床上最常见的一类甲状腺炎,约占22.5%[2]。近年来,HT的发病率不断上升[3]。其发病机制复杂,目前尚未完全阐明,部分研究提示炎症、免疫失调以及氧化损伤可能是AIT的重要发病机制[4-6]。其临床治疗药物,包括糖皮质激素、左旋甲状腺素、雷公藤多苷片等对部分患者有一定疗效,但它们诸多的不良反应和断药易复发是不容忽视的缺点[7]。
异甘草素是豆科植物甘草的主要活性成分之一,研究表明其具有广谱的生物活性,其主要包括抗炎、抗氧化、免疫调节等生物学效应[8-10]。基于异甘草素的药理作用与AIT的发病机制有部分重合,以及目前异甘草素对AIT的实验研究尚未见报道,因此本实验将通过皮下注射高碘水和猪甲状腺球蛋白混合液建立AIT小鼠模型,探讨异甘草素抗AIT作用。
1 材料 1.1 动物广东省医学实验动物中心购买60只SPF级、雄性的C57BL/6J小鼠,挑选体质量:18~22 g,动物合格证号:SCXK(粤)2019-0002,实验经广东医科大学动物实验伦理委员会批准,批准号:GDMU-2022-000247。
1.2 药品与试剂异甘草素:纯度≥98%,批号:062541,购买于南京景竹生物科技有限公司;碘化钠:批号:20210315,购买于上海源叶生物科技有限公司;完全弗氏佐剂:批号:251223,购买于武汉易泰科技有限公司上海分公司;不完全弗氏佐剂,批号:415214,购买于武汉易泰科技有限公司上海分公司;猪甲状腺球蛋白(PTg):批号:652917,购买于武汉易泰科技有限公司上海分公司;雷公藤多苷片:规格:10 mg×100片,批号:20210617,购买于贵州汉方药业有限公司;小鼠甲状腺过氧化物酶抗体(TPOAb)化学发光试剂盒:批号:Y26587405,购买于北京雅安达生物技术有限公司;小鼠甲状腺球蛋白抗体(TGAb)化学发光试剂盒:批号:Y59856514,购买于北京雅安达生物技术有限公司;白介素8(IL-8)ELISA检测试剂盒:批号:12587514,购买于武汉博士德生物工程有限公司;白介素6(IL-6)ELISA检测试剂盒:批号:58782157,购买于武汉博士德生物工程有限公司;白介素23(IL-23)ELISA检测试剂盒:批号:23524558,购买于武汉博士德生物工程有限公司;NLRP3单克隆抗体:批号:X52658715,购买于Abcam公司;Caspase-1单克隆抗体:批号:X12587498,购买于Abcam公司。
1.3 主要仪器DR-3518酶标分析仪购买于山东莱恩德智能科技有限公司;DM2500光学显微镜购买于奥林巴斯。RM2235型轮转切片机:徕卡显微系统(上海)贸易有限公司;ZF-368全自动凝胶成像分析系统:广州沪瑞明仪器有限公司;荧光ZEISS共聚焦显微镜购买于北京瑞科中仪科技有限公司;DYY-6D电泳仪购买于北京六一生物科技有限公司。
2 方法 2.1 AIT模型建立小鼠AIT模型的构建主要参照李泽垄等[11]方法,具体方法为将PTg和完全弗氏佐剂以1∶1配成浓度为0.25 mg/mL的油包水乳剂。皮下多点注射上述乳剂,给药剂量和频次分别为50 μg/只和1次/周,共2周。配制PTg和不完全弗氏佐剂乳化的浓度为0.25 mg/mL的油包水乳剂,并从第3周开始注射,给药方法同上,共注射3周。同时小鼠每日自由饮用浓度为0.63 mg/mL的高碘水。
2.2 分组与给药本实验共设置6组,分别为空白对照组,模型组、雷公藤多苷片组,异甘草素低中高剂量组,每组10只。造模当天给药,给药组分别灌胃给予雷公藤多苷片5 mg/(kg·d),异甘草素50 mg/(kg·d)、100 mg/(kg·d)、200 mg/(kg·d),空白对照组和模型组灌胃等量生理盐水,共给药3周。
2.3 检测指标实验结束后,异氟烷麻醉小鼠后,摘眼球取血,离心条件:3 000 r/min,离心半径87 mm,分离血清。利用ELISA检测试剂盒检测各组小鼠血清中TPOAb、TGAb、IL-8、IL-6和IL-23水平。分离各组小鼠甲状腺组织,于10%中性甲醛溶液浸泡24 h,分别于70%、95%和100%酒精中梯度脱水3 h,石蜡包埋后,切片,厚度为5 μm,按试剂盒方法进行组织切片HE染色。
将各组甲状腺组织切片分别浸泡二甲苯2次,每次10 min,随后分别浸泡于100%、95%、70%的乙醇以及纯化水中10 min进行梯度水化。将组织切片浸泡于含EDTA抗原修复液(pH9.0)的高压锅中10 min进行抗原修复,PBS洗3次,5 min/次,使用0.5% TritonX-100溶液浸泡30 min,随后PBS洗3次,5 min/次,使用2% BSA溶液浸泡30 min,不洗,于4 ℃冰箱孵育NLRP3和Caspase-1一抗过夜,PBS洗3次,5 min/次,接着常温孵育荧光二抗1 h,PBS洗3次,每次5 min/次,使用DAPI溶液孵育5 min,PBS洗3次,5 min/次,使用荧光显微镜下拍照,image J软件分析图片荧光强度。
配制合适浓度的SDS-PAGE分离胶-浓缩胶。每孔加入10 uL甲状腺组织样品(总蛋白浓度50 μg)和5 μL彩色预染蛋白Marker,120 V恒压跑胶。甲醇浸泡PVDF膜5 min后,110 V恒压转模120 min。使用5%脱脂奶粉室温封闭PVDF膜2 h。TBST摇床晃动洗膜5次,10 min/次。随后将膜用NLRP3和Caspase-1一抗于4 ℃冰箱中孵育过夜,TBST洗膜5次,10 min/次,接着室温继续孵育二抗1 h。TBST洗膜5次,10 min/次。将PVDF膜滴上显影液后放入成像仪器中曝光并拍照,保存蛋白电泳条带图。使用Image J软件,分析其相对蛋白表达量。
3 统计学方法实验数据选用SPSS 16.0软件及GraphPad Prism 7.0整理分析。计量资料数据以均数±标准差(x ± s)表示,多组间比较采用单因素方差分析(One-way ANOVA),P<0.05认为差异有统计学意义。
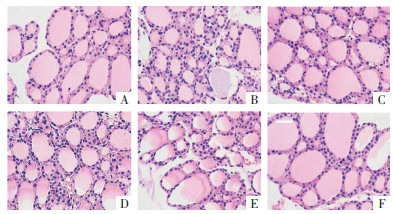
4 结果 4.1 异甘草素对各组小鼠甲状腺组织病理学变化的影响如图 1所示,空白对照组小鼠甲状腺组织中腺泡比较规则,呈立方状,间质厚度均匀,胶质饱满,无明显的炎症细胞浸润。而模型组小鼠的甲状腺结构明显紊乱,不规则滤泡多见,胶质明显减少,滤泡间隔明显增厚,炎症细胞浸润明显。给药后改善效果明显,可见雷公藤多苷片组和异甘草素给药组甲状腺滤泡间隔明显变薄,胶质明显增多,炎症细胞浸润明显减轻,异甘草素呈剂量依赖性地改善上述症状。
|
| 注:A,空白对照组;B,模型组,C,雷公藤多苷片组;D,异甘草素低剂量组;E,异甘草素中剂量组;F,异甘草素高剂量。 图 1 各组小鼠甲状腺组织病理学变化(HE染色,×10) |
如表 1所示,相对于假手术组,模型组小鼠血清TGAb和TPOAb水平显著上调(P < 0.01)。而相对于模型组,其他给药组小鼠血清TGAb和TPOAb水平显著下调(P < 0.01)。其中异甘草素给药组下调TGAb和TPOAb水平呈剂量依赖性。
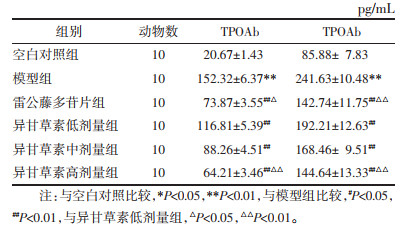
如表 2所示,相对于空白对照组,模型组小鼠血清IL-8、IL-6和IL-23水平显著上调(P < 0.01)。相对于模型组,其他给药组小鼠血清IL-8、IL-6和IL-23水平显著下调(P < 0.05)。其中异甘草素给药组下调TGAb和TPOAb水平呈剂量依赖性。
相对于空白对照组,模型组小鼠甲状腺组织NLRP3和Caspase-1蛋白表达水平显著上调(P < 0.01)。相对于模型组,其他给药组小鼠甲状腺组织NLRP3和Caspase-1蛋白表达水平显著下调(P < 0.01)。图见开放科学(资源服务)标识码(OSID)。
4.5 异甘草素对各组小鼠甲状腺组织NLRP3和Caspase-1蛋白的表达水平的影响如图 2所示,相对于空白对照组,模型组小鼠甲状腺组织NLRP3和Caspase-1蛋白的相对表达水平显著上调(P < 0.01)。相对于模型组,其他给药组小鼠甲状腺组织NLRP3和Caspase-1蛋白相对表达水平显著下调(P < 0.05)。其中异甘草素给药组下调NLRP3和Caspase-1蛋白相对表达水平呈剂量依赖性。
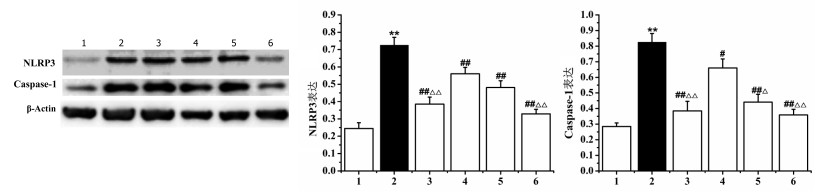
|
| 注:1为空白对照组,2为模型组,3为雷公藤多苷片组,4为异甘草素低剂量组,5为异甘草素中剂量组,6为异甘草素高剂量组,与空白对照比较,**P<0.01,与模型组比较,#P<0.05,##P<0.01,与异甘草素低剂量组,△P<0.05,△△P<0.01。 图 2 各组小鼠甲状腺组织NLRP3和Caspase-1蛋白的表达水平(x ± s) |
AIT是一种临床上常见的器官特异性免疫疾病。虽然目前用于建立AIT动物模型有多种方法,例如脾细胞体外活化移植诱导法、cDNA疫苗免疫法、高碘联合Tg法以及高碘诱发法等[12],但以高碘联合Tg的造模方法最为常用,是建立AIT小鼠模型最为理想的方法[13],而AIT动物模型的病理特点是甲状腺内淋巴细胞广泛浸润。雷公藤多苷对AIT药效确切,早已有研究证实[14],此外,其商品化药物雷公藤多苷片具有祛风解毒、除湿消肿和舒经通络的作用,用于治疗类风湿性关节炎、肾病综合征和系统性红斑狼疮等自身免疫性疾病,研究表明其药理作用包括抗炎、免疫调节以及抗氧化损伤等[15]。故本研究选取雷公藤多苷片作为阳性对照药,探讨异甘草素抗AIT效果。
异甘草素是豆科植物甘草的主要活性成分之一,研究表明其具有抗炎、抗氧化、免疫调节等广谱的生物活性[8-10]。NLRP3/Caspase-1信号通路与AIT的关系是近年来研究的热点,由NLRP3、ASC和Caspase-1所组成的NLRP3炎性体与先天性免疫密切相关[16],其可通过激活Caspase-1,从而将IL-1β等前体炎症因子加工成具有活性炎症因子[17]。GUO等[18]研究表明增强的NLRP3在AIM2介导的甲状腺滤泡细胞的甲状腺功能亢进以及细胞因子分泌均与AIT密切相关。此外,JIANG等[19]研究显示免疫细胞通过NLRP3/Caspase-1炎性体途径参与了先天免疫应答。本研究发现模型组小鼠甲状腺结构紊乱,滤泡不规则明显,胶质明显减少,滤泡间隔明显增厚,可见大量的炎症细胞浸润其中。与李泽垄等[11]研究一致,初步认为AIT小鼠模型构建成功。异甘草素呈浓度依赖性地减轻甲状腺病理学损伤,还可下调血清TGAb和TPOAb水平。而异甘草素高剂量组的改善效果与雷公藤多苷片组相似。
近年来,IL-23已被证实参与了AIT发生发展进程,IL-23主要通过促进Th17细胞的增殖以及分化,活化的Th17细胞进一步分泌大量的IL-17,进一步促进AIT的炎症反应以及免疫损伤[20]。此外,IL-23与IL-17还形成了一条特殊的炎性轴,进一步激活多条炎症相关信号通路,诱导IL-6和IL-8等多种炎症因子的释放,其在AIT进程发挥关键作用[21]。本研究结果显示异甘草素呈浓度依赖性地下调血清IL-6、IL-8和IL-23水平。而异甘草素高剂量组下调血清IL-6、IL-8和IL-23水平与雷公藤多苷片组相似。
异甘草素可能通过调控NLRP3/Caspase-1信号通路以及抑制炎症,从而改善AIT小鼠的甲状腺功能,该研究初步为异甘草素作为抗AIT新药提供部分理论依据。
| [1] |
PAPARO S R, FERRARI S M, PATRIZIO A, et al. Myoinositol in autoimmune thyroiditis[J]. Frontiers in Endocrinology, 2022, 13: 930756. DOI:10.3389/fendo.2022.930756 |
| [2] |
王苹. 桥本甲状腺炎的病因和治疗研究进展[J]. 医学理论与实践, 2022, 35(15): 2556-2558, 2555. |
| [3] |
MARTINEZ QUINTERO B, YAZBECK C, SWEENEY L B. Thyroiditis: evaluation and treatment[J]. American Family Physician, 2021, 104(6): 609-617. |
| [4] |
DUNTAS L H, ALEXANDRAKI K I. On the centennial of vitamin D-vitamin D, inflammation, and autoimmune thyroiditis: A web of links and implications[J]. Nutrients, 2022, 14(23): 5032. DOI:10.3390/nu14235032 |
| [5] |
RAGUSA F, FALLAHI P, ELIA G, et al. Hashimotos' thyroiditis: epidemiology, pathogenesis, clinic and therapy[J]. Best Practice & Research Clinical Endocrinology & Metabolism, 2019, 33(6): 101367. |
| [6] |
RUGGERI R M, CAMPENNÍA, GIUFFRIDA G, et al. Oxidative stress as a key feature of autoimmune thyroiditis: an update[J]. Minerva Endocrinologica, 2020, 45(4): 326-344. |
| [7] |
范尧夫, 刘克冕, 张会峰, 等. 中西医结合治疗桥本甲状腺炎甲状腺功能减退的Meta分析[J]. 中国实验方剂学杂志, 2016, 22(3): 221-224. |
| [8] |
孙建军, 周杰, 李长栋, 等. 异甘草素对颅脑损伤大鼠IL-6和IL-10表达的影响[J]. 中华神经创伤外科电子杂志, 2021, 7(1): 12-16. |
| [9] |
王贵佐, 王霜, 陈芬芬, 等. 异甘草素对小鼠急性肺损伤的保护作用及其机制[J]. 山西医科大学学报, 2021, 52(3): 283-288. |
| [10] |
郭傲. 甘草及其成分促进Treg细胞的产生与功能及单倍体干细胞M期观察的研究[D]. 合肥: 中国科学技术大学, 2016.
|
| [11] |
李泽垄, 李智奇, 喻涛. 基于Notch1/ROR-γt信号通路研究芹菜素对自身免疫性甲状腺炎小鼠的保护作用[J]. 广东药科大学学报, 2021, 37(6): 89-94. |
| [12] |
姜玲, 胡玲, 黄慧钟. 实验性自身免疫性甲状腺炎动物模型的比较[J]. 实用临床医学, 2010, 11(3): 7-9, 139. |
| [13] |
田恩江, 赵树君, 孙富军, 等. 3种诱导自身免疫性甲状腺炎动物模型的效果比较[J]. 中国地方病学杂志, 2003, 22(6): 488-491. |
| [14] |
李智奇, 喻涛. 萝卜硫素对自身免疫性甲状腺炎小鼠的作用及机制[J]. 广东药科大学学报, 2022, 38(2): 50-54. |
| [15] |
姜淼, 张海波, 丁樱. 雷公藤多苷药理作用及临床应用研究进展[J]. 中华中医药学刊, 2021, 39(3): 59-63. |
| [16] |
WANG F H, LIANG Q Q, MA Y X, et al. Silica nanoparticles induce pyroptosis and cardiac hypertrophy via ROS/NLRP3/Caspase-1 pathway[J]. Free Radical Biology and Medicine, 2022, 182: 171-181. DOI:10.1016/j.freeradbiomed.2022.02.027 |
| [17] |
蔡琳, 易小波, 袁利邦, 等. 丹参酮ⅡA通过NLRP3炎症体信号通路对小胶质细胞糖氧剥夺/再灌注损伤的保护作用[J]. 四川大学学报(医学版), 2016, 47(5): 660-664. |
| [18] |
GUO Q L, WU Y, HOU Y Y, et al. Cytokine secretion and pyroptosis of thyroid follicular cells mediated by enhanced NLRP3, NLRP1, NLRC4, and AIM2 inflammasomes are associated with autoimmune thyroiditis[J]. Frontiers in Immunology, 2018, 9: 1197. DOI:10.3389/fimmu.2018.01197 |
| [19] |
JIANG W K, LV H P, WANG H J, et al. Activation of the NLRP3/caspase-1 inflammasome in human dental pulp tissue and human dental pulp fibroblasts[J]. Cell and Tissue Research, 2015, 361(2): 541-555. DOI:10.1007/s00441-015-2118-7 |
| [20] |
周晓丽. 碘摄入量过高对BABL/c小鼠IL-23、IL-17、IFN-γ表达的影响[D]. 天津: 天津医科大学, 2014.
|
| [21] |
柯文才, 毛会军, 顾芸霞, 等. 维生素D在NOD.H-2h4小鼠实验性自身免疫性甲状腺炎中的作用研究[J]. 检验医学与临床, 2021, 18(3): 289-292. |
 2024, Vol. 43
2024, Vol. 43