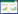文章信息
- 王三凤, 陈炜, 何程, 栾军
- WANG Sanfeng, CHEN Wei, HE Cheng, LUAN Jun
- 基于MAPK/ERK/Nrf2信号通路的参七虫草方对肺纤维化大鼠免疫串化的动态实验研究
- Dynamic experimental study on the effect of Shenqi Chongcao Formula on immune tandem reaction in IPF model rats based on the MAPK/ERK/Nrf2 signal pathway
- 天津中医药大学学报, 2024, 43(8): 713-722
- Journal of Tianjin University of Traditional Chinese Medicine, 2024, 43(8): 713-722
- http://dx.doi.org/10.11656/j.issn.1673-9043.2024.08.08
-
文章历史
收稿日期: 2024-03-05
2. 安徽中医药大学第一附属医院呼吸内科, 合肥 230031
2. The First Affiliated Hospital of Anhui University of Chinese Medicine, Hefei 230031, China
特发性肺纤维化(IPF)是一种原因不明的、具有特定的病理及影像学表现的、慢性进行性纤维化性间质性肺炎[1],以刺激性干咳、进行性加重的呼吸困难和肺功能下降为主要临床表现。有报道表明IPF的发病率呈上升趋势[2],且其预后与一些恶性肿瘤相似甚至更差[3]。在美国胸科协会(ATS)、欧洲呼吸病学会(ERS)、日本呼吸病学会(JRS)以及拉丁美洲胸科联盟(ALAT)更新的IPF临床诊疗指南中[4],仅将尼达尼布和吡非尼酮作为IPF非急性加重期的治疗药物,然其治疗效果并不理想。
近年研究发现,免疫细胞参与肺部的炎症反应,调节肺间质细胞的迁移、增殖和功能转化,通过细胞因子的分泌、胶原的代谢等环节在IPF的发生发展过程中起着重要作用[5]。IPF发生和发展的主要机制是不受控制的免疫反应和不平衡的损伤-炎症-修复过程[6]。免疫反应发展的进程是通过细胞因子激活免疫细胞、免疫细胞从而进一步释放细胞因子的过程,本课题组将这种过度的“细胞因子-免疫细胞-细胞因子”串联的免疫反应称之为“免疫串化”。在肺受损的情况下,多种调控因子层层传导,与肺部主要的免疫细胞——巨噬细胞表面受体结合,促进其表型转化,进而释放更多的免疫因子,加速肺纤维化进程。因此,及早干预IPF的“免疫串化”现象、延缓肺重塑,对于改善患者的预后、提高患者的生存质量有着重要的意义。
参七虫草方是在国医大师韩明向教授“虚瘀”理论指导下形成的经验方,组方简小却不失灵验,由西洋参、三七、冬虫夏草、黄精、虎杖组成,有补益肺肾,益气养阴活血之效。前期研究显示[7-9],参七虫草方可以调控PI3K/AKT/HIF-1α通路、ASS1介导的Src/STAT3、MAPK/ERK的信号通路,又能促进Th1/Th2细胞因子平衡恢复,进而干预免疫反应,减轻肺部炎症,干预血管新生,延缓肺纤维化的进展。本研究在前期基础之上,立足于巨噬细胞角度,基于MAPK/ERK/Nrf2信号通路,探究参七虫草方调控IPF大鼠“免疫串化”的过程。
1 实验材料与方法 1.1 实验动物辽宁长生生物技术股份有限公司提供的150只SPF级雄性SD大鼠,鼠龄(7±1)周,体质量(220±20) g。动物合格证书号:SCXK(辽)2020-0001。伦理审批号:2023049。
1.2 实验药物戊巴比妥钠(国药集团化学试剂有限公司);博来霉素(Invitrogen公司);参七虫草方(西洋参15 g,三七10 g,冬虫夏草3 g,黄精10 g,虎杖9 g,由安徽省中医院制剂中心提供);吡非尼酮胶囊(北京康蒂尼药业有限公司);Nrf2抑制剂ML385(MedChem Express公司)。
1.3 主要试剂p-MAPK(bioss公司,批号:AD19526602);p-ERK(CST公司,批号:11);抗AP-1单克隆抗体(bioss公司,批号:AG19526310);大鼠Nrf2、HO-1试剂盒(武汉基因美科技有限公司,批号:GR2022-11);DEPC-H2O(Generay Biotech公司,批号:2208G12);Trizol(Life technogies公司,批号:391305);PrimeScriptTM RT reagent Kit with gDNA Eraser(TaKaRa公司,批号:ALG2080A);Novostart SYBR qPCR SuperMix Plus(novoprotein公司,批号:05246001);CD68-FITC(Santa Crruz公司,批号:A2213);CD86-PE(Santa Crruz公司,批号:F1614);CD206-Alexa FluorⓇ647(Santa Crruz公司,批号:C2818);PBS(Hyclone公司,批号:AD24464280)等。
1.4 主要仪器低速迷你离心机(海门市其林贝尔仪器制造有限公司);普通PCR仪(杭州晶格科学仪器有限公司);荧光定量PCR仪(Thermo Scientific);PIKO Plate Illuminator(Thermo Scientific);流式细胞仪(BECKMAN公司);微量移液器(德国Eppendorf);移液枪(Dragon公司)等。
1.5 实验方法 1.5.1 模型制备根据既往实验研究,简单随机抽样法将150只SPF级雄性SD大鼠均分成5组:空白组(Ctrl组)、模型组(IPF组)、参七虫草组(SQCC组)、吡非尼酮组(PFD组)、Nrf2抑制剂ML385组(ML385组)。除Ctrl组以外,其余四组大鼠均采用气管内滴注博来霉素法制备IPF大鼠模型[10]。用1%戊巴比妥钠(40 mg/kg)腹腔注射以麻醉,固定大鼠后将灌胃针置于其后咽部,待回抽无阻力,经气管向近心端缓慢注入5 mg/ml浓度的博来霉素生理盐水混合液(5 mg/kg),后迅速拿起大鼠保持其直立,旋转8~10次。Ctrl组向气管内滴注同等体积的生理盐水,操作方法同前。
1.5.2 分组及给药除Ctrl组外,其余四组大鼠均于博来霉素造模1 d后给药,SQCC组予参七虫草方汤剂灌胃(每天0.423 g/kg,相当于成人剂量6.3倍);PFD组予溶于生理盐水的吡非尼酮粉末灌胃(每天50 mg/只)[11];ML385组予以Nrf2抑制剂ML385(30 mg/kg)腹腔内注射,每周2次[12];A组、B组均按1 mL/100 g生理盐水灌胃。给药疗程为28 d。
1.5.3 取材与标本采集于药物干预后的第7、14、21、28天取材,各组分别处死大鼠6~8只。大鼠麻醉后(方法同前)腹主动脉采血并置-80 ℃冷藏,采血后迅速打开胸腔,分离肺脏,生理盐水洗去肺组织上的血液。取右肺组织浸于福尔马林溶液固定,以备病理切片和免疫组化检测用;取左肺组织置于EP管,并于液氮中冷藏,以供基因、免疫细胞群检测用。
2 实验观察与指标检测 2.1 动物一般情况观测大鼠的精神状态、口唇及四肢爪甲色泽、饮食及体质量等情况。
2.2 肺组织病理学观察大鼠右肺组织以福尔马林固定、石蜡包埋、切片、HE及Masson染色,观察病理学改变,评价肺泡炎症和肺纤维化的程度。
2.3 ELISA法检测各组大鼠血清Nrf2、HO-1的含量将冷冻的血液取出融化后,在室温平15~30 min,离心20 min左右(2 000~3 000 r/min,离心半径30 cm),仔细收集血清。严格按照HO-1、Nrf2酶联免疫分析试剂盒的说明书进行操作,试验结果判定以酶标仪读数为准,最后计算血清中Nrf2及HO-1的实际浓度。
2.4 RT-qPCR法检测各组大鼠肺组织MEK1、MEK2、ERK1、ERK2、AP-1的基因相对表达量称取大鼠肺组织约100 mg,剪碎、液氮研磨成粉末状、收集粉末、加入TRIzol裂解,并依次进行RNA的提取、RT反应、荧光定量PCR反应,Relative Quantification Study法进行分析,2-ΔΔCt法进行计算。荧光定量PCR反应中各检测指标引物序列见表 1。
将采集到的各组大鼠肺组织制备成单细胞悬液;收集各组细胞加入适量的CD86的抗体,常温避光15 min;加入细胞固定液和破膜液、适量的CD68和CD206,常温避光20 min;PBS洗涤并重悬细胞;流式细胞仪进行检测、FlowJo_V10软件进行分析。
3 统计方法SPSS 26.0统计学软件进行数据分析。定量资料以均数±标准差(x±s)表示,组间两两比较采用SNK法,多组间采用单因素方差分析。若数据非正态分布或方差不齐,则采用非参数检验。P < 0.05为差异有统计学意义。
4 结果 4.1 大鼠一般情况造模前,各组大鼠一般情况无明显差异。造模后,同时间点下Ctrl组大鼠精神状态最佳,活动最多,口唇及四肢爪甲颜色正常,饮食正常;IPF组大鼠精神状态最差,活动量小,多数大鼠可见口唇及四肢爪甲明显紫绀,饮食量明显减少;其余三组大鼠一般状况介于Ctrl组与IPF组之间,精神状态一般,活动量尚可,部分可见口唇及四肢爪甲轻、中度紫绀,饮食量尚可。药物干预3~4周后,SQCC组、PFD组及ML385组大鼠一般状态较前两周有所改善。
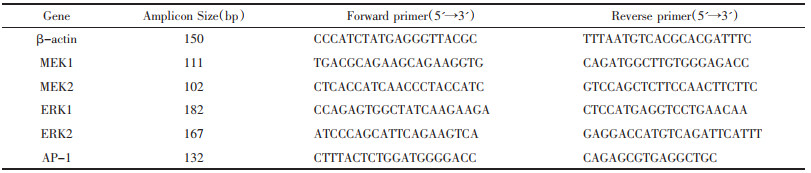
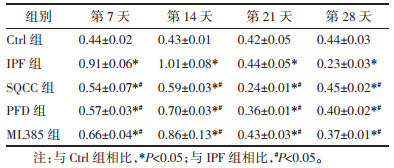
造模前称取并记录大鼠体质量,此后每隔7 d称重记录,各组大鼠体质量均随时间增加。造模前各组大鼠体质量无明显差异(P > 0.05)。造模后第7天,同时间点下相较于Ctrl组,其余四组大鼠体质量均较低,但差异无统计学意义(P > 0.05);相较于IPF组,药物干预的三组大鼠体质量均高,但差异无统计学意义(P > 0.05)。造模后第14、21、28天,同时间点下相较于Ctrl组,其余4组大鼠体质量均低(P < 0.05);相较于IPF组,药物干预的3组大鼠体质量均高(P < 0.05)。同时间点下,药物干预的3组大鼠体质量差异无统计学意义(P > 0.05)。见图 1。可见,肺纤维化模型大鼠的体质量较正常大鼠体质量增加缓慢,参七虫草方、吡非尼酮、Nrf2抑制剂干预后均能改善肺纤维化大鼠体质量增加缓慢的状况,且参七虫草方的作用非劣于吡非尼酮和Nrf2抑制剂。
|
| 图 1 大鼠体质量变化情况(x±s,g) |
Ctrl组大鼠肺组织结构较完整,轮廓清晰,未见明显炎性细胞浸润,间隔未见增厚。同时间点,IPF组大鼠可见不同程度的肺泡结构破坏、肺泡腔融合、间隔增宽,肺组织有不同程度的炎性细胞浸润,且病变程度随天数的增加而明显加重。药物干预的3组大鼠肺组织病理变化趋势类似于IPF组,但同时间点下的病变程度较模型组轻,且3组间的病变程度差异不明显。见图 2。可见,肺纤维化大鼠的肺组织内存在炎症反应,正常肺泡结构被破坏,参七虫草方、吡非尼酮、Nrf2抑制剂干预后均能减轻肺纤维化大鼠肺组织内的炎症反应和肺泡受损程度,且参七虫草方的作用非劣于吡非尼酮和Nrf2抑制剂。
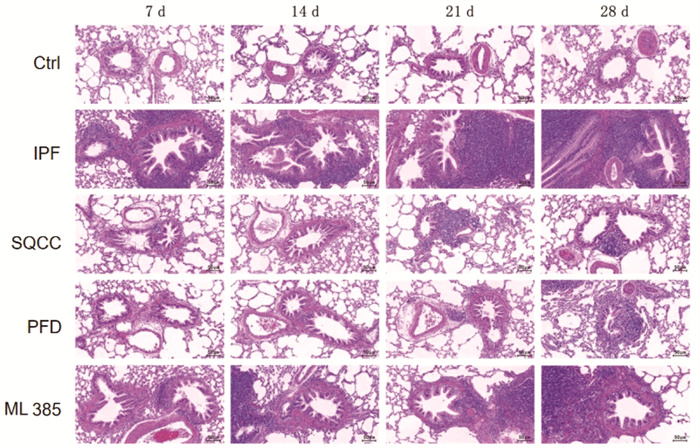
|
| 图 2 大鼠肺组织HE染色结果(×200) |
Ctrl组大鼠支气管管壁及血管壁结构正常,周围未见明显蓝染区。同时间点,IPF组大鼠可见气管、血管周围有不同面积的蓝染区,气管、血管被不同数量的蓝色胶原纤维包围,且蓝染区的面积随天数的增加而明显变大,胶原逐渐致密,呈粗条索状或大片分布状,最终形成纤维化改变。药物干预的3组大鼠气管及血管胶原纤维形成趋势类似于IPF组,但同时间点下的蓝色胶原沉积程度较模型组轻,且3组间的纤维化改变程度差异不明显。见图 3。可见,肺纤维化大鼠的肺组织存在纤维化改变,参七虫草方、吡非尼酮、Nrf2抑制剂干预后均能减轻肺纤维化大鼠肺组织的纤维化程度,且参七虫草方的作用非劣于吡非尼酮和Nrf2抑制剂。
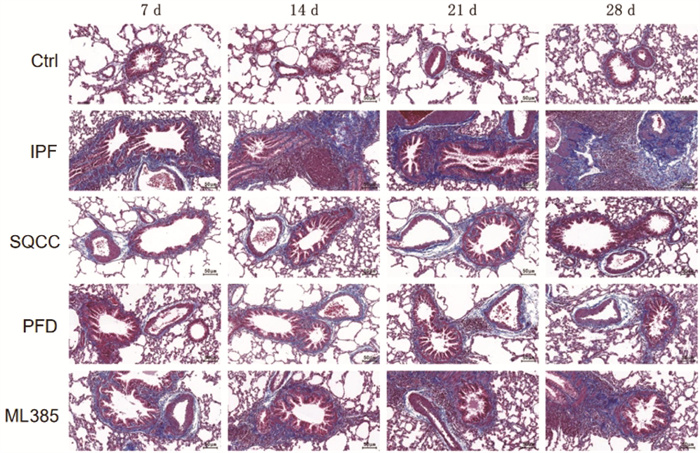
|
| 图 3 大鼠肺组织Masson染色结果(×200) |
同时间点,相较于Ctrl组,其余四组大鼠肺组织Nrf2、HO-1的含量明显升高(P < 0.05)。相较于IPF组,药物干预的3组大鼠肺组织Nrf2、HO-1的含量明显降低(P < 0.05)。药物干预的3组大鼠肺组织Nrf2、HO-1的含量无明显差异(P > 0.05)。见图 4。可见,肺纤维化大鼠血清中存在着Nrf2和HO-1的高表达,参七虫草方、吡非尼酮、Nrf2抑制剂干预后均能降低肺纤维化大鼠血清中Nrf2和HO-1的含量,且参七虫草方的作用非劣于吡非尼酮和Nrf2抑制剂。
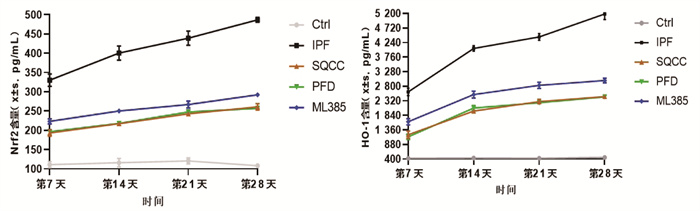
|
| 图 4 大鼠血清Nrf2、HO-1含量(x±s,pg/mL) |
同时间点,相较于Ctrl组,其余4组大鼠肺组织MEK1、MEK2、ERK1、ERK2、AP-1 mRNA的相对表达量明显升高(P < 0.05)。相较于IPF组,药物干预的3组大鼠MEK1、MEK2、ERK1、ERK2、AP-1 mRNA的相对表达量明显降低(P < 0.05)。同时间点下,药物干预的3组大鼠肺组织MEK1、MEK2、ERK1、ERK2、AP-1 mRNA的相对表达量差异无统计学意义(P > 0.05)。见图 5。可见,肺纤维化大鼠肺组织内存在着MEK1、MEK2、ERK1、ERK2、AP-1的高表达,参七虫草方、吡非尼酮、Nrf2抑制剂干预后均能降低肺纤维化大鼠肺组织内MEK1、MEK2、ERK1、ERK2和AP-1的含量,且参七虫草方的作用非劣于吡非尼酮和Nrf2抑制剂。
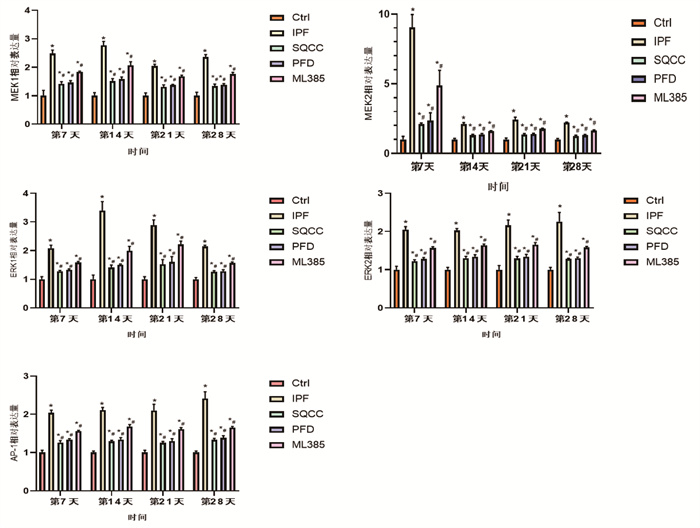
|
| 注:与Ctrl组相比,*P<0.05;与IPF组相比,#P<0.05 图 5 大鼠肺组织MEK1、MEK2、ERK1、ERK2、AP-1 mRNA相对表达量(x±s) |
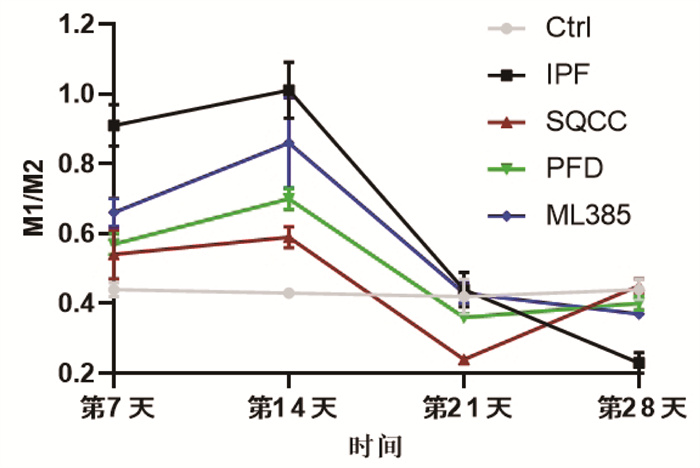
同时间点,相较于Ctrl组,IPF组大鼠早期肺组织巨噬细胞M1/M2明显升高(P < 0.05),后期M1/M2明显降低(P < 0.05);药物干预的3组大鼠早期肺组织巨噬细胞M1/M2明显升高(P < 0.05),后期M1/M2无明显差异(P > 0.05)。相较于IPF组,药物干预的3组大鼠早期肺组织巨噬细胞M1/M2明显降低(P < 0.05),后期M1/M2明显升高(P < 0.05)。结果见图 6、图 7、图 8、图 9、图 10。可见,肺纤维化大鼠肺组织内早期存在着巨噬细胞向M1型极化的过程,后期存在着巨噬细胞向M2型极化的过程,参七虫草方、吡非尼酮、Nrf2抑制剂干预后巨噬细胞早期向M1型极化的过程、后期向M2型极化的过程会被抑制,且参七虫草方的抑制作用非劣于吡非尼酮和Nrf2抑制剂。
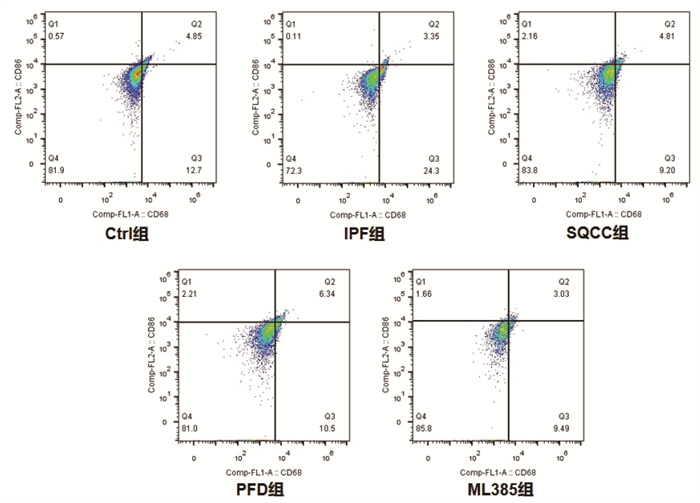
|
| 图 6 第7天大鼠肺组织M1型巨噬细胞检测图 |
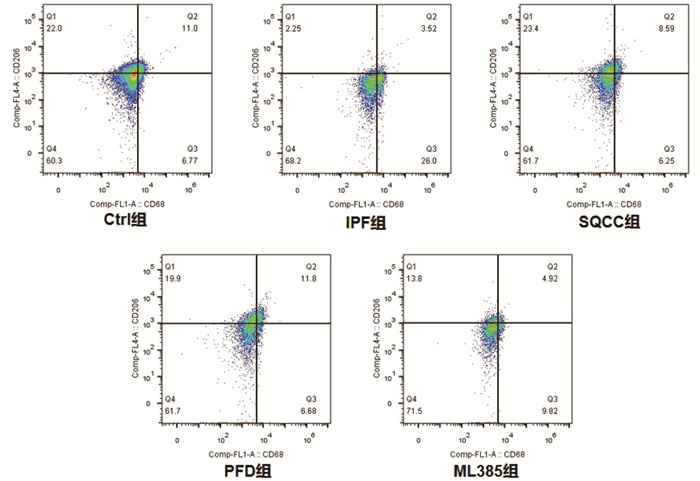
|
| 图 7 第7天大鼠肺组织M2型巨噬细胞检测图 |
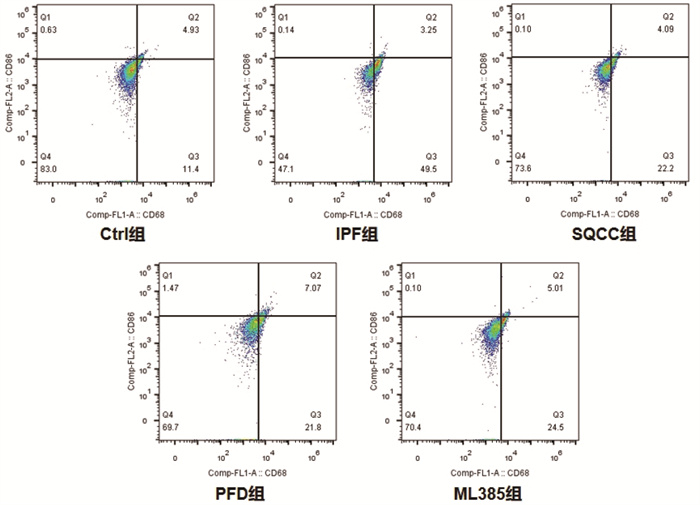
|
| 图 8 第28天大鼠肺组织M1型巨噬细胞检测图 |
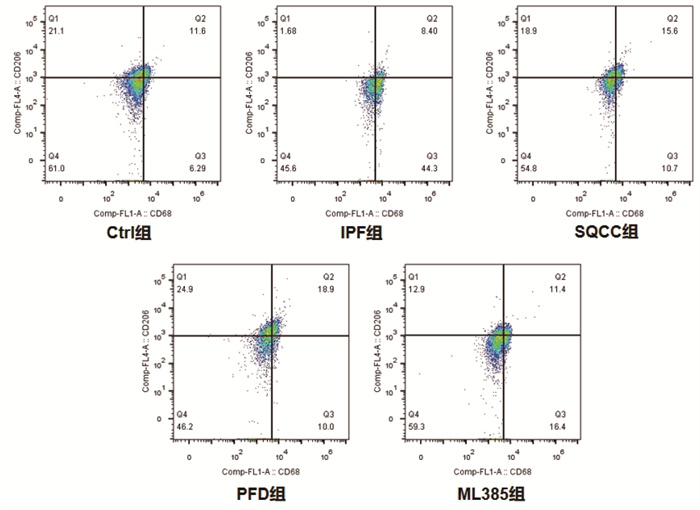
|
| 图 9 第28天大鼠肺组织M2型巨噬细胞检测图 |
|
| 图 10 大鼠肺组织巨噬细胞M1/M2 |
IPF的发生发展不仅与细胞外基质沉积有关,还与肺脏结构的破坏、远端气道的异常重塑以及气体交换的受损等有关。一旦肺脏结构被破坏,即使使用高效的抗纤维化药物也很难恢复正常,肺功能也会逐渐丧失[13]。吡非尼酮和尼达尼布能够减缓疾病的进展,但也存在一些局限性[13]。因此,新的IPF的特异性药物亟待被研发,更好地了解IPF的发病机制和信号通路有助于药物的研发。
巨噬细胞既是肺部的主要抗菌吞噬细胞,也是IPF的中心介质。在肺纤维化过程的早期炎症阶段,肺组织中的巨噬细胞被Th1型细胞因子活化为促炎性M1表型,诱导肺组织持续的炎症反应,造成组织损伤[14]。在肺纤维化过程的中后期,肺组织中M2型巨噬细胞的比例显著增加,高表达多种趋化因子和促纤维化因子[15],趋化因子又可作用于来源细胞,进一步招募巨噬细胞,加速免疫炎症反应。此为巨噬细胞所参与的肺纤维化发病机制。据此,该课题组将过度“细胞因子-免疫细胞-细胞因子”串联的免疫反应称为“免疫串化”。IPF属于中医“肺痿”“肺痹”的范畴,本课题组认为IPF的病机特点为“肺失治节,因虚致瘀”。肺气阴皆虚,日久不愈,迁延于肾,肺肾气阴两虚为病之本;肺失治水,痰浊内停,气机阻滞,瘀血内生,痰瘀滞络为病之标,IPF存在气、血、水的失衡。参七虫草方以益气养阴活血立法,是国医大师韩明向教授在“虚瘀”病机理论指导下的形成的临床效验方,能够益气、养阴、活血,从气、血、水重建肺之治节之功。药理研究表明,西洋参中的多糖和皂苷类成分能够通过影响巨噬细胞的吞噬能力而调节免疫[16];三七能够通过抑制肺成纤维细胞的增殖及向肌成纤维细胞的转化、调节TGF-β1/Smads信号通路、NF-κB信号通路、肺组织CatB/CatD和Fas/FasL的活性等多个途径干预模型动物肺纤维化的进展[17];冬虫夏草菌丝能够通过抑制炎症因子及免疫细胞延缓肺纤维化[18]。既往研究发现参七虫草方能够通过多靶点干预肺纤维化的进程[7-9],此次实验基于MAPK/ERK/Nrf2信号通路,立足于巨噬细胞角度,在既往研究基础上进一步深化研究。实验共设计5个组别,包括空白组、模型组、参七虫草组,以及有延缓肺纤维化进展的两个药物组别——吡非尼酮组与Nrf2抑制剂ML385组,以作结果对比。
M1型巨噬细胞高表达CD86、CD11c等细胞表面抗原,M2型巨噬细胞高表达CD163、CD206等细胞表面抗原[19],因此,可通过检测这些细胞表面抗原来计算亚型巨噬细胞的阳性率。本实验研究结果显示,同时间点下相较于空白组,模型组大鼠早期肺组织巨噬细胞M1/M2明显升高(P < 0.05),后期M1/M2明显降低(P < 0.05);药物干预的3组大鼠早期肺组织巨噬细胞M1/M2明显升高(P < 0.05),后期M1/M2无明显差异(P > 0.05)。相较于模型组,药物干预的3组大鼠早期肺组织巨噬细胞M1/M2明显降低(P < 0.05),后期M1/M2明显升高(P < 0.05)。结果表明,参七虫草方可在早期抑制巨噬细胞向M1型的极化,减轻肺纤维化进程中的早期炎症反应;在后期抑制巨噬细胞向M2型的极化,延缓肺纤维化进程中的纤维化改变。
丝裂原活化蛋白激酶(MAPK)和细胞外调节蛋白激酶(ERK)共同介导的信号通路,即信号通路,MAPK/ERK信号通路,是免疫炎症反应的一条重要信号转导通路[20]。MAPK是真核细胞中的重要蛋白激酶,能够将细胞外信号向真核细胞内传输,广泛参与机体炎症与纤维化过程[21]。ERK是MAPK信号酶的一种,与IPF关系最为密切[22],其主要有ERK1和ERK2两种类型。核因子E2相关因子2(Nrf2)是调控细胞对抗外来异物及氧化损伤的关键转录因子[23];血红素加氧酶-1(HO-1)是调节血红素分解代谢的限速酶,是Nrf2发挥作用的重要媒介,且这一作用与巨噬细胞密切相关;衔接蛋白复合物-1(AP-1)作为炎症信号的最终汇合点,介导巨噬细胞活化的过程,与相应炎症介质的基因调控区的TPA反应元件(TRE)结合,调控炎症介质的表达,影响IPF免疫平衡[24]。研究表明[25],血管内皮细胞ERK或MAPK的抑制因子能够阻止Nrf2发生核转移,Nrf2的核转移需要MAPK的激活;活化的Nrf2和AP-1转移到细胞核,诱导多种基因发挥抗氧化作用,并调控炎症细胞因子,从而进一步放大炎症反应。当MAPK/ERK/Nrf2信号通路被激活时,HO-1、AP-1等细胞因子高度表达,介导以巨噬细胞为核心的免疫反应,发起“免疫串化”,加重肺间质免疫损伤。本实验研究结果显示,同时间点下,相较于空白组,其余4组大鼠肺组织Nrf2、HO-1含量及MEK1、MEK2、ERK1、ERK2、AP-1 mRNA的相对表达量均明显升高(P < 0.05),表明肺纤维化大鼠体内存在MAPK/ERK/Nrf2信号通路的激活和细胞因子HO-1、AP-1的高度表达;相较于模型组,药物干预的三组大鼠肺组织Nrf2、HO-1含量及MEK1、MEK2、ERK1、ERK2、AP-1 mRNA的相对表达量均降低(P < 0.05),表明参七虫草方同吡非尼酮与Nrf2抑制剂ML385,均能抑制MAPK/ERK/Nrf2信号通路,降低HO-1、AP-1的表达水平,且参七虫草方的作用非劣于吡非尼酮与Nrf2抑制剂。结合大鼠体质量变化及肺组织病理染色结果,说明参七虫草方可减轻肺纤维化大鼠肺部炎症损伤,减少胶原沉积。
综上所述,参七虫草方可干预IPF大鼠肺部的“免疫串化”反应,减轻炎症损伤,减少胶原沉积,延缓肺纤维化进展,其机制可能与抑制MAPK/ERK/Nrf2信号通路、降低细胞因子HO-1、AP-1的表达水平、干预巨噬细胞极化有关,故MAPK/ERK/Nrf2信号通路可能是潜在的IPF治疗靶点。然而本次实验数据量小,实验进行时间较短,为了进一步验证该治疗靶点的可靠性,仍需要进行大量实验以补充不足。
| [1] |
徐莉莉, 洪赟晢, 李智慧, 等. 特发性肺纤维化预后标志物的研究进展[J]. 中国全科医学, 2023, 26(3): 372-379. DOI:10.12114/j.issn.1007-9572.2022.0327 |
| [2] |
MAHER T M, BENDSTRUP E, DRON L, et al. Global incidence and prevalence of idiopathic pulmonary fibrosis[J]. Respiratory Research, 2021, 22(1): 197. DOI:10.1186/s12931-021-01791-z |
| [3] |
谢惠康, 武春燕. 病理在特发性肺纤维化诊断及鉴别诊断中作用的变迁[J]. 中华病理学杂志, 2023, 52(6): 552-557. DOI:10.3760/cma.j.cn112151-20220902-00759 |
| [4] |
RAGHU G, REMY-JARDIN M, RICHELDI L, et al. Idiopathic pulmonary fibrosis(an update) and progressive pulmonary fibrosis in adults: An official ATS/ERS/JRS/ALAT clinical practice guideline[J]. American Journal of Respiratory and Critical Care Medicine, 2022, 205(9): e18-e47. DOI:10.1164/rccm.202202-0399ST |
| [5] |
魏婷, 涂名进, 郑斯平, 等. 免疫调节细胞影响特发性肺纤维化的研究进展[J]. 国际呼吸杂志, 2022, 42(8): 618-622. DOI:10.3760/cma.j.cn131368-20211206-00897 |
| [6] |
SHENDEROV K, COLLINS S L, POWELL J D, et al. Immune dysregulation as a driver of idiopathic pulmonary fibrosis[J]. The Journal of Clinical Investigation, 2021, 131(2): e143226. DOI:10.1172/JCI143226 |
| [7] |
陈炜, 袁平凡, 张念志. 益气养阴活血法对博来霉素诱导IPF的大鼠PI3K/AKT/HIF-1α信号通路的影响[J]. 时珍国医国药, 2021, 32(7): 1577-1581. DOI:10.3969/j.issn.1008-0805.2021.07.10 |
| [8] |
董梅, 张念志, 陈炜, 等. 参七虫草胶囊干预肺间质纤维化大鼠模型PI3K/Akt信号通路实验研究[J]. 安徽中医药大学学报, 2020, 39(2): 76-79. |
| [9] |
何程, 陈炜, 张念志. 参七虫草方通过抑制促血管生成因子表达改善大鼠肺组织纤维化实验研究[J]. 陕西中医, 2022, 43(10): 1332-1336. DOI:10.3969/j.issn.1000-7369.2022.10.003 |
| [10] |
王搏, 宋庆华, 唐会猛, 等. 博来霉素诱导的肺纤维化动物模型研究进展[J]. 中国实验动物学报, 2023, 31(12): 1617-1628. |
| [11] |
刘莹. 吡非尼酮对二氧化硅诱导的矽肺小鼠的干预效果评估[D]. 北京: 北京协和医学院, 2021.
|
| [12] |
肖石林. Nrf2/Keap1信号通路介导氯胺酮调节气道高反应的作用及机制探究[D]. 北京: 中国医学科学院, 2023.
|
| [13] |
张明蕊, 黄歆梅, 曹孟淑. 特发性肺纤维化药物治疗研究进展[J]. 国际呼吸杂志, 2023, 43(11): 1357-1364. DOI:10.3760/cma.j.cn131368-20230915-00162 |
| [14] |
蔡泽慧, 赵鹏, 张蓝熙, 等. 巨噬细胞活化参与肺纤维化机制研究进展[J]. 中国老年学杂志, 2022, 42(15): 3853-3857. DOI:10.3969/j.issn.1005-9202.2022.15.061 |
| [15] |
WYNN T A, VANNELLA K M. Macrophages in tissue repair, regeneration, and fibrosis[J]. Immunity, 2016, 44(3): 450-462. DOI:10.1016/j.immuni.2016.02.015 |
| [16] |
钟运香, 袁娇, 刘丰惠, 等. 西洋参化学成分、药理作用及质量控制研究进展[J]. 中国中医药现代远程教育, 2020, 18(7): 130-133. |
| [17] |
李娜, 江开春, 王婷婷, 等. 中药三七及其复方防治器官纤维化的研究进展[J]. 中成药, 2021, 43(9): 2442-2447. |
| [18] |
岳会敏, 刘飞, 李范林, 等. 冬虫夏草菌丝体提取物通过抑制炎性因子及Treg细胞功能缓解肺纤维化[J]. 中国免疫学杂志, 2016, 32(10): 1472-1476. |
| [19] |
王晓蓉, 李炳辉, 王知, 等. 脱细胞真皮基质对M1型巨噬细胞向M2型巨噬细胞转变的影响[J]. 中华实验外科杂志, 2022, 39(9): 1670-1673. |
| [20] |
XIONG Y, CUI X C, ZHOU Y J, et al. Dehydrocostus lactone inhibits BLM-induced pulmonary fibrosis and inflammation in mice via the JNK and p38 MAPK-mediated NF-κB signaling pathways[J]. International Immunopharmacology, 2021, 98: 107780. |
| [21] |
EBRAHIMPOUR A, WANG M, LI L, et al. Esomeprazole attenuates inflammatory and fibrotic response in lung cells through the MAPK/Nrf2/HO1 pathway[J]. Journal of Inflammation, 2021, 18(1): 17. |
| [22] |
朱振东, 皮娜, 何琴, 等. 滇龙胆草抑制MAPK信号通路对小鼠肺纤维化的影响[J]. 医药导报, 2022, 41(2): 161-166. |
| [23] |
XU L T, WANG T, FANG K L, et al. The ethanol extract of flower buds of Tussilago farfara L. attenuates cigarette smoke-induced lung inflammation through regulating NLRP3 inflammasome, Nrf2, and NF-κB[J]. Journal of Ethno- pharmacology, 2022, 283: 114694. |
| [24] |
张文涛, 杨伟江, 罗杰夫, 等. ALA-PDT通过NF-kB通路调节巨噬细胞极化状态[J]. 激光杂志, 2021, 42(3): 197-201. |
| [25] |
伍培, 赵建美. AP-1的研究进展[J]. 南通大学学报(医学版), 2018, 38(1): 41-45. |
 2024, Vol. 43
2024, Vol. 43