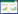文章信息
- 薛维, 张梅雪, 高媛媛, 王欣欣, 贾献玲, 王海霞
- XUE Wei, ZHANG Meixue, GAO Yuanyuan, WANG Xinxin, JIA Xianling, WANG Haixia
- 蛇床子-海螵蛸对白色念珠菌性阴道炎模型大鼠阴道黏膜修复的影响
- Effect of the common cnidium fruit-cuttlebone on the repair of vaginal mucosa in rats with candida albicans vaginitis model
- 天津中医药大学学报, 2024, 43(8): 723-729
- Journal of Tianjin University of Traditional Chinese Medicine, 2024, 43(8): 723-729
- http://dx.doi.org/10.11656/j.issn.1673-9043.2024.08.09
-
文章历史
收稿日期: 2024-03-08
2. 山东第二医科大学, 潍坊 261053
2. Shandong Second Medical University, Weifang 261053, China
白色念珠菌性阴道炎(VVC),也被称为霉菌性阴道炎,是一种常见的妇科炎症,大约有75 %的女性在有生之年都会感染一次以上,VVC易复发,给患者身心健康带来巨大影响[1-2],阴道瘙痒、白带大量增多、阴道黏膜红肿破溃等是其主要临床症状,关于白色念珠菌性阴道炎的研究,国内外发现白色念珠菌是该病最重要的致病菌,高达80%~90%[3],主要黏着在人类口腔及阴道黏膜中[4]。黏膜(mucosa)是一种在生殖道、呼吸道及肠道等腔道中普遍存在的天然屏障,能够抵御各种病原菌从生殖道侵入体内。一般情况下,VVC的发生,与白念珠菌的毒力和数量有关之外,还与机体阴道的黏膜免疫防御功能有关,当黏膜屏障的保护作用不能控制致病微生物的破坏作用(如数量、毒力等)时,那么便会打破宿主之间原有的稳态平衡,引起阴道炎感染的发生[5],造成阴道黏膜结构的损伤。白色念珠菌在正常情况下不会致病,但当宿主免疫力低下或免疫缺陷时便会大量繁殖,其具有较强的黏附能力,会对阴道黏膜进行黏附和攻击,并会转化为强有力的菌丝侵袭阴道黏膜组织[6],造成阴道黏膜炎症性疾病,同时阴道黏膜损伤也会增加白色念珠菌感染的概率[7],因此导致VVC反复发作,难以根除。
目前,VVC在西医的治疗中以抗真菌药物为主,常用的有咪唑类、多烯类等,虽然大多数抗真菌药物临床治疗效果较好,但其毒副作用(如:胃肠道反应、肝毒性)却不容小觑,并且抗真菌药物的长期使用使病人产生耐药性,危害了患者的身心健康,因此开发新药成为关键[8]。
随着中医药事业不断发展,中医药逐渐应用在治疗白色念珠菌性阴道炎中,中医药具有相对的安全性、针对性,且耐药性相对较低。在中医中,VVC归属“阴痒”“带下病”的范畴,其病机为脾肾两虚、湿邪入侵、带脉失养,治疗应以清热解毒、燥湿止痒、补益脾肾为主[9]。本实验以蛇床子和海螵蛸“相使”为用,以《金匮要略》中的蛇床子散为基础,根据临床经验得到的组方,发酵液使用乳酸杆菌进行发酵,取名为蛇床子-海螵蛸。蛇床子具有杀虫止痒等功效,在现代药理学中具有抗菌、抗炎等功能[10],蛇床子可抑制白色念珠菌繁殖。海螵蛸具有收敛止血、收湿敛疮等功效,其在现代药理学中具有抗炎、促进创面愈合、保护黏膜等作用,其化学成分主要有海螵蛸多糖、碳酸钙、壳聚糖等[11],其中壳聚糖作为天然氨基多糖,具有独特的结构和多功能性质,在医药中得到广泛应用。其显著特征包括高生物相容性、可接受的生物降解性和低毒性,以及抗菌和抗过敏特性[12],因其生物相容性和可降解性而有助于伤口愈合[13],因此其对伤口的愈合有促进作用,且对黏膜的修复有较好效果。乳酸杆菌作为健康女性阴道微生物的优势菌群,在防御外来病原体侵袭机体中起到了重要作用,通过对其进行发酵,可以提高阴道中益生菌的数量,阻止致病菌过度繁殖,保护并修复阴道黏膜[14]。课题组前期实验结果证明,蛇床子-海螵蛸具有较强的抑制真菌效果和较强的体内抗炎作用,其效果优于单独使用蛇床子的效果,且当蛇床子与海螵蛸比例为2∶1时及药物浓度为5 g生药/mL时蛇床子-海螵蛸抑菌效果最佳,表示海螵蛸能够协助蛇床子抑菌抗炎,增强药物整体抗菌作用。为了进一步探究蛇床子-海螵蛸治疗白色念珠菌性阴道炎模型大鼠阴道黏膜效果,本实验使用蛇床子-海螵蛸修复白色念珠菌性阴道炎模型大鼠阴道黏膜结构,并比较蛇床子-海螵蛸与蛇床子对白色念珠菌性阴道炎模型大鼠阴道黏膜修复作用差异,为白色念珠菌病阴道炎的治疗提供新思路。
1 材料 1.1 菌种及动物40只SPF级SD雌鼠,7~9周龄,体质量180~220 g,购自济南朋悦实验动物繁育有限公司(许可证号:SCXK (鲁)2019-0003)。伦理编号:2021SDL110。白色念珠菌(ATCC90028),由潍坊医学院附属医院检验科赠送。卷曲乳酸杆菌由山东省蛋白质与多肽药物实验室提供。
1.2 药物及实验材料蛇床子、海螵蛸中药饮片购自于潍坊医学院附属医院中药房。苯甲酸雌二醇(批号C11924649)购自麦克林生化科技有限公司。沙氏液体培养基(HB0253-71)、沙氏琼脂培养基(HB0253-81)、MRS肉汤(HB0384-1)、MRS培养基(HB0384-5)均购自青岛高科技工业园海博生物技术有限公司。白细胞酯酶(LE)批号:LZ-E030709、乙酰氨基葡萄糖苷酶(OGA)批号:HB-PD8163S均购自上海化邦生物科技有限公司。
1.3 实验仪器Nikon光学显微镜(型号:Eclipse E200尼康上海仪器有限公司)、ZXGP-B2080型恒温箱(上海智诚分析仪器制造有限公司)、ZWY-240型全温振荡培养箱(上海智诚分析仪器制造公司)、RE801型旋转蒸发仪(广州德菲科学仪器有限公司)等。
2 方法 2.1 菌液配制感染液制备:从4 ℃保存的沙氏琼脂培养基上挑取白色念珠菌单菌落,接种至液体沙氏培养基中,37 ℃,200 r/min培养24 h,计数,磷酸盐缓冲液(PBS)稀释调至1×108/mL待用。
发酵液制备:将冻存的卷曲乳杆菌于超净台复苏后用MRS肉汤液体培养基培养,并传代,配制浓度为1×108个/mL的菌液备用。
2.2 药物制备将蛇床子、海螵蛸磨粉,按照蛇床子:海螵蛸为2∶1的比例进行制备,将各比例药物加入适量去离子水煮沸,煮30 min后滤出药渣,将过滤出的药液倒入瓶中,离心取上清液(6 000 r/min,15 min,2次),用旋转蒸发仪将药液浓缩至浓度5 g生药/mL,浓缩完后将药液倒入锥形瓶中,纱布塞紧瓶口,放入灭菌锅进行高温灭菌,灭菌结束后静置至室温,加入卷曲乳酸杆菌放入37 ℃恒温箱中进行发酵,发酵48 h后放入灭菌锅灭菌,灭菌完毕后进行离心取上清液,放4 ℃冰箱保存。
2.3 VVC模型大鼠建立、分组及给药取大鼠40只,每组10只,将大鼠分组为蛇床子-海螵蛸组、蛇床子组、空白组、模型组。各组大鼠在接种前4 d开始皮下注射0.1 mL,浓度为2 mg/mL的苯甲酸雌二醇,以后每2天注射1次,直至造模结束。然后阴道内接种,接种7天,将国际标准株ATCC90028用沙氏葡萄糖液体培养基将其密度调为1×108/mL,用微量加样器吸取菌悬液50 μL注入大鼠的阴道内,原位停留1~2 min,防止菌液溢出。空白组阴道内注入50 μL无菌PBS。于接种第7天进行阴道分泌物真菌镜检,若镜检有大量脱落细胞和真菌孢子或有菌丝生成,即确定建模成功。建模成功后,次日对每组每只大鼠进行药物治疗,蛇床子-海螵蛸组使用药物浓度为5 g生药/mL的发酵药物进行阴道灌洗,蛇床子组取药物浓度为5 g生药/mL的发酵药物进行阴道灌洗,空白组和模型组使用等体积的生理盐水进行阴道灌洗,每只每次灌药1 mL,每日1次,共灌洗10 d。
2.4 大鼠阴道pH值测定于给药的第0、5、10天分别对各组大鼠使用无菌PBS进行阴道灌洗,将收集的各组大鼠阴道灌洗液使用精密pH试纸进行测试,待试纸显色后进行读数。
2.5 苏木素-伊红(HE)染色观察大鼠阴道组织形态的改变于末次给药日(给药第10天)的24 h后,将大鼠以颈椎脱臼法处死后,采集阴道组织,用10%中性甲醛固定,经石蜡包埋、切片(4 μm)等制作阴道组织石蜡切片,进行常规HE染色,通过光学显微镜观察阴道黏膜组织形态学变化。
2.6 酶联免疫吸附测定法(ELISA)检测大鼠阴道黏膜组织中相关活性因子蛋白水平将大鼠处死后,取各组大鼠阴道组织,研磨匀浆,离心取上清液,按照ELISA试剂盒说明书严格进行操作,计算阴道黏膜组织中LE、OGA蛋白水平。
2.7 转录组学分析分别取模型组及蛇床子-海螵蛸组大鼠阴道黏膜组织,每组各取4例样本,进行转录组测序,提取样品总核糖核酸(RNA),根据RNA种类进行文库构建,使用Illumina测序仪进行测序,采用Trimmomatic软件对原始数据进行质量预处理,得到总体高质量数据(Clean Data),并对结果进行注释。筛选模型组与蛇床子海螵蛸发酵液组之间的差异基因,筛选标准为P < 0.05且|log2(FC)| > 1.0,并将筛选出的差异表达基因(DEGs)进行GO、KEGG分析。
2.8 统计学处理采用SPSS 22.0统计软件处理实验数据。计量数据资料以均数±标准差(x±s)表示,采用单因素方差分析进行方差齐性检验和组间显著性t检验,P<0.05为差异有统计学意义。计数数据资料采用χ2检验,P<0.05为差异有统计学意义。
3 结果 3.1 各组药物对VVC大鼠阴道pH值的影响空白组大鼠阴道pH值属于正常值范围;在用药第0天,各组大鼠阴道pH值与空白组比较均升高(P<0.01);给药结束后,模型组大鼠阴道pH值无显著改变,蛇床子-海螵蛸组、蛇床子组经治疗后较模型组均有所降低(P<0.01),且在给药第5天、第10天,蛇床子-海螵蛸组大鼠阴道pH值呈现逐渐下降状态,在给药第10天,蛇床子-海螵蛸组大鼠阴道pH值接近正常组大鼠pH值,其中在给药第10天,蛇床子-海螵蛸组pH值低于蛇床子组(P<0.05)。结果见图 1。
|
| 注:与空白组比较,*P<0.01;与模型组比较,#P<0.01;与蛇床子组比较,△P<0.05。 图 1 各组大鼠阴道pH值(x±s,n=10) |
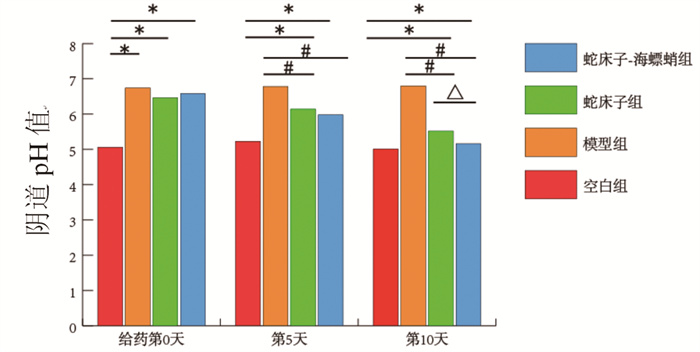
空白组大鼠阴道黏膜结构未见损伤;模型组大鼠阴道黏膜结构被破坏,黏膜厚度降低并伴有大量炎症细胞浸润;经药物治疗后,蛇床子组炎症细胞浸润较模型组减轻,阴道黏膜结构未见明显恢复;蛇床子-海螵蛸组黏膜层炎症细胞浸润较模型组和蛇床子组减少,且其组大鼠阴道黏膜上皮层结构较完整,阴道黏膜结构得到一定修复,黏膜层厚度升高。结果见图 2。
|
| 注:黑色箭头表示炎性细胞浸润。 图 2 各组大鼠阴道组织病理学形态(HE, ×200) |
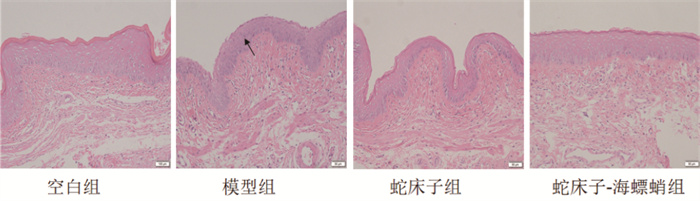
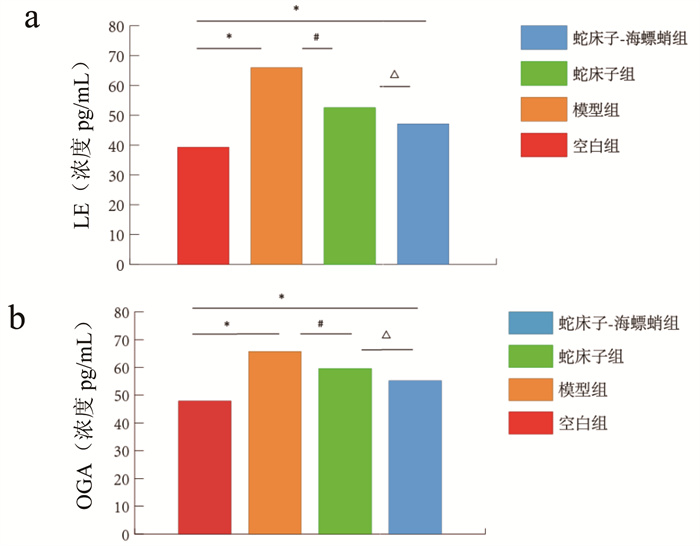
相比较空白组,模型组大鼠阴道组织内LE、OGA蛋白水平显著升高(P<0.01);经过药物治疗后,相比较模型组,蛇床子-海螵蛸组、蛇床子组大鼠阴道内LE、OGA蛋白水平明显下降(P<0.01);相比较蛇床子组,蛇床子-海螵蛸组LE、OGA蛋白水平降低(P<0.05),结果见图 3A、B。
|
| 注:图A为治疗后各组大鼠阴道内的LE蛋白水平;图B为治疗后各组大鼠阴道内的OGA蛋白水平;与空白组比较,*P<0.01;与模型组比较,#P<0.01;与蛇床子组比较,△P<0.05。 图 3 各组间大鼠阴道黏膜组织中活性因子蛋白水平(x±s,n=10) |
通过转录组学分析,我们得出,相较模型组,蛇床子-海螵蛸组共有523个差异基因,有291个上调基因,232个下调基因。为了探究蛇床子-海螵蛸对VVC模型大鼠阴道黏膜修复的机制,进一步对差异基因进行GO、KEGG富集分析。
3.4.1 差异基因GO富集分析与模型组比较,蛇床子-海螵蛸组主要差异基因表现在生物学过程(BP)、细胞组分(CC)、分子功能(MF),其中BP占12项,CC占3项,MF占3项,其中差异基因在细胞黏着(cell adhesion)、真菌防御反应(defense response to fungus)、伤口愈合(wound healing)、细胞-细胞黏附介质活性(Cell-cell adhesion mediator activity)、细胞外基质(extracellular matrix)等相关过程的信号通路有富集,结果见图 4。
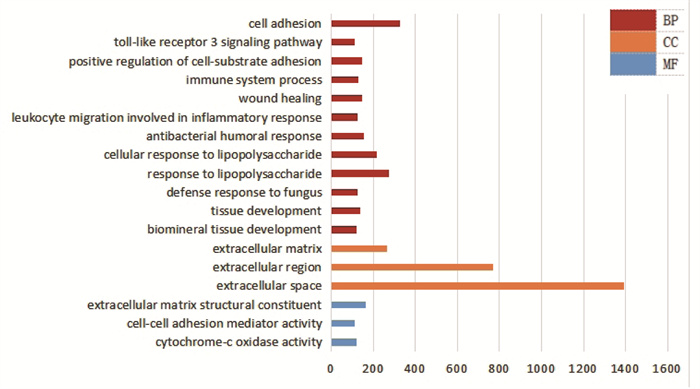
|
| 图 4 差异基因GO富集项目 |
通过KEGG数据库分析差异基因的信号通路,并对每条途径中的差异基因进行显著性统计。其中表达上调的信号通路主要富集在黏着斑(Focal adhesion)、ECM受体相互作用(ECM-receptor interaction)、过氧化物酶体增殖物激活受体信号通路(PPAR signaling pathway)、药物代谢-细胞色素P450(Drug metabolism-cytochrome P450)等条目上;表达下调的信号通路主要包括病毒蛋白与细胞因子及细胞因子受体的相互作用(viral protein interaction with cytokine and cytokine receptor)、Apelin信号通路(Apelin signalling pathway)、肿瘤坏死因子信号通路(TNF signaling pathway)等。表明蛇床子-海螵蛸的治疗阴道黏膜的作用可能与调控PPAR信号通路及细胞P450酶有关。前10位上调与下调的KEGG差异基因富集气泡图见开放科学(资源服务)标识码(OSID)。
4 讨论VVC致病菌是白色念珠菌,它可以快速繁殖,并转变成一种具有很高致病性的菌丝侵袭黏膜,且其会在pH值改变、机体局部免疫功能降低的情况下,大量繁殖,产生炎症[15],造成黏膜损伤。阴道黏膜损伤会增加白色念珠菌的黏附致病的概率,而炎症发生发展也会使阴道黏膜结构受到损伤,两者相互影响导致VVC反复发展,经久不愈,因此阻断白色念珠菌的黏附,保护并修复阴道黏膜结构是治疗VVC的重要举措,能够有效防止VVC复发。中医将VVC归至“阴痒”“带下病”等范畴,当以清热解毒、燥湿止痒、补益脾肾治疗[9]。
本实验选用蛇床子-海螵蛸治疗VVC模型大鼠阴道黏膜结构,蛇床子具有杀虫止痒之功效,抑菌抗炎作用较好,海螵蛸具有收湿敛疮、收敛止血之功效,其化学成分中的壳聚糖具有保护黏膜、促进伤口愈合、改善微环境等作用[16],两药相使为用,并使用乳酸杆菌发酵,能够调节阴道菌群,增强药物整体抑制白色念珠菌的黏附作用,达到修复阴道黏膜结构的作用。
本实验构建VVC大鼠模型的方法应用高原[17]等人的造模方法,于接种菌的第7天,对大鼠分泌物进行真菌镜检,见较多真菌孢子和假菌丝,说明大鼠阴道黏膜层已经出现假菌丝植入,且在实验过程中,大鼠出现阴道红肿、阴道分泌物增多呈白色豆腐渣样的现象,这些均表明动物模型建立成功。本实验分为4组,分别为空白组、模型组、蛇床子组、蛇床子-海螵蛸组,所有组别均采用阴道灌洗的方式进行给药。蛇床子-海螵蛸组及蛇床子组均使用溶剂为液体的相同药物浓度的发酵药物进行阴道灌洗,有利于辨别海螵蛸能否促进黏膜修复;空白组及模型组均使用等体积的生理盐水进行阴道灌洗,使实验过程中大鼠治疗方式及溶剂相同,有利于分析实验结果。
根据各组大鼠HE染色结果显示,蛇床子-海螵蛸组阴道黏膜炎症细胞浸润减少,阴道黏膜结构得到恢复,而蛇床子组阴道黏膜结构未见明显修复,这可能是由于海螵蛸具有促进黏膜修复、缩短伤口愈合时间等功效,海螵蛸中的壳聚糖作为阴道黏膜修复敷料的主要成分之一,它的生物相容性、可降解性、成膜性、吸附性都很好,在创面愈合、伤口止血、抗菌等方面有广泛应用[18],且其能有效促进血管内皮细胞和上皮细胞生长,有助于创面的迅速修复,降低瘢痕产生的可能性[19]。本实验给药方式为阴道局部给药,可将药物及乳酸杆菌的作用直接作用于阴道黏膜,并黏附于黏膜,达到更好的治疗效果。根据大鼠阴道pH值数据结果表明,蛇床子-海螵蛸组pH值经蛇床子-海螵蛸治疗后均低于其他治疗组。根据ELISA法检测大鼠阴道黏膜组织蛋白水平结果显示,经治疗后蛇床子-海螵蛸组LE、OGA蛋白水平仍高于对照组,但低于模型组及其他治疗组。pH值升高会破坏阴道微生态,导致阴道黏膜结构受到破坏;阴道黏膜结构损伤以及假丝酵母菌感染会导致LE、OGA蛋白水平上调[20]。本实验结果显示VVC模型大鼠经蛇床子-海螵蛸治疗后pH值降低以及LE、OGA蛋白水平下调,表明蛇床子-海螵蛸具有修复阴道黏膜结构、调节pH值的作用,其原因可能与海螵蛸中的壳聚糖有关,壳聚糖能激活阴道内多种免疫细胞等细胞,使机体的免疫系统得到恢复和加强,改善阴道内的生态环境[21]。且阴道菌群中乳酸杆菌是有益菌,其通过产生乳酸、过氧化氢(H2O2)等来维持阴道微生态、降低pH值[22-23],达到修复阴道黏膜结构的作用,但要恢复到阴道黏膜结构的正常水平,仍需一定时间。
黏膜修复是一个复杂的过程,包括止血、炎症、增殖、重塑等,而炎症是黏膜修复过程中的决定性因素之一,过度、持续的炎症会导致黏膜修复过慢并产生瘢痕。根据大鼠HE染色结果初步表明蛇床子-海螵蛸具有修复阴道黏膜结构的作用,对其修复阴道黏膜结构作用进行探讨,因此对模型组与蛇床子-海螵蛸组进行转录组学分析,根据转录组学实验数据表明,蛇床子-海螵蛸组差异基因主要富集在细胞黏着、真菌防御反应、伤口愈合等信号通路中,且P450酶、PPAR信号通路上调,其表达的上调基因差异主要为Cyp2e1、Fmo6、Gsta2、Gsta5等。其差异基因主要富集在真菌防御反应及伤口愈合通路中,表明蛇床子-海螵蛸相使使用能够增加抑菌消炎作用,并且海螵蛸具有促进伤口愈合作用,能够修复黏膜,促进黏膜愈合。P450酶作为动物界及微生物界生长过程中必不可少的一部分,对机体细胞的增殖、分化、独立有重要的调节作用[24]。PPAR是核转录因子,能够被配体激活的,其有三个亚型:PPARα,PPARβ,PPARγA。配体激活PPARs后,可对多种基因的表达进行转录水平上的调节,让基因的表达在机体分化、代谢、免疫调节和炎症反应等方面都可以被调控,PPARα和PPARγ可以发挥出抗炎的效果,可对核因子NF-κB的表达进行抑制,对TNF-α、IL-1β、IL-6等炎性因子的生成和释放起到影响,达到消炎效果[25],炎症减轻并消除,阴道黏膜结构就能恢复。转录组结果表明,许多炎症相关基因被显著富集,因此表明蛇床子-海螵蛸可能是通过调控PPAR信号通路和细胞P450酶的表达抑制促炎因子的释放来修复对阴道黏膜屏障损伤。
综上所述,蛇床子-海螵蛸组在黏膜修复、调节阴道pH值等方面均优于蛇床子组,表明海螵蛸可协助蛇床子抑菌抗炎,增强抑菌抗炎作用,降低白色念珠菌的黏附力,有效修复了阴道黏膜结构,此外海螵蛸还具有修复黏膜、改善微生态作用,实验结果显示蛇床子-海螵蛸能够降低VVC模型大鼠阴道pH值,表明其可调节阴道菌群,促进阴道有益菌生长,达到了修复并保护阴道黏膜结构的作用,阴道黏膜结构得到修复,白色念珠菌黏附力就会降低,炎症发生概率便会降低,能够有效防止VVC反复发作。根据转录组结果,推测蛇床子-海螵蛸修复阴道黏膜机制可能是通过调控PPAR信号通路及细胞色素P450酶,达到了修复阴道黏膜结构的作用,这为防止VVC反复发作提供了新思路。
| [1] |
BLOSTEIN F, LEVIN-SPARENBERG E, WAGNER J, et al. Recurrent vulvovaginal candidiasis[J]. Annals of Epidemiology, 2017, 27(9): 575-582. e3. DOI:10.1016/j.annepidem.2017.08.010 |
| [2] |
WILLEMS H M E, AHMED S S, LIU J Y, et al. Vulvovaginal candidiasis: A current understanding and burning questions[J]. Journal of Fungi(Basel, Switzerland), 2020, 6(1): 27. |
| [3] |
杨亚超, 苏刘艳, 刘一丹, 等. 康复新液抗念珠菌性阴道炎的药效研究[J]. 中国现代中药, 2019, 21(7): 903-908. |
| [4] |
DADAR M, TIWARI R, KARTHIK K, et al. Candida albicans-Biology, molecular characterization, pathogenicity, and advances in diagnosis and control-An update[J]. Microbial Pathogenesis, 2018, 117: 128-138. DOI:10.1016/j.micpath.2018.02.028 |
| [5] |
CAUCHIE M, DESMET S, LAGROU K. Candida and its dual lifestyle as a commensal and a pathogen[J]. Research in Microbiology, 2017, 168(9/10): 802-810. |
| [6] |
COSTA-DE-OLIVEIRA S, RODRIGUES A G. Candida albicans antifungal resistance and tolerance in bloodstream infections: The triad yeast-host-antifungal[J]. Microorganisms, 2020, 8(2): 154. DOI:10.3390/microorganisms8020154 |
| [7] |
吴惠婵, 李春霞. 咪康唑联合氟康唑治疗重度外阴阴道假丝酵母菌病52例临床观察[J]. 中国民族民间医药, 2016, 25(1): 58-59. |
| [8] |
张耀文. 加减龙胆泻肝汤联合中药熏洗治疗霉菌性阴道炎疗效探讨[J]. 中外医疗, 2020, 39(21): 1-4. |
| [9] |
孟萌, 毕巧莲. 中药外洗联合西药治疗霉菌性阴道炎30例[J]. 中医研究, 2021, 34(7): 34-38. |
| [10] |
李昱. 关于蛇床子的化学成分与药理作用研究进展[J]. 全科口腔医学电子杂志, 2019, 6(26): 22-23. |
| [11] |
蔡晓华. 海洋矿物药海螵蛸的研究进展与方向[J]. 中华中医药杂志, 2018, 33(9): 4013-4015. |
| [12] |
AZADBAKHT K, HADIPOUR S, RASHIDIPOUR M, et al. Antifungal effects of thymol-loaded chitosan nanocomposite alone and in combined with nystatin against Candida albicans, a major cause of oral candidiasis[J]. Global Journal of Medical, Pharmaceutical, and Biomedical Update, 2022, 17: 7. |
| [13] |
DAS A, RINGU T, GHOSH S, et al. Processing and biomedical applications of novel eco-sustainable fluconazole-loaded zinc oxide(ZnO) encapsulated chitosan(CS) biopolymer nanocomposite by inhibiting microbe species against candidiasis[J]. Materials Today Communications, 2023, 37: 107071. |
| [14] |
吉小彦. 红核妇洁洗液联合乳酸菌阴道胶囊对霉菌性阴道炎患者阴道微生态指标及灌洗液细胞因子水平的影响[J]. 临床医学研究与实践, 2021, 6(23): 89-91. |
| [15] |
骆阳, 徐兴伟, 嵇武. 白色念珠菌致病机制研究进展[J]. 山东医药, 2023, 63(29): 111-114. |
| [16] |
韩晓红, 郭留城, 杜利月, 等. 保妇康栓联合壳聚糖抗菌膜对宫颈上皮内瘤变患者行宫颈锥切术后疗效及相关指标的影响[J]. 中国药房, 2017, 28(3): 338-341. |
| [17] |
高原, 季宇彬, 曲颖, 等. 丁香酚对白色念珠菌及其生物膜形成抑制作用研究[J]. 中华中医药学刊, 2021, 39(11): 80-83, 262. |
| [18] |
孙久惠, 王梦军, 程凤, 等. 新型壳聚糖止血材料体外性能研究[J]. 创伤与急危重病医学, 2022, 10(4): 254-256. |
| [19] |
梁丽仪, 张秀群, 杨玮琳, 等. 探讨壳聚糖宫颈抗菌膜联合聚甲酚磺醛溶液对宫颈HPV感染的治疗效果[J]. 数理医药学杂志, 2016, 29(3): 324-326. |
| [20] |
阮丽君. 脾虚湿阻型复发性外阴阴道假丝酵母菌病的阴道微生态研究[D]. 广州: 广州中医药大学, 2020.
|
| [21] |
李晓春, 王莉芳, 郑旭, 等. 阴道黏膜修复敷料的生物学评价[J]. 中国医药科学, 2018, 8(16): 246-249. |
| [22] |
ZHANG Q Q, ZHANG L, LIU Y, et al. Effect of ozonated water on normal vaginal microecology and Lactobacillus[J]. Chinese Medical Journal, 2019, 132(9): 1125-1127. |
| [23] |
ZHENG N N, GUO R Y, WANG J X, et al. Contribution of Lactobacillus iners to vaginal health and diseases: A systematic review[J]. Frontiers in Cellular and Infection Microbiology, 2021, 11: 792787. |
| [24] |
黄玉松, 李力. 细胞色素P450酶参与动物体内代谢的研究与展望[J]. 药物生物技术, 2021, 28(1): 94-98. |
| [25] |
华丽娟, 李生浩, 常国楫, 等. 药物调控PPAR-γ/RXR-α信号通路对改善丰宫并殖吸虫感染所致大鼠肺损伤的作用[J]. 中国寄生虫学与寄生虫病杂志, 2023, 41(6): 691-698. |
 2024, Vol. 43
2024, Vol. 43