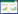文章信息
- 方涛, 石绍顺
- FANG Tao, SHI Shaoshun
- 中药调控Nrf2通路治疗支气管哮喘的实验研究进展
- Progress of experimental research in the treatment of bronchial asthma with traditional Chinese medicine on the modulation of Nrf2 pathway
- 天津中医药大学学报, 2024, 43(8): 752-761
- Journal of Tianjin University of Traditional Chinese Medicine, 2024, 43(8): 752-761
- http://dx.doi.org/10.11656/j.issn.1673-9043.2024.08.13
-
文章历史
收稿日期: 2024-02-25
2. 辽宁中医药大学附属第二医院, 沈阳 110034
2. The Second Affiliated Hospital of Liaoning University of Traditional Chinese Medicine, Shenyang 110034, China
支气管哮喘(BA)是一种由多种细胞及细胞因子介导的气道慢性炎症性疾病,病理生理主要涉及以嗜酸性粒细胞(EOS)增多为主的T2型炎症和以中性粒细胞增多为主的非T2型炎症[1]。哮喘的患病率每年都在增加,预计2025年全球将有4亿哮喘患者[2]。目前,低剂量吸入糖皮质激素是控制哮喘最有效的治疗方法,但对于严重哮喘患者,即便应用高剂量激素,病情仍难以得到有效控制[1]。相关研究显示,Nrf2通路在哮喘发病机制中起着重要作用,参与哮喘的氧化应激、炎症损伤及气道重塑[3],严重哮喘与Nrf2活性缺乏有关[4]。近些年,中药调控Nrf2通路防治哮喘疗效明显。本研究就Nrf2通路与哮喘的关系,以及多种中药复方、中药提取物和单体激活Nrf2通路治疗哮喘的实验研究进行综述,以期为中医药防治哮喘提供思路。
1 Nrf2通路概述核因子E2相关因子2(Nrf2)是细胞内抗氧化应激的主调控因子,属于转录因子CNC家族,由7个功能域(Neh1~7)组成。正常生理情况下,Nrf2与Kelech样环氧氯丙烷相关蛋白1(Keap1)结合,并通过泛素化-蛋白酶体途径进行降解。而当细胞受到刺激(如ROS、毒物、癌变信号等)时,Keap1蛋白被失活,导致Nrf2稳定化并进入细胞核。在细胞核中,Nrf2与sMaf蛋白形成异二聚体,结合到抗氧化应激反应元件(ARE)上,并激活其靶基因的转录,进而参与到调节氧化应激、线粒体功能、氨基酸代谢、脂质代谢、铁代谢、自噬、炎症与免疫等过程[5-6]。
2 Nrf2通路与哮喘的关系 2.1 Nrf2通路介导气道炎症气道炎症是哮喘发病的核心,激活Nrf2通路可减轻气道炎症。一方面,上调Nrf2活性可直接干预哮喘的慢性气道炎症。EH等[7]研究发现,激活Nrf2通路可抑制白细胞介素-6(IL-6)与白细胞介素-1β(IL-1β)基因的表达,进而抑制巨噬细胞炎症。研究表明,激活Nrf2通路,可促进血红素加氧酶-1(HO-1)的表达,减轻气道平滑肌细胞(ASMC)和支气管上皮细胞的炎症损伤,降低哮喘严重程度[8-9]。另一方面,丝裂原激活蛋白激酶(MAPK)[10]、核因子κB(NF-κB)[11]通路与线粒体功能障碍[12]均参与了哮喘的气道炎症。氧化应激下,活性氧(ROS)过量产生,会促进MAPK(ERK1/2、JNK和p38)及NF-kB磷酸化,加速线粒体自噬与凋亡,进而加重哮喘患者肺部细胞及组织损伤,加重气道炎症[13]。通过激活Nrf2通路,可促进谷胱甘肽过氧化酶(GSH-PX)、过氧化氢酶(CAT)及超氧化歧化酶(SOD)等抗氧化剂的表达,增强清除ROS的能力[6],进而抑制MAPK、NF-kB信号的表达,维护线粒体功能稳态,减轻ROS介导气道炎症。此外,铁死亡与哮喘密切相关,Nrf2通路可以通过调节铁代谢、氨基酸代谢、脂质代谢以及ROS水平等多种途径抑制铁死亡,进而抑制哮喘的气道炎症[14]。上调Nrf2活性还可以恢复严重哮喘对糖皮质激素的敏感性[4]。
2.2 Nrf2通路介导气道重塑气道重塑是哮喘的重要病理特征,表现为上皮细胞黏液增生、上皮杯状细胞及ASMC增殖、气道上皮胶原蛋白沉积及纤维化等一系列复杂改变。目前,认为上皮-间质转化(EMT)在哮喘的气道重塑中起着重要作用。转化生长因子-β1(TGF-β1)可促进细胞外基质胶原沉积,诱导EMT,促进成纤维细胞和肌成纤维细胞增殖,是调控肺组织纤维化导致气道重塑的关键因子[15]。激活Nrf2通路,可以抑制TGF-β1/Smad通路阻断肺泡上皮细胞的EMT[16],进而延缓气道重塑。此外,慢性气道炎症刺激也是导致哮喘气道重塑的重要原因。炎症刺激下,气道内炎性细胞(EOS、N、巨噬细胞等)及气道上皮细胞等持续激活,使内源性ROS过量产生,导致氧化应激,进而引起气道上皮细胞结构与功能改变,增加黏液分泌,加重炎症损伤及气道重塑[17]。上调Nrf2活性,可减轻氧化应激及炎症,缓解气道重塑。基质金属蛋白酶-9(MMP-9)是一种促炎因子,可促进气道杯状细胞及平滑肌增生、刺激气道壁胶原沉积等异常免疫修复,调节细胞外基质重塑,导致气道重塑[18]。Nrf2通路可直接抑制MMP-9表达,也可通过抑制NF-kB信号,降低MMP-9表达[19]。气道重塑的过程十分复杂,涉及多个通路间的相互作用,具体机制还有待进一步明确。
3 中医药调控Nrf2通路防治哮喘 3.1 中药复方调控Nrf2通路防治哮喘 3.1.1 调肝理肺类哮喘宁颗粒是从《伤寒论》的四逆散合小柴胡汤加减而来,具有调肝理肺,化痰平喘的功效。候丹等[20]研究发现,哮喘宁颗粒可能通过激活Nrf2/HO-1信号通路,缓解心理应激哮喘大鼠的气道炎症和氧化应激。
朝医麻黄定喘汤出自《东医寿世保元》,具有补肺泻肝、化痰定喘的功效。延光海等[21]研究发现,朝医麻黄定喘汤可能通过激活Nrf2/HO-1信号通路,抑制p38MAPK磷酸化,改善气道内炎症细胞浸润,抑制黏液分泌,减少胶原纤维沉积,缓解哮喘的炎症及氧化应激。
苏黄止咳胶囊源于晁恩祥教授的临床经验,具有宣肺化痰,止咳平喘之功。JIANG等[22]研究表明,苏黄止咳胶囊可以通过上调CVA大鼠体内β-羟基丁酸含量,抑制GSK3β磷酸化,激活AMPK/Nrf2/HO-1信号通路,缓解咳嗽变异性哮喘大鼠的氧化应激,进而减轻炎性损伤。
3.1.2 补气健脾类固本防哮饮是由二陈汤合玉屏风散加减而成,具有补气健脾化痰的功效。代晓寒等[23]研究显示,哮喘小鼠经固本防哮饮干预后,血清ATP、SOD、CAT水平升高,ROS、MDA含量降低,同时肺组织中p-AMPK、Nrf2、HO-1、CREB蛋白表达及线粒体呼吸链复合物活性升高,炎性因子(IL-4、IL-5)含量减少,提示固本防哮饮能抑制氧化应激,改善线粒体功能,缓解哮喘气道慢性炎症,可能与其激活AMPK/Nrf2/HO-1信号通路有关。
健脾补肺化痰方由参苓白术散加减而成,具有益气健脾、补肺化痰的功效。汤雯等[24]研究发现,健脾补肺化痰方联合地塞米松可能通过调节Keap1/Nrf2/HO-1信号通路,缓解哮喘的气道炎症和氧化应激。
培元定喘汤具有益气温阳,化痰平喘之功效。张若琦等[25]发现培元定喘汤可以降低哮喘小鼠BALF中EOS及N数量,减轻气道炎性细胞浸润,活化Nrf2、促进HO-1表达,推测其抗炎机制可能与激活Nrf2/HO-1信号表达有关。中药复方调控Nrf2通路治疗哮喘的作用机制,见表 1。
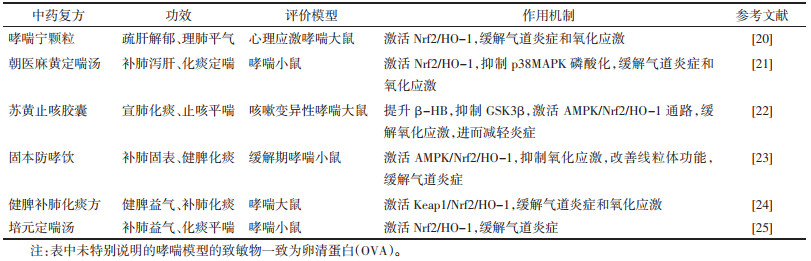
紫花前胡具有降气化痰、散风清热的功效;现代药理学表明,其主要活性成分为香豆素类化合物,具有降压、抗凝、抗癌、抗炎及抗氧化的作用[26]。Lee等[27]研究发现,紫花前胡提取物可通过激活Nrf2通路,减轻氧化应激及过敏性炎症,抑制NF-kB/MMP-9信号表达,减轻气道炎性细胞浸润及黏液分泌,达到缓解哮喘的目的。
升麻为毛茛科升麻属植物的干燥根,味甘、辛,性凉,具有解表透疹、清热解毒的功效;药理研究表明其具有抗过敏、抗氧化、抗炎、增强免疫力等作用[28]。相关研究[29]表明,在OVA致敏的哮喘小鼠模型中,升麻提取物可能通过上调Nrf-2/HO-1/NQO1信号,减轻炎症与氧化应激,进而抑制NF-κB磷酸化与MMP-9的表达,达到治疗过敏性哮喘的目的。
苦味叶下珠全草入药,味苦,性微寒,具有清热解毒、止咳平喘等功效,药理学提示其具有抗肿瘤、抗菌、抗氧化、抗炎等作用[30]。邬薇等[31]研究发现,苦味叶下珠提取物(包含次叶下珠素、叶黄素等)可以通过促进Nrf2 mRNA和抑制iNOs mRNA的表达,上调SOD、GSH,下调MDA、NO,从而减轻哮喘大鼠氧化-硝化应激反应。
白芍是毛茛科植物芍药的干燥根,其提取物白芍总苷(TGP)具有镇痛、抗炎、抗氧化、免疫调节等作用[32]。尹珊珊等[33]研究TGP对OVA诱导过敏性哮喘小鼠的治疗作用发现,TGP可能通过激活Nrf2/HO-1信号通路,发挥抗炎、抗氧化的作用,进而抑制TGF-β1、MMP-9 mRNA表达,促进TIMP-1 mRNA表达,缓解哮喘气道重塑。
苦楝子味苦,性寒,有小毒,具有行气止痛的功效,其提取物具有抗菌、抗肿瘤、抗炎、抗氧化的作用[34]。DVM等[35]研究发现,在OVA哮喘小鼠模型中,苦楝子提取物给药可以激活Nrf2/HO-1信号,抑制MMP-9表达,抑制氧化应激、炎症及黏液的产生,缓解气道高反应及气道重塑。
高丽玄参味苦、咸,性寒,归肺、胃、肾经,具有清热凉血、滋阴降火、解毒散结的功效,其提取物具有抗炎、抗氧化、免疫调节等药理活性[36]。Jung等[37]研究发现,高丽玄参提取物可能通过激活Nrf2/HO-1,抑制NF-κB磷酸化控制哮喘气道的氧化应激和炎症。
三桠乌药是樟科山胡椒属灌木植物,其树皮及叶可入药,具有活血祛瘀,消肿止痛的功效,其提取物具有抗炎、抗氧化、抗过敏等作用[38]。Lee等[39]研究表明,在OVA哮喘小鼠模型及肿瘤坏死因子-α干预的NCI-H292细胞中,三桠乌药叶提取物可通过激活Nrf-2/HO-1/NQO1通路,发挥抗氧化、抗炎、抗过敏的作用。
铜藻是马尾科藻类植物,味咸,性寒,具有消痰软坚,清热利水的功效,其提取物具有抗氧化、抗菌、抗肿瘤等药理活性[40]。相关研究[41]表明,在哮喘小鼠模型中,铜藻可能通过激活Nrf-2/HO-1信号,抑制MAPK(ERK1/2、JNK和p38)磷酸化,减轻哮喘小鼠的氧化损伤及炎症。中药提取物调控Nrf2通路治疗哮喘的作用机制,见表 2。
芒柄花素是从黄芪中提取的一种异黄酮类化合物,具有抗氧化、抗癌、抗炎、抗菌抗病毒等作用。Yi等[42]发现,在OVA哮喘小鼠模型中,芒柄花素通过激活Nrf2/HO-1信号,抑制NF-κB磷酸化,改善气道氧化失衡和炎性浸润,缓解气道高反应和重塑。淫羊藿苷是淫羊藿的主要活性成分,为黄铜苷类化合物,具有抗炎、抗氧化、抗细胞凋亡等作用。刘建秋、王雪慧等[43-45]研究表明,淫羊藿苷可以通过激活慢性哮喘大鼠的Nrf2信号,促进其下游血红素加氧酶-1、醌氧化还原酶1及谷胱甘肽还原酶(HO-1、NQO1及GR)的表达,减少ROS、MDA含量,提升SOD水平,缓解哮喘的氧化应激。马莹[46]研究发现,淫羊藿苷可能通过提升激素抵抗型哮喘(SRA)小鼠肺组织中Nrf-2的表达,激活Nrf-2/ARE信号通路,抑制哮喘的气道炎症和氧化应激,同时参与提升组蛋白去乙酰化酶2(HDAC2)、糖皮质激素受体的活化,恢复SRA模型小鼠对地塞米松的敏感性。异泽兰黄素是从艾叶中分离出的黄酮类活性成分,具有抗炎、抗氧化、抗过敏、抗癌、保护神经的作用。Bai等[47]研究结果表明,异泽兰黄素可能通过激活Nrf2信号,抑制NF-κB、MAPK磷酸化,减轻哮喘小鼠及脂多糖(LPS)处理的RAW264.7细胞中的炎症。鸢尾黄素是一种存在于葛根干花中的黄酮类化合物,具有抗肿瘤、抗氧化、抗菌、抗炎、神经保护等药理活性。JIANG等[48]研究表明,鸢尾黄素通过激活哮喘小鼠中Keap1/Nrf2/HO-1信号通路,缓解哮喘的氧化损伤及炎症。金雀异黄酮是存在与金雀花、山豆根、槐角等豆类植物中的天然三羟基异黄酮,具有抗氧化、抗炎、抗凋亡等作用。楚荷莹等[49]研究表明:金雀异黄酮可能通过激活Nrf2/HO-1通路,减轻哮喘氧化损伤及气道炎症,进而抑制TGF-β蛋白表达,减轻气道平滑肌增生,缓解气道重塑。芹菜素是一种黄酮类化合物,广泛存在于芹菜、洋葱等蔬菜以及橙子、草莓等水果,具有抗氧化、抗炎、抗癌、抗过敏等生物活性。李珍等[50-51]研究发现,芹菜素可能通过调节AMPK/Nrf2/HO-1信号通路,在OVA致敏的哮喘小鼠体内发挥抗炎、抗氧化的作用。花青素是一种广泛存在于蔬菜、水果中的生物类黄酮物质,具有抗炎抑菌、预防癌症、抗氧化、降血糖等作用。刘宇彤等[52]研究发现,花青素可能通过激活Nrf2/HO-1信号通路,降低哮喘小鼠模型中ROS水平,进而抑制NF-κB表达,减轻炎症细胞募集及Th2炎症因子(IL-4、IL-5、IL-13)释放,最终实现缓解哮喘氧化应激和炎症。
3.3.2 生物碱类黄连素是存在于黄连、黄柏等中药材中的异喹啉类生物碱,具有抗炎、抗微生物、免疫调节、抗肿瘤的药理活性。郑怜玉等[53]研究表明,黄连素通过激活Keap1/Nrf2/HO-1信号通路,缓解哮喘大鼠的气道炎症和氧化应激,减轻心肺组织细胞损伤及凋亡。汉防己甲素是粉防己根茎中提取出来的双苄基异喹啉类生物碱,具有抗炎、抑制免疫、抗过敏、抗氧化、抗癌、杀菌的药理作用。Lin等[54-55]研究发现,汉防己甲素可能通过激活Nrf2/HO-1通路减轻哮喘的氧化应激与气道炎症,进而抑制TGF-β1、MMP-9、a-SMA的表达,抑制气道重塑。川芎嗪是中药川芎的主要活性成分之一,属于酰胺类生物碱,具有抗氧化、抗肿瘤、抗炎、调节免疫的作用。徐畅等[56]研究表明,川芎嗪通过上调AMPK/Nrf-2/HO-1通路,抑制NF-κB,抑制氧化应激和气道炎症,改善哮喘病程进展。
3.3.3 萜类积雪草苷为积雪草的主要活性成分,属于三萜类化合物,具有抗肿瘤、抗氧化、抗炎、抗纤维化等作用。姜京植等[57]研究表明,积雪草苷可通过激活Nrf2/HO-1信号,发挥抗炎、抗氧化作用,治疗过敏性哮喘。贝壳杉烯酸(KA)是一种二萜类化合物,广泛存在于南美蟛蜞菊、五加皮、白簕叶等药用植物中,具有抗炎、抗惊厥、抗菌和抗肿瘤等药理活性。相关研究[58]表明,KA可降低哮喘小鼠气道中炎性细胞、IL-33、IL-4和IL-5含量,抑制了NF-κB磷酸化、iNOS和gp91 phox mRNA表达及超氧阴离子产生,促进了Nrf2、HO-1、NQO1 mRNA表达,从而减轻哮喘小鼠的炎症和氧化应激,其作用机制可能与上调Nrf2/HO-1/NQO1通路及抑制NF-κB通路有关。18β-甘草次酸(18β-GA)为甘草根的主要活性成分,属于五环三萜类化合物,具有平喘、抗菌、抗炎等药理作用。Liu等[59]研究表明,在哮喘小鼠模型中,18β-GA通过上调Nrf2/HO-1通路,抑制NF-κB磷酸化,缓解小鼠的氧化损伤及炎症。人参皂苷是人参的重要活性成分,属于三萜类糖苷化合物,具有抗炎、抗氧化、抗肿瘤的作用。相关研究[60]表明,人参皂苷Rg3可能通过激活Nrf2/HO-1通路,上调SOD、GSH水平,下调MDA水平,缓解哮喘小鼠的氧化损伤,进而缓解小鼠气道炎症。Xu等[61]研究发现,在OVA哮喘小鼠模型中,人参皂苷Rh2可能通过激活AKT/Nrf2/NF-κB和MAPK/Nrf 2/NF-κB通路,抑制肥大细胞活化,减少TNF-α、IL-4、IL-8和IL-1b的产生,缓解过敏性哮喘的炎症。
3.3.4 二苯乙烯类紫檀芪为二苯乙烯类化合物,存在与紫檀、蓝莓、葡萄、龙血蝎等植物中,具有抗肿瘤、抗炎、抗氧化等作用。Xu等[62-63]将紫檀芪给予OVA致敏的哮喘小鼠及LPS刺激的16 HBE细胞后发现,紫檀芪可通过AMPK/Sirt1/Nrf2/HO-1通路抑制氧化应激,减轻炎症反应。虎杖苷是中药虎杖根茎中提取的二苯乙烯类化合物,具有抗炎、抗氧化、免疫调节、抗肿瘤等作用。赵雨喆等[64]研究发现,虎杖苷可能通过激活AMPK/Nrf2/HO-1信号通路,改善气道炎症,进而降低HYP及a-SMA水平,抑制气道重塑。
3.3.5 多糖类多糖是一类至少超过10个的单糖组成的高分子碳水化合物,广泛存在于蛹虫草、别克参、当归、黄芪等中药中,具有抗炎、抗氧化、免疫调节等作用[65-66]。Song等[67-68]研究表明,蛹虫草多糖可通过激活Nrf2/HO-1信号、抑制NF-κB信号,减轻哮喘小鼠肺组织氧化损伤和炎症反应。高珊珊等[69]发现,别克参多糖可能通过激活Nrf2/HO-1通路,提升SOD含量,降低MDA水平,抑制氧化应激,进而减少气道炎性细胞数量(包括总细胞数、N、EOS等),减轻哮喘小鼠的气道炎症。
3.3.6 醌类海胆色素(Echinochrome)是从海胆壳和刺中提取出来的天然萘醌类色素,具有抗菌、抗炎、抗氧化和镇痛的功效。相关研究[70]表明,在OVA致敏的哮喘小鼠模型中,海胆色素可通过调节Keap1/Nrf2信号通路,上调CAT、GSH、GST浓度,下调MDA、NO浓度,同时降低IgE、IL-4和IL-1β水平,发挥抗氧化及抗炎的作用,从而保护肺、肝、脾、肾,达到缓解哮喘的目的。芦荟素(Aloin)是芦荟中的一种蒽醌类化合物,具有抗肿瘤、抗炎、抗损伤、抗氧化、抗菌等药理活性。Wu等[71]研究表明,芦荟素通过上调Nrf2/HO-1通路,抑制哮喘小鼠的氧化应激和炎症。
3.3.7 其他类五味子乙素属于联苯环辛烯类木脂素,是北五味子最主要的活性物质,具有抗炎、抗氧化、抗肿瘤的功效。Chen等[72]研究发现,五味子乙素可激活Nrf2/HO-1通路,抑制NF-kB通路,抑制氧化应激,减轻气道炎症。苦杏仁苷是一种天然芳香族氰苷类物质,也是中药苦杏仁中的有效成分,具有抗肿瘤、抗纤维化、抗炎、镇痛、免疫调节等药理作用。钟昌会等[73]研究发现,苦杏仁苷可以提高哮喘大鼠肺组织中CAT、SOD及GSH水平,抑制氧化应激,进而缓解气道炎症,其作用机制可能与激活Keap1/Nrf2信号通路有关。姜油酮来源于姜科植物姜的根茎,是香草基丙酮,具有抗炎、抗氧化、增强免疫、抗肿瘤等药理作用。相关研究[74-75]表明,在OVA诱导致敏的哮喘小鼠模型中,姜油酮可通过激活AMPK/Nrf2/HO-1和抑制NF-kB信号,发挥抗氧化、抗炎的作用。番茄红素是一种天然存在的类胡萝卜素,广泛存在于番茄、西瓜、石榴等植物中,具有抗氧化、抗炎、抗肿瘤等功效。张文慧等[76]研究发现,番茄红素可能通过激活Nrf2/ARE/HO-1信号通路抑制哮喘小鼠气道的氧化应激及炎症反应。萝卜硫素是一种天然的异硫氰酸盐,广泛存在于西兰花、芥蓝、北方圆红萝卜等十字花科植物中,具有抗肿瘤、抗氧化、抗炎、抗衰老等药理活性。相关研究[77]表明,在蟑螂变应原提取物诱导的混合粒细胞哮喘小鼠模型中,萝卜硫素通过激活Nrf2信号,抑制氧化应激,减轻哮喘气道炎症。原花青素是广泛存在于水果、蔬菜等植物中的多酚类物质,具有抗氧化、抗肿瘤、抗炎、抗过敏及免疫调节等作用。Qian等[78]研究表明,在激素不敏感性哮喘小鼠模型中,预防性给予原花青素(葡萄籽提取物)能够激活Nrf2/miR-29b信号,降低PDGFC、PIK3R1和COL3A1蛋白表达,恢复小鼠激素的敏感性;同时减轻气道炎性细胞数量,降低IL-4、IL-13和TGF-β1水平,提升IFN-γ,缓解哮喘小鼠的气道炎症。中药单体调控Nrf2通路治疗哮喘的作用机制,见表 3。
哮喘是一种慢性的异质性疾病,易反复发作且迁延难愈,严重影响了患者的身心健康,并且加重了患者及社会的经济负担,当前的治疗手段不能完全满足患者需求。在整体观念的指导下,中医通过四诊合参、辨证论治,治疗哮喘临床疗效突出,且中药具有副作用小、多途径、多靶点等多种优势,因此中药防治哮喘引起了研究者的关注。近些年,随着哮喘研究的不断深入,发现中医药可以通过上调Nrf2活性,调节下游相关基因表达,抑制氧化应激、减轻炎症损伤与气道重塑,从而缓解哮喘的发生发展,证实Nrf2通路为治疗哮喘的潜在药物靶点。
目前研究存在的问题:1)绝大部分研究仅是观察到在中药复方、单味中药提取物及中药单体干预哮喘模型后,Nrf2基因及蛋白的表达增强,但中药激活Nrf2通路的具体机制尚不清楚,今后应加强研究的深度。2)相对中药单体和单味中药提取物,中药复方的有效成分更为复杂,涉及效应靶点更为广泛,然而当前中药复方研究较少,今后应加大中药经方的研究力度,同时应突出其临床有效的关键中药成分。3)目前,中医药干预Nrf2通路防治哮喘的研究以动物实验为主,形成的疗效证据链还需进一步的临床验证。今后应在完善基础实验的基础上,积极开展高质量、多中心、大样本的临床研究。
总之,现有的研究可以表明,中药调控Nrf2通路治疗支气管哮喘具有广阔的前景,同时需要面对的挑战也很多。其中,明确中药在哮喘治疗中的具体作用机制仍是未来亟待解决的关键问题。笔者认为,未来研究仍可从以下几方面努力:首先,明确治疗哮喘的各个通路之间的关联性(包含并列、协同、拮抗等关系);其次,明确中药作用于哮喘的具体靶点基因,临床有效的中药具体成分以及各中药成分之间的关联性;最后,需要建立起多种药物、多种成分、多个靶点之间的效应机制网络。未来仍需广大的中医研究者积极开展基础临床实验,深挖中药治疗哮喘的分子机制,为中药防治哮喘提供新的理论依据。
| [1] |
CHUNG K F, DIXEY P, ABUBAKAR-WAZIRI H, et al. Characteristics, phenotypes, mechanisms and management of severe asthma[J]. Chinese Medical Journal, 2022, 135(10): 1141-1155. DOI:10.1097/CM9.0000000000001990 |
| [2] |
CLOUTIER M M, DIXON A E, KRISHNAN J A, et al. Managing asthma in adolescents and adults: 2020 asthma guideline update from the national asthma education and prevention program[J]. JAMA, 2020, 324(22): 2301-2317. DOI:10.1001/jama.2020.21974 |
| [3] |
MIZUMURA K, MARUOKA S, SHIMIZU T, et al. Role of Nrf2 in the pathogenesis of respiratory diseases[J]. Respiratory Investigation, 2020, 58(1): 28-35. DOI:10.1016/j.resinv.2019.10.003 |
| [4] |
AUDOUSSET C, MCGOVERN T, MARTIN J G. Role of Nrf2 in disease: novel molecular mechanisms and therapeutic approaches-pulmonary disease/asthma[J]. Frontiers in Physiology, 2021, 12: 727806. DOI:10.3389/fphys.2021.727806 |
| [5] |
TONELLI C, CHIO I I C, TUVESON D A. Transcriptional regulation by Nrf2[J]. Antioxidants & Redox Signaling, 2018, 29(17): 1727-1745. |
| [6] |
HE F, RU X L, WEN T. NRF2, a transcription factor for stress response and beyond[J]. International Journal of Molecular Sciences, 2020, 21(13): 4777. DOI:10.3390/ijms21134777 |
| [7] |
KOBAYASHI E H, SUZUKI T, FUNAYAMA R, et al. Nrf2 suppresses macrophage inflammatory response by blocking proinflammatory cytokine transcription[J]. Nature Communications, 2016, 7: 11624. DOI:10.1038/ncomms11624 |
| [8] |
YANG H, LIANG J, LI X N, et al. Inhibition of lincRNA-Cox2 alleviates apoptosis and inflammatory injury of lipopolysaccharide-stimulated human bronchial epithelial cells via the Nrf2/HO-1 axis[J]. Journal of Clinical Biochemistry and Nutrition, 2023, 72(3): 234-241. DOI:10.3164/jcbn.22-102 |
| [9] |
SAUNDERS R M, BIDDLE M, AMRANI Y, et al. Stressed out-The role of oxidative stress in airway smooth muscle dysfunction in asthma and COPD[J]. Free Radical Biology & Medicine, 2022, 185: 97-119. |
| [10] |
武明云, 虞坚尔, 薛征, 等. 基于MAPK信号通路的中药治疗支气管哮喘的实验研究进展[J]. 上海中医药大学学报, 2019, 33(2): 86-91. |
| [11] |
杨瑛, 席建宏, 王志旺, 等. NF-κB信号通路参与调控支气管哮喘病理学特征研究新进展[J]. 兰州大学学报(医学版), 2023, 49(8): 76-81. |
| [12] |
BAI Q Y, WANG Z G, PIAO Y H, et al. Sesamin alleviates asthma airway inflammation by regulating mitophagy and mitochondrial apoptosis[J]. Journal of Agricultural and Food Chemistry, 2022, 70(16): 4921-4933. DOI:10.1021/acs.jafc.1c07877 |
| [13] |
ALBANO G D, GAGLIARDO R P, MONTALBANO A M, et al. Overview of the mechanisms of oxidative stress: Impact in inflammation of the airway diseases[J]. Antioxidants, 2022, 11(11): 2237. DOI:10.3390/antiox11112237 |
| [14] |
LI M M, LI M, HOU Y J, et al. Ferroptosis triggers airway inflammation in asthma[J]. Therapeutic Advances in Respiratory Disease, 2023, 17: 17534666231208628. DOI:10.1177/17534666231208628 |
| [15] |
KIM K K, SHEPPARD D, CHAPMAN H A. TGF-β1 signaling and tissue fibrosis[J]. Cold Spring Harbor Perspectives in Biology, 2018, 10(4): a022293. DOI:10.1101/cshperspect.a022293 |
| [16] |
ZHANG C Y, GUAN X X, SONG Z H, et al. COX-2/sEH dual inhibitor PTUPB attenuates epithelial-mesenchymal transformation of alveolar epithelial cells via Nrf2-mediated inhibition of TGF-β1/smad signaling[J]. Oxidative Medicine and Cellular Longevity, 2022, 2022: 5759626. |
| [17] |
王斐, 车春莉. 氧化应激机制在支气管哮喘中的研究进展[J]. 临床肺科杂志, 2021, 26(9): 1443-1447. DOI:10.3969/j.issn.1009-6663.2021.09.032 |
| [18] |
YANG X X, WANG S, CUI L L, et al. Pharmacological effects of Bufei Jianpi Granule on chronic obstructive pulmonary disease and its metabolism in rats[J]. Frontiers in Pharmacology, 2022, 13: 1090345. DOI:10.3389/fphar.2022.1090345 |
| [19] |
HILLIARD A, MENDONCA P, RUSSELL T D, et al. The protective effects of flavonoids in cataract formation through the activation of Nrf2 and the inhibition of MMP-9[J]. Nutrients, 2020, 12(12): 3651. DOI:10.3390/nu12123651 |
| [20] |
候丹, 黄帅阳, 吕明圣, 等. 哮喘宁颗粒对心理应激哮喘大鼠的治疗作用及抗氧化作用机制[J]. 中国实验方剂学杂志, 2022, 28(2): 55-61. |
| [21] |
延光海, 孙天一, 咸哲民, 等. 朝医麻黄定喘汤对支气管哮喘模型小鼠p38MAPK/Nrf2/HO-1信号通路的影响[J]. 中医杂志, 2019, 60(10): 881-886. |
| [22] |
JIANG H, BAI Z Y, OU Y Y, et al. β-Hydroxybutyric acid upregulated by Suhuang antitussive capsule ameliorates cough variant asthma through GSK3β/AMPK-Nrf2 signal axis[J]. Journal of Ethnopharmacology, 2023, 307: 116013. DOI:10.1016/j.jep.2022.116013 |
| [23] |
代晓寒, 赵霞, 严花, 等. 固本防哮饮对支气管哮喘缓解期模型小鼠肺组织氧化应激与AMPK/Nrf2/HO-1通路的影响[J]. 中医杂志, 2024, 65(2): 205-212. |
| [24] |
汤雯. 基于Keap1/Nrf2/HO-1信号通路探讨健脾补肺化痰方联合激素对哮喘大鼠氧化应激的影响[D]. 合肥: 安徽中医药大学, 2023.
|
| [25] |
张若琦. 培元定喘汤通过调控Nrf2/HO-1通路对哮喘小鼠气道炎症的影响[D]. 哈尔滨: 黑龙江中医药大学, 2023.
|
| [26] |
宋芷琪, 李斌, 田琨宇, 等. 前胡与紫花前胡的化学成分和药理作用研究进展[J]. 中草药, 2022, 53(3): 948-964. |
| [27] |
LEE S J, LEE A Y, PAK S W, et al. Protective effects of Angelica decursiva Franchet & Savatier on allergic responses through enhancement of Nrf2 and suppression of NF-κB/MMP-9 in ovalbumin-exposed mice[J]. Journal of Ethnophar- macology, 2024, 318(Pt A): 116863. |
| [28] |
孙慧娟, 朱镠娈, 王宪波, 等. 升麻的研究进展[J]. 中国中医基础医学杂志, 2021, 27(5): 837-840, 849. |
| [29] |
LIM J O, SONG K H, LEE I S, et al. Cimicifugae rhizoma extract attenuates oxidative stress and airway inflammation via the upregulation of Nrf2/HO-1/NQO1 and downregulation of NF-κB phosphorylation in ovalbumin-induced asthma[J]. Antioxidants, 2021, 10(10): 1626. DOI:10.3390/antiox10101626 |
| [30] |
李莹. 苦味叶下珠药效物质及药理学研究进展[J]. 鞍山师范学院学报, 2023, 25(4): 40-44. DOI:10.3969/j.issn.1008-2441.2023.04.008 |
| [31] |
邬薇. 苦味叶下珠对哮喘大鼠气道炎症的作用研究[D]. 南京: 南京医科大学, 2021.
|
| [32] |
杨硕, 石典花, 王加锋, 等. 白芍总苷药理活性及临床免疫应用研究进展[J]. 食品与药品, 2024, 26(1): 111-116. |
| [33] |
尹珊珊, 马红, 姜琦. 白芍总苷调控Nrf-2/HO-1信号通路对支气管哮喘小鼠气道重塑的影响[J]. 中国免疫学杂志, 2023, 39(10): 2171-2177. DOI:10.3969/j.issn.1000-484X.2023.10.027 |
| [34] |
MEHREEN SADAF H, BIBI Y M, ARSHAD M, et al. Analysis of Peganum harmala, Melia azedarach and Morus alba extracts against six lethal human cancer cells and oxidative stress along with chemical characterization through advance Fourier Transform and Nuclear Magnetic Resonance spectroscopic methods towards green chemotherapeutic agents[J]. Saudi Pharmaceutical Journal: SPJ: the Official Publication of the Saudi Pharmaceutical Society, 2021, 29(6): 552-565. |
| [35] |
PAK S W, LEE I S, KIM W I, et al. Melia azedarach L. reduces pulmonary inflammation and mucus hypersecretion on a murine model of ovalbumin exposed asthma[J]. Journal of Ethnopharmacology, 2024, 320: 117426. DOI:10.1016/j.jep.2023.117426 |
| [36] |
刘依茹, 刘考铧, 秦路平, 等. 中药玄参的化学成分、药理活性、炮制及临床应用的研究进展[J]. 中国中药杂志, 2023, 48(16): 4302-4319. |
| [37] |
JUNG T Y, LEE A Y, SONG J H, et al. Scrophularia koraiensis nakai attenuates allergic airway inflammation via suppression of NF-κB and enhancement of Nrf2/HO-1 signaling[J]. Antioxidants, 2020, 9(2): 99. DOI:10.3390/antiox9020099 |
| [38] |
HAQUE M E, AZAM S, BALAKRISHNAN R, et al. Therapeutic potential of Lindera obtusiloba: Focus on antioxidative and pharmacological properties[J]. Plants(Basel, Switzer- land), 2020, 9(12): 1765. |
| [39] |
LEE B W, HA J H, SHIN H G, et al. Lindera obtusiloba attenuates oxidative stress and airway inflammation in a murine model of ovalbumin-challenged asthma[J]. Antioxidants, 2020, 9(7): 563. DOI:10.3390/antiox9070563 |
| [40] |
郑丽杰, 缪晓冬, 韩威, 等. 铜藻主要化学成分分析及抗氧化活性评价[J]. 食品工业科技, 2020, 41(22): 232-239. |
| [41] |
ASANKA SANJEEWA K K, JAYAWARDENA T U, LEE H G, et al. The protective effect of Sargassum horneri against particulate matter-induced inflammation in lung tissues of an in vivo mouse asthma model[J]. Food & Function, 2019, 10(12): 7995-8004. |
| [42] |
YI L, CUI J, WANG W Q, et al. Formononetin attenuates airway Inflammation and oxidative stress in murine allergic asthma[J]. Frontiers in Pharmacology, 2020, 11: 533841. DOI:10.3389/fphar.2020.533841 |
| [43] |
刘建秋, 马莹, 王雪慧. 淫羊藿苷对慢性哮喘大鼠氧化应激及肺组织Nrf2、HO-1表达的影响[J]. 中华中医药学刊, 2019, 37(12): 2823-2826. |
| [44] |
王雪慧, 刘航, 乔羽. 淫羊藿苷对哮喘模型大鼠氧化应激的影响[J]. 解放军预防医学杂志, 2019, 37(8): 33-34. |
| [45] |
王雪慧, 李竹英, 李星, 等. 淫羊藿苷对哮喘大鼠醌氧化还原酶1及谷胱甘肽还原酶表达及氧化应激的影响[J]. 现代中西医结合杂志, 2020, 29(8): 799-801, 827. DOI:10.3969/j.issn.1008-8849.2020.08.001 |
| [46] |
马莹. 淫羊藿苷通过介导Nrf-2/ARE信号通路对激素抵抗型哮喘小鼠模型的干预机制[D]. 哈尔滨: 黑龙江中医药大学, 2020.
|
| [47] |
BAI D H, SUN T X, LU F, et al. Eupatilin suppresses OVA-induced asthma by inhibiting NF-κB and MAPK and activating Nrf2 signaling pathways in mice[J]. International Journal of Molecular Sciences, 2022, 23(3): 1582. DOI:10.3390/ijms23031582 |
| [48] |
JIANG Y N, VAN NGUYEN T, JIN J, et al. Tectorigenin inhibits oxidative stress by activating the Keap1/Nrf2/HO-1 signaling pathway in Th2-mediated allergic asthmatic mice[J]. Free Radical Biology and Medicine, 2024, 212: 207-219. DOI:10.1016/j.freeradbiomed.2023.12.031 |
| [49] |
楚荷莹, 王峰, 白勇, 等. 金雀异黄酮对幼龄哮喘大鼠TGF-β/Nrf2/HO-1信号通路及气道重塑的影响[J]. 热带医学杂志, 2021, 21(5): 580-585, 673. DOI:10.3969/j.issn.1672-3619.2021.05.012 |
| [50] |
李珍, 庞玲玲, 于鹏飞, 等. Nrf2参与芹菜素改善哮喘气道炎症和氧化应激的研究[J]. 国际呼吸杂志, 2023, 43(6): 652-657. DOI:10.3760/cma.j.cn131368-20220902-00772 |
| [51] |
李珍. 芹菜素通过AMPK/Nrf2/HO-1信号通路改善哮喘气道炎症和氧化应激的研究[D]. 青岛: 青岛大学, 2023.
|
| [52] |
刘宇彤, 车楠, 李莉, 等. 花青素通过Nrf-2/HO-1信号通路调控哮喘气道炎症[J]. 免疫学杂志, 2019, 35(1): 36-41. |
| [53] |
郑怜玉, 陈骏, 徐丛荣. 黄连素激活Nrf2通路缓解新生大鼠哮喘模型氧化应激反应和对心肺组织的保护作用[J]. 中国医院药学杂志, 2019, 39(10): 1002-1006. |
| [54] |
LIN Y P, YAO J C, WU M L, et al. Tetrandrine ameliorates airway remodeling of chronic asthma by interfering TGF-β1/nrf-2/HO-1 signaling pathway-mediated oxidative stress[J]. Canadian Respiratory Journal, 2019, 2019: 7930396. |
| [55] |
林益平, 吴美玲, 魏艳丽, 等. 汉防己甲素对卵蛋白诱导大鼠哮喘模型的抗氧化保护作用[J]. 浙江医学, 2020, 42(3): 227-231, 306. |
| [56] |
徐畅, 宋艺兰, 姜京植, 等. 川芎嗪通过AMPK/NF-κB和Nrf-2/HO-1途径减轻过敏性气道炎症和氧化应激的实验研究[J]. 免疫学杂志, 2021, 37(2): 100-106. |
| [57] |
姜京植. 积雪草苷通过TLR4/NF: κB、Wnt/β: Catenin、Nrf2/HO: 1信号通路缓解过敏性哮喘和皮炎的作用及机制研究[D]. 延吉: 延边大学, 2021.
|
| [58] |
BORGHI S M, DOMICIANO T P, RASQUEL-OLIVEIRA F S, et al. Sphagneticola trilobata(L.) Pruski-derived kaurenoic acid prevents ovalbumin-induced asthma in mice: Effect on Th2 cytokines, STAT6/GATA-3 signaling, NFκB/Nrf2 redox sensitive pathways, and regulatory T cell phenotype markers[J]. Journal of Ethnopharmacology, 2022, 283: 114708. DOI:10.1016/j.jep.2021.114708 |
| [59] |
LIU J M, XU Y Q, YAN M Y, et al. 18β-Glycyrrhetinic acid suppresses allergic airway inflammation through NF-κB and Nrf2/HO-1 signaling pathways in asthma mice[J]. Scientific Reports, 2022, 12(1): 3121. DOI:10.1038/s41598-022-06455-6 |
| [60] |
HUANG W C, HUANG T H, YEH K W, et al. Ginsenoside Rg3 ameliorates allergic airway inflammation and oxidative stress in mice[J]. Journal of Ginseng Research, 2021, 45(6): 654-664. DOI:10.1016/j.jgr.2021.03.002 |
| [61] |
XU C, LI L C, WANG C Y, et al. Effects of G-Rh2 on mast cell-mediated anaphylaxis via AKT-Nrf2/NF-κB and MAPK-Nrf2/NF-κB pathways[J]. Journal of Ginseng Research, 2022, 46(4): 550-560. DOI:10.1016/j.jgr.2021.10.001 |
| [62] |
XU C, SONG Y L, WANG Z G, et al. Pterostilbene suppresses oxidative stress and allergic airway inflammation through AMPK/Sirt1 and Nrf2/HO-1 pathways[J]. Immunity, Inflammation and Disease, 2021, 9(4): 1406-1417. DOI:10.1002/iid3.490 |
| [63] |
徐畅. 紫檀芪通过AMPK/Sirt1/Nrf2/HO-1信号通路缓解哮喘模型小鼠氧化应激和气道炎症的实验研究[D]. 延边: 延边大学, 2021.
|
| [64] |
赵雨喆. 虎杖苷通过AMPK/Nrf2/HO-l通路改善哮喘小鼠气道炎症及气道重塑[D]. 延吉: 延边大学, 2019.
|
| [65] |
HOU C Y, CHEN L L, YANG L Z, et al. An insight into anti-inflammatory effects of natural polysaccharides[J]. International Journal of Biological Macromolecules, 2020, 153: 248-255. DOI:10.1016/j.ijbiomac.2020.02.315 |
| [66] |
刘瑶瑶, 刘娟娟, 秦怡玉, 等. 18种中药多糖与Siglec-9的亲和力测试及其抗炎作用研究[J]. 陆军军医大学学报, 2024, 46(5): 410-418. |
| [67] |
SONG L Y, YANG J T, KONG W H, et al. Cordyceps militaris polysaccharide alleviates ovalbumin-induced allergic asthma through the Nrf2/HO-1 and NF-κB signaling pathways and regulates the gut microbiota[J]. International Journal of Biological Macromolecules, 2023, 238: 124333. DOI:10.1016/j.ijbiomac.2023.124333 |
| [68] |
宋蓝月. 蛹虫草Cordycepsmilitaris多糖的分离纯化、结构解析及其改善过敏性哮喘作用的研究[D]. 长春: 吉林农业大学, 2022.
|
| [69] |
高珊珊, 周悦, 冯悦, 等. 别克参多糖对哮喘小鼠氧化应激的影响[J]. 中国食品卫生杂志, 2022, 34(2): 217-224. |
| [70] |
ABDELMAWGOOD I A, MAHANA N A, BADR A M, et al. Echinochrome ameliorates physiological, immunological, and histopathological alterations induced by ovalbumin in asthmatic mice by modulating the Keap1/Nrf2 signaling pathway[J]. Marine Drugs, 2023, 21(8): 455. DOI:10.3390/md21080455 |
| [71] |
WU S Y, XIA Y, YANG C C, et al. Protective effects of aloin on asthmatic mice by activating Nrf2/HO-1 pathway and inhibiting TGF-β/Smad2/3 pathway[J]. Allergologia et Immuno- pathologia, 2023, 51(4): 10-18. DOI:10.15586/aei.v51i4.863 |
| [72] |
CHEN Y Q, KONG Y, WANG Q L, et al. Schisandrin B attenuates airway inflammation by regulating the NF-κB/Nrf2 signaling pathway in mouse models of asthma[J]. Journal of Immunology Research, 2021, 2021: 8029963. |
| [73] |
钟昌会, 钱进, 杨远征, 等. 苦杏仁苷对支气管哮喘大鼠Kelch样环氧氯丙烷相关蛋白-1/核因子E2相关因子2信号通路的影响[J]. 中国临床药理学杂志, 2022, 38(18): 2157-2161. |
| [74] |
高金莹. 姜酮通过激活AMPK/Nrf2/HO-1通路对OVA诱导的哮喘小鼠模型起保护作用[D]. 长春: 吉林大学, 2020.
|
| [75] |
ZHU Y J, WANG C Y, LUO J J, et al. The protective role of Zingerone in a murine asthma model via activation of the AMPK/Nrf2/HO-1 pathway[J]. Food & Function, 2021, 12(7): 3120-3131. |
| [76] |
张文慧. 探究番茄红素经Nrf2/ARE/HO-1通路对支气管哮喘的抗氧化及抗炎作用[D]. 成都: 成都医学院, 2023.
|
| [77] |
AL-HARBI N O, NADEEM A, AHMAD S F, et al. Sulforaphane treatment reverses corticosteroid resistance in a mixed granulocytic mouse model of asthma by upregulation of antioxidants and attenuation of Th17 immune responses in the airways[J]. European Journal of Pharmacology, 2019, 855: 276-284. DOI:10.1016/j.ejphar.2019.05.026 |
| [78] |
QIAN Y, SUN Y, CHEN Y, et al. Nrf2 regulates downstream genes by targeting miR-29b in severe asthma and the role of grape seed proanthocyanidin extract in a murine model of steroid-insensitive asthma[J]. Pharmaceutical Biology, 2022, 60(1): 347-358. DOI:10.1080/13880209.2022.2032205 |
 2024, Vol. 43
2024, Vol. 43