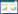文章信息
- 米未, 王影, 付志飞
- MI Wei, WANG Ying, FU Zhifei
- 基于UHPLC/Q-Orbitrap-MS的石决明散化学成分鉴定及降压作用网络药理学研究
- Identification of chemical compounds of Shi-Jue-Ming-San based on ultra-high performance liquid chromatography-quadrupole Orbitrap mass spectrometry and its network pharmacology in treatment of hypertension
- 天津中医药大学学报, 2024, 43(9): 787-797
- Journal of Tianjin University of Traditional Chinese Medicine, 2024, 43(9): 787-797
- http://dx.doi.org/10.11656/j.issn.1673-9043.2024.09.04
-
文章历史
收稿日期: 2024-04-18
2. 天津中医药大学, 天津 301617
2. Tianjin University of Traditional Chinese Medicine, Tianjin 301617, China
石决明散(SJMS)出自于方剂书籍《普济方》,组成为石决明,草决明,菊花,羌活和甘草等。其中石决明、草决明共入肝经且能清热,故共为君药;菊花也入肝经,且具有清肝平肝之功效,因此为臣药,辅助君药以清肝经之热;羌活性温,且可佐制其他药物的寒凉之性,使全方不过于寒凉[1]。甘草为使,调和诸药,使全方性质更加缓和。诸药合用,共奏清肝明目之功,可对症治疗上亢型高血压,因此在临床上广泛用于肝阳上亢型高血压。
虽然SJMS配伍思路经典,临床疗效确切,但其化学成分及降压作用研究较少。研究首次运用超高效液相色谱-四级杆/静电场轨道阱高分辨质谱联用(UHPLC/Q-Orbitrap-MS)技术在正、负离子模式下同时采集质谱数据,对SJMS的化学成分及入血成分进行较为全面的分析,为进一步明确其药效物质及其作用机制提供科学的理论基础。
网络药理学是系统生物学的1个分支,它通过构建多层次的“成分-靶点-疾病”网络,生动地展示了中药的特点,即“多成分、多靶点、多途径”的作用机制[2]。这种方法直观地阐明了药物的作用方式,对揭示中药及其复方的疗效机制作出重要贡献。研究利用液质联用技术鉴定了SJMS的主要化学成分和入血成分。在此基础上,结合网络药理学预测干预靶点,研究SJMS中具有降压作用的潜在化学成分、作用靶点和作用途径。
1 仪器和试药 1.1 仪器UHPLC/Q-Orbitrap-MS四级杆-静电场轨道阱高分辨质谱仪(赛默飞世尔科技公司,Q-Exactive系列),十万分之一天平(梅特勒XA205DU分析天平),涡旋混合仪(上海泸西分析仪器厂),5424R低温高速离心机(德国艾本德公司),FDU-1200冷冻干燥机(日本东京理化EYELA公司)。
1.2 试药色谱级乙腈、甲醇(赛默飞世尔科技中国有限公司),乙酸(默克Sigma-Aldrich试剂公司),Milli-Q超纯水净化系统(美国Milli-Q-pore公司),SJMS复方药材购自河北春开制药股份有限公司。
对照品:异欧前胡素(批号:B21546),绿原酸(批号:B20782),新绿原酸(批号:B21396),紫花前胡苷(批号:B21685),异甘草素(批号:H03D9Z76567),甘草酸(批号:P11A9F58301),红链霉素-6-O-β-龙胆二糖苷(批号:T20O8Z46315),异甘草素(批号:H03D9Z76567),橙黄决明素(批号:Z03J8B27993),芹糖甘草苷(批号:R03A9F67328),甘草次酸(批号:T27J7X18416),黄决明素(批号:M21O8S46232),组氨酸(批号:H10A9Z58208),谷氨酸(批号:J30S9R71489),脯氨酸(批号:B21928),酪氨酸(批号:WXBB0881V),无水柠檬酸(批号:SM0425GA14),阿魏酸(批号:L03A9D57744),7-羟基香豆素(批号:A04A6L1),咖啡酸(批号:Y17D6C7672)购于上海源叶生物科技有限公司,质量分数 > 99.0%;柚皮素(批号:MUST-19032406),决明素(批号:MUST-17091305),槲皮素-3-β-D-葡萄糖酸苷(批号:B50276),槲皮苷(批号:MUST-18120503),木犀草素(批号:MUST-18102605),芹菜素(批号:MUST-19032605),甘草素(批号:MUST-18101611)购于成都曼思特生物科技有限公司,质量分数 > 99.0%;决明子苷(批号:RS27203602)购于北京酷莱博科技有限公司,质量分数 > 99.0%;甘草酸铵(批号:110731-201619),芦荟大黄素(批号:110795-201710),腺苷(批号:110879-201703),大黄酸(批号:T09J8F28351)购于中国食品药品检定研究院,质量分数 > 99.0%。
1.3 实验动物SPF级健康雄性SD大鼠6只,3~4月龄,体质量(220±20) g,购于北京华阜康生物科技股份有限公司,实验动物生产许可证号SCXK(京)2019-0008,研究涉及的实验动物方案已得到天津中医药大学实验动物伦理委员会的批准(批件号:TCM-LAEC2023200w1352)。
2 方法 2.1 色谱条件色谱柱:Waters HSS T3(2.1×100 mm,1.8 μm);流动相:0.1%乙酸水(A),乙腈(D);梯度洗脱(0~9 min,5%~15%D;9~20 min,15%~30%D;20~28 min,30%~100%D),柱温:30 ℃;流速:0.3 mL/min;进样量:2 μL。
2.2 质谱条件高能电喷雾离子源(HESI),正、负离子扫描模式,喷雾电压-3.0 kV/+3.5 kV;鞘气(N2)35 L/h;辅助气(N2)10 L/h;吹扫气(N2)0 L/h;毛细管温度320 ℃;辅助气加热温度350 ℃。扫描模式Full MS/dd-MS2(TopN),MS1全扫描范围是100~1 500 m/z,分辨率是70 000;MS2质谱扫描是动态质量范围,分辨率是17 500。归一化碰撞能量(NCE)为10/30/50 V,隔离窗口宽度设置为4.0 Da。
2.3 供试品溶液的准备SJMS(石决明、羌活、草决明、菊花各10 g,炙甘草5 g),加入450 mL蒸馏水浸泡0.5 h,煎煮1.5 h,滤过;残渣加入360 mL蒸馏水,煎煮1 h,合并两次煎煮液,浓缩冷冻干燥,最后得SJMS冻干粉。精密称定冻干粉,加50%甲醇配成3 mg/mL,14 000 r/min离心10 min,离心半径8.4 cm,取上清液过0.22 μm微孔滤膜,即得。
2.4 混合对照品溶液的制备精密称取31种对照品适量,用甲醇溶解定容,配成1.0 mg/mL对照品储备液。取各对照品储备液加入甲醇稀释,配制成各成分质量浓度约为2 μg/mL的混合对照品溶液。
2.5 SJMS入血成分分析 2.5.1 血浆样品的制备及前处理6只雄性SD大鼠给药前禁食12 h,自由饮水。大鼠灌胃“2.3”项下制备的SJMS提取物,以水为溶剂。《普济方》中记载:每服二钱,以水一盏,煎六分;水一盏约为200 mL,煎六分,大约为120 mL。正常人的剂量二钱(大约为7.46 g)。按照动物与人体间的等效剂量换算,每只大鼠的剂量约为:0.671 g/kg。分别于给药前0 h及给药后0.083、0.167、0.25、0.5、1.0、2.0、4.0、8.0、12、24 h经大鼠眼眶静脉丛取血,置于肝素化离心管中,4 ℃下3 000 r/min离心10 min,离心半径8.4 cm,取上层血浆,储存在-80 ℃冰箱中备用。
将6只雄性SD大鼠给药前血浆样品及给药后各时间点血浆样品涡旋混合以减少个体差异,取血浆样品100 μL,加入600 μL冰甲醇(冷藏于4 ℃),涡旋振荡,离心后,取上清液氮气吹干,用50 μL 50%甲醇水复溶,涡旋5 min,14 000 r/min离心10 min,离心半径8.4 cm,取上清5 μL进入LC-MS分析。
2.5.2 入血原型成分的鉴定利用UHPLC/Q-Orbitrap-MS同时采集SJMS水煎液给药组和空白组(0 h)大鼠血浆样品的质谱信息,色谱及质谱条件同“2.1”“2.2”项下一致,在对SJMS复方化学成分定性分析研究的基础上,结合色谱保留时间与质谱碎片信息确定原型成分。
2.6 网络药理学分析 2.6.1 药物入血成分靶点预测从Pubchem数据库获取入血成分的2D结构,将23个入血成分SMIELS结构式上传至SwissTargetPrediction及SEA数据库分析,获得入血成分的潜在作用靶点。
2.6.2 高血压相关靶点的获取以“hypertension”为关键词,分别在DrugBank、Genecards数据库进行高血压(HT)疾病靶点搜集。合并所有数据库获得的靶点,去重后即得疾病相关靶点。
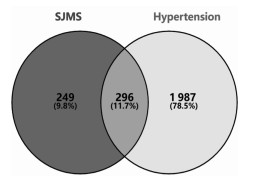
2.6.3 SJMS入血成分-HT靶点拓扑分析将获得的入血成分靶点和HT疾病靶点进行整理统计,筛选交集靶点,利用在线制图工具绘制韦恩图。将获得的入血成分作用靶点与HT相关靶点进行相互映射,共得到了SJMS治疗HT潜在的296个靶点。
将296个共有基因靶点上传至String平台,选择“multiple proteins”分析模式、限定种属为“Homo sapiens”、最小互作分数为0.9,获得药物靶蛋白-疾病靶蛋白相互作用(PPI)网络,导入Cytoscape 3.8.1软件进行制图分析。
2.6.4 基因本体(GO)生物进程及京都基因与基因组百科全书(KEGG)通路分析用DAVID数据库对交集核心靶点进行GO生物功能注释和KEGG富集分析,以“Homo sapiens”为物种要求,以P < 0.01为显著功能和通路的临界值,获取相应数据并运用微生信平台绘制气泡图与柱状图,使其结果可视化。
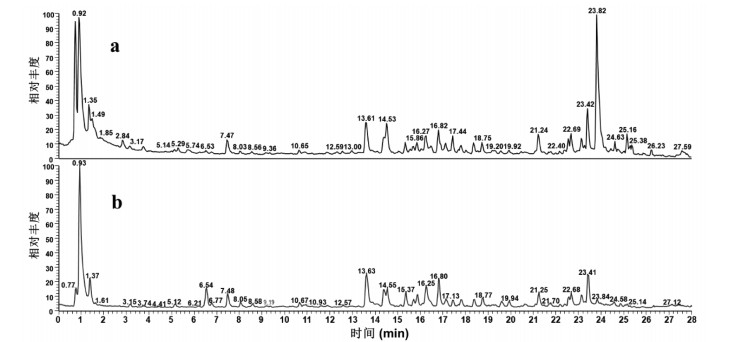
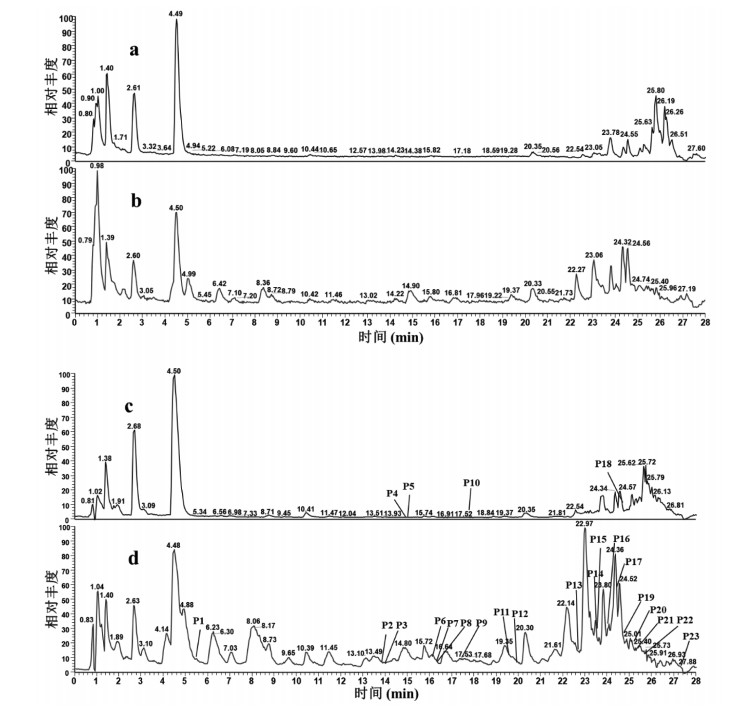
3 结果 3.1 SJMS化学成分及入血成分分析采用UHPLC/Q-Orbitrap-MS法对SJMS进行定性分析,初步鉴定出129个化合物[3-15]。包括17个蒽醌及其苷类化合物,7氨基酸类化合物,38个黄酮及其苷类化合物,13个香豆素类化合物,3个糖类化合物,5个生物碱类化合物,4个萜类化合物,1个二苯乙烯类化合物,1个苯并吡喃类化合物,4个萘并吡喃类化合物,1个酚类化合物,2个皂苷类化合物,6个苯丙素类,7个有机酸类化合物和20个其他类型化合物。所有化合物的前级离子质量的准确度均小于5 ppm。UHPLC-Q-Orbitrap/MS总离子流图,见图 1,鉴定结果见开放科学(资源服务)标识码(OSID)。SJMS经大鼠口服吸收后,根据上述各离子峰的质谱信息进行比对,在血浆中共鉴定出23个原型入血移行成分,采集总离子流图,见图 2。
|
| 图 1 SJMS样品正(a)、负离子(b)模式下总离子流色谱图 |
|
| 注:a、b、c、d分别为空白血浆正离子模式、空白血浆负离子模式、含药血浆正离子模式、含药血浆负离子模式。 图 2 血浆样品总离子流图 |
SwissTarget-Prediction数据库整合SEA数据库筛选入血移行成分的作用靶点,去重后共获得1 761个靶点。DrugBank、Genecards数据库中查询HT疾病共获得2 291个疾病靶点。
3.3 SJMS抗HT的PPI网络构建和关键靶点筛选将SJMS入血成分作用靶点与HT相关靶点输入在线分析工具Venny 2.1.0,并绘制Venn图,见图 3,得到296个交集靶点,即为SJMS治疗HT的潜在靶点。
|
| 图 3 SJMS入血成分与HT疾病靶点交集的韦恩图 |
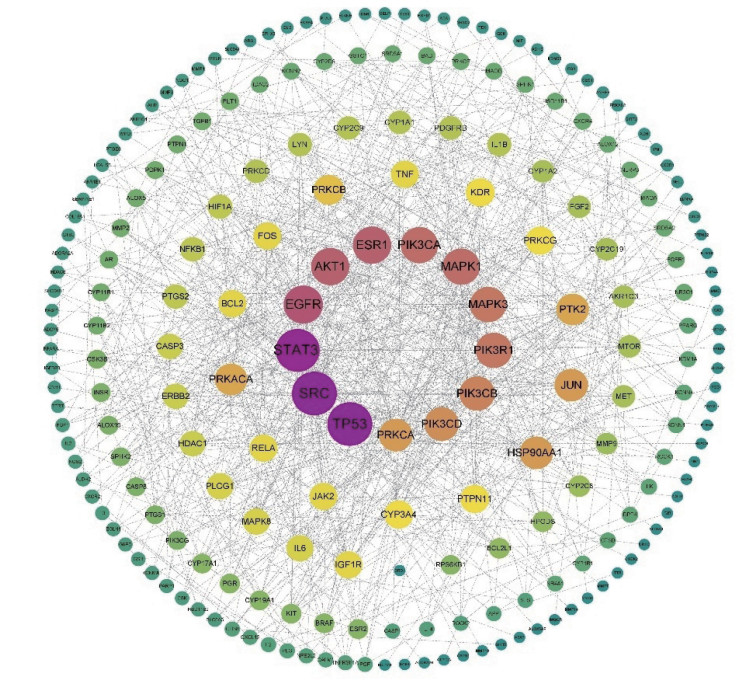
将SJMS治疗HT的潜在靶点导入String 11.5平台并分析后导入Cytoscape 3.8.1软件生成PPI网络图,去除游离基因后,见图 4。该网络共295个节点(代表相互作用靶点),5 334条边(代表各靶点之间相互作用关系)组成平均节点度为36.2,平均局部聚类系数为0.524。用“CytoNCA”模块分析,计算各节点的“度中心性(degree)”“介数中心性(betweenness)”和“接近中心性(Closeness)”,以3个拓扑参数均大于交集网络所有节点平均值的标准筛选,获得关键靶点。其中degree的平均值为6.89,Betweenness的平均值为765.43,Closeness的平均值为0.32,筛选出符合degree > 7.88,Betweenness > 592.43且Closeness > 0.28的关键靶点,图中所示节点越大、颜色越深代表该节点重要程度越髙,按照degree值排名前10位的核心节点信息见表 1。结果显示肿瘤抑制因子(TP53)、非受体酪氨酸激酶(SRC)、信号转导和转录激活因子3(STAT3)在SJMS治疗HT过程中、在靶点之间相互作用较多。
|
| 图 4 交集靶点PPI网络图 |
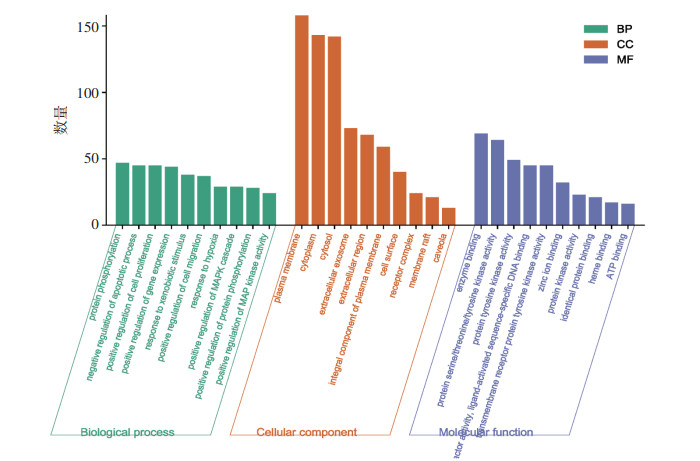
对SJMS治疗HT的核心靶点进行GO生物功能注释,结果如图 5所示。图中横坐标表示GO富集条目,纵坐标为基因数,气泡越大代表富集到该GO条目上的基因数量越多,气泡颜色越红表示P值越小,GO特征越为显著。共获得2 219个GO富集条目,其中生物途径(BP)942个,细胞定位(CC)103个,分子功能(MF)232个。BP、CC、MF富集分析结果按P值从小到大排列,前10项可视化结果见图 5。
|
| 图 5 GO富集分析图 |
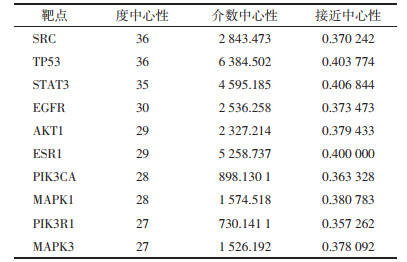
生物途径主要富集在蛋白质磷酸化、凋亡过程的负调控、细胞增殖的正向调节、基因表达的正向调控等;细胞定位主要集中在细胞膜、细胞质、细胞液等;分子功能主要集中在酶结合、蛋白丝氨酸/苏氨酸/酪氨酸激酶活性、RNA聚合酶Ⅱ转录因子活性等。KEGG富集分析共获得189条信号通路,主要包括以下通路:缺氧诱导因子-1(HIF-1)信号通路、癌症通路、高级糖基化终末产物-受体(AGE-RAGE)信号通路、第一代表皮生长因子受体酪氨酸激酶抑制剂通路、脂质与动脉粥样硬化等,将20个显著富集的通路的详细信息进行整理,结果见表 2,可视化气泡图见图 6。
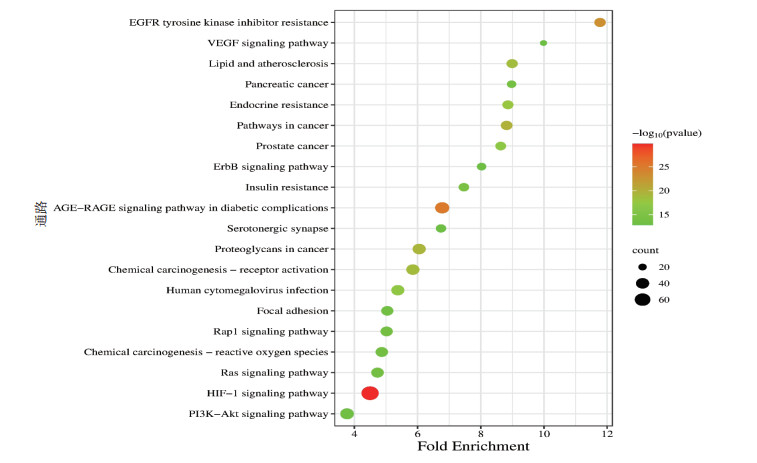
|
| 图 6 通路富集分析气泡图 |
将SJMS的23个入血活性成分、296个潜在交集关键靶点和20条KEGG信号通路(P < 0.01),导入Cytoscape 3.8.1进行整合,构建SJMS治疗HT的“成分-疾病-通路-靶点”网络图,见图 7。分析图显示,有341个节点,1 174条边。匹配到23个入血成分、296个交集靶点、20条通路。
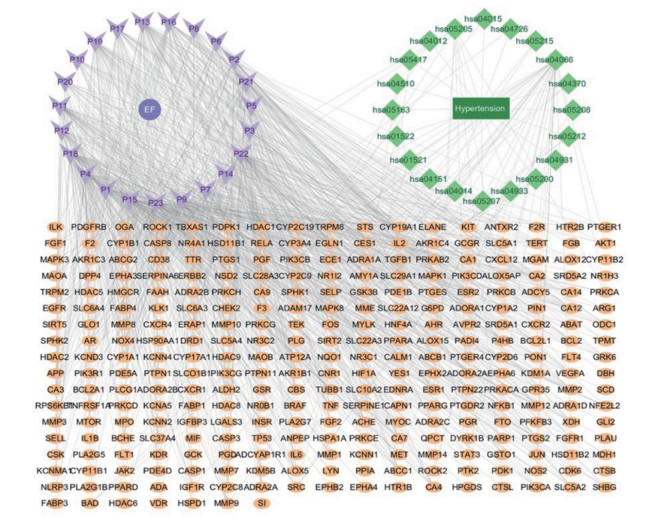
|
| 图 7 成分-疾病-通路-靶点作用网络 |
研究运用UHPLC/Q-Orbitrap-MS技术对SJMS进行成分分析,明确了SJMS的体外化学成分谱,并对其体内入血成分进行分析,筛选出23个SJMS抗HT的入血活性成分。决明子具有清肝火、平肝阳、清热治疗头眼病的功效。用于治疗肝阳上亢引起的头痛头晕时,常与菊花、钩藤、夏枯草配伍[16]。据《江西本草》记载,决明子煎液(15 g),可以治疗高血压、眩晕。含有决明子的中成药如山菊降压片和清脑降压片已经在临床中应用[17]。在脂多糖刺激的RAW264.7细胞炎症模型中橙黄决明素(P16)能显著降低一氧化氮、前列腺素E2的产生,抑制环氧合酶-2、肿瘤坏死因子-α(TNF-α)和白介素(IL)-6,为橙黄决明素作为1种新的炎症相关疾病的治疗药物提供了科学依据[18]。橙黄决明素诱导血管舒张依赖于内皮完整性和一氧化氮(NO)的产生,而NO的产生是通过内皮磷脂酰肌醇3激酶/蛋白激酶B/内皮型一氧化氮合酶(PI3K/Akt/eNOS)途径介导来舒张体动脉,提示橙黄决明素作为1种新的潜在的血管扩张剂,对HT有一定的治疗作用。除此之外作为决明子的有效活性成分,有研究也表明,决明子中萘吡喃酮类红链霉素-6-O-β-龙胆二糖(P10)具有明显的保肝活性,决明柯酮(P4)对4株甲氧西林耐药菌株有明显的抗菌作用[19]。根据早期的研究结果,菊花在降低血压和预防HT相关的心肌纤维化方面是有效的[20]。菊花中的芹菜素是1种广泛分布的天然膳食类黄酮,已被证明在预防和治疗许多疾病,如癌症、糖尿病、阿尔茨海默病和年龄相关的功能衰退中发挥有效作用,并作为自由基清除剂和抗氧化剂,具有抗诱变、抗炎和抗病毒作用[21]。最新研究指出,芹菜素(P22)在抑制Akt激酶的同时,能有效抑制人前列腺癌PC3-M细胞中的HIF-1α表达[22]。He等[23]研究表明芹菜素可以通过抑制HIF-1α增加Kv1.5的表达,来抑制缺氧大鼠肺动脉平滑肌细胞的增殖并诱导线粒体依赖性凋亡,从而降低肺动脉高压。甘草酸(P14)是甘草的主要活性化合物,约占甘草根干重的10%,是1种β-淀粉样三萜皂苷,许多临床前研究报告称其具有抗病毒、神经保护和强效抗炎特性。异甘草素(P15)和甘草素(P11)也被报道具有抗炎作用[24]。
4.2 SJMS抗HT的关键靶点分析通过蛋白互作网络拓扑分析,获得SJMS活性成分抗HT的核心靶点。这些靶点主要包括SRC、TP53、STAT3、EGFR、Akt1、ESR1、PIK3CA、MAPK1、PI3KA1、MAPK3等。通过“药物-成分-疾病-通路-靶点”网络图可以发现SJMS并非通过单一的成分和单一的靶点起到抗高血压的作用,而是通过多成分,而这些活性成分可以通过作用于1个或多个靶点来达到治疗疾病的效果[25]。生理性致癌基因SRC是1种非受体蛋白酪氨酸激酶,活化SRC磷酸化信号转导通路中的底物,如Ras/MAPK和PI3K/Akt通路,涉及SRC/FAK复合物的信号网络在细胞增殖、迁移、血管生成和转移中起关键作用。Liu等[26]体外实验结果表明,抑制SRC(Tyr416)磷酸化可通过Akt/mTOR信号通路抑制HIF-1α的表达,从而抑制肺动脉高压平滑肌细胞(PAH-PASMC)的增殖和迁移。STAT3作为1种转录因子,参与调控细胞存活、血管生成、发育和再生、能量学和代谢储备以及抗氧化途径等众多基因。STAT3早期作为1种急性期反应蛋白被发现,可以被大多数促炎因子如TNF-α、IL-1和IL-6激活,STAT3通路是IL-6的直接下游效应因子,该通路可以诱导多种重要的生物活动,包括炎症和癌症。STAT3也在血管生长的旁分泌介质中起重要作用。例如,心肌细胞特异性过表达STAT3会增加心肌毛细血管密度,增强促血管生成血管内皮生长因子(VEGF)和血管内皮(VE)-钙黏蛋白的表达[27]。Akt1是1种丝氨酸/苏氨酸蛋白激酶,在调节多种细胞过程中发挥重要作用,包括代谢、增殖、细胞存活和转化[28]。Akt1的失调与包括心血管疾病在内的多种发病机制疾病有关。Akt1可磷酸化激活NF-κB p65,从而激活或抑制炎性细胞因子如TNF-α和IL-6,Akt1可通过抑制IL-6表达,从而改善心肌氧化应激、炎症反应、纤维化等,也可抑制新生内膜细胞凋亡与内皮型一氧化氮合酶(eNOS)的激活,在血管重塑中发挥着保护作用。研究表明高同型半胱氨酸血症主要通过Akt1/NF-κB p65/IL-6通路协同加重高血压动脉损伤,Akt1缺乏也可减轻肺动脉高压的发展[28-29]。肿瘤抑制因子Trp53(p53)作为1种转录因子,参与胞质蛋白相互作用、基因组稳定性、DNA修复、细胞分裂、细胞凋亡和细胞能量代谢等多种细胞过程的调控,在生理条件下维持正常的心脏结构。p53是细胞内代谢的重要上游调节因子,在许多心血管疾病中,p53和线粒体的变化经常是一致的,p53和线粒体通过多种机制相互关联。p53可通过调节细胞色素C氧化酶的合成来影响线粒体呼吸。p53在抑制血管生成等方面也发挥着重要作用,如在心脏缺血再灌注过程中p53被激活抑制氧化磷酸化,但增加活性氧的产生,从而导致氧化应激加重心肌损伤[30]。MAPK1、MAPK3均属于MAPKs家族,MAPKs调节基本的生物过程以及细胞对外部应激信号的反应,并能够调节炎症介质和凋亡介质的合成[31]。表皮生长因子受体(EGFR)是参与生长因子信号传导的主要分子靶点,EGFR激活介导多种细胞信号通路,包括PI3K/Akt/mTOR和Ras/Raf/MEK/ERK,激活这些途径导致细胞增殖失控,细胞凋亡、血管生成、迁移和转移受到抑制;研究发现EGFR抑制剂能够抑制氧化应激、促炎细胞因子的诱导产生、泡沫细胞的形成以及平滑肌细胞增殖,从而抑制动脉粥样硬化斑块的生成[31-32]。骨髓细胞EGFR的缺失能够下调IL-6、TNF-α的表达,减少脂质的摄取和炎症反应。
4.3 SJMS抗HT的KEGG通路分析KEGG通路富集分析主要涉及通路方面则集中在HIF-1信号通路、AGE-RAGE信号通路、EGFR酪氨酸激酶抑制剂耐药性等多条通路。HIF-1由功能亚基、氧调节亚基HIF-1α和组成亚基HIF-1β组成。HIF-1α调节细胞反应的转录因子,如增殖、能量代谢、存活、纤维化、炎症和血管生成。在Fawn-hooded大鼠中,HIF-1α被激活,通过钾通道通路破坏氧传感并引发肺动脉高压。在缺氧条件下,HIF-1α的泛素化和降解过程被抑制,导致HIF-1α迅速累积,启动和促进巨噬细胞泡沫化、内皮细胞功能障碍,加重炎症反应,HIF-1可能作为炎症疾病治疗的1个新靶点。AGE为糖基化终末产物,RAGE为糖基化终产物受体,当AGE与其配体结合后可启动包括NF-κB在内的多条信号通路而致炎症的发生,导致细胞功能紊乱。AGEs-RAGE系统通过信号传导产生氧化应激反应和炎症反应参与高血压靶器官损害的进程。通过阻滞AGEs的形成就可以阻断AGEs-RAGE的信号传导系统,减少氧化应激反应所致的靶器官损害[33]。
4.4 SJMS抗HT的机制研究研究借助UHPLC/Q-Orbitrap-MS技术初步阐明了SJMS的主要化学成分及药效物质基础,同时借助网络药理学探讨了SJMS抗HT的作用机制。SJMS通过新绿原酸、红链霉素-6-O-β-D-龙胆二糖苷,甘草素,柚皮素,甘草酸,异甘草素,橙黄决明素,芹菜素,甘草次酸等23个主要活性成分,作用于PIK3CA、HRAS、MMP9、EGFR、MTOR、TNF等关键靶点,调控了HIF-1、AGE-RAGE相关的多条信号通路,抑制了HT炎症反应的加重和增强机体免疫来共同发挥抗HT的作用。然而基于中药作用的复杂性及网络药理学的局限性,有待今后药理实验验证。
| [1] |
万晨阳. 石决明散对小鼠干眼模型眼表损伤修复作用及作用机制研究[D]. 沈阳: 辽宁中医药大学, 2020.
|
| [2] |
马程遥, 宋珊珊, 王一清, 等. 基于UHPLC-Q-TOF-MS整合网络药理学探讨青娥丸效应成分及抗抑郁作用机制[J]. 中国药理学通报, 2023, 39(11): 2170-2176. |
| [3] |
梁红宝, 孙建之, 姜宇珺, 等. 基于GC-MS和UPLC-Q-ExactiveMS技术的首荟通便胶囊质量标志物研究[J]. 中草药, 2022, 53(21): 6674-6685. |
| [4] |
安芸, 杨剑宏, 王臣臣, 等. UHPLC/Q-TOF-MS法分析决明子化学成分[J]. 中成药, 2017, 39(4): 776-781. |
| [5] |
黄梦文, 吴欢, 于伟, 等. 超高效液相色谱-四极杆-飞行时间质谱法快速辨识芪玉三龙汤化学成分[J]. 色谱, 2021, 39(7): 730-743. |
| [6] |
董玉洁, 蒋沅岐, 刘毅, 等. 决明子的化学成分、药理作用及质量标志物预测分析[J]. 中草药, 2021, 52(9): 2719-2732. |
| [7] |
CHEN Y Y, WU H W, WANG L X, et al. Chemical composition and absorption characteristics of Raw and Prepared Cassiae Semen extracts based on ultra-high-performance liquid chromatography-quadrupole Orbitrap high-resolution mass spectrometry[J]. Journal of Separation Science, 2024, 47(1): e2300826. DOI:10.1002/jssc.202300826 |
| [8] |
李雪岩, 刘洋, 刘芳, 等. 菊花黄酮类化合物与黄嘌呤氧化酶的药靶结合动力学研究[J]. 中国中药杂志, 2021, 46(7): 1822-1831. |
| [9] |
韩星. 基于多成分药物代谢的菊花、秦艽、枸杞子质量控制成分筛选研究[D]. 北京: 北京中医药大学, 2020.
|
| [10] |
LI Y F, YANG P Y, LUO Y H, et al. Chemical compositions of Chrysanthemum teas and their anti-inflammatory and antioxidant properties[J]. Food Chemistry, 2019, 286: 8-16. DOI:10.1016/j.foodchem.2019.02.013 |
| [11] |
孙玉振, 王文娟, 孙宏远, 等. 基于质谱技术的甘草饮片及其炮制品化学成分系统分析和差异成分分析[J]. 中国现代中药, 2023, 25(1): 47-57. |
| [12] |
段伟萍, 李缘嫒, 郑云枫, 等. 基于LC-MS/MS法分析生、炙甘草中水溶性成分[J]. 中成药, 2020, 42(5): 1237-1243. |
| [13] |
刘刚, 吴燕, 刘育辰, 等. 乌拉尔甘草化学成分研究进展[J]. 中国现代中药, 2021, 23(11): 2006-2016. |
| [14] |
蔡信福, 徐雅, 刘和平, 等. 基于液质联用技术的经典名方羌活胜湿汤标准煎液的化学成分分析[J]. 中国中药杂志, 2022, 47(2): 343-357. |
| [15] |
马丽梅, 杨军丽. 羌活药材的化学成分和药理活性研究进展[J]. 中草药, 2021, 52(19): 6111-6120. |
| [16] |
CHEN Y Y, CHEN X X, YANG X Y, et al. Cassiae Semen: A comprehensive review of botany, traditional use, phytochemistry, pharmacology, toxicity, and quality control[J]. Journal of Ethnopharmacology, 2023, 306: 116199. DOI:10.1016/j.jep.2023.116199 |
| [17] |
DONG X, FU J, YIN X B, et al. Cassiae Semen: A review of its phytochemistry and pharmacology(Review)[J]. Molecular Medicine Reports, 2017, 16(3): 2331-2346. DOI:10.3892/mmr.2017.6880 |
| [18] |
CHOI S S, LEE S H, LEE K A. A comparative study of hesperetin, hesperidin and hesperidin glucoside: Antioxidant, anti-inflammatory, and antibacterial activities in vitro[J]. Antioxidants(Basel, Switzerland), 2022, 11(8): 1618. |
| [19] |
LIU Y, SUN X M, HU X P, et al. Pharmacological properties and underlying mechanisms of aurantio-obtusin(Review)[J]. Experimental and Therapeutic Medicine, 2023, 26(2): 380. DOI:10.3892/etm.2023.12079 |
| [20] |
WANG Y, LI Y Y, GUO W, et al. Comparison of the chemical components, efficacy and mechanisms of action of Chrysanthemum morifolium flower and its wild relative Chrysanthemum indicum flower against liver-fire hyperactivity syndrome of hypertension via integrative analyses[J]. International Journal of Molecular Sciences, 2022, 23(22): 13767. DOI:10.3390/ijms232213767 |
| [21] |
PEI L X, SHU S N, WANG X Y, et al. Effect of Chrysanthemum extract on myocardial fibrosis in rats with renovascular hypertension[J]. Chung i Tsa Chih Ying Wen Pan, 2019, 39(4): 542-549. |
| [22] |
MIRZOEVA S, KIM N D, CHIU K, et al. Inhibition of HIF-1 alpha and VEGF expression by the chemopreventive bioflavonoid apigenin is accompanied by Akt inhibition in human prostate carcinoma PC3-M cells[J]. Molecular Carcinogenesis, 2008, 47(9): 686-700. DOI:10.1002/mc.20421 |
| [23] |
HE Y Z, FANG X Y, SHI J, et al. Apigenin attenuates pulmonary hypertension by inducing mitochondria-dependent apoptosis of PASMCs via inhibiting the hypoxia inducible factor 1α-KV1.5 channel pathway[J]. Chemico-Biological Interactions, 2020, 317: 108942. DOI:10.1016/j.cbi.2020.108942 |
| [24] |
MAJIMA T, YAMADA T, TEGA E, et al. Pharmaceutical evaluation of liquorice before and after roasting in mice[J]. Journal of Pharmacy and Pharmacology, 2004, 56(5): 589-595. |
| [25] |
郭文韬, 闫伊萌, 黄青, 等. 基于入血成分分析的靶向网络药理学结合分子对接研究黄英咳喘糖浆的药效物质基础及作用机制[J]. 分析化学, 2023, 51(8): 1332-1344. |
| [26] |
LIU P F, GU Y, LUO J, et al. Inhibition of Src activation reverses pulmonary vascular remodeling in experimental pulmonary arterial hypertension via Akt/mTOR/HIF-1 signaling pathway[J]. Experimental Cell Research, 2019, 380(1): 36-46. DOI:10.1016/j.yexcr.2019.02.022 |
| [27] |
ZHANG H X, YANG P L, LI E M, et al. STAT3beta, a distinct isoform from STAT3[J]. International Journal of Biochemistry & Cell Biology, 2019, 110: 130-139. |
| [28] |
SUN X T, KELLNER M, DESAI A A, et al. Asymmetric dimethylarginine stimulates Akt1 phosphorylation via heat shock protein 70-facilitated carboxyl-terminal modulator protein degradation in pulmonary arterial endothelial cells[J]. American Journal of Respiratory Cell and Molecular Biology, 2016, 55(2): 275-287. DOI:10.1165/rcmb.2015-0185OC |
| [29] |
TANG H Y, CHEN J W, FRAIDENBURG D R, et al. Deficiency of Akt1, but not Akt2, attenuates the development of pulmonary hypertension[J]. American Journal of Physiology Lung Cellular and Molecular Physiology, 2015, 308(2): L208-L220. DOI:10.1152/ajplung.00242.2014 |
| [30] |
WANG H, YU W, WANG Y B, et al. p53 contributes to cardiovascular diseases via mitochondria dysfunction: a new paradigm[J]. Free Radical Biology & Medicine, 2023, 208: 846-858. |
| [31] |
SINGH D, ATTRI B K, GILL R K, et al. Review on EGFR inhibitors: Critical updates[J]. Mini Reviews in Medicinal Chemistry, 2016, 16(14): 1134-1166. DOI:10.2174/1389557516666160321114917 |
| [32] |
殷春燕, 董占军, 陈江魁. 基于网络药理学和分子对接技术研究花生红衣多酚抗动脉粥样硬化的作用机制[J]. 食品与发酵工业, 2023, 49(20): 242-249. |
| [33] |
甘泽隆, 谢光波, 谢丽源. 基于网络药理学及分子对接技术探究猴头菇治疗慢性胃炎的潜在作用机制[J]. 菌物学报, 2023, 42(12): 2422-2441. |
 2024, Vol. 43
2024, Vol. 43