文章信息
- 王瑞瑞, 刘小梅, 王晓明, 黄宇虹, 潘桂湘
- WANG Ruirui, LIU Xiaomei, WANG Xiaoming, HUANG Yuhong, PAN Guixiang
- 血必净注射液与阿奇霉素联用在急性肺炎小鼠及巨噬细胞中的药动学相互作用
- Study on pharmacokinetic interaction by the combination of Xuebijing Injection and Azithromycin in acute pneumonia mouse and inflammation cells
- 天津中医药大学学报, 2024, 43(9): 798-803
- Journal of Tianjin University of Traditional Chinese Medicine, 2024, 43(9): 798-803
- http://dx.doi.org/10.11656/j.issn.1673-9043.2024.09.05
-
文章历史
收稿日期: 2024-05-10
2. 天津中医药大学第二附属医院, 天津 300250
2. Second Affiliated Hospital of Tianjin University of Traditional Chinese Medicine, Tianjin 300250, China
阿奇霉素(AZM)为大环内酯类抗菌药物,是临床上治疗支原体肺炎常用药物[1],抗菌效果显著,具有组织分布广泛、抗菌谱广和半衰期长等特点[2-3],但对于难治性支原体肺炎的疗效有限,临床使用中有发热、流感样症状和肌肉疼痛等不良反应报道,若大量或长期使用易产生耐药性的问题[4]。
血必净注射液(简称XBJ)是由王今达教授基于“菌毒炎并治”及“四正四法”的辨证原理,在血府逐瘀汤处方基础上研制而成的现代中药注射剂[5],由赤芍、当归、红花、丹参和川芎5味中药组方而成[6],临床上广泛用于重症肺炎、脓毒症和因感染诱发的全身炎症反应综合征等重症疾病的治疗[4, 7]。新型冠状病毒感染疫情期间,XBJ作为三药三方之一,显示出显著的临床疗效[8]。XBJ含有羟基红花黄色素A(HSYA)、芍药苷(PE)、阿魏酸、木犀草素、丹参素、洋川芎内酯I等成分,其中HSYA与PE在制剂中的含量及其静注后在体内的暴露程度最高[9-11]。这两种成分具有良好的抗炎作用:HSYA可降低肺炎大鼠肿瘤坏死因子-α(TNF-α)、白介素(IL)-1β、IL-6 mRNA的表达,显著抑制核内NF-κB p65蛋白表达并阻碍NF-κB p65的核移位,减轻博来霉素所致大鼠急性肺炎症[12];可降低脂多糖(LPS)诱导急性肺损伤小鼠肺组织TLR4、TNF-α、IL-1β及IL-6 mRNA和蛋白的表达,减轻炎症反应,改善急性肺损伤小鼠肺功能的损伤[13];PE可抑制肺组织αvβ3/TGF-β1通路的激活,减少促炎细胞因子的产生和肺胶原沉积,改善甲型流感病毒诱导的小鼠急性肺损伤[14]。
近年来中西药联合被广泛采纳。中药注射剂具有见效快、安全性好等优点[15],常与化学药物联合使用,以达到增效减毒的目的[16]。例如中药制剂喜炎平注射液、麻杏石甘汤和热毒宁注射液与AZM联合用于小儿支原体肺炎治疗,疗效较单独给药组相比有所增加,且不良反应发生率有所降低[17-19]。与之类似的临床研究发现,将AZM与中药XBJ联合用于支原体肺炎治疗时,疗效更为显著[20];1项140例支原体肺炎患者的观察发现,AZM联合XBJ组疗效明显优于单独使用AZM组[21]。因此,笔者推测XBJ与AZM联用后,在血浆、组织或者细胞层面可能发生潜在的药动学相互作用,使药物体内/细胞暴露水平增高,进而产生药效增效的效果。
研究采用液相色谱串联质谱(LC-MS/MS)法测定XBJ与AZM单用/联用后,AZM、HSYA、PE在急性肺炎小鼠血浆、肺组织、RAW264.7细胞内的药物浓度,判断两药联用是否存在药动学相互作用,以期为临床安全合理用药提供依据。
1 材料与仪器 1.1 仪器AB QTRAP5500三重四极杆质谱(美国AB公司),Acquity UPLC超高液相色谱(美国Waters公司),AG22331真空浓缩仪(德国Eppendorf公司),JXFSTPRP-24全自动样品快速研磨仪(上海净信有限公司),P-150904非接触式细胞破碎仪(比利时Diagenode公司),Flex Station 3多功能酶标仪(Molecular Devices),5427R低温超速离心机(德国Eppendorf公司,离心半径25 cm)。
1.2 试剂XBJ(国药准字:Z20040033)购于天津红日药业有限公司;注射用AZM(国药准字:J20140073)购于美国辉瑞制药有限公司;标准品罗红霉素、HSYA、AZM和氯霉素均购于中国药品生物制品检定研究院;标准品PE购于北京索莱宝科技有限公司;乙腈和甲醇购于美国Fisher公司;甲酸购于ROE公司;培养基(高糖)(DMEM)和胎牛血清(FBS)均购于美国Gibco公司;脂多糖和双抗(青链霉素)购于美国Sigma公司;NF-κBp65(D14E12)XP Rabbit mAb购于美国CST公司;山羊抗兔IgG H&L(Alexa Fluo@555)购于英国Abcam公司。
1.3 动物360只SPF级ICR雄性小鼠,体质量22~25 g,由北京维通利华实验动物技术有限公司提供,实验伦理审查批准号:TJAB-TJU20160032。饲养于温度23~27 ℃、湿度45%~65%、12 h光/暗循环条件下,适应性喂养7 d后开始实验。
1.4 细胞小鼠单核巨噬细胞RAW264.7细胞购于中国科学院上海生命科学研究院细胞资源中心。
2 方法与结果 2.1 动物肺炎模型及给药方案成人日用AZM剂量为500 mg,XBJ日用剂量为50 mL,根据体表面积法,20 g小鼠对应70 kg成人的换算系数为0.002 6,折算成小鼠AZM剂量为65 mg/kg,XBJ剂量为6.5 mL/kg[22]。实验分为AZM单用组(65 mg/kg)、XBJ单用组(6.5 mL/kg)以及AZM+XBJ联合给药组(同等剂量的AZM和XBJ同时给药)。随机分组,每组120只小鼠。实验开始前12 h,所有组别小鼠禁食不禁水,小鼠麻醉后,通过气管滴注50 μL 1 mg/mL的LPS建立急性肺炎小鼠模型。
造模12 h后,各组120只小鼠分别尾静脉注射给药,每只小鼠随机对应于给药后的0、0.167、0.25、0.5、1、2、4、6、12、24、48、96、192 h中的某1个采血时间点,每个时间点10只小鼠,眼眶取血。全血置于含有肝素钠的EP管中,8 000 r/min离心10 min,取血浆作为待测血浆样品。每只小鼠取血后立即脱颈处死取出肺组织称质量,取肺组织作为待测组织样品。
2.2 细胞培养及药物处理RAW264.7细胞用含10%FBS和5%双抗的DMEM培养基于37 ℃、5% CO2的培养箱中培养,待细胞融合度约80%-90%时,进行传代或用于实验。实验分为7组,分别为AZM组(2 μg/mL)、XBJ组(稀释50、100和200倍)以及AZM+XBJ联合给药组(同等浓度的AZM和XBJ同时给药)。每组细胞中加入10 μg/mL LPS孵育30 min,建立炎性细胞模型。分别于给药后的0、0.25、0.5、1、2、3、6 h不同时间点,收集细胞并破碎,蛋白含量测定后,将其保存在-80 ℃下,作为待测细胞样品。
2.3 超高效液相色谱-质谱联用技术(UPLC-MS)条件 2.3.1 色谱条件Waters ACQUITY UPLC BEH C18色谱柱(100 mm×2.1 mm,1.7 μm),以0.1%甲酸-水为流动相A,以0.1%甲酸-乙腈为流动相B进行梯度洗脱,流速0.3 mL/min,柱温40℃,进样体积2 μL。AZM洗脱的条件为:0.00~1.00 min,5%(B);1.00~1.01 min,5%~40%(B);1.01~1.70 min,40%(B);1.70~2.00 min,40%~95%(B);2.00~2.30 min,95%(B);2.30~2.31 min,95%~5%(B);2.31~4.00 min,5%(B)。XBJ的洗脱条件为:0.00~4.00 min,5%~95%(B);4.00~5.00 min,95%~5%(B)。
2.3.2 质谱条件采用电喷雾离子化电离源(ESI),扫描方式为多反应监测(MRM),检测AZM时采用正离子模式扫描,喷雾电压为5.5 kV,离子化温度为600 ℃,气帘气为30 psi,GS1为55 psi,GS2为50 psi;检测XBJ时采用负离子模式检测,喷雾电压为4.5 kV,离子化温度为550 ℃,气帘气为40 psi,GS1为55 psi,GS2:60 psi。
2.4 溶液配制精密称取AZM、HSYA、PE对照品适量,分别加入甲醇配制成1 mg/mL的储备液。精密称取罗红霉素、氯霉素对照品适量,分别加入甲醇配制为1 mg/mL的储备液,稀释后得500 ng/mL的罗红霉素、氯霉素的内标溶液。
2.5 生物样本预处理方法 2.5.1 血浆样本取50 μL血浆,依次加入50 μL罗红霉素内标溶液、氯霉素内标溶液,加入50 μL乙腈-水(3:2,V/V)溶液,涡旋混匀后加入350 μL甲醇,涡旋5 min,以14 000 r/min离心10 min,取上清液,进样分析。在进行AZM测定前,需要对血浆样品进行10倍的稀释处理;对于HSYA和PE的测定,则无须对血浆样品进行稀释处理。
2.5.2 肺组织样本称取适量小鼠肺组织样品置于研磨管中,按照肺组织质量: 甲醇=1:3的比例加入甲醇,研磨。取组织匀浆液,以14 000 r/min离心10 min,取上清液,得肺组织研磨液。取50 μL肺组织研磨液,依次加入50 μL罗红霉素内标溶液、氯霉素内标溶液,加入50 μL乙腈-水(3:2,V/V)溶液,涡旋混匀后加入350 μL甲醇,涡旋5 min,以14 000 r/min离心10 min,取上清液,进样分析。
2.5.3 细胞样本待测物为AZM的细胞样本前处理:取50 μL细胞悬液,加入50 μL罗红霉素内标溶液、50 μL乙腈-水(3:2,V/V)溶液,涡旋混匀后加入350 μL甲醇,涡旋5 min,以14 000 r/min离心10 min,取上清液,进样分析。
待测物为HSYA和PE的细胞样本前处理:取50 μL细胞悬液,加入50 μL氯霉素内标溶液、50 μL乙腈-水(3:2,V/V)溶液,涡旋混匀后加入350 μL甲醇,涡旋5 min,以14 000 r/min离心10 min,取400 μL上清液置于真空离心浓缩仪,挥干溶剂,残渣加100 μL甲醇复溶,涡旋5 min,以14 000 r/min离心5 min,取上清液,进样分析。
2.6 统计学方法采用WinNonlin 8.1药动学软件非房室模型拟合各成分的药动学参数,运用GraphPad Prism 8.0软件分析并进行独立样本t检验,显著性差异水平设定为P < 0.05,P < 0.01,P < 0.001,具有统计学意义。
2.7 血浆药动学取各组血浆样本,按“2.5.1”项下方法处理,测定AZM、HSYA和PE各时间点的血浆药物浓度。
药-时曲线如图 1所示,AZM在药后192 h内仍可被检测到,且AZM+XBJ联用组中AZM的药时曲线下面积大于AZM单独用药,差异具有统计学意义(P < 0.001);XBJ主要成分HSYA和PE在12 h内均能被检测到,联合用药后HSYA和PE的药时曲线下面积也高于XBJ单独用药,差异具有统计学意义(P < 0.001)。
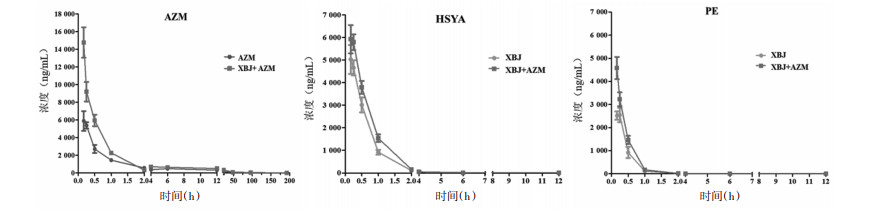
|
| 图 1 AZM、HSYA和PE在血浆中的药-时曲线 |
药代动力学参数见表 1。结果显示,与AZM单用组相比,AZM与XBJ联合使用后,血浆中AZM的t1/2、Cmax与AUC0-t均升高, 差异具有统计学意义(分别为P < 0.05,P < 0.001),CL下降,差异具有统计学意义(P < 0.001)。与XBJ单用组相比,联合给药后HSYA与PE在体内的Cmax与AUC0-t提高,差异具有统计学意义(分别为P < 0.05,P < 0.01),CL下降,差异具有统计学意义(P < 0.001),但两者的半衰期和平均滞留时间差异无统计学意义(P > 0.05)。
取各组肺组织样本,按“2.5.2”项下方法处理后进样,测定AZM、HSYA、PE各时间点的组织药物浓度,采用WinNonlin 8.1软件处理后,使用GraphPad Prism 8.0软件分析并进行独立样本的t检验。结果如图 2所示,联合给药组的AZM、HSYA和PE在肺组织中的含量均高于单独给药组。
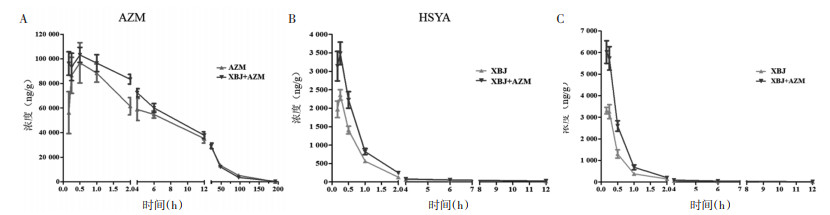
|
| 图 2 AZM、HSYA和PE在肺组织中的药-时曲线 |
取各组细胞样本,按“2.5.3”项下方法处理后进样,测定AZM、HSYA和PE各时间点的细胞药物浓度,采用WinNonlin 8.1软件处理,计算药动学参数AUC,使用GraphPad Prism 8.0软件分析并进行独立样本的t检验。AZM、HSYA和PE的细胞药物浓度变化如图 3所示,药-时曲线下面积见表 2。给药后AZM、HSYA和PE均可快速被细胞摄取;AZM在2 h达到浓度峰值,AZM细胞内药物浓度和AUC,联合给药组较单独给药组均有所升高,差异具有统计学意义(分别为P < 0.01,P < 0.001);HSYA和PE的细胞内药物浓度与AUC,联合给药组和单独给药组未发生变化,差异无统计学意义(P > 0.05)。
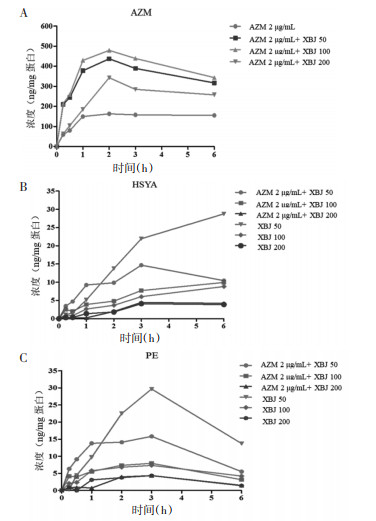
|
| 图 3 AZM、HSYA和PE在RAW264.7细胞内的药-时曲线 |
AZM具有特殊的药代动力学特征(半衰期长,在血液和组织中高浓度聚集),若能长期维持较高的体内药物浓度,则有望进一步增强其疗效。基于此,实验将XBJ与AZM联合使用,探讨两药合用后中药对西药及西药对中药药物浓度的影响。药动学研究结果显示,AZM与XBJ联用后可显著增加AZM、XBJ中的HSYA和PE在肺炎小鼠体内的t1/2与在血浆和肺组织中的AUC、Tmax,减小AZM、HSYA和PE在血浆中的CL,提示联合用药可延长AZM、HSYA和PE在血浆与肺组织中的滞留时间,减缓其在体内的清除。有临床研究表明,AZM与XBJ联合用于支原体肺炎治疗,合用组较AZM单用组可显著促进炎症消散,明显缩短治愈时间,增加治愈率[21]。由此笔者推测两药联用后产生的药代动力学变化,可能是AZM增加药物抗炎药效的重要因素。
通常而言,药物发挥药效需要跨越许多生物学屏障,并与细胞内的特定靶标产生相互作用[23]。因此与血浆药物浓度相比,靶细胞内药物浓度有时可以更好地反映出药效[24]。RAW264.7细胞药代动力学实验结果显示,AZM与XBJ联合使用后,AZM的细胞药代动力学特征出现显著变化,细胞内药物浓度较单一用药显著增加;而HSYA与PE的细胞药代动力学未发生改变,这可能与AZM独特的药代动力学特征(AZM对细胞的靶向作用较强[25],能高效地富集于细胞内,尤其是吞噬细胞[26])有关。据报道,AZM可通过中和巨噬细胞中溶酶体pH,增加AZM的外排,使其以较高浓度蓄积在细胞内[27]。笔者推测:炎症状态下,XBJ可促进巨噬细胞摄取AZM,使其富集于溶酶体内,增加AZM在巨噬细胞内的暴露水平,随后再靶向转移分布至感染组织,达到增强抗炎作用的效果。
另一方面,XBJ与AZM联合用药后,有助于改变AZM在血液、组织间液与细胞内液间的分布,增加AZM、HSYA和PE在肺组织的富集,减少AZM向肺外组织的分布,起到减少AZM不良反应(累及多个组织器官)的目的。
| [1] |
田野. 阿奇霉素序贯疗法治疗小儿支原体肺炎的临床疗效分析[J]. 中国现代药物应用, 2022, 16(10): 130-132. |
| [2] |
PARNHAM M J, ERAKOVIC HABER V, GIAMARELLOS-BOURBOULIS E J, et al. Azithromycin: Mechanisms of action and their relevance for clinical applications[J]. Pharmacology & Therapeutics, 2014, 143(2): 225-245. |
| [3] |
P?USA T. Azithromycin in the treatment of patients with exacerbation of chronic obstructive pulmonary disease[J]. Polski Merkuriusz Lekarski, 2020, 48(283): 65-68. |
| [4] |
李小平. 解毒益气中药联合阿奇霉素治疗围产期沙眼衣原体感染临床研究[J]. 亚太传统医药, 2016, 12(4): 120-121. |
| [5] |
SONG Y L, YAO C, YAO Y M, et al. XueBiJing injection versus placebo for critically ill patients with severe community-acquired pneumonia: a randomized controlled trial[J]. Critical Care Medicine, 2019, 47(9): e735-e743. DOI:10.1097/CCM.0000000000003842 |
| [6] |
李娣, 曹雪晓, 蒲位凌, 等. 血必净注射液中有效成分的HPLC法定量检测[J]. 中国现代中药, 2018, 20(9): 1157-1160. |
| [7] |
王笑晴. 阿奇霉素与两种中药制剂治疗小儿上呼吸道感染临床观察[J]. 中国误诊学杂志, 2009, 4(19): 4588-4589. |
| [8] |
HUANG K, ZHANG P, ZHANG Z H, et al. Traditional Chinese Medicine(TCM) in the treatment of COVID-19 and other viral infections: Efficacies and mechanisms[J]. Pharmacology & Therapeutics, 2021, 225: 107843. |
| [9] |
王红, 刘玲, 苏联麟, 等. HPLC-ESI-MS/MS法同时测定血必净注射液中11种有效成分的含量[J]. 药学与临床研究, 2021, 29(4): 246-250. |
| [10] |
欧阳慧子, 何俊. LC-MS/MS测定血必净注射液中9种有效成分在大鼠体内血药浓度及药代动力学研究[J]. 中国中药杂志, 2018, 43(17): 3553-3561. |
| [11] |
陈向梅, 王晓雯, 骆晶, 等. 血必净注射液大鼠体内的药动学研究[J]. 药物分析杂志, 2012, 32(5): 744-748, 754. |
| [12] |
JIN M, XUE C J, WANG Y, et al. Protective effect of hydroxysafflor yellow A on inflammatory injury in chronic obstructive pulmonary disease rats[J]. Chinese Journal of Integrative Medicine, 2019, 25(10): 750-756. |
| [13] |
宋丽娟, 朱煜, 金鸣. 羟基红花黄色素A抑制脂多糖诱导的急性肺损伤小鼠炎症因子表达的研究[J]. 中国呼吸与危重监护杂志, 2016, 15(6): 577-582. |
| [14] |
YU W D, ZENG M S, XU P P, et al. Effect of paeoniflorin on acute lung injury induced by influenza A virus in mice. Evidences of its mechanism of action[J]. Phytomedicine, 2021, 92: 153724. |
| [15] |
CHENG C, LIN J Z, LI L, et al. Pharmacokinetics and disposition of monoterpene glycosides derived from Paeonia lactiflora roots(Chishao) after intravenous dosing of antiseptic XueBiJing injection in human subjects and rats[J]. Acta Pharmacologica Sinica, 2016, 37(4): 530-544. |
| [16] |
SHANG T, YU Q L, REN T T, et al. Xuebijing injection maintains GRP78 expression to prevent Candida albicans-induced epithelial death in the kidney[J]. Frontiers in Pharmacology, 2019, 10: 1416. |
| [17] |
孟昱瑾. 喜炎平联合阿奇霉素治疗小儿支原体肺炎的效果[J]. 中国医药指南, 2022, 20(14): 53-56. |
| [18] |
朱丽臻, 肖达民, 石艳红, 等. 麻杏石甘汤加减联合阿奇霉素治疗小儿肺炎支原体肺炎临床研究[J]. 新中医, 2023, 55(20): 31-35. |
| [19] |
许宝红. 热毒宁注射液联合阿奇霉素治疗儿童支原体肺炎的临床效果观察[J]. 实用中医内科杂志, 2020, 34(10): 94-96. |
| [20] |
DU D, LIAO S P, WU Y, et al. Serological analysis and drug resistance of Chlamydia pneumoniae and Mycoplasma pneumoniae in 4500 healthy subjects in Shenzhen, China[J]. BioMed Research International, 2017, 2017: 3120138. |
| [21] |
徐世红. 血必净注射液联合阿奇霉素治疗支原体肺炎70例临床观察[J]. 中国医药指南, 2017, 15(17): 6-7. |
| [22] |
李才, 任立群. 人类疾病动物模型的复制[M]. 2版. 北京: 人民卫生出版社, 2017.
|
| [23] |
梁艳, 邢蓉, 刘嘉莉, 等. 药代动力学新技术与新理论的研究进展[J]. 中国药科大学学报, 2014, 45(6): 607-616. |
| [24] |
倪苹, 张经纬, 刘嘉莉, 等. 细胞药代动力学研究进展[J]. 药学进展, 2014, 38(12): 881-885. |
| [25] |
陈雯, 高琛, 牟稷征, 等. 中药注射剂在新型冠状病毒肺炎治疗中的应用研究[J]. 中国医院用药评价与分析, 2021, 21(3): 377-380, 384. |
| [26] |
WILMS E B, TOUW D J, HEIJERMAN H G. Pharmacokinetics of azithromycin in plasma, blood, polymorphonuclear neutrophils and sputum during long-term therapy in patients with cystic fibrosis[J]. Therapeutic Drug Monitoring, 2006, 28(2): 219-225. |
| [27] |
OLIVER M E, HINKS T S C. Azithromycin in viral infections[J]. Reviews in Medical Virology, 2021, 31(2): e2163. |
 2024, Vol. 43
2024, Vol. 43