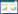文章信息
- 刘婧訸, 郑宜岚, 杨钦茹, 刘娴, 曹克刚, 许颖智, 唐璐
- LIU Jinghe, ZHENG Yilan, YANG Qinru, LIU Xian, CAO Kegang, XU Yingzhi, TANG Lu
- PI3K/AKT信号通路参与菖蒲参麦方改善急性脑梗死后神经功能缺损的分子机制
- PI3K/AKT signaling pathway is involved in the molecular mechanism of Changpu Shenmai Decoction in improving neurological deficits after acute cerebral infarction
- 天津中医药大学学报, 2024, 43(9): 804-815
- Journal of Tianjin University of Traditional Chinese Medicine, 2024, 43(9): 804-815
- http://dx.doi.org/10.11656/j.issn.1673-9043.2024.09.06
-
文章历史
收稿日期: 2024-04-20
2. 北京中医药大学中医脑病研究院, 北京 100027
2. Institute of Traditional Chinese medicine Encephalopathy, Beijing University of Chinese Medicine, Beijing 100027, China
急性脑梗死(ACI),是指各种原因导致脑部血液供应障碍,局部脑组织缺血、缺氧性坏死,继而出现相应神经功能缺损的一类临床综合征。ACI早期治疗关键在于尽早开通阻塞血管,包括静脉溶栓和血管内介入治疗,但静脉溶栓时间窗较短,血管内介入治疗需要医生具备一定操作技术及经验,实际受益人数有限[1],中国静脉溶栓率不足6%、血管内治疗率不足2%[2]。中医药具有多成分、多靶点的优势,能明显改善ACI患者的神经功能缺损症状,降低患者的致残率和死亡率,扩大受益人群[3]。
“正虚”是ACI根本病机,其中“气虚”是始动因素[4]和病情变化的关键因素[5-6],但易被“风、火、痰、瘀”之标实所掩盖,因此脑梗死急性期补气扶正治尤为重要。根据临床经验创制的具有补气扶正作用的菖蒲参麦方用于ACI疗效确切,其作用机制有必要进一步分析。研究基于网络药理学对菖蒲参麦方治疗ACI可能的分子生物学机制进行探讨,并通过分子对接技术及动物实验进行验证,旨在为今后指导菖蒲参麦方的临床应用和进一步研究提供基础与思路。
1 资料与方法 1.1 网络药理学预测菖蒲参麦方治疗ACI可能的分子生物学机制 1.1.1 菖蒲参麦方活性成分获取及靶点筛选在中医药系统药理学平台(TCMSP)数据库中,分别以人参、石菖蒲、巴戟天、鬼箭羽作为关键词进行化合物成分检索,以口服利用度OB≥30%且类药性DL≥0.18为条件筛选出活性成分及其对应的靶点。麦冬未纳入TCMSP数据库,因此在中药分子机制生物信息学分析工具(BATMAN-TCM)数据库中检索。运用蛋白数据库(UniProt)将靶点转换成GeneSymbol,对靶点与基因信息进行规范化处理。
1.1.2 ACI成分靶点的获取以“Acute Cerebral Infarction”作为关键词,在人类基因数据库(GeneCards)、在线人类孟德尔遗传数据库(OMIM)、遗传药理学与药物基因组学数据库(PharmGkb)、DrugBank数据库中进行基因检索,将物种设定为智人,获得已知ACI的靶点,运用R语言软件绘制韦恩图。
1.1.3 活性成分-潜在作用靶点网络构建运用R语言软件将所得菖蒲参麦方的活性成分对应靶点与ACI疾病靶点相映射,得到菖蒲参麦方治疗ACI的潜在靶点,并绘制韦恩图。将交集靶点导入Cytoscape 3.9.1软件中,构建菖蒲参麦方-药物活性成分-靶点间的互作网络图。图中“node”表示各节点,“edge”表示节点之间的相互关系。
1.1.4 蛋白互作网络(PPI)的构建为进一步探讨菖蒲参麦方与ACI靶点间的网络协同作用,将交集靶点导入蛋白互作网络数据库(STRING),物种设置为“Homo sapiens”,置信度评分≥0.95,删除游离的靶点。下载其结果string_interactions.tsv并导入Cytoscape 3.9.1进行可视化,构建PPI网络。利用Cytoscape软件中的CytoNCA插件功能对PPI网络进行拓扑分析,得到网络的“中介中心性(BC)”“接近中心性(CC)”“度中心性(DC)”“特征向量中心性(EC)”“网络中心性(NC)”“局部平均连通性(LAC)”等参数值,用R语言取软件筛选出BC、CC、DC、EC、LAC、NC的值均大于所有节点中位值的节点,筛选出潜在核心靶点。利用Cytoscape计算PPI网络中每个节点连接的边数,边数越多表示靶蛋白与其他蛋白之间的相互作用越强。
1.1.5 基因本体(GO)富集和京都基因与基因组百科全书(KEGG)通路富集用R语言软件对菖蒲参麦方治疗ACI的潜在靶点进行GO基因功能分析和KEGG通路富集分析。将过滤条件设置为P≤0.05、Q≤0.05,将结果导入Excel并进行可视化。
1.2 分子对接技术预测菖蒲参麦方活性成分与潜在靶点结合能力将核心活性成分与核心靶点进行分子对接验证。于Pubchem数据库中获取核心活性成分的2D结构,并保存为SDF格式。通过Chem3D软件将2D结构转换为3D结构,并保存为mol2格式。于Uniprot数据库中获取核心靶点ID,将ID输入PDB数据库中,获取其晶体结构,保存为PDB格式后,通过PyMOL软件打开,执行“remove solvent、remove organic”命令,并再次保存为PDB格式。通过Autodock1.5.7软件将上述处理后的核心活性成分及核心靶点(在本软件中进行加氢处理)保存为PDBQT格式,通过Grid Box功能寻找活性口袋,设置x-dimension、y-dimension、z-dimension均为40,Spacing(angstrom)为1.000。最后,采用Autodock Vina软件进行对接处理,用Pymol软件对其绘图观察核靶点与核心活性成分氢键的形成情况。以结合能大小衡量对接结果,结合能越小代表其对接结果越好,以结合能≤-5 kcal/mol表明两者具有较好的相互作用[7]。
1.3 基于大鼠大脑中动脉梗死(MCAO)模型验证菖蒲参麦方治疗急性脑梗死的作用机制 1.3.1 大鼠分组、MCAO模型建立SPF雄性SD大鼠35只,8周龄,体质量(260~280) g,购于北京华阜康生物科技股份有限公司[许可证编号SCXK(京)2020-0004],分笼饲养于北京中医药大学东直门医院屏障级动物房(温度20~26 ℃,湿度40%~70%)。每日提供大鼠标准饲料与饮用水。由北京中医药大学东直门医院中医内科学教育部重点实验室动物伦理委员会批准,批号23-12。
将实验动物随机分为假手术组(Sham组)、模型组(MCAO组)、菖蒲参麦方给药组(CPSM组)、抑制剂组(LY294002组)、菖蒲参麦方+抑制剂组(CPSM+LY294002组),每组7只。通过线栓法构建MCAO大鼠模型[8],大鼠造模前禁食12 h。腹腔注射1 %戊巴比妥钠4 mL/kg麻醉大鼠。将麻醉后的大鼠仰卧固定于手术台,暴露颈前皮肤,沿着颈部正中偏右侧1~2 mm位置纵向切开皮肤,分离肌肉、筋膜直至暴露右侧颈总动脉血管(CCA),结扎CCA近心端,用结扎线在CCA远心端系一活结。分离颈内动脉(ICA)和颈外动脉(ECA),结扎ECA近心端。血管夹夹闭ICA的远心端,在距离CCA分叉部约5 mm处剪一小口为线栓入口,将线栓插入ICA后撤去血管夹,将线栓沿入颅方向推进,直至栓线上的标记黑点位于ICA、ECA和CCA的交界处停止,系牢CCA远心端的细线,最后缝合切口并用碘伏消毒,并予青霉素钠抗感染。假手术组除不插入栓线外,其余处理与各组相同。
术后待大鼠清醒,根据Zea-Longa评分[9]对大鼠进行神经功能测评。0分:提尾时大鼠肢体伸展正常,无神经功能缺损症状;1分:提尾时患侧肢体不能完全伸展;2分:行走时,大鼠向患侧转圈;3分:行走时大鼠向患侧倾倒;4分:无法自发行走,可伴意识障碍。得分1-3分则造模成功,0分(未成模)或4分(神经功能损伤过重,无法存活)为造模不成功,剔除。
1.3.2 药物及试剂来源菖蒲参麦方(组成:人参、麦冬、巴戟天、石菖蒲、鬼箭羽,购于亳州市悠善堂生物科技有限责任公司)。PI3K抑制剂LY2940002(厂家:GLPBIO;货号:GC15485)。鼠源一抗Caspase-9(1:1 000)(厂家:Bioway;货号10380-1-AP);兔源一抗p-AKT(1:1 000)(厂家:Abways;货号CY6569);兔源一抗AKT(1:1 000)(厂家:Bioway;货号60203-2-lg);HRP-山羊抗小鼠二抗(1:5 000)(厂家:Servicebio;货号GB23301);HRP-山羊抗兔二抗(1:5 000)(厂家:Servicebio;货号GB23303)。2%TTC染色液(厂家:Solarbio;货号:P1020)。
1.3.3 药物干预中药饮片置于自动煎药锅中,加入6倍量的水,浸泡1 h后,加热煎煮50 min,用9号药筛进行过滤,保存药液,药渣加入6倍量的水进行煎煮(煎煮方式同第1次),均匀混合药液,干燥至粉并保存于干燥环境中。参考《药理实验方法学》[9]中人与大鼠体表面积折算的等效剂量比值计算大鼠每日用量,CPSM组、CPSM+LY294002组每日给药量为0.406 g/kg,使用蒸馏水将中药溶解至0.12 g/mL灌胃给药。LY294002组、CPSM+LY294002组于造模前0.5 h尾静脉注射LY294002 0.3 mg/kg[10],并于造模后每日注射相同剂量药物。Sham组及MCAO组每日灌胃相同体积蒸馏水并尾静脉注射相同体积生理盐水。所有组均连续给药1周,每日1次。
1.3.4 观察指标与方法 1.3.4.1 行为学实验每组随机选取6只大鼠进行行为学实验,包括改良神经功能评分(mNSS)、抓力实验、转棒实验。mNSS评分评定大鼠神经功能:分别于造模后1、3、5、7 d由两名实验员共同对大鼠做mNSS评分[11],其主要包括运动功能、感觉功能、平衡木、反射、异常运动5个方面。
抓力实验评定大鼠肢体力量:将抓力仪置于水平桌面,轻抓大鼠尾部,使大鼠前爪握住抓力仪,后爪悬空,待大鼠平静匀速后拉,大鼠前爪掉落后屏幕呈现数值即为大鼠肢体力量。每只大鼠于造模7 d后测量3次抓力,并取平均值,每次测试间隔10 min。
转棒实验评定大鼠运功及共济水平:将动物放于缓慢转动的转棒上2 min,适应后启动转棒,转棒从4 r/min匀速增快,记录大鼠从转棒上掉落的时间。每只大鼠于造模7 d后测3次取平均值,每次测试间隔10 min。
1.3.4.2 2,3,5-三苯基氯化四氮唑(TTC)染色每组随机取3只大鼠,造模7 d后断头取脑,-20 ℃冰箱冰冻20 min,后将大脑等分6片。将大脑切片置于TTC染色液(37 ℃恒温箱中预热20 min),37 ℃孵育10~20 min,后置于4 %细胞固定液中10~20 min。将固定好的脑组织切片按顺序摆放于深夜背景板上,并用相机拍照。将照片导入Image J软件分析梗死面积百分比(染色后正常脑组织呈红色,梗死部位脑组织呈白色),梗死面积百分比=白色梗死面积总和/各大脑切片面积总和×100 %。
1.3.4.3 免疫蛋白印迹(Western Blot)检测每组随机取4只大鼠,造模7 d后检测蛋白表达情况。脑组织(各造模组取脑皮质缺血区)提取蛋白后用BCA法测定浓度。电泳分离蛋白后转移至PVDF膜,涮洗转印完的膜后将其放入装有TBST的孵育盒中,室温下使用5 %脱脂奶粉液封闭30 min。倒掉封闭液后加入配置好的一抗,并于4 ℃孵育摇床过夜(摇床慢摇)。用TBST洗脱后将二抗用TBST按照1:5 000的比例稀释,室温下于摇床上慢摇孵育30 min,再次用TBST洗脱。最后利用化学发光成像系统对ECL发光检测成像并拍照,使用AIWBwellTM软件分析结果。
1.3.5 统计学方法使用SPSS 27.0软件,将符合正态分布的计量资料以均数±标准差(x±s)表示,多组间采用单因素方差分析,采用LSD法进行事后两两比较;非正态分布计量资料用非参数秩和检验。以P < 0.05为差异有统计学意义。
2 结果 2.1 菖蒲参麦方活性成分获取及靶点筛选通过TCMSP数据库检索共获取人参、石菖蒲、巴戟天、鬼箭羽的活性成分及对应靶点分别为22、210、4、85、20、108、8、242个。通过BATMAN-TCM检索获取麦冬的活性成分18个、对应靶点305个。即菖蒲参麦方共有活性成分72个,活性成分对应靶点共有950个,并利用Unitprot数据库查询靶点蛋白的基因名称,经去重后共有414个。
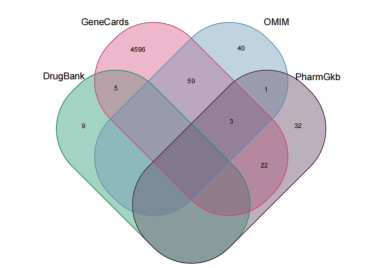
2.2 ACI靶点及筛选通过GeneCards、OMIM、PharmGkb、DrugBank数据库分别获4 685、103、58、14个靶点,去重后共4 767个靶点,绘制韦恩图,见图 1。
|
| 图 1 ACI靶点韦恩图 |
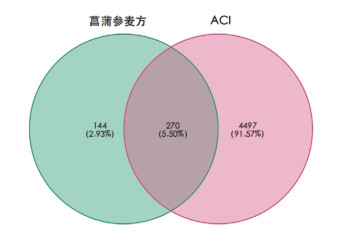
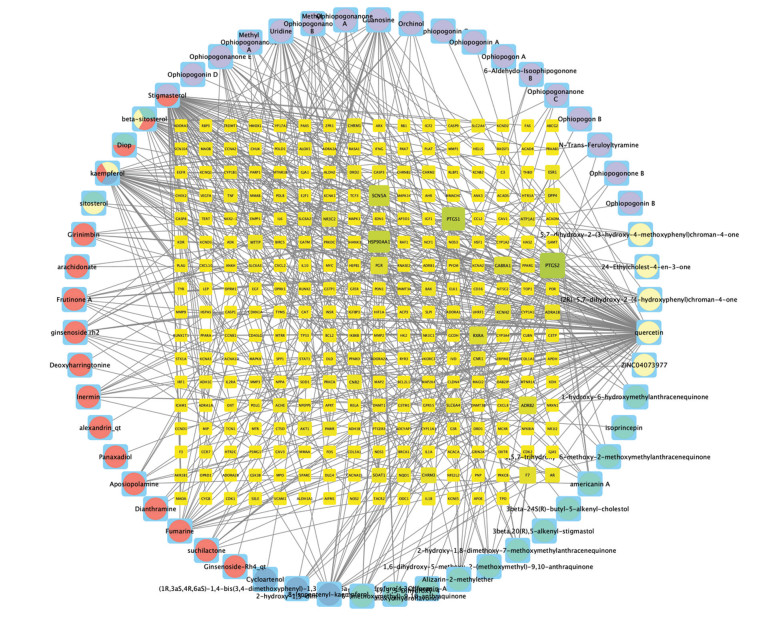
运用R语言软件将菖蒲参麦方活性成分靶点与ACI靶点相映射,得到270个菖蒲参麦方治疗ACI潜在靶点,绘制韦恩图,见图 2。运用R语言将得到270个潜在作用靶点对应55个活性成分,通过Cytoscape 3.9.1软件构建菖蒲参麦方治疗ACI的“活性成分-潜在作用靶点”网络,结果如图 3。该网络共包含325个节点和559边,325个节点中包括55个活性成分、270个潜在作用靶点,其中来源于人参的活性成分有13个,用红色表示;来源于石菖蒲的活性成分有3个,用蓝色表示;来源于巴戟天的活性成分有12个,用绿色表示;来源于鬼箭羽的活性成分有5个,用黄色表示;来源于麦冬的活血成分有17个,用紫色表示;来源于多种药物的活性成分有5个。靶点节点面积越大、颜色越深表明该节点越重要。其中对应靶点数目前五位的活性成分及其对应靶点数目见下表,提示可能是菖蒲参麦方治疗ACI的核心活性成分见表 1。
|
| 图 2 菖蒲参麦方治疗ACI潜在靶点韦恩图 |
|
| 图 3 菖蒲参麦方治疗ACI的“活性成分-潜在作用靶点”网络图 |
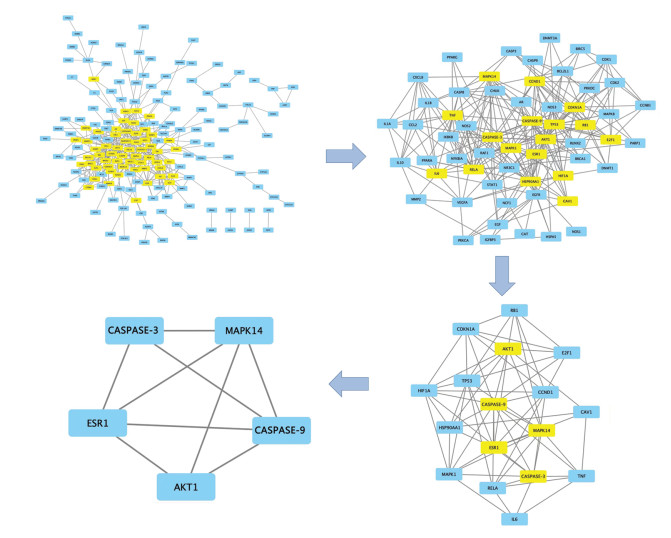
运用STRING数据库,对交集靶点进行蛋白间相互作用分析,构建PPI网络图,共筛选出节点176个,边数454条,见图 4。将结果导入Cytoscape3.9.1软件构建PPI网络后分析计算,得到BC、CC、DC、EC、LAC和NC值,每次筛选保留6个数值均大于中位数的靶点。经过3次筛选,最后得到ESR1、MAPK14、AKT1、Caspase-3、Caspase-9共5个靶点,提示上述靶点可能是菖蒲参麦方治疗ACI的潜在核心靶点,结果见图 5。

|
| 图 4 菖蒲参麦方与ACI交集靶点的PPI网络图 |
|
| 图 5 菖蒲参麦方治疗ACI的潜在核心靶点 |
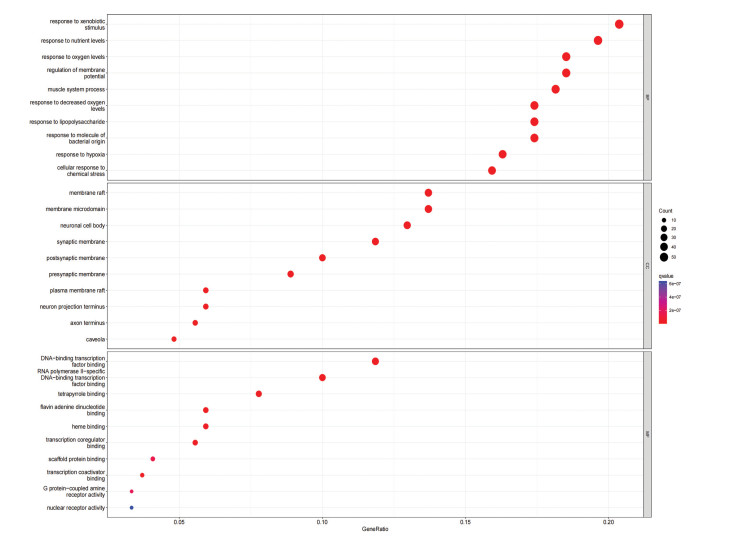
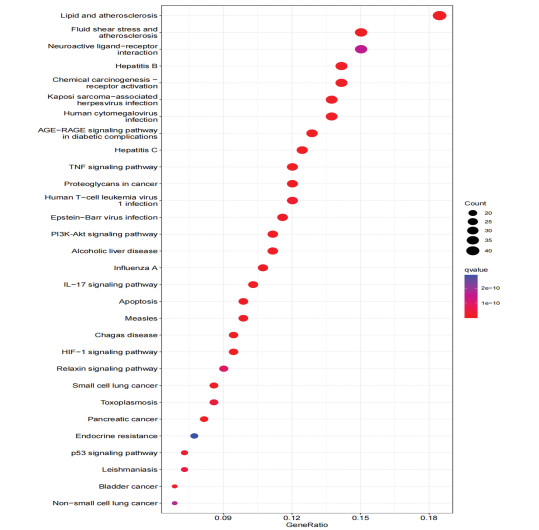
运用R语言软件对菖蒲参麦方治疗ACI的潜在靶点进行GO基因功能富集分析。GO功能富集分析得到3 129个条目,包括2 710个生物过程(BP)、259个分子功能(MF)和587个细胞组分(CC)。每类前10个条目的气泡图结果见图 6。选择与ACI密切相关的生物过程进一步富集分析发现,菖蒲参麦方治疗ACI的潜在核心靶点主要参与对氧气的反应、对营养的反应等生物过程。圆点越大则基因数量越多,颜色越红则富集性越高。运用R语言对潜在核心靶点进行KEGG通路富集分析,共筛选得到188条信号通路。依据P值从小到大筛选前30条信号通路进行可视化处理,见图 7,提示菖蒲参麦方作用于ACI的作用机制可能与脂质和动脉粥样硬化、AGE-RAGE信号通路、PI3K-AKT信号通路、HlF-1信号通路等相关。
|
| 图 6 菖蒲参麦方与ACI的交集靶点GO富集分析气泡图 |
|
| 图 7 菖蒲参麦方与ACI的交集靶点KEGG通路富集分析柱状图 |
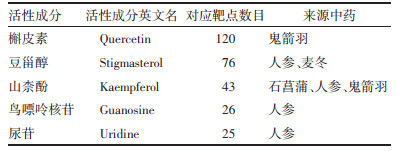
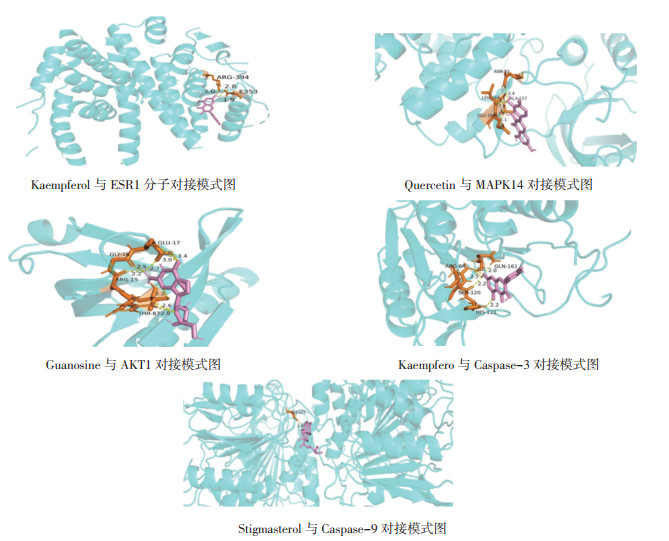
将上述核心活性成分与靶点进行分子对接验证,结果显示其对接结合能均<-5 kcal/mol,见表 2,表明核心靶点和核心活性成分对接良好,也再次验证了网络药理学的准确性。其中Kaempferol与ESR1、Quercetin与MAPK14、Guanosine与AKT1、Kaempfero与Caspase-3、Stigmasterol与Caspase-9的结合能较低,分别为-8.3、-8.2、-6.9、-8.1、-9.5 kcal/mol,用Pymol软件对其绘图,见图 8,图中蓝色为核心靶点结构、粉色为核心活性成分结构、橘色为核心靶点与活性成分的对接部分、黄色为对接形成的氢键,由图可见其在不同位点均形成氢键,因此具有较强的结合力。
|
| 图 8 分子对接模式图 |
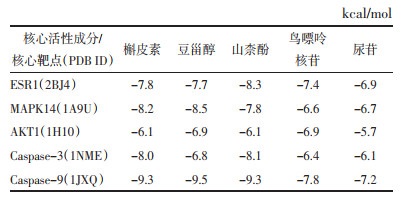
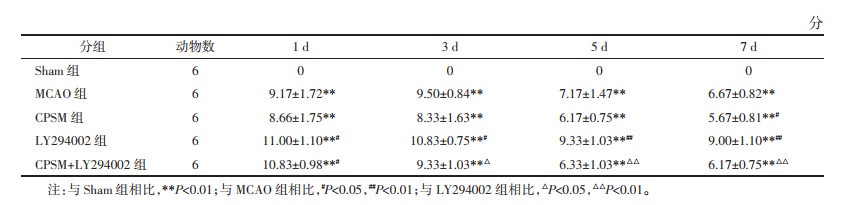
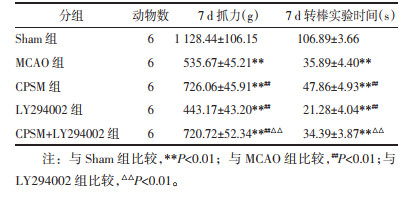
Sham组大鼠神经功能正常,MCAO组大鼠造模后出现明显的神经功能缺损症状,造模后1周一定程度恢复,但仍未恢复正常。与MCAO组相比,CPSM组在术后7 d神经功能改善,差异具有统计学意义(P<0.05);单纯LY294002给药组大鼠较MCAO大鼠神经功能缺损症状进一步加重,差异具有统计学意义(P<0.01)。与LY294002组相比,CPSM+LY294002组在术后3 d即可改善大鼠的神经功能缺损症状,差异具有统计学意义(P<0.05),且恢复程度随治疗时间逐步增强,见表 3。
各造模组大鼠抓力均小于Sham组,差异具有统计学意义(P<0.01)。与MCAO组相比,CPSM组在造模后用药干预7 d后肢体力量增强,差异具有统计学意义(P<0.01),LY294002组肢体力量下降,差异具有统计学意义(P<0.01)。CPSM+LY294002组肢体力量恢复显著。与LY294002组相比,CPSM+LY294002组抓力增强,差异具有统计学意义(P<0.01)。见表 4。
各造模组大鼠在转棒上的停留时间均小于Sham组,差异具有统计学意义(P<0.01)。与MCAO组相比,CPSM组在术后7 d后在转棒上停留时间延长,差异具有统计学意义(P<0.01);LY294002组在转棒上停留时间缩短,差异具有统计学意义(P<0.01)。与LY294002组相比,CPSM+LY294002组在转棒上停留时间延长,差异具有统计学意义(P<0.01),见表 4。
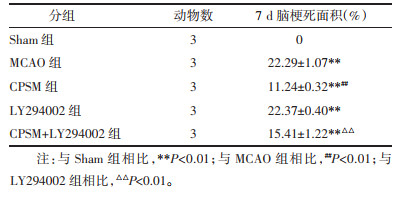
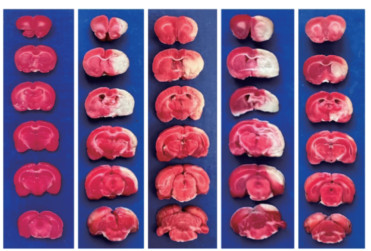
2.7.4 TTC染色结果比较Sham组大鼠未发现梗死灶,其余各组大鼠脑梗死面积均明显可见,差异具有统计学意义(P<0.01),见图 9。与MCAO组相比,CPSM组梗死面积减小,差异具有统计学意义(P<0.01);LY294002组脑梗面积稍增加,但差异无统计学意义。与LY294002组相比,LY294002+CPSM组脑梗死面积减小,差异具有统计学意义(P<0.01),见表 5。
|
| 注:从左至右依此为:Sham组、MCAO组、CPSM组、LY294002组、CPSM+LY294002组。 图 9 各组大鼠脑组织TTC染色图片 |
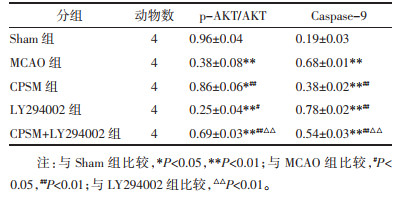
与Sham组相比,造模7 d后各组Caspase-9的表达量均升高,差异具有统计学意义(P<0.01)。与MCAO组相比,CPSM组此蛋白表达量降低(P<0.01),LY294002组表达量升高(P<0.01),差异均具有统计学意义。与LY294002组相比,CPSM+LY294002组Caspase-9的表达量降低,差异具有统计学意义(P<0.01)。与Sham组相比,造模7 d后各组p-AKT/AKT比值均降低,差异具有统计学意义(P<0.01或P<0.05)。与MCAO组相比CPSM组比值升高(P<0.01),LY294002组比值降低(P<0.05),差异均具有统计学意义。与LY294002组相比,CPSM+LY294002组组比值升高,差异具有统计学意义(P<0.01),见表 6。
卒中为中国首要的过早死亡原因[1],ACI是最常见的卒中类型,占中国新发卒中的69.6%~72.8%[12],2019年全球疾病负担研究数据显示,卒中是中国伤残调整生命年的第一大病因[13]。ACI约占全部卒中的80%[1],其高发病率、高致残率、高病死率、高复发率且并发症多的特点[14]给患者、家庭及社会造成巨大负担。
中医药在脑梗死中临床应用广泛,取得疗效的关键在于谨守病机、把握证候[15]。团队通过多年临床研究,发现气虚证患者神经功能缺损程度较非气虚患者更重、急性期气虚证与发病第90天预后不良有密切关系等,得出“气虚”是ACI病机的始动及关键因素[5, 16]。由此所建立补气扶正治法,被纳入2021年中国中西医结合学会颁布的《脑梗死中西医结合诊疗专家共识》(T/CAIM 022-2021)、2023年中国中西医结合学会联合中华中医药学会、中华医学会颁布的《脑梗死中西医结合诊疗指南》团体标准。本研究团队在补气扶正法指导下,结合多年临床经验创制了菖蒲参麦方,并在临床中取得确切疗效,但其药理作用机制尚不明确。中药多成分、多靶点的特点与网络药理系统性、整体性的特点一致,因此可使用网络药理学方法探讨菖蒲参麦方治疗ACI的分子机制,并通过分子对接技术验证其合理性,通过动物实验初步阐明作用机制,对寻找针对ACI的有效治疗方法具有重要意义。
菖蒲参麦方主要由人参,麦冬,石菖蒲,巴戟天,鬼箭羽组成,人参、麦冬、巴戟天,益气养阴,补气扶正,鬼箭羽活血通络,加入石菖蒲意在畅通气机,化痰开窍,开通玄府。石菖蒲针对急性期病理产物之“痰浊”及脑之“玄府开合不利”,起到化痰开窍、开通玄府之效[11];全方共奏益气活血、化痰通络、开通玄府之功,以达扶正祛邪护脑之效。
研究通过构建菖蒲参麦方治疗ACI的“活性成分-潜在作用靶点”网络图发现,其核心成分活性包括槲皮素、豆甾醇、山柰酚、鸟嘌呤核苷、尿苷等。槲皮素具有缓解炎症反应和氧化应激反应、减轻组织水肿,缓解脏器损伤的作用[17],如杨青丽等[18]发现槲皮素可保护缺氧缺血性脑损伤神经元细胞。β-谷甾醇具有较强的抗炎作用,Choi等[19]的研究结果显示β-谷甾醇可提高抗炎因子白细胞介素(IL)-10的活性,减少肿瘤坏死因子-α及IL-1等炎症因子的分泌。山柰酚在抗炎、抗凋亡等方面的作显著,如其能够通过介导NF-κB途径改善脑缺血再灌注大鼠的神经功能缺损,减轻神经炎症,提高疗效[20]。鸟嘌呤核苷在多种离体和在体的神经系统疾病模型中的保护作用已被证实,ACI腹腔注射鸟苷具有神经保护作用,延长动物生存期,改善神经功能结局,降低脑组织损伤,减小梗死体积,减轻氧化应激损[21-23]。Liu等[24]研究发现尿苷可以在组织损伤模型中助力损伤或病变组织的再生修复,如在心肌梗死模型中,尿苷能有效缓解急性炎症、提升损伤心脏的收缩能力。
PPI网络及富集分析结果表明,菖蒲参麦方治疗ACI的潜在核心靶点可能为ESR1、MAPK14、AKT1、Caspase-3、Caspase-9。GO富集分析与KEGG通路富集结果表明,菖蒲参麦方治疗ACI的潜在靶点可富集到GO条目3 129个,影响炎性反应、细胞代谢、凋亡过程等生物过程,所联络的通路包括HIF-1、PI3K-Akt等188条。PI3K-Akt信号通路在脑组织中广泛存在,其中Akt控制机体蛋白质合成、细胞周期及血管新生的进展[25],在缺血性脑组织中具有神经保护和抗氧化作用[26]。HIF-1信号通路对维持体内氧的稳态具有重要意义,同时参与血管生成和炎症的调节。在脑缺血过程中,PI3K-AKT通路可激活HIF-1α,从而上调VEGF等血管生成相关蛋白的表达,促进血管生成[27]。HIF-1α的激活同时可促进参与细胞存活的靶基因转录及翻译[28],对缺血性损伤产生神经元保护及诱导受损神经元凋亡的双重作用[29]。分子对接结果显示核心靶点和核心活性成分对接良好,对接结合能均<-5 kcal/mol,验证了网络药理学的准确性。其中结合能较低的基因与活性成分可以运用Pymol软件寻找到结合的氢键,再次证明其结合力较强。
综合分析PPI富集、GO富集与KEGG通路富集结果,菖蒲参麦方可能通过调控PI3K/AKT信号通路抑制细胞凋亡。PI3K/AKT信号通路为KEGG通路富集得到的前30条信号通路之一,它的激活与免疫反应、炎性反应、抗凋亡等多种病理过程相关[30],其参与介导抗细胞凋亡与脑梗死密切相关[31]。PI3K为磷酸肌醇3-激酶,AKT为一种丝氨酸/苏氨酸蛋白激酶;AKT1、Caspase-3、Caspase-9为菖蒲参麦方治疗ACI的潜在核心靶点。当脑缺血缺氧发生后,机体释放出如神经细胞生长因子等物质,可激活PI3K[32]。PI3K激活后可磷酸化细胞膜上的肌醇,产生第二信使PIP3,PIP3通过与Akt的PH结构域结合,促使Akt从细胞质转移至细胞膜的同时改变AKT构象,通过磷酸化Ser473和Thr308位点激活Akt,成为p-AKT[33]。p-AKT可促进凋亡相关因子半胱氨酸天门冬酶前体-9(Caspase-9)的Ser196位点磷酸化而使其失去活性,抑制细胞凋亡执行者Caspase-3的活性,达到抑制细胞凋亡的效果[34]。
进一步通过动物实验对上述研究结果初步检验。通过线栓法建立大鼠脑缺血模型,通过神经功能评分、抓力实验、转棒实验从行为学角度检验菖蒲参麦方药疗,通过TTC染色检测脑梗死面积,通过Western Blot法检测Caspase-9和p-AKT/AKT蛋白的表达。结果显示,菖蒲参麦方可明显改善脑缺血大鼠神经功能,显著减小脑梗死面积,并可作用于Caspase-9、p-AKT、AKT等靶点上。LY294002是一种经典的PI3K抑制剂[35],已应用于多种疾病的研究,可通过抑制PI3K达到抑制其下游信号分子AKT表达的效果[36]。较单独使用LY294002,联合使用LY294002和菖蒲参麦方可降低mNSS评分、提高肢体力量、延长在转棒上的运动时间、减小脑梗死面积、降低Caspase-9蛋白表达、提高p-AKT/AKT比值,提示菖蒲参麦方也许可通过介导PI3K/AKT信号通路抑制细胞凋亡从而干预ACI。
综上所述,相关研究结果将为菖蒲参麦方治疗ACI提供参考,为发挥中医扶正护脑优势,寻找针对ACI的有效药物,提高临床疗效,减轻病残程度提供理论及实验依据。
| [1] |
霍晓川, 高峰. 急性缺血性卒中血管内治疗中国指南2023[J]. 中国卒中杂志, 2023, 18(6): 684-711. |
| [2] |
YE Q, ZHAI F F, CHAO B H, et al. Rates of intravenous thrombolysis and endovascular therapy for acute ischaemic stroke in China between 2019 and 2020[J]. The Lancet Regional Health Western Pacific, 2022, 21: 100406. DOI:10.1016/j.lanwpc.2022.100406 |
| [3] |
杨程, 张婕, 李花, 等. 中医药治疗脑梗死的临床研究进展[J]. 时珍国医国药, 2018, 29(8): 1963-1965. |
| [4] |
高颖, 黄粤, 张华, 等. 应用时序序列探讨缺血性中风急性期证候与OCSP分型的相关性[J]. 北京中医药大学学报, 2010, 33(10): 685-689, 694. |
| [5] |
马苏苏. 中风发生前关键环节病情变化对始发态病情及预后影响的研究[D]. 北京: 北京中医药大学, 2022.
|
| [6] |
刘深, 张兆旭, 孔令博, 等. 从脉络学说构建脑梗死血管再通后无复流的理法方药体系[J]. 世界中医药, 2023, 18(13): 1834-1838. |
| [7] |
HSIN K Y, GHOSH S, KITANO H. Combining machine learning systems and multiple docking simulation packages to improve docking prediction reliability for network pharmacology[J]. PLoS One, 2013, 8(12): e83922. DOI:10.1371/journal.pone.0083922 |
| [8] |
LONGA E Z, WEINSTEIN P R, CARLSON S, et al. Reversible middle cerebral artery occlusion without craniectomy in rats[J]. Stroke, 1989, 20(1): 84-91. DOI:10.1161/01.STR.20.1.84 |
| [9] |
魏伟, 吴希美, 李元建. 药理实验方法学[M]. 4版. 北京: 人民卫生出版社, 2010.
|
| [10] |
何俊芳, 刘新平, 吕学海, 等. PI3K/AKT信号通路介导脂联素对脑缺血再灌注大鼠的保护作用[J]. 中国卒中杂志, 2022, 17(8): 857-862. |
| [11] |
杨田田. 三七总皂苷对MCAO大鼠和SH-SY5Y细胞缺氧缺糖损伤后Lingo-1及EGFR/PI3K/AKT通路的调节作用[D]. 北京: 北京中医药大学, 2018.
|
| [12] |
中华医学会神经病学分会, 中华医学会神经病学分会脑血管病学组. 中国急性缺血性卒中诊治指南2023[J]. 中华神经科杂志, 2024, 57(6): 523-559. |
| [13] |
KISA A, KISA S, COLLABORATORS G S. Global, regional, and national burden of stroke and its risk factors, 1990-2019:a systematic analysis for the Global Burden of Disease Study 2019[J]. The Lancet Neurology, 2021, 26. |
| [14] |
徐永明, 李建国, 徐玢. 优化急诊绿色通道在急性脑梗死再灌注治疗中的应用[J]. 中国临床医生杂志, 2022, 50(11): 1268-1271. |
| [15] |
王永炎. 再度思考提高治疗脑血管病疗效的难点[J]. 中国中西医结合杂志, 2017, 37(10): 1164-1166. |
| [16] |
辛喜艳, 高颖, 马斌, 等. 中风病气虚证与神经功能缺损程度及远期预后的关系研究[J]. 中国中西医结合杂志, 2011, 31(12): 1627-1631. |
| [17] |
范崇桂, 张燕平, 付国惠, 等. 槲皮素对急性脑梗死大鼠模型神经功能和氧化应激的影响[J]. 中华实验外科杂志, 2020, 37(4): 685-688. |
| [18] |
杨青丽, 陈彦锋. 槲皮素对缺氧缺血性脑损伤新生大鼠远期学习记忆及PARP-1/AIF信号通路的影响[J]. 临床儿科杂志, 2016, 34(12): 936-941. |
| [19] |
CHOI J N, CHOI Y H, LEE J M, et al. Anti-inflammatory effects of β-sitosterol-β-D-glucoside from Trachelospermum jasminoides(Apocynaceae) in lipopolysaccharide-stimulated RAW 264.7 murine macrophages[J]. Natural Product Research, 2012, 26(24): 2340-2343. DOI:10.1080/14786419.2012.654608 |
| [20] |
LI W H, CHENG X, YANG Y L, et al. Kaempferol attenuates neuroinflammation and blood brain barrier dysfunction to improve neurological deficits in cerebral ischemia/reperfusion rats[J]. Brain Research, 2019, 1722: 146361. DOI:10.1016/j.brainres.2019.146361 |
| [21] |
CHANG R, ALGIRD A, BAU C, et al. Neuroprotective effects of guanosine on stroke models in vitro and in vivo[J]. Neuroscience Letters, 2008, 431(2): 101-105. DOI:10.1016/j.neulet.2007.11.072 |
| [22] |
RATHBONE M P, SALEH T M, CONNELL B J, et al. Systemic administration of guanosine promotes functional and histological improvement following an ischemic stroke in rats[J]. Brain Research, 2011, 1407: 79-89. DOI:10.1016/j.brainres.2011.06.027 |
| [23] |
CONNELL B J, DI IORIO P, SAYEED I, et al. Guanosine protects against reperfusion injury in rat brains after ischemic stroke[J]. Journal of Neuroscience Research, 2013, 91(2): 262-272. DOI:10.1002/jnr.23156 |
| [24] |
LIU Z P, LI W, GENG L L, et al. Cross-species metabolomic analysis identifies uridine as a potent regeneration promoting factor[J]. Cell Discovery, 2022, 8(1): 6. DOI:10.1038/s41421-021-00361-3 |
| [25] |
吴登艳, 邓娅, 郝进, 等. PI3K/AKT/mTOR信号通路介导黄芩苷抑制增生性瘢痕组织成纤维细胞的增殖[J]. 中国生物化学与分子生物学报, 2014, 30(1): 60-67. |
| [26] |
张科儒, 李花, 陶黎, 等. MiR-24通过PI3K/AKT抑制脑梗死大鼠脑损伤的机制研究[J]. 中风与神经疾病杂志, 2023, 40(2): 109-112. |
| [27] |
胡小伟, 李琳, 龚荧荧, 等. 补阳还五汤激活PI3K-AKT通路促进氧糖剥夺再灌注损伤的脑微血管内皮细胞血管生成[J]. 浙江大学学报(医学版), 2022, 51(5): 544-551. |
| [28] |
SHELDON R A, LEE C L, JIANG X N, et al. Hypoxic preconditioning protection is eliminated in HIF-1α knockout mice subjected to neonatal hypoxia-ischemia[J]. Pediatric Research, 2014, 76(1): 46-53. DOI:10.1038/pr.2014.53 |
| [29] |
高椿, 罗永杰. 缺氧诱导因子-1α及相关靶基因在缺血性脑卒中的作用研究进展[J]. 实用医院临床杂志, 2015, 12(2): 145-148. |
| [30] |
周彬彬, 郑雪蕊, 谢志扬, 等. 红景天苷对LPS诱导的脑内炎症反应的抑制作用机制研究[J]. 中国药理学通报, 2023, 39(11): 2096-2101. |
| [31] |
陈慧, 郑晓梅, 夏晓, 等. PI3K/Akt信号通路对脐血间充质干细胞减轻缺血性脑损伤和炎症反应的调节作用[J]. 中国免疫学杂志, 2021, 37(2): 155-160. |
| [32] |
仇志富, 颜勇, 吴晓光. PI3K/Akt信号转导通路与神经细胞凋亡研究进展[J]. 中风与神经疾病杂志, 2015, 32(10): 952-953. |
| [33] |
李秀坤, 黄英华. 基于PI3K/Akt信号转导通路探讨电针足三里、曲池对脑缺血再灌注大鼠神经细胞凋亡的影响[J]. 重庆医学, 2016, 45(3): 303-306. |
| [34] |
LI D, NI S, MIAO K S, et al. PI3K/Akt and caspase pathways mediate oxidative stress-induced chondrocyte apoptosis[J]. Cell Stress & Chaperones, 2019, 24(1): 195-202. |
| [35] |
LONG H Y, WANG C Y, YANG Y E. LY294002, a PI3K inhibitor, attenuates Tourette syndrome in rats[J]. Metabolic Brain Disease, 2017, 32(5): 1619-1625. DOI:10.1007/s11011-017-0051-z |
| [36] |
单玉栋, 赵艳萌, 靳晓飞, 等. 补阳还五汤通过PI3K/AKT通路调控自噬抗大鼠脑缺血/再灌注损伤的作用[J]. 中国药理学通报, 2023, 39(2): 386-391. DOI:10.12360/CPB202110046 |
 2024, Vol. 43
2024, Vol. 43