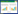文章信息
- 曹萌, 张波, 杨清, 刘钰, 曹世杰, 康宁
- CAO Meng, ZHANG Bo, YANG Qing, LIU Yu, CAO Shijie, KANG Ning
- 黄连水提物对脾胃湿热型胃溃疡大鼠的治疗作用机制
- Mechanism of Rhizoma coptidis water extract in the treatment of the rats of gastric ulcer of spleen-stomach damp-heat type
- 天津中医药大学学报, 2025, 44(1): 21-30
- Journal of Tianjin University of Traditional Chinese Medicine, 2025, 44(1): 21-30
- http://dx.doi.org/10.11656/j.issn.1673-9043.2025.01.05
-
文章历史
收稿日期: 2024-09-15
2. 天津中医药大学组分中药国家重点实验室, 天津 301617;
3. 天津中医药大学医学技术学院, 天津 301617
2. State Key Laboratory of Component-Based Chinese Medicine, Tianjin University of Traditional Chinese Medicine, Tianjin 301617, China;
3. School of Medical Technology, Tianjin University of Traditional Chinese Medicine, Tianjin 301617, China
胃溃疡是指胃局部黏膜甚至肌层发生的溃疡性病变。胃溃疡的起病具有隐匿性,有患者以大出血、急性穿孔为首发症状,严重损害患者的生活质量[1]。胃溃疡在中医被称为“胃脘痛”,最早见于《黄帝内经》。胃溃疡存在多种临床证候[2],其中脾胃湿热型胃溃疡是临床常见证型,其发病机制常与外邪侵袭、饮食不节、脾胃虚弱等因素相关[3]。尽管随着西药的开发与应用,胃溃疡的治愈率不断上升,但是数据表明胃溃疡仍然存在较高的复发率与不良反应[4]。
黄连属于清热燥湿类中药。研究发现黄连具有广泛的药理活性,如降血糖[5]、调节免疫[6]、抗炎[7]、抗氧化[8]及调节肠道菌群[9]等。黄连及其复方是临床治疗胃溃疡的常用药物[10-11]。然而,黄连对脾胃湿热型胃溃疡的疗效及其作用机制仍不明确。本研究使用传统中药提取方法——水提法对黄连进行提取,该方法能够有效提取药效成分,且具有高效、经济等优点[12]。另外,本研究使用的动物模型在既往研究基础上进行了改进,使用高温高湿环境、高脂饮食及56%乙醇共同构建脾胃湿热型胃溃疡模型[13],并且通过检测大鼠多种生化指标及肠道微生物群的组成与结构,研究黄连水提物改善脾胃湿热型胃溃疡的药效及其相关机制。
1 实验材料 1.1 实验动物SPF级Wistar大鼠28只,雄性,(200±20)g,购于北京维通利华实验动物技术有限公司。动物饲养于天津中医药大学动物实验中心SPF级动物房,使用许可证号:SCXY(京)2021-0006,饲养温度(23±2)℃,湿度(55±10)%,昼12 h/夜12 h,规律喂养。动物的使用已经获得天津中医药大学实验动物伦理委员会批准,动物实验伦理审查编号:TCM-LAEC2023162。
1.2 主要药品及试剂黄连购于北京同仁堂(天津)连锁店,盐酸雷尼替丁胶囊(批号:306220118)购自苏州弘森药业股份有限公司,高脂饲料购自小鼠有泰(北京)生物科技有限公司(D12451-白色),胃蛋白酶试剂盒(A080-1-1)购自南京建成生物工程研究所,别藻蓝蛋白(APC)标记CD3抗体(201414)、异硫氰酸荧光素(FITC)标记CD4抗体(201505)、藻红蛋白(PE)标记CD8抗体(200607)购自Biolegend(北京)生物科技有限公司,超氧化物岐化酶(SOD)试剂盒(S0101M)、丙二醛(MDA)试剂盒(S0131M)购自上海碧云天生物技术股份有限公司,二喹啉甲酸(BCA)定量试剂盒(PC0020-50T)购自北京索莱宝科技有限公司,PrimeScriptTM RT试剂盒(RR037A)购自Takara生物技术有限公司,荧光定量聚合酶链式反应(PCR)核酸染料(118679)购自MCE公司。
1.3 主要仪器小动物培养箱(北京陆希科技有限公司,型号:DWX-300FPY)、大小鼠抓力测定仪(北京智鼠多宝生物科技有限责任公司,型号:YLS-13A)、冷冻离心机(Heal Force,型号:Neofuge 13R)、PCR仪器(Thermo Fisher,型号:A28132)、酶标仪(TECAN,型号:Spark 20M)、流式细胞仪器(Becton Dickinson Bioscience,型号:A00-1-1102)、石蜡包埋机(Leica,型号:HistoCore Arcadia H)、石蜡切片机(Leica,型号:RM2235)、显微镜(Leica,型号:DM750)、血糖仪(罗氏卓越金彩,型号:NC)。
2 实验方法 2.1 脾胃湿热型胃溃疡大鼠模型制备适应性喂养1周后,将大鼠按照体质量随机分为对照组、模型组、黄连水提物组、盐酸雷尼替丁组,每组7只(灌胃过程中,模型组和盐酸雷尼替丁组各死亡1只,最终动物数为6只)。具体模型制备步骤如下:对照组采用正常环境、普通饲料喂养。除对照组外,其他各组大鼠第0~63天,每日自由摄入高脂饲料并置于小动物培养箱(温度35 ℃,相对湿度90%,1级光照)满8 h,自由饮水。第56~63天,再以1 mL/100 g的56%乙醇灌胃制备模型(对照组灌胃等量水)。造模后以其外在表现、胃组织病理学特征和胃组织特征性指标结果作为模型构建成功的评价标准。
2.2 给药方法 2.2.1 黄连水提物配制方法称取黄连100 g,加入蒸馏水1 L,煎煮1.5 h,共煎煮3次,合并煎煮液,冷冻干燥。使用高效液相色谱仪检测黄连水提物中的小檗碱含量为35.5%。准确称取黄连水提物,以0.5%羧甲基纤维素钠(CMC-Na)溶液为溶剂,配制成8.5 mg/mL的黄连水提物。各给药组在第49~63天以1 mL/100 g标准,每日灌服相应药物1次(对照组、模型组灌胃等量溶剂)。
2.2.2 给药剂量对照组、模型组给予等量5%的CMC-Na溶液,黄连水提物组给予85 mg/kg的黄连水提物溶液,盐酸雷尼替丁组给予30 mg/kg的盐酸雷尼替丁混悬液。
2.3 体质量、摄食量、抓力和行为学变化实验过程中,间隔时间对大鼠体质量与摄食量等情况进行记录。将大鼠平行置于大小鼠抓力测定仪进行抓力检测,具体操作为抓取大鼠尾部,用力均匀拉开大鼠,重复测定3次取平均值。旷场实验采用规格为100 cm×100 cm×40 cm的正方形黑箱作为旷场,将大鼠置于旷场实验箱正中央,记录大鼠5 min内在旷场自由活动的总路程。
2.4 血糖和血脂相关指标检测最后1次灌胃结束后,禁食12 h,使用毛细管从大鼠眼内眦部,与面部呈45 °夹角旋转刺入取血,弃掉第1滴血,使用第2滴血进行大鼠血糖检测;腹腔注射戊巴比妥钠麻醉后,腹主动脉取得大鼠血液,置于采血管内室温放置2 h,后以4 000 r/min、4 ℃离心10 min(离心半径18 cm),取上清。使用生化仪检测总胆固醇(TC)、三酰甘油(TG)及低密度脂蛋白胆固醇(LDL-C)水平。
2.5 胃溃疡相关指标检测 2.5.1 胃酸检测将大鼠胃部沿胃大弯剪开,收集其中内容物,3 000 r/min、室温离心10 min(离心半径18 cm)取胃液上清液0.2 mL,加入等量的蒸馏水稀释后,加入50 μL酚红溶液至稀释液中,以0.01 mol/L氢氧化钠(NaOH)滴定至终点(待测稀释溶液呈现橙色,且30 s内粉红色不褪去),记录0.01 mol/L的NaOH消耗体积,计算大鼠胃液总酸度。
2.5.2 胃蛋白酶活力测定利用胃蛋白酶试剂盒,取各组大鼠胃黏膜组织匀浆上清液样本,检测大鼠胃黏膜胃蛋白酶的活性,并用BCA试剂盒测定其蛋白含量,按照试剂盒说明书进行操作。
2.5.3 胃溃疡宏观状况胃组织剖开后,使用冰生理盐水冲洗胃内容物,平放于观察板上,观察胃组织损伤情况并进行拍照。
2.5.4 胃溃疡指数(UI)测定胃溃疡形态呈点状或线状出血,使用游标卡尺计量每1个黏膜损伤的长度(mm)和宽度(mm)。溃疡指数(GU index)按照如下方法进行评分:无溃疡(0 mm),1~5个瘀点(< 1 mm)计1分,6~10个瘀点(< 1 mm)计2分,> 10个瘀点(< 1 mm)计3分,小线状溃疡(< 2 mm)计2分,中等线性溃疡(2~4 mm)计3分,较大线性溃疡(> 4 mm)计4分。若宽度 > 1 mm,则评分增加1倍。
2.5.5 胃组织苏木精-伊红(HE)染色统一将左下部胃置于4%多聚甲醛中用于HE染色。将固定好的组织样本制成厚度为5 μm的石蜡切片,脱蜡后,苏木素染色5 min,盐酸分化液3 s,流动水冲洗,伊红1 min,流动水冲洗30 s,脱水,透明,用中性树胶封片,待片干置于显微镜下观察。
2.6 免疫指标检测收集脾脏,置于滤网研磨,制成单细胞悬液。向样本中加入CD3、CD4、CD8流式抗体,同时做好单染管、双染管及三染管。应用流式细胞仪对脾脏组织中的CD3+、CD4+、CD8+细胞表达情况进行检测。
2.7 炎症指标检测称取大鼠胃组织并进行匀浆,使用TRIZOL法提取核糖核酸(RNA),用Nanodrop检测RNA纯度及含量,应用PrimeScriptTM RT试剂盒合成cDNA,使用SYBR Green qPCR Mix进行实时荧光定量PCR检测,以GAPDH为参考基因,采用2-ΔΔCt法进行分析,引物序列见表 1。
根据试剂盒说明书,选取离心好的血浆用于SOD检测。采用胃组织匀浆后的上清液检测MDA含量。
2.9 肠道菌群测序及分析收集大鼠盲肠内容物,置于灭菌的冻存管中,先放入液氮,后在-80 ℃条件下保存。所有样本均运送至广东美格基因科技有限公司进行16S rRNA测序。先进行脱氧核糖核酸(DNA)提取,再通过PCR扩增16S rRNA基因的V3~V4区域。采用Illumina公司的NEBNext UltraTM II DNA Library Prep Kit制备测序文库。采用机器进行高通量测序,结束后进行筛查分析。
2.10 统计学分析采用SPSS 23.0统计软件进行数据分析。计量资料采用均数±标准差(x±s)表示,数据满足正态分布与方差齐时,组间比较采用单因素方差分析,两两比较采用LSD法。P<0.05为差异有统计学意义。
3 实验结果 3.1 各组大鼠体质量、摄食量、抓力及行为学比较与对照组比较,模型组大鼠体质量、摄食量及抓力均降低,旷场运动总距离明显缩短(P < 0.01);与模型组比较,各给药组大鼠体质量、摄食量、抓力均增加,旷场运动总距离增多,其中黄连水提物组运动总距离显著增多(P < 0.05)。见图 1及表 2。

|
| 图 1 各组大鼠体质量、摄食量变化情况(x±s,n=6) |
与对照组比较,模型组大鼠血糖浓度升高(P < 0.05);与模型组比较,各给药组大鼠血糖水平下降(P < 0.05)。与对照组比较,模型组大鼠TC、TG、LDL-C水平升高(P < 0.001或P<0.05);与模型组比较,黄连水提物组大鼠TC、LDL-C水平降低(P < 0.01或P<0.05),盐酸雷尼替丁组大鼠LDL-C水平降低(P < 0.05)。见表 3。
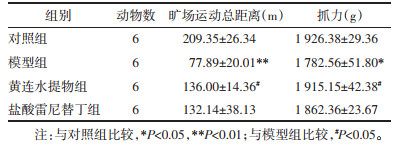
与对照组比较,模型组大鼠胃液中H+浓度升高(P < 0.05);与模型组比较,黄连水提物组大鼠胃液中H+浓度显著下降(P < 0.05),盐酸雷尼替丁组也有下降趋势。与对照组比较,模型组大鼠胃蛋白酶含量显著升高(P < 0.01);与模型组比较,各给药组大鼠胃蛋白酶含量显著下降(P < 0.05)。与对照组比较,模型组大鼠胃溃疡指数显著升高(P < 0.01);与模型组比较,黄连水提物组和盐酸雷尼替丁组大鼠胃溃疡指数显著下降(P < 0.01或P<0.05)。见表 4。
对照组大鼠胃黏膜表面光滑,无充血、出血现象。模型组大鼠胃黏膜可见广泛分布的出血点及条索状、点状溃疡。黄连水提物组和盐酸雷尼替丁组大鼠胃黏膜组织出血点、溃疡明显减少,充血情况好转。见图 2。

|
| 注:箭头指示为出血点及溃疡处。 图 2 各组大鼠胃溃疡宏观表现 |
对照组大鼠胃黏膜结构完整,腺体排列均匀整齐。模型组大鼠胃黏膜缺损,充血水肿,局部腺体破坏,胃黏膜出现溃疡面,并伴有炎性细胞浸润。各给药组大鼠胃黏膜病理改善明显,大鼠胃黏膜炎性细胞浸润及腺体破坏程度均见减轻。见图 3。

|
| 注:箭头指示为黏膜缺损、充血及炎性细胞浸润处。 图 3 各组大鼠胃组织病理变化情况 |
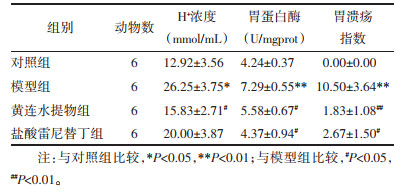
与对照组比较,模型组大鼠CD4+T含量和CD4+/CD8+显著降低(P < 0.01或P<0.05),CD8+T含量显著升高(P < 0.05);与模型组比较,黄连水提物组大鼠CD8+T含量显著降低(P < 0.05),盐酸雷尼替丁组大鼠CD4+T含量、CD4+/CD8+显著上升(P < 0.001),CD8+T含量显著降低(P < 0.001)。见表 5。
与对照组比较,模型组大鼠IL-4 mRNA水平显著降低(P < 0.05),IL-6 mRNA、TNF-α mRNA水平显著升高(P < 0.05);与模型组比较,黄连水提物组大鼠IL-4 mRNA水平显著上升(P < 0.05),IL-6 mRNA、TNF-α mRNA水平显著下降(P < 0.01或P<0.05),盐酸雷尼替丁组大鼠TNF-α mRNA水平显著降低(P < 0.001)。见表 6。
与对照组比较,模型组大鼠SOD水平显著降低(P < 0.05),MDA水平显著升高(P < 0.05);与模型组比较,各给药组大鼠SOD水平上升,MDA水平下降(P < 0.001或P<0.01或P<0.05)。见表 7。
韦恩图结果见图 4A,表明3组间共同的操作分类单位(OTU)数目有711个,对照组、模型组、黄连水提物组分别有544、161、116个独有OTU。Alpha多样性指数比较见图 4B及图 4C,基于OTU水平,与对照组比较,模型组Chao1指数和Shannon指数显著降低(P < 0.001),黄连水提物组Chao1指数和Shannon指数低于模型组(P < 0.01),表明黄连水提物改变了肠道菌群群落的丰富性和多样性。Beta多样性分析见图 4D,主坐标分析(PcoA)结果显示3组间分隔较远,表明3组在肠道微生物组成方面存在显著差异。

|
| 注:A,韦恩图;B,Chao1指数;C,Shannon指数;D,PcoA结果。 图 4 黄连水提物对脾胃湿热型胃溃疡大鼠肠道微生物物种群落的影响(x±s,n=5) |
在门水平上,结果表明厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)、疣微菌门(Verrucomicrobia)、拟杆菌门(Bacteroidota)为优势菌群。与对照组比较,模型组拟杆菌门丰度降低,放线菌门丰度升高。与模型组比较,黄连水提物组厚壁菌门丰度降低,变形菌门、疣微菌门丰度增高。与先前报道一致[13]。
在属水平上,对照组排名前4位的优势菌属分别为罗姆布茨菌属(Romboutsia)、瘤胃球菌科_ UGG_014(Ruminococcaceae_UCG-014)、毛螺菌科_ NK4A136_group(Lachnospiraceae_NK4A136_group)和瘤胃球菌科_NK4A214_group(Ruminococcaceae_ NK4A214_group);模型组排名前4位的优势菌属分别为Lachnoclostridium、罗姆布茨菌属(Romboutsia)、乳杆菌属(Lactobacillus)和布劳特氏菌属(Blautia);黄连水提物组排名前4位的优势菌属分别为阿克曼氏菌属(Akkermansia)、埃希氏-志贺氏菌属(Escherichia-Shigella)、罗姆布茨菌属(Romboutsia)和考拉杆菌属(Phascolarctobacterium)。与对照组比较,模型组瘤胃球菌科_UGG_014、毛螺菌科_ NK4A136_group、瘤胃球菌_NK4A214_group等相对丰度降低,Lachnoclostridium、乳杆菌属和布劳特氏菌属相对丰度升高。与模型组比较,黄连水提物组Lachnoclostridium、乳杆菌属相对丰度降低,但黄连水提物增加了肠球菌属(Enterococcus)、阿克曼氏菌属和考拉杆菌属的相对丰度。
在种水平上,对照组的优势菌群为解脲棒杆(Corynebacterium_urealyticum)、Allobaculum_ster-coricanis、Lactobacillus_intestinalis、Lactobacillus_sp._D2-2-1;模型组的优势菌群为嗜黏蛋白艾克曼菌(Akkermansia_muciniphila)、鼠乳杆菌(Lactobacillus_murinus)、Lactobacillus_sp._D2-2-1、bacterium_ NLAE-zl-H19;黄连水提物组的优势菌群为嗜黏蛋白艾克曼、Morganella_morganii_subsp._morganii、Lactobacillus_sp._D2-2-1、解脲棒杆菌,且嗜黏蛋白艾克曼菌含量较模型组显著增高。见图 5。
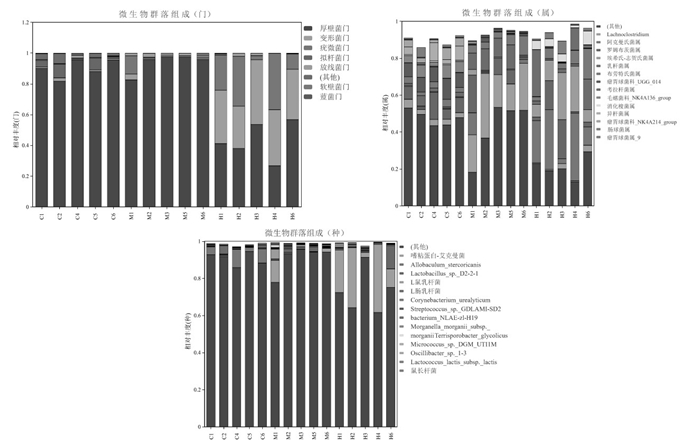
|
| 图 5 黄连水提物对脾胃湿热型胃溃疡大鼠肠道微生物群落组成的影响(n=5) |
通过Spearman相关性分析进一步分析肠道菌群变化与体质量、血糖、血脂、炎症、免疫、氧化应激相关生化指标变化的关系。结果表明,瘤胃球菌科_UGG_014与SOD、LDL-C、TC存在负相关关系,与体质量、CD4+存在正相关关系;毛螺菌科_ NK4A136_group与TC、LDL-C存在负相关关系,与体质量、CD4+存在正相关关系;Lachnoclostridium与SOD存在负相关关系,与IL-6、MDA、CD8+、TNF-α存在正相关关系;布劳特氏菌属与IL-6存在正相关关系,与体质量、CD4+存在负相关关系;考拉杆菌属与H+浓度、MDA、CD8+、TNF-α存在负相关关系,与SOD、IL-4存在正相关关系;阿克曼氏菌属与体质量、CD4+存在负相关关系,与LDL-C存在正相关关系;埃希氏-志贺氏菌属与CD4+存在负相关关系,与SOD存在正相关关系。见图 6。

|
| 注:BW为体质量。 图 6 肠道微生物种群变化与脾胃湿热型胃溃疡评价指标的相关性分析(n=5) |
脾胃湿热型胃溃疡是胃溃疡的一种常见临床分型。薛生白曰:“内外相引,故病湿热。”实验在中医药理论的指导下,运用高脂饮食与湿热环境共同诱导脾胃湿热型胃溃疡大鼠模型,以模拟临床上该类疾病的表现。实验结果表明,模型组大鼠体质量减轻,抓力减小,而且会出现倦怠、静卧少动的情况。这与之前构建脾胃湿热型胃溃疡模型的实验结果一致[14]。
当胃溃疡发生时,机体免疫平衡会被打破,导致CD4+下降、CD8+上升、CD4+/CD8+降低[15]。实验结果表明,给予黄连水提物的大鼠较模型组CD8+细胞数显著降低,CD4+/CD8+存在升高趋势,提示黄连水提物可能通过促进T淋巴细胞的成熟分化增殖,提高机体免疫功能,从而起到抗溃疡作用。
胃溃疡的发生、发展与炎症因子的表达和分泌密切相关[16]。具体来说,TNF-α是巨噬细胞分泌的主要促炎因子,可以激活多条炎症信号通路,强化炎症反应程度,促使溃疡创面的生成与发展[17]。不仅如此,高浓度的TNF-α也会促进细胞因子IL-6等的分泌[18]。IL-6可以激活并诱导细胞增殖分化,并释放多种炎症介质,引起消化系统损伤。IL-4等抗炎因子通过拮抗TNF-α、IL-6从而减轻炎症反应。本研究发现,黄连水提物可以上调IL-4 mRNA表达,降低IL-6 mRNA、TNF-α mRNA表达,提示黄连水提物可能通过调节炎症因子水平,从而发挥治疗脾胃湿热型胃溃疡大鼠的作用。
胃黏膜的氧化水平与抗氧化防御失衡是导致胃溃疡发生的主要机制[19]。SOD是体内最重要的抗氧化酶,能够维持氧化与抗氧化之间的平衡[20]。SOD活性下降后,抗氧化能力下降造成氧化应激反应发生,导致氧自由基受损,促进胃溃疡发生[21]。过氧化产物MDA会使细胞膜失去功能或凋亡,也会直接与蛋白质核酸产生作用,导致细胞甚至器官的病变或死亡[22]。课题组发现,相比于模型组,黄连水提物可以提高SOD水平,降低MDA水平,说明黄连水提物可以通过提高抗氧化应激能力来缓解胃溃疡情况。
肠道菌群在调节内皮屏障功能、促进胃黏膜愈合、炎症反应和免疫激活等方面发挥重要作用[23]。肠道菌群失调可以调节肠道代谢物,破坏肠道免疫,增加对胃溃疡的易感性。基于肠道菌群的靶向治疗,如通过饮食重塑肠道菌群已经被证明对缓解胃黏膜损伤具有较好的治疗效果[24]。已有研究表明,中药主要成分可以通过增加有益菌群丰度和降低有害菌群丰度来调节肠道菌群,进而治疗胃溃疡[25]。门水平上,厚壁菌门与拟杆菌门的比值(F/B)是反映肠道菌群紊乱的重要指标[26]。本实验研究发现,F/B在模型组中增高,经黄连水提物干预后回调。属水平上,黄连水提物组大鼠的肠道菌群中的肠球菌属、阿克曼氏菌属、考拉杆菌属相对丰度升高。其中肠球菌属一般被认为是有益菌,可以起到调理肠道菌群、维持肠道菌群平衡的效果[27]。其次,阿克曼氏菌属在保护肠壁屏障、减少炎症和免疫反应方面具有重要作用[28],被认为是最有希望的益生菌候选者[29]。另外,考拉杆菌属可以抑制肠道中艰难梭菌等有害菌的定植[30]。研究表明,考拉杆菌属相对丰度的增加对于多种疾病的治疗与改善具有重要意义[31-33]。考拉杆菌属可以产生短链脂肪酸,包括乙酸盐和丙酸盐[34],而短链脂肪酸中的乙酸被发现具有胃黏膜保护作用[35],丙酸则能够参与激活G蛋白偶联受体信号通路,抑制炎症发生[36]。本实验结果提示黄连水提物可以改善模型组大鼠肠道菌群的多样性和菌群紊乱,从而使脾胃湿热型胃溃疡大鼠症状明显好转。
大量报道证实肠道菌群变化参与调控机体糖脂代谢、氧化应激、炎症和免疫反应。其中,考拉杆菌属与炎症、氧化应激指标具有相关性[37]。本实验还发现,考拉杆菌属的变化与MDA、TNF-α存在负相关关系,与SOD、IL-4存在正相关关系,提示黄连水提物可能通过提高考拉杆菌属的相对丰度,抑制炎症并减少氧化应激发生,从而发挥治疗胃溃疡的作用。研究表明,瘤胃球菌科_UGG_014与TC、LDL-C呈负相关,可以改善肥胖病[38]。与此研究结果一致,本实验结果也发现瘤胃球菌科_UGG_014与TC、LDL-C具有负相关性,提示黄连水提物可能通过调节血脂相关指标缩短胃溃疡病程。既往研究表明,阿克曼氏菌可以缓解肥胖并能够参与系统免疫[39]。本实验同样证明阿克曼氏菌能够降低体质量,并与CD4+T细胞含量密切相关。另外,本研究结果显示黄连提取物可以明显增加布劳特氏菌属相对丰度,降低Lachnoclostridium的相对丰度。同时相关性分析结果显示,布劳特氏菌属与CD4+T细胞水平呈负相关,而Lachnoclostridium与CD8+T细胞含量存在正相关关系,提示黄连水提物可能通过影响这两种菌群调节免疫以发挥抗胃溃疡作用。在以往研究中,布劳特氏菌属与乙酸、丙酸、丁酸水平呈正相关,增加其含量可以减少炎症反应的发生[40]。但本研究发现布劳特氏菌属与IL-6呈正相关,这可能需要后续进一步研究布劳特氏菌属中的菌群组成来解释其原因。
综上所述,黄连水提物能够通过调节免疫、炎症、氧化应激及肠道菌群对脾胃湿热型胃溃疡发挥治疗作用。本研究为阐明黄连水提物治疗胃溃疡的作用机制提供了实验证据,也为指导临床用药提供了一定的科学依据。
| [1] |
何勇, 李自成, 罗中勇, 等. 厚朴温中汤加味辅治胃溃疡脾胃虚寒气滞型临床观察[J]. 实用中医药杂志, 2023, 39(11): 2145-2147. |
| [2] |
中华中医药学会脾胃病分会, 张声生, 王垂杰. 消化性溃疡中医诊疗专家共识意见(2017)[J]. 中华中医药杂志, 2017, 32(9): 4089-4093. |
| [3] |
傅斌, 陈建章, 范姝, 等. 清中愈疡汤对脾胃湿热型胃溃疡作用的实验研究[J]. 中国医学创新, 2022, 19(16): 28-34. |
| [4] |
龚伊凡. 清利护胃散联合泮托拉唑治疗脾胃湿热型胃溃疡患者的临床观察[D]. 福州: 福建中医药大学, 2020.
|
| [5] |
陈志雄, 王晨秀, 徐连强, 等. 黄连素对2型糖尿病早期患者胃肠道激素及糖脂代谢的影响[J]. 中国当代医药, 2021, 28(34): 120-122,126. |
| [6] |
夏烨, 俞嵩. 半夏泻心汤合黄连温胆汤联合针刺治疗脾胃湿热型浅表性胃炎临床研究[J]. 河南中医, 2023, 43(12): 1895-1899. |
| [7] |
XIE Q, LI H Y, MA R, et al. Effect of Coptis chinensis franch and Magnolia officinalis on intestinal flora and intestinal barrier in a TNBS-induced ulcerative colitis rats model[J]. Phytomedicine, 2022, 97(4): 153-169. |
| [8] |
李锐楷, 王鹏, 李毓琪, 等. 黄连素通过抑制氧化应激和内质网应激减轻非酒精性脂肪性肝炎小鼠肝脏炎症[J]. 新医学, 2024, 55(1): 40-47. |
| [9] |
WANG X M, LIANG F N, DAI Z Y, et al. Combination of Coptis chinensis polysaccharides and berberine ameliorates ulcerative colitis by regulating gut microbiota and activating AhR/IL-22 pathway[J]. Journal of Ethnopharmacology, 2024, 318(PtB): 1170-1185. |
| [10] |
王亚男, 麻春杰. 左金丸治疗胃溃疡研究进展[J]. 实用中医内科杂志, 2021, 35(5): 103-106. |
| [11] |
梁保坤. 黄连解毒汤联合隔姜灸治疗热毒蕴结证胃溃疡的效果[J]. 河南医学研究, 2021, 30(30): 5705-5708. |
| [12] |
王雯, 侯雨君, 王路, 等. 胃溃疡中医证候动物模型研究进展[J]. 中国实验动物学报, 2023, 31(10): 1351-1360. |
| [13] |
阎力君, 孙瑶, 苏适, 等. 芩莲正积方水提物中总黄酮提取工艺的优化[J]. 化学工程师, 2024, 38(2): 92-96. |
| [14] |
YANG Y N, CAO S J, XU W Y, et al. Dual modulation of gut bacteria and fungi manifests the gut-based anti-hyperlipidemic effect of Coptidis Rhizoma[J]. Biomedecine & Pharmacotherapie, 2022, 153(12): 1135-1142. |
| [15] |
张明丽, 吴雪飞, 赵志旭. 四联疗法治疗Hp相关性胃溃疡的效果观察[J]. 实用中西医结合临床, 2023, 23(21): 19-21,62. |
| [16] |
兰永利, 霍新慧, 李盼, 等. 基于NLRP3/Caspase-1/GSDMD信号通路探讨针灸预防应激性胃溃疡细胞焦亡的作用机制[J]. 江苏中医药, 2024, 56(1): 73-77. |
| [17] |
方镕泽, 曾奇, 吴红梅, 等. 基于网络药理学和分子对接结合体内实验探究黄花白及抗胃溃疡的作用机制[J]. 遵义医科大学学报, 2023, 46(11): 1067-1075. |
| [18] |
MANSOURI M T, HEMMATI A A, NAGHIZADEH B, et al. A study of the mechanisms underlying the anti-inflammatory effect of ellagic acid in carrageenan-induced paw edema in rats[J]. Indian Journal of Pharmacology, 2015, 47(3): 292-298. |
| [19] |
SAFARI S, BAHRAMIKIA S, DEZFOULIAN O. Silver nanoparticles synthesized from Quercus brantii ameliorated ethanol-induced gastric ulcers in rats by decreasing oxidative stress and improving antioxidant systems[J]. Inflam-mopharmacology, 2023, 31(5): 2615-2630. |
| [20] |
MOUSA A M, EL-SAMMAD N M, HASSAN S K, et al. Antiulcerogenic effect of Cuphea ignea extract against ethanol-induced gastric ulcer in rats[J]. BMC Complementary and Alternative Medicine, 2019, 19(1): 345-356. |
| [21] |
尤思路, 李娟, 晏陶, 等. 黄连-白术复方对小鼠胃溃疡模型的预防作用[J]. 中南大学学报(医学版), 2020, 45(1): 8-16. |
| [22] |
ZOU Y L, CUI X M, XIANG Q, et al. Protective effect of against ethanol-induced gastric ulcer and its mechanism[J]. Journal of Zhejiang University Medical Sciences, 2021, 50(5): 561-567. |
| [23] |
ZHANG D J, XIANG M, JIANG Y, et al. The protective effect of polysaccharide SAFP from Sarcodon aspratus on water immersion and restraint stress-induced gastric ulcer and modulatory effects on gut microbiota dysbiosis[J]. Foods, 2022, 11(11): 1567-1577. |
| [24] |
WU J Z, GAN Y X, LI M X, et al. Patchouli alcohol attenuates 5-fluorouracil-induced intestinal mucositis via TLR2/MyD88/NF-κB pathway and regulation of microbiota[J]. Biomedecine & Pharmacotherapie, 2020, 124(10): 1098-1108. |
| [25] |
LI L, DU Y Y, WANG Y, et al. Atractylone alleviates ethanol-induced gastric ulcer in rat with altered gut microbiota and metabolites[J]. Journal of Inflammation Research, 2022, 15(20): 4709-4723. |
| [26] |
黄焕迪, 何瑞坤, 戴庆玲, 等. 高通量测序研究3味山姜属中药黄酮类成分对胃溃疡寒证大鼠肠道菌群的影响[J]. 中华中医药学刊, 2022, 40(1): 103-10. |
| [27] |
ZHANG T, LI Q Q, CHENG L, et al. Akkermansia mucini- phila is a promising probiotic[J]. Microbial Biotechnology, 2019, 12(6): 1109-1125. |
| [28] |
OTTMAN N, REUNANEN J, MEIJERINK M, et al. Pili-like proteins of Akkermansia muciniphila modulate host immune responses and gut barrier function[J]. PLoS One, 2017, 12(3): e173-e184. |
| [29] |
ZHANG Q, GUO J J, YAU Y M, et al. Effect of Huanglian Decoction on the intestinal microbiome in stress ulcer(SU) mice[J]. Evidence-Based Complementary and Alternative Medicine, 2021, 21(19): 3087-3100. |
| [30] |
NAGAO-KITAMOTO H, LESLIE J L, KITAMOTO S, et al. Interleukin-22-mediated host glycosylation prevents Clostri- dioides difficile infection by modulating the metabolic activity of the gut microbiota[J]. Nature Medicine, 2020, 26(4): 608-617. |
| [31] |
SUN M, LI D, HUA M, et al. Analysis of the alleviating effect of black bean peel anthocyanins on type 2 diabetes based on gut microbiota and serum metabolome[J]. Journal of Functional Foods, 2023, 102(10): 1054-1065. |
| [32] |
HE X, LIANG J, LI X, et al. Dahuang zhechong pill ameliorates hepatic fibrosis by regulating gut microbiota and metabolites[J]. Journal of Ethnopharmacology, 2023, 63(7): 1174-1182. |
| [33] |
FENG J, LI Z, MA H, et al. Quercetin alleviates intestinal inflammation and improves intestinal functions via modulating gut microbiota composition in LPS-challenged laying hens[J]. Poultry Science, 2023, 102(3): 102433. |
| [34] |
WU F F, GUO X F, ZHANG J C, et al. Phascolarctobacterium faecium abundant colonization in human gastrointestinal tract[J]. Experimental and Therapeutic Medicine, 2017, 14(4): 3122-3126. |
| [35] |
LIU J M, WANG J D, SHI Y L, et al. Short chain fatty acid acetate protects against ethanol-induced acute gastric mucosal lesion in mice[J]. Biological & Pharmaceutical Bulletin, 2017, 40(9): 1439-1446. |
| [36] |
LIN Y, LV Y, Mao Z, et al. Polysaccharides from Tetrastigma Hemsleyanum Diels et Gilg ameliorated inflammatory bowel disease by rebuilding the intestinal mucosal barrier and inhibiting, inflammation through the SCFA-GPR41/43 signaling pathway[J]. International Journal of Biological Macromolecules, 2023, 250(6): 1261-1267. |
| [37] |
WEI Y Y, WANG H R, ZHANG Y N, et al. Comprehensive effect of carbon tetrachloride and reversal of Gandankang formula in mice liver: Involved in oxidative stress, excessive inflammation, and intestinal microflora[J]. Antioxidants, 2022, 11(11): 2234-2245. |
| [38] |
HU Q Y, NIU Y X, YANG Y X, et al. Polydextrose alleviates adipose tissue inflammation and modulates the gut microbiota in high-fat diet-fed mice[J]. Frontiers in Pharmacology, 2021, 12(15): 7954-7963. |
| [39] |
冯赛赛. 阿克曼氏菌基因组多样性和免疫刺激特性分析[D]. 无锡: 江南大学, 2022.
|
| [40] |
姜康佳. 刺槐豆胶寡糖和罗望子胶寡糖对溃疡性结肠炎的缓解作用及机制研究[D]. 济南: 齐鲁工业大学, 2023.
|
 2025, Vol. 44
2025, Vol. 44