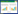文章信息
- 何媛媛, 绳菁煜, 刘雨桐, 李琳, 于春泉, 李珠, 高杉
- HE Yuanyuan, SHENG Jingyu, LIU Yutong, LI Lin, YU Chunquan, LI Zhu, GAO Shan
- 丹蒌方对冠心病痰瘀互结证大鼠早期“湿化”的影响
- Influence of Danlou Prescription on the "dampness" in the early stage of coronary heart disease with blending of phlegm and blood stasis syndrome
- 天津中医药大学学报, 2025, 44(1): 41-49
- Journal of Tianjin University of Traditional Chinese Medicine, 2025, 44(1): 41-49
- http://dx.doi.org/10.11656/j.issn.1673-9043.2025.01.07
-
文章历史
收稿日期: 2024-09-30
2. 浙江中医药大学基础医学院, 杭州 310053
2. School of Basic Medical Sciences, Zhejiang Chinese Medical University, Hangzhou 310053, China
2023年发布的美国心脏协会研究报告显示,心血管疾病的致死率占比最高[1],其中冠状动脉粥样硬化性心脏病(简称冠心病)对人类健康的威胁位居首位[2]。目前针对冠心病的西医治疗方式包括手术和药物治疗,手术治疗虽然能够极大程度地降低心血管疾病的发病率及致死率,但同时不可避免地会发生支架内再狭窄、复灌后无复流等现象[3-4]。西医治疗药物多以抗炎降脂为主,虽然在一定程度上减少了冠状动脉事件的发生,但是由于西药的作用靶点和调控路径相对单一,在面对病因多样、机制复杂的心血管疾病时,单一药物无法全面有效地控制心血管疾病的发生与发展[5]。基于辨证论治的中医药疗法在临床应用时卓见成效,中药复方是其主要形式。方剂中的药物协同配伍,组成多样,具有多途径、多靶点的独特优势,寻找有效方药防治冠心病,进而揭示其作用机制已经成为热点研究方向。
中医常将冠心病归属于“胸痹心痛”“真心痛”范畴,认为痰瘀互结是其主要病因病机,患者在素体本虚的基础上,积聚痰、瘀等病理产物,容易导致急性心肌梗死等恶性心血管事件[6]。研究显示,冠心病的证候类型以气虚血瘀、气虚痰瘀、气阴两虚兼血瘀、痰瘀互结最为多见[7]。“痰瘀兼化”是在刘完素“病邪兼化”理论基础上提出的冠心病重要病机,研究发现阳微阴弦为冠心病病理总括,早期“湿化”、中期(活动期)“热化”与后期“虚化”是冠心病发生、发展的变化分期,而痰瘀互结贯穿始终[8-9]。早期“湿化”包括各种病因化湿以及湿转化为痰、热(火)及其他病邪两种情况。在某种程度上,湿为痰之“液相”,痰为湿之“固相”[8]。湿在冠心病早期较为明显,在合并代谢综合征的冠心病患者中更为突出,湿是该类患者疾病发生、发展过程中的关键“枢机”[10]。
课题组前期开展丹蒌片干预冠心病痰瘀互结证中国多中心、精细化临床研究,发现其机制与调节内皮损伤、脂质代谢、炎症因子、凝血功能等相关指标密切相关[11-12]。此外,现代药理研究表明丹蒌方中多味中药具有降脂、抗炎、抗动脉粥样硬化作用[13-15]。因此,本研究选用治疗冠心病痰瘀互结证的经典方剂——丹蒌方,进一步研究其对冠心病痰瘀互结证大鼠早期“湿化”的影响。
该研究在课题组前期建立的冠心病痰瘀互结证大鼠模型基础上,通过模拟冠心病痰瘀互结状态,建立冠心病痰瘀互结证大鼠模型,阐释冠心病痰瘀互结证早期“湿化”形成的病理学机制,探讨丹蒌方缓解冠心病痰瘀互结证早期“湿化”状态、防止其病情转化加重的作用机制,为冠心病的早期防治提供理论依据。
1 实验材料 1.1 实验动物选择Wistar雄性大鼠260只,体质量(180±20)g/只,由北京斯贝福生物技术有限公司提供,许可证号为SCXK(京)2019-0010。饲养于天津中医药大学SPF级动物中心,饲养期间保持常规条件,自由饮水,温度24~26 ℃,相对湿度40%~60%,适应性饲养1周后开始实验。本研究符合天津中医药大学动物实验伦理审查,伦理审查编号为TCM-LAEC2021135。
1.2 实验药品丹蒌方(瓜蒌皮、薤白、葛根、川芎、丹参、赤芍、泽泻、黄芪、骨碎补、郁金)原粉(批号:20210604)由吉林康乃尔制药有限公司(中国吉林)提供,于室温避光干燥保存。课题组前期相关研究已经对丹蒌方的有效活性成分进行鉴定分析[13]。阳性对照药物阿托伐他汀由辉瑞制药有限公司提供,密封、25 ℃以下干燥保存。
1.3 实验饲料动脉粥样硬化模型饲料由20%可可脂、1.25%胆固醇、22.5%蛋白质、45%碳水化合物和0.5%胆酸钠构成,简称高脂饲料(4.5 kcal/mg),由江苏美迪森生物医药有限公司提供,产品编号:MD12017。置于4 ℃冰箱密封保存。
1.4 实验仪器低温离心机(美国Theomo Scientific公司);小型离心机(美国Theomo Scientific公司);电子天平(上海衡平科学仪器有限公司);荧光/光学显微镜(日本Olympus公司);Vevo®2100小动物超声仪(加拿大Visual Sonics公司);石蜡切片机(德国Leica有限公司);数码拍摄系统(日本Olympus公司);烤片机(德国Leica有限公司);包埋机(德国Leica有限公司);显影仪(美国GE公司);全自动生化分析仪(荷兰威图公司);转移脱色摇床(泰州诺米医疗科技有限公司);全自动血流变仪(北京赛科希德科技有限公司);涡旋振荡仪(其林贝尔仪器制造有限公司);恒温水浴锅(上海科恒实业发展有限公司)。
1.5 实验试剂异氟烷(美国Sigma公司,货号:N5751);4%组织细胞固定液(北京索莱宝科技有限公司,货号:P1110);0.9%生理盐水(山东齐都药业有限公司,货号:36373);超声耦合剂(天津市西苑寺制作所,货号:YY0299);胆固醇(TC)试剂盒(南京建成生物工程研究所,货号:F002-1-1);三酰甘油(TG)试剂盒(南京建成生物工程研究所,货号:F001-1-1);低密度脂蛋白胆固醇(LDL-C)试剂盒(南京建成生物工程研究所,货号:A113-2-1);高密度脂蛋白胆固醇(HDL-C)试剂盒(南京建成生物工程研究所,货号:F003-1-1);无水乙醇(天津市康科德科技有限公司,货号:8009GR0500);苏木精-伊红(HE)染色试剂盒(南京建成生物工程研究所,货号:D006-1-1);2,3,5-氯化三苯基四氮唑(TTC)染色溶剂(美国Sigma公司,货号:T8170)。
2 实验方法 2.1 造模、分组及给药空白组和假手术组大鼠普通饲料喂养5周,模型组、丹蒌方低剂量组(200 mg/kg)、丹蒌方中剂量组(400 mg/kg)、丹蒌方高剂量组(800 mg/kg)和阿托伐他汀组(10 mg/kg)大鼠高脂饲料喂养5周,5周末行冠状动脉左前降支结扎术。麻醉后固定大鼠,皮肤消毒后,于左侧第3~4肋间打开胸腔,轻压胸部挤出心脏,迅速找到左前降支并用5-0号线结扎,造成心肌缺血模型。结扎完成后,立即将心脏送回胸腔,挤出胸腔内气体后迅速关闭胸腔,用3-0号线缝合伤口后再用碘伏消毒。假手术组只穿线不结扎,其余步骤与模型组一致。空白组不进行任何处理,自由摄食及饮水。
使用Vevo®2100小动物超声成像系统检测各组大鼠心脏超声,剔除死亡及左心室射血分数(EF)>50%的大鼠,手术后24 h内根据EF对大鼠重新分组。适应性喂养1周后,分别按照丹蒌方200、400、800 mg/kg及阿托伐他汀10 mg/kg对大鼠进行灌胃给药4周,空白组、假手术组和模型组给予同等体积的蒸馏水灌胃,并根据体质量变化及时调整给药量。分别于5周末、给药4周(10周末)时检测各组部分大鼠相关指标。
2.2 实验取材及样品处理对大鼠进行麻醉处理,选用内径0.5~1.0 mm硬质毛细玻璃管,大鼠目内眦采血,取血约1 mL。于4 ℃、4 000 r/min离心15 min(离心半径17.5 cm),取上层血清备用检测。
第10周末,大鼠禁食12 h后行腹主动脉取血。采血后上下颠倒晃匀,静置2 h,4 ℃、4 000 r/min离心15 min(离心半径17.5 cm)取血清,分装后置于-80 ℃冰箱储存备用。
取大鼠心脏组织,用生理盐水冲洗,留取左心室,置于干燥微量离心管中,-80 ℃冰箱保存备用。
2.3 观察大鼠一般状态观察大鼠饮食(进食量)、毛发、行为和精神状态。
2.4 大鼠血流动力学及心脏形态学检测第5周末结扎后2 h,使用Vevo®2100小动物超声实时影像仪分别检测各组大鼠心功能情况。测量M-型超声图像,在长轴测量包(PLAX)界面下,每次超声测定值随机选取3个连续心动周期进行测量,取平均值。
2.5 大鼠血脂指标检测分别在第5、10周末,对大鼠进行目内眦取血,采用全自动生化仪测定TC、TG、LDL-C、HDL-C水平。具体操作参照TC、TG、LDL-C与HDL-C试剂盒说明书。
2.6 大鼠血液流变学检测肝素抗凝管取血5 mL,采用全自动血流变仪进行检测。
2.7 大鼠心肌组织TTC染色于第5周末取空白组、假手术组和模型组各3只大鼠的左心室样本进行TTC染色。心肌组织TTC染色可以观察到红色、灰白色,红色为心肌非梗死区,灰白色为心肌梗死区。
2.8 大鼠心肌组织HE染色第10周末取血结束后,剪取心脏,每组取3个心脏样本放置于4%组织细胞固定液中固定,用于HE染色。主要步骤包括心肌组织脱水、包埋、切片、染色、图像采集与分析。
2.9 统计学分析实验结果以均数±标准差(x±s)表示,实验数据采用SPSS 24.0软件进行统计分析。若实验数据呈正态性分布且满足方差齐性,采用单因素方差分析;若实验数据呈非正态分布,采用非参数检验。P < 0.05表示差异具有统计学意义。
3 实验结果 3.1 一般状态观察空白组和假手术组大鼠饮食规律,活动情况一般,精神较好。模型组大鼠结扎后活动度降低,出现厌食明显、精神状态萎靡、毛发油腻、发黄、活动度降低情况。丹蒌方各剂量组、阿托伐他汀组大鼠给药4周后精神状态和活动度出现不同程度恢复。
3.2 大鼠5周末心功能变化情况与空白组比较,假手术组大鼠EF和短轴缩短率(FS)水平差异无统计学意义(P > 0.05)。与空白组和假手术组比较,模型组、丹蒌方各剂量组、阿托伐他汀组大鼠EF和FS水平降低,差异有统计学意义(P < 0.01)。与模型组比较,丹蒌方各剂量组、阿托伐他汀组大鼠EF和FS水平无明显变化,差异无统计学意义(P > 0.05)。见图 1。
|
| 注:与空白组比较,**P<0.01;与假手术组比较,##P<0.01。 图 1 大鼠5周末心功能变化情况(x±s) |
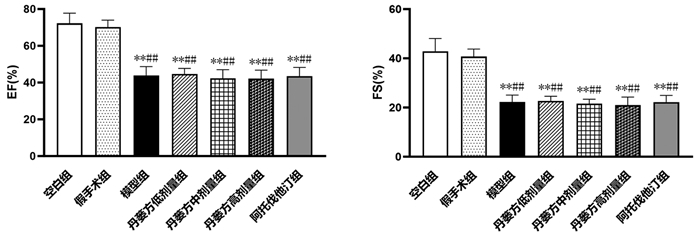
与空白组比较,假手术组大鼠TC、TG、LDL-C和HDL-C含量差异无统计学意义(P > 0.05)。与空白组和假手术组比较,模型组、丹蒌方各剂量组、阿托伐他汀组大鼠血清中TC和LDL-C含量升高(P < 0.05或P < 0.01)。见图 2。
|
| 注:与空白组比较,*P<0.05,**P<0.01;与假手术组比较,#P<0.05,##P<0.01。 图 2 大鼠5周末血脂水平(x±s,n=8) |
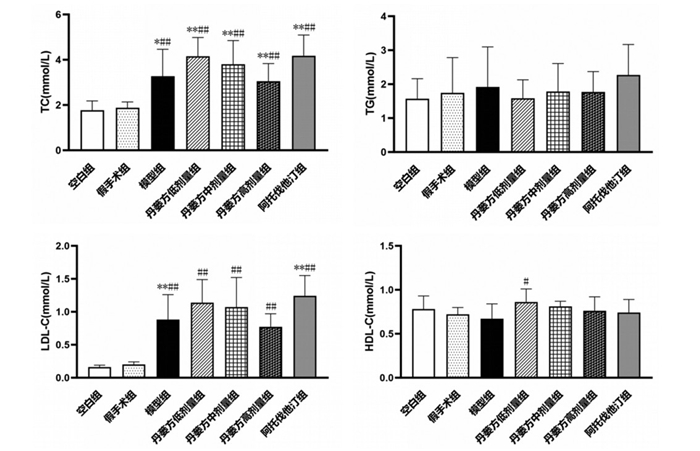
5周末进行血液流变学检测,结果显示,与空白组比较,假手术组大鼠全血黏度(BV)低切(3/S)、BV中切(30/S)、BV高切(200/S)和血浆黏度(PV)差异无统计学意义(P > 0.05)。与空白组比较,模型组大鼠的BV低切(3/S)、BV中切(30/S)、BV高切(200/S)和PV升高,差异有统计学意义(P < 0.05)。见图 3。
|
| 注:与空白组比较,*P<0.05。 图 3 大鼠5周末BV、PV水平(x±s,n=3) |
5周末在空白组、假手术组和模型组中各随机选取3只大鼠,采用TTC染色法检测大鼠心肌梗死区域。结果显示,空白组和假手术组大鼠心肌组织呈红色,颜色较深,未见梗死区域;模型组大鼠可见明显灰白色区域,为梗死区域。见图 4。
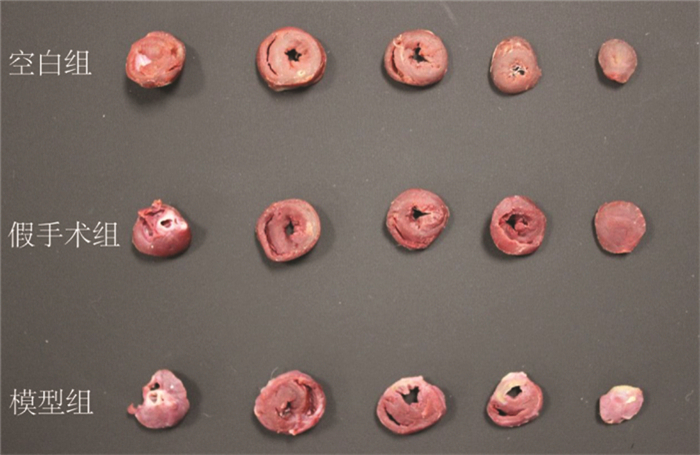
|
| 图 4 大鼠5周末心肌梗死面积变化情况 |
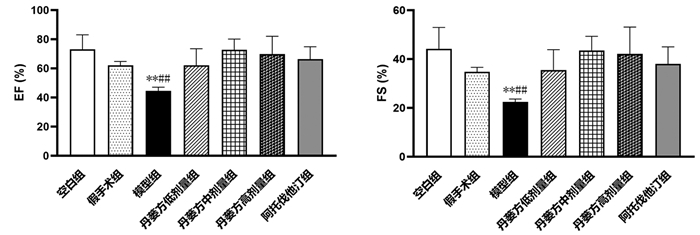
丹蒌方给药4周后,结果显示,与空白组比较,假手术组大鼠的EF和FS无统计学意义(P > 0.05)。与空白组和假手术组比较,模型组大鼠EF、FS降低(P < 0.01)。与模型组比较,丹蒌方各剂量组、阿托伐他汀组大鼠的EF和FS升高(P < 0.01)。见图 5。
|
| 注:与空白组比较,**P<0.01;与假手术组比较,##P<0.01;与模型组比较,△△P<0.01。空白组n=7,假手术组n=5,模型组n=6,丹蒌方低剂量组n=5,丹蒌方中剂量组n=6,丹蒌方高剂量组n=6,阿托伐他汀组n=6。 图 5 丹蒌方给药4周后大鼠心功能情况(x±s) |
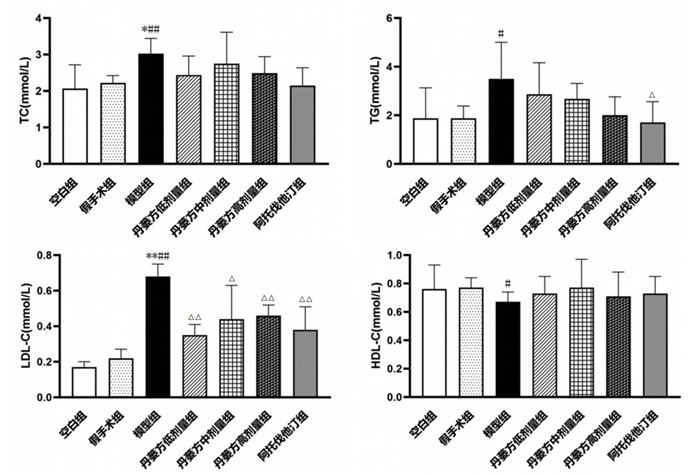
与空白组比较,假手术组大鼠TC、TG、LDL-C和HDL-C含量差异无统计学意义(P > 0.05)。与空白组和假手术组比较,模型组大鼠血清中TC、TG、LDL-C含量升高(P < 0.05或P < 0.01),HDL-C含量降低(P < 0.05)。与模型组比较,给药4周后丹蒌方各剂量组、阿托伐他汀组大鼠LDL-C含量降低(P < 0.05或P < 0.01),阿托伐他汀组大鼠TG含量降低(P < 0.05)。见图 6。
|
| 注:与空白组比较,*P<0.05,**P<0.01;与假手术组比较,#P<0.05,##P<0.01;与模型组比较,△P<0.05,△△P<0.01。 图 6 丹蒌方给药4周后血脂水平(x±s,n=6) |
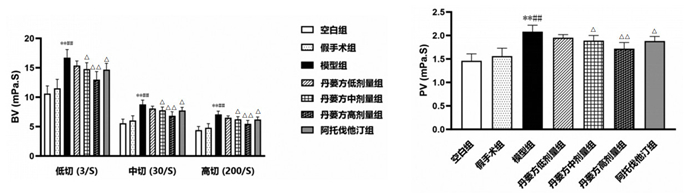
与空白组比较,假手术组大鼠的BV低切(3/S)、BV中切(30/S)、BV高切(200/S)和PV差异无统计学意义(P > 0.05)。与空白组和假手术组比较,模型组大鼠的BV低切(3/S)、BV中切(30/S)、BV高切(200/S)和PV升高(P < 0.01)。与模型组比较,丹蒌方中剂量组、丹蒌方高剂量组和阿托伐他汀组大鼠的BV低切(3/S)、BV中切(30/S)、BV高切(200/S)和PV降低(P < 0.01或P < 0.05)。见图 7。
|
| 注:与空白组比较,**P<0.01;与假手术组比较,##P<0.01;与模型组比较,△P<0.05,△△P<0.01。 图 7 丹蒌方给药4周后BV和PV水平(x±s,n=3) |
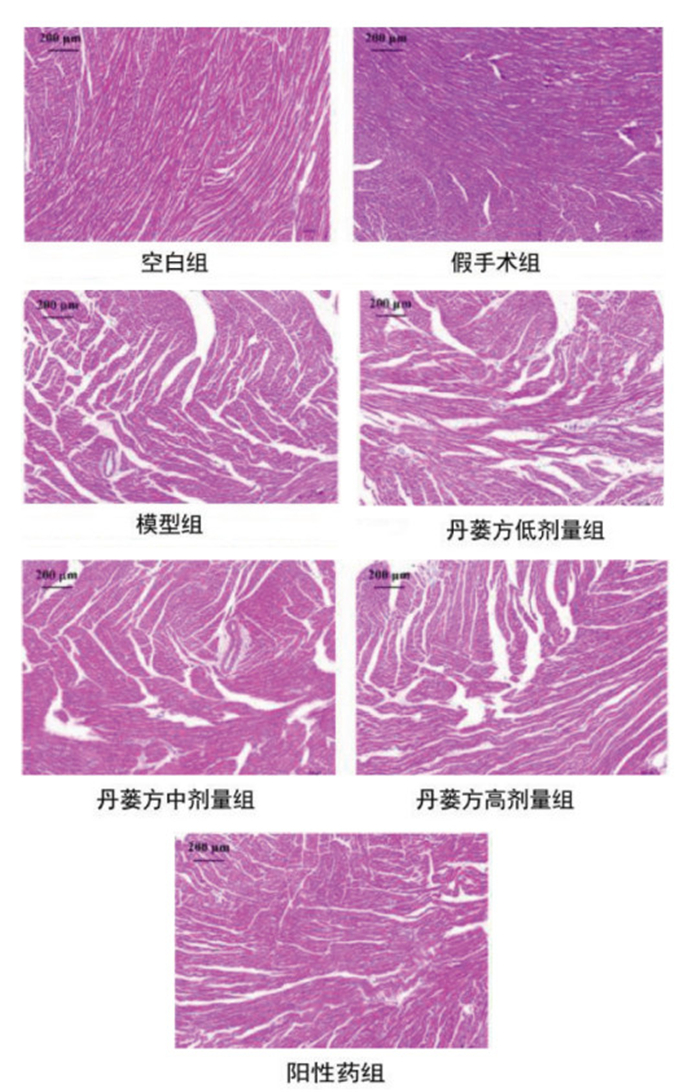
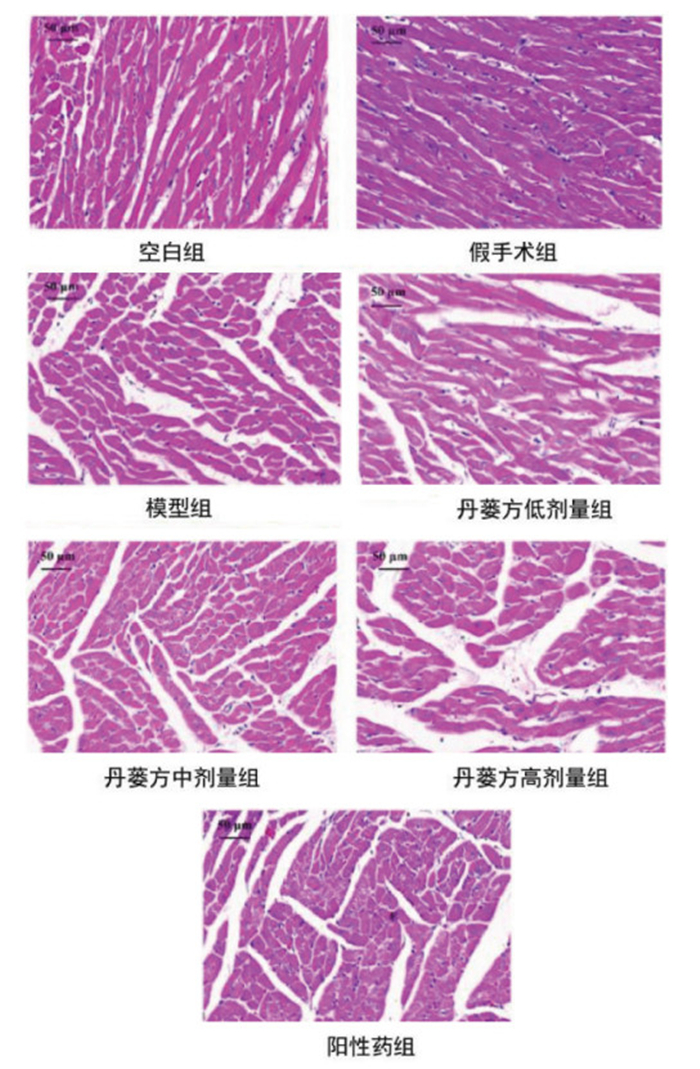
丹蒌方给药4周后,分别对各组大鼠的心肌组织进行HE染色,观察各组大鼠心肌组织横切面的病理变化。丹蒌方给药4周后,空白组及假手术组大鼠心肌细胞完整,心肌纤维排列整齐、紧密,结构清楚,横纹清晰,细胞核居中呈均匀分布,细胞间质形态结构正常,着色均匀,未见明显水肿、出血、坏死。模型组大鼠心肌广泛病变,局部心肌细胞灶性坏死,心肌组织呈片状坏死,心肌纤维断裂,部分横纹消失或边界不清,排列稀疏、紊乱,细胞核溶解碎裂,心肌间质水肿增宽,心肌毛细血管扩张,充血明显,伴有弥漫性炎性细胞浸润。丹蒌方各剂量组和阿托伐他汀组大鼠心肌损伤程度相较于模型组程度减轻,病变范围缩小,间质水肿及炎性细胞浸润减少。见图 8、图 9。
|
| 图 8 丹蒌方给药4周后HE染色结果(×10,n=3) |
|
| 图 9 丹蒌方给药4周后HE染色结果(×40,n=3) |
中医认为痰湿内停,阻滞气机,血行受阻,引起血瘀;而瘀血阻滞,气机不畅,会引起体内津液代谢障碍而形成痰湿,痰可致瘀,瘀亦可致痰,两者彼此影响同时存在。而正是由于痰湿与瘀血的存在,造成血流缓慢,堵塞血管,诱发冠心病[16]。
湿化是指由于水液代谢异常停聚,引起的一系列病理变化过程,具体可以概括为:饮食失节→脾胃虚弱→痰湿内生→痰湿生变(痰瘀互结或痰瘀气滞等),其中痰湿既是引起湿化的病理基础,也是参与湿化形成的关键环节[17]。冠心病痰瘀互结证早期“湿化”由脾胃虚弱而生,过食肥甘厚腻,运化失常,水湿停聚,郁久成痰、饮,致痰湿壅盛。因此,冠心病痰瘀互结证动物模型多从易患危险因素——高脂血症入手,进行药物或手术干预造成冠状动脉狭窄及梗死。
高脂、高糖等动脉粥样硬化致病因素皆可以称之为“血中之痰浊”。采用喂养高脂饲料的方法导致大鼠脾胃虚弱,运化失常,水液代谢障碍,进而呈现冠心病痰瘀互结证早期“湿化”的病理表现,郁久成痰、饮,形成动脉粥样硬化,模拟痰浊状态。血瘀指机体内有血液停滞,主要是离经之血蓄积体内,或血运不畅,阻滞于经脉及脏腑内的血液。因此,采用高脂饲料喂养造成脂代谢紊乱模拟“痰”的特征,冠状动脉左前降支结扎造成心肌缺血模拟“瘀”的特征,两者联合建立冠心病痰瘀互结证大鼠模型,使造模结果接近于临床冠心病痰瘀互结证的病机特点。研究显示,冠状动脉左前降支结扎术可以直接有效地阻断冠状动脉,常被用于冠心病模型的制备,模拟血瘀症状[18]。课题组前期在高脂饲料喂养基础上联合冠状动脉左前降支结扎的方法成功建立了大鼠冠心病痰瘀互结证模型,并通过一般状态、心脏超声情况、血脂、心肌酶、炎症因子和病理学改变,以及磷脂酰肌醇3激酶(PI3K)/蛋白激酶B(AKT)信号通路的调控作用等方面探讨了冠心病痰瘀互结证的发病机制[19-20],其中冠心病痰瘀互结证早期阶段出现脂代谢紊乱和炎症反应与早期“湿化”阶段相一致,但未对丹蒌方干预冠心病痰瘀互结证大鼠模型早期“湿化”阶段的治疗效果进行研究。因此,本研究在模拟冠心病痰瘀互结证早期“湿化”状态的同时给予丹蒌方干预,探讨丹蒌方缓解冠心病痰瘀互结证早期湿化状态、防止其病情转化加重的作用机制,符合中医“既病防变”理念,也可以为冠心病的早期防治提供理论基础。
4.2 丹蒌方组方分析在冠心病发生早期,湿邪为关键因素。湿浊内生易致痰瘀,痰瘀又可化湿,当痰浊、瘀血互相胶结、互为因果时,疾病较为稳定,处于“湿化”阶段。此阶段湿邪重浊、黏腻,易阻病邪,炎症反应发展缓慢。因此,“湿化”是冠心病的早期病理阶段,是发生“热化”与“虚化”的前期基础[21]。丹蒌方是临床治疗冠心病痰瘀互结证的常用方药,市售中成药为丹蒌片,已经获得国家药品监督管理局批准,其安全性和有效性已经被广泛报道。丹蒌方源于汉代张仲景治疗胸痹心痛的瓜蒌薤白白酒汤,由瓜蒌皮、薤白、葛根、川芎、丹参、赤芍、泽泻、黄芪、骨碎补、郁金10味中药组成。诸药合用,共奏清热祛湿、利水渗湿、益气通阳、化痰散结、活血化瘀之效。本研究发现丹蒌方对冠心病痰瘀互结证早期“湿化”阶段具有较好的治疗作用,特别是在抑制该阶段的脂代谢紊乱、炎症反应方面效果显著。因此,针对丹蒌方开展药理作用机制研究,对冠心病痰瘀互结证痰瘀早期“湿化”阶段的临床治疗具有重要意义。
4.3 丹蒌方对冠心病痰瘀互结证大鼠血流动力学的影响本研究采用小动物超声仪无创、动态地观察了冠心病痰瘀互结证大鼠模型建立后与丹蒌方给药4周后的心功能变化情况,实验结果与文献报道一致。结果显示,模型组大鼠心脏功能明显下降,丹蒌方给药4周后能够提高冠心病痰瘀互结证大鼠心脏功能,改善心脏形态变化。
4.4 丹蒌方对冠心病痰瘀互结证大鼠血脂水平的影响中医将脂代谢紊乱归属于“痰湿”范畴,认为冠心病痰瘀互结证早期痰浊内盛的过程即为“湿化”阶段。而血清TC、TG、LDL-C、HDL-C作为血脂检测的基本指标,其表达水平可以有效反映冠心病患者的血脂变化[22]。研究表明,TC、TG、LDL-C含量的变化能够作为冠心病痰瘀互结证辨证的客观指标[23]。血清中脂类含量增多可以视作痰浊内生的微观表现[24]。痰湿体质人群常出现脂代谢障碍,脂肪在体内堆积,进而引起动脉粥样硬化。与冠心病“非痰”“非瘀”证型患者相比,痰瘀证患者TC、TG、LDL-C含量明显升高,而HDL-C则相反[25],与本研究结果一致。丹蒌方抗高脂血症的药理作用已被明确[26]。在本研究中,丹蒌方给药后大鼠TC、LDL-C含量可见不同程度降低。以上结果充分证明了丹蒌方的早期干预具有较好的降低血脂作用,能够尽早改善痰浊状态。
4.5 丹蒌方对冠心病痰瘀互结证大鼠血液流变学的影响现代医家将中医和西医有机结合,认为冠心病痰浊的无形之痰可以表现为沉积在血管中的脂类,瘀血可以表现为血液黏稠度增加及血栓形成,因此高脂血症、微循环障碍为痰瘀互结表现,痰浊、瘀血与血黏度、血液流变学及微循环等改变密切相关。冠心病痰瘀互结证血液呈现明显的黏、凝、聚状态,主要反映在全血及血浆黏度增高。BV和PV是诊断冠心病血瘀证的重要理化指标[27]。丹蒌方给药4周后,发现各给药组大鼠BV和PV水平显著降低,说明丹蒌方干预能够降低血液黏度。
4.6 丹蒌方对冠心病痰瘀互结证大鼠病理学的影响心肌梗死面积通常被认为是衡量心肌损伤程度的“金标准”,多采用梗死区心肌面积占左心室面积的百分比来说明缺血再灌注(IR)的损伤程度[28]。TTC是脂溶性光敏感复合物,常用于检测种子的生存能力及哺乳动物组织的缺血梗死。正常组织在TTC染色后呈红色,梗死区呈白色,而正常组织和梗死区之间的风险区呈淡红色。本研究结果显示,模型组大鼠心肌组织出现白色梗死区,能够模拟冠心病痰瘀互结证大鼠“瘀”的状态。
心肌病理形态学观察是最能直观反映大鼠心肌损伤程度的方法[29]。HE染色结果显示,模型组大鼠心肌病变范围广泛,局部心肌细胞灶性坏死,心肌组织呈片状坏死,心肌纤维断裂,部分横纹消失或边界不清,排列稀疏、紊乱,细胞核溶解碎裂,心肌间质水肿增宽,心肌毛细血管扩张,充血明显,伴有弥漫性炎性细胞浸润。各给药组大鼠的心肌损伤程度相较于模型组减轻,病变范围缩小,间质水肿及炎性细胞浸润减少。
综上所述,冠心病的发生与发展是一个多因素、多途径相互作用的结果,其病因多样,病机错杂。“痰”“瘀”分别代表的脂代谢紊乱和血液流变学改变是冠心病发生、发展的重要物质基础,阐释了冠心病痰瘀互结证早期“湿化”形成的病理机制。丹蒌方给药后能够明显改善冠心病痰瘀互结证大鼠的心功能损伤状态,降低血脂水平,改善血液黏度,抑制炎性细胞浸润,从而改善冠心病痰瘀互结证大鼠心肌损伤。
5 结论丹蒌方能够有效改善冠心病痰瘀互结证大鼠早期“湿化”的心脏结构和功能,降低血脂水平,改善血液黏、浓、凝、聚状态,减轻心肌组织间质水肿,抑制炎性细胞浸润。
| [1] |
TSAO C W, ADAY A W, ALMARZOOQ Z I, et al. Heart disease and stroke statistics-2023 update: a report from the American heart association[J]. Circulation, 2023, 147(8): e593-e621. |
| [2] |
GBD RISK FACTOR COLLABORATORS. Global, regional, and national comparative risk assessment of 84 behavioural, environmental and occupational, and metabolic risks or clusters of risks for 195 countries and territories, 1990-2017:a systematic analysis for the global burden of disease study 2017[J]. Lancet, 2018, 392(59): 1923-1994. |
| [3] |
章娟, 肖刚. 直接PTCA加支架置入术对急性心肌梗死患者的近期疗效及对QTd的影响[J]. 心血管康复医学杂志, 2019, 28(2): 229-232. DOI:10.3969/j.issn.1008-0074.2019.02.25 |
| [4] |
陈绪军, 郑宝石, 张永, 等. 冠状动脉旁路移植术双桡动脉桥多中心应用的中期结果[J]. 中华医学杂志, 2019, 99(14): 1069-1074. |
| [5] |
谢柱, 闻永洋. 他汀类药物治疗冠心病的临床疗效及其安全性[J]. 临床合理用药杂志, 2021, 14(15): 118-120. |
| [6] |
徐闯, 袁鑫, 徐京育. 中医药治疗痰瘀互结型冠心病的应用及现代研究进展[J]. 吉林中医药, 2019, 39(4): 551-555. |
| [7] |
毕颖斐, 王贤良, 赵志强, 等. 冠心病现代中医证候特征的临床流行病学调查[J]. 中医杂志, 2017, 58(23): 2013-2019. |
| [8] |
胡镜清. 病机兼化理论框架下的冠心病病机解析[J]. 中国中医基础医学杂志, 2017, 23(1): 4-7,11. |
| [9] |
雒明池, 刘昳佳, 李琳, 等. 冠心病痰瘀互结证痰瘀兼化理论初探[J]. 中国中医基础医学杂志, 2018, 24(8): 1049-1051. |
| [10] |
金磊. 代谢综合征中医证候研究[D]. 北京: 中国中医科学院, 2013.
|
| [11] |
徐一兰, 高杉, 邓兵, 等. 丹蒌方干预冠心病稳定性心绞痛痰瘀互结证的临床生化基础研究[J]. 天津中医药, 2018, 35(11): 808-812. DOI:10.11656/j.issn.1672-1519.2018.11.03 |
| [12] |
许慧愚, 王朔, 邓兵, 等. 冠心病稳定型心绞痛痰瘀互结证中医证候量表与生化指标相关性[J]. 中华中医药杂志, 2019, 34(4): 1457-1461. |
| [13] |
HUANG M N, ZHAO H, GAO S, et al. Identification of coronary heart disease biomarkers with different severities of coronary stenosis in human urine using non-targeted metabolomics based on UPLC-Q-TOF/MS[J]. Clinica Chimica Acta: International Journal of Clinical Chemistry, 2019, 497(2): 95-103. |
| [14] |
LI Z, YANG L, LIU Y C, et al. Anti-inflammatory and antioxidative effects of Dan-Lou tablets in the treatment of coronary heart disease revealed by metabolomics integrated with molecular mechanism studies[J]. Journal of Ethnopharmacology, 2019, 240(3): 1119-1129. |
| [15] |
GAO L N, ZHOU X, LU Y R, et al. Dan-Lou prescription inhibits foam cell formation induced by ox-LDL via the TLR4/NF-κB and PPARγ signaling pathways[J]. Frontiers in Physiology, 2018, 9(10): 590-599. |
| [16] |
崔祺, 王春毅. 高黏滞血症病因病机之我见[J]. 世界中西医结合杂志, 2009, 4(10): 749-750. DOI:10.3969/j.issn.1673-6613.2009.10.025 |
| [17] |
喻松仁, 王萍, 舒晴, 等. 肥胖痰湿衍变规律探析[J]. 中华中医药杂志, 2018, 33(4): 1483-1485. |
| [18] |
蒋之林. 基于多组学整合探讨活血化痰中药治疗冠心病痰瘀互结证机制研究[D]. 北京: 中国中医科学院, 2024.
|
| [19] |
王朔, 梁如, 许慧愚, 等. 高脂饲料联合结扎冠状动脉左前降支探讨冠心病痰瘀互结证大鼠模型的建立与评价[J]. 天津中医药, 2018, 35(10): 727-731. DOI:10.11656/j.issn.1672-1519.2018.10.03 |
| [20] |
高杉, 王鹏伟, 冯曼, 等. 基于PI3K/Akt通路的冠心病痰瘀互结证大鼠发病机制研究[J]. 天津中医药, 2020, 37(2): 209-213. |
| [21] |
蔡嫣然, 江丽杰, 李子赟, 等. 痰瘀兼化: 冠心病病机新论及临床应用[J]. 中国中医基础医学杂志, 2019, 25(1): 100-102,126. |
| [22] |
温灵武, 杨世映, 陈逸敏, 等. 冠心病患者血脂指标水平变化及其临床意义[J]. 数理医药学杂志, 2021, 34(6): 817-820. DOI:10.3969/j.issn.1004-4337.2021.06.009 |
| [23] |
冯飞雪, 武曼, 王大望, 等. 冠心病中医证型与生化、凝血检验指标的相关性研究[J]. 临床医学研究与实践, 2021, 6(26): 25-27. |
| [24] |
王阶, 姚魁武, 李军, 等. 冠心病"痰瘀滞虚"病机及临床研究[J]. 中国中西医结合杂志, 2019, 39(8): 1015-1019. |
| [25] |
周韶爽. 血脂异常中医证型及血脂变化与四时变化的相关性研究[D]. 北京: 北京中医药大学, 2017: 1-6.
|
| [26] |
李琳, 王莹, 高杉, 等. 丹蒌片抗高脂血症的研究进展[J]. 天津中医药大学学报, 2014, 33(1): 61-64. DOI:10.11656/j.issn.1673-9043.2014.01.20 |
| [27] |
王阶, 熊兴江, 邢雁伟, 等. 冠心病血瘀证标准规范、生物学基础及循证评价: 基于病证结合的"证候"研究思路与方法[J]. 中国实验方剂学杂志, 2019, 25(8): 1-6. |
| [28] |
GERCZUK P Z, KLONER R A. An update on cardioprotection: a review of the latest adjunctive therapies to limit myocardial infarction size in clinical trials[J]. Journal of the American College of Cardiology, 2012, 59(11): 969-978. DOI:10.1016/j.jacc.2011.07.054 |
| [29] |
FELDMAN A T, WOLFE D. Tissue processing and hematoxylin and eosin staining[J]. Methods in Molecular Biology(Clifton, N J), 2014, 118(1): 31-43. |
 2025, Vol. 44
2025, Vol. 44