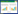文章信息
- 张常喜, 马琴, 张安妮, 陈立娟, 平昕翀
- ZHANG Changxi, MA Qin, ZHANG Anni, CHEN Lijuan, PING Xinchong
- 通心络含药血清对高葡萄糖环境下大鼠心肌成纤维细胞增殖的影响
- To study the effect of Tongxinluo drug-containing serum on the proliferation of rat cardiac fibroblasts under high glucose
- 天津中医药大学学报, 2025, 44(1): 50-58
- Journal of Tianjin University of Traditional Chinese Medicine, 2025, 44(1): 50-58
- http://dx.doi.org/10.11656/j.issn.1673-9043.2025.01.08
-
文章历史
收稿日期: 2024-08-31
2. 暨南大学, 广州 510632;
3. 宁夏医科大学, 银川 750004;
4. 甘肃中医药大学, 兰州 730000
2. Jinan University, Guangzhou 510632, China;
3. Ningxia Medical University, Yinchuan 750004, China;
4. Gansu University of Traditional Chinese Medicine, Lanzhou 730000, China
糖尿病心肌病(DCM)是一种心脏功能结构发生改变的疾病,主要由糖尿病引起,严重者最终可能导致心力衰竭[1]。现如今糖尿病的发病率和发病人群比例在全世界范围内广泛增长,DCM引起的病死率也在逐年上升[2]。研究认为,心肌成纤维细胞过度增殖是DCM患者发生心肌组织病理改变的主要原因[3]。在高葡萄糖环境下,心肌成纤维细胞能够激活心肌组织转化生长因子-β1(TGF-β1)的表达。另有研究表明,TGF-β1-p38丝裂原活化蛋白激酶(p38MAPK)-环磷腺苷效应元件结合蛋白(CREB)信号通路在糖尿病及其相关疾病中发挥重要作用,尤其在平滑肌细胞增殖过程中发挥重要作用[4]。
通心络胶囊是一种中药复方制剂,主要功效为活血益气、通络止痛,且国内外学者在DCM相关疾病领域已经开展了广泛研究[5],但关于TGF-β1/p38MAPK/CREB信号通路的相关研究未见报道。因此,研究采用原代分离大鼠心肌成纤维细胞,以不同浓度的通心络含药血清和阳性对照药物——缬沙坦含药血清处理细胞48 h后,检测心肌成纤维细胞功能及TGF-β1/p38MAPK/CREB信号通路蛋白的变化水平,拟为临床治疗DCM提供新的靶点。
1 材料与方法 1.1 实验材料与仪器大鼠心肌成纤维细胞(Zvast-Bio);波形蛋白(Vimentin,10366-1-AP,Proteintech);TGF-β1(AF1027,Affinity);山羊抗兔免疫球蛋白G(IgG)cy3(AS007,ABdonal);GlutaMAXTM(10565018,gibco);细胞增殖及毒性检测(CCK-8)细胞增殖检测试剂盒(KGA317,凯基生物);鼠抗β-Actin(HC201,TransGen Biotech);辣根过氧化物酶(HRP)标记的山羊抗小鼠(H+L)(GB23301,Servicebio);兔抗TGF-β1(AF1027,Affinity);兔抗磷酸化p38MAPK(p-p38MAPK,AF4001,Affinity);兔抗磷酸化CREB(p-CREB,AF3189,Affinity);荧光显微镜(CKX53,OLYMPUS);倒置荧光显微镜(MF53,广州市明美光电有限公司);NovoCyteTM流式细胞仪[NovoCyte 2060R,艾森生物(杭州)有限公司];多功能酶标分析仪(SuPerMax3100,上海闪谱生物科技有限公司);全自动酶标仪(WD-2102B,北京市六一仪器厂);蛋白垂直电泳仪(DYY-6C,北京市六一仪器厂);恒温摇床(TC-100B,上海领成生物科技有限公司);超高灵敏度化学发光成像系统[Chemi DocTM XRS+,伯乐生命医学产品(上海)有限公司];全自动化学发光图像分析系统(Tanon-5200,上海天能科技有限公司)。
缬沙坦胶囊购自北京诺华制药有限公司(国药准字:H51023583,中国北京)。通心络胶囊(批准号:Z19980015,批号:101005)由石家庄以岭大药房(中国河北)提供。甘露醇(J06D10R104863)购自上海叶原生物技术有限公司。葡萄糖(G107850)购自上海阿拉丁生化科技有限公司。
超高压液相(Agilent 1290,Agilent Technologies);高分辨质谱(Agilent 6545 QTOF,Agilent Technologies);色谱柱(ACQUITY UPLC HSS T3 1.8 μm,2.1 mm×100 mm,Waters);乙腈(Merck,德国达姆施塔特);甲醇(Merck,德国达姆施塔特);甲酸(上海安谱实验科技股份有限公司,中国上海);超纯水(Merck,德国达姆施塔特);乙酸铵(上海安谱实验科技股份有限公司,中国上海)。
1.2 实验动物SPF级雄性SD大鼠,体质量(220±20) g,由宁夏医科大学医学院实验动物中心提供。实验均在已经获批且发布的指南/标准指导下进行,已经通过宁夏医科大学伦理委员会批准。
1.3 大鼠含药血清的制备适应性喂养1周后,将大鼠随机分为5组,每组15只。对照血清组(相当于5 mmol/L葡萄糖溶液)、通心络胶囊低药血清组[0.25 g/(kg·d)]、通心络胶囊中药血清组[0.50 g/(kg·d)]、通心络胶囊高药血清组[1.00 g/(kg·d)]均灌胃给药,每日2次。阳性药物组[0.9%生理盐水配制成含缬沙坦1.6 mg/mL溶液,30 mg/(kg·d)]灌胃给药,每日1次。各组均连续灌胃7 d,末次灌胃结束后1 h下腔静脉采血,离心分离血清(离心半径6.26 cm,转速3 000 r/min,离心时长10 min),56 ℃灭活30 min,于-80 ℃单独储存。后续根据20%含药血清的剂量制备培养基,加入至细胞中进行处理。
1.4 原代细胞鉴定在培养板中将已经完成细胞爬片的培养皿使用磷酸缓冲盐溶液(PBS)浸洗3次,每次5 min;4%多聚甲醛固定30 min,使用PBS浸洗培养皿3次;移液枪吸净PBS,在培养皿中滴加5%牛血清白蛋白(BSA),37 ℃封闭30 min;移液枪吸掉多余液体,将稀释好的一抗Vimentin(1∶100)足量滴加至培养皿内;湿盒内4 ℃孵育过夜;PBS浸洗后滴加稀释好的荧光二抗三甲川花菁染料(Cy3,1∶200),37 ℃孵育30 min,PBS浸洗,滴加4’,6-二脒基-2-苯基吲哚(DAPI)避光孵育5 min,对标本进行细胞核染色;用50%甘油封闭培养皿,通过荧光显微镜观察并采集图像。
1.5 细胞活力测定将细胞接种于96孔板的100 μL培养基中,每孔4 000个细胞。根据造模条件分为3组:对照组、甘露醇组(54.5 mmol/L甘露醇)、模型组(25 mmol/L葡萄糖)。细胞分别培养0、6、12、24、48、72 h后,将10 μL细胞增殖及毒性检测(CCK-8)溶液添加至各孔中,孵育2 h,温度设置为37 ℃。在450 nm波长下通过酶标仪测定吸光度值。在每个时间节点,采用CCK-8检测各组细胞活力,筛选最佳造模时间。
1.6 细胞培养及实验分组待细胞密度至80%~90%时需要对细胞进行传代。加入0.25%胰酶[含0.02%(EDTA)]进行消化,等待细胞变圆后加入培养基终止消化,并收集细胞悬液至10 mL离心管中,1 000 r/min离心3 min(离心半径10 cm),弃去上清液,后加入培养基重悬细胞;以1∶3的比例将细胞悬液分配至培养皿中,最后置于培养箱中。将不同浓度的通心络、缬沙坦含药血清置于水浴锅56 ℃灭活30 min,按照20%含药血清用量配制培养基,加入细胞中处理48 h。
实验共分为8组,分别为对照组、甘露醇组(54.5 mmol/L甘露醇)、模型组(25 mmol/L葡萄糖)、模型组+对照组(20%对照血清)、模型组+低剂量血清(5%通心络含药血清+15%对照血清)、模型组+中剂量血清(10%通心络含药血清+10%对照血清)、模型组+高剂量血清(20%通心络含药血清)、模型组+阳性药物(20%缬沙坦含药血清)。
1.7 CCK-8法检测待测的96孔板细胞样本具有100 μL相同的培养基。每孔加入10 μL的CCK-8试剂,培养箱中孵育2 h。酶标仪在450 nm波长处检测每孔吸光度值。
1.8 流式细胞仪检测细胞凋亡将收集得到的1×106~3×106个细胞,加入1 mL的PBS,1 500 r/min离心3 min(离心半径10 cm),清洗2遍。采用双蒸水将5×Binding Buffer稀释为1×Binding Buffer,以预冷的1×Binding Buffer重悬细胞300 μL。各自加入5 μL的Annexin V-FITC与10 μL的碘化丙啶(PI)。轻微混匀后,室温避光孵育15 min。每罐中加入200 μL预冷的1×Binding Buffer。混匀后使用流式细胞仪进行检测。
1.9 ELISA法检测细胞内半胱氨酸天冬氨酸蛋白酶-3(Caspase-3)、B淋巴细胞瘤2(Bcl-2)和转化生长因子-β1(TGF-β1)蛋白的分析使用ELISA法,具体操作流程根据试剂盒说明书进行。在96孔板的各孔中加入50 μL样品,再加入生物素-抗原工作液50 μL。将平板37 ℃孵育30 min,并用缓冲液洗涤5次,加入亲和HRP抗体进行第2次孵育。经过2次洗涤后,将底物A、B加入每个孔中,各50 μL,避光孵育10 min(37 ℃)。最后每孔加入终止液50 μL,15 min后在450 nm波长处测定各孔吸光度值。
1.10 免疫荧光检测用PBS将在培养板中完成细胞爬片的培养皿浸洗3次,每次用时3 min;4%多聚甲醛固定15 min,培养皿以PBS浸洗3次,每次用时3 min;然后将组织周围的PBS吸净,在玻片上滴加5%BSA,37 ℃封闭30 min;培养皿内的封闭液用移液枪吸干,不需要清洗,将稀释好的足够量的一抗TGF-β1(1∶200)滴加至每个培养皿中;放入4 ℃冰箱过夜。
将37 ℃孵育过的培养皿取出,培养皿以PBS浸洗3次,每次5 min,滴加稀释好的荧光二抗cy3(1∶200),37 ℃孵育30 min,PBS充分淋洗;滴加DAPI避光孵育3 min,对标本进行细胞核染色,将多余的DAPI以PBS冲洗,50%甘油封闭培养皿;在荧光显微镜下观察培养皿并采集图像。
1.11 蛋白免疫印记(Western blot)法检测取各组细胞样品,加入细胞裂解液并弃去细胞培养液,置于冰上20 min,12 000 r/min离心10 min(离心半径10 cm)。取上清液,移至新的离心管,用于二喹啉甲酸(BCA)法测定,弃去沉淀。吸取上清液后加入缓冲液,煮沸5 min,得到总蛋白,保存于-20 ℃,并用BCA试剂盒检测细胞上清中的蛋白质浓度,绘制标准曲线。
制作十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)凝胶,上样,开始泡胶电泳,转膜。3%脱脂牛奶封闭液封闭1 h。一抗孵育过夜,洗膜3次;二抗孵育2 h,洗膜3次。发光液浸湿聚偏氟乙烯(PVDF)膜后放置于超高灵敏度化学发光成像系统样品放置区,运行程序显影成像,检测TGF-β1、p-p38MAPK及p-CREB的蛋白表达含量。
1.12 统计学分析采用SPSS 20.0软件进行统计学分析,所有实验重复3次。计量资料采用均数±标准差(x±s)表示,组间比较采用单因素方差分析,两两比较采用LSD法,采用Graphpad prism 9绘图。P < 0.05表示差异有统计学意义。
2 实验结果 2.1 原代细胞鉴定结果于大鼠心脏组织中分离出心肌成纤维细胞。70%非心肌细胞与30%心肌细胞组成心脏组织,在非心肌细胞中心肌成纤维细胞占比较多(90%)。心肌成纤维细胞体积较大,轮廓清晰,其细胞核为卵圆形,核仁明显且较大,以突起的纺锤形或星形的扁平状居多。心肌成纤维细胞不仅负责细胞基质外的合成,而且可以产生旁分泌生长因子,同样对心肌细胞起到结构支持作用。采用Vimentin抗体免疫荧光鉴定心肌成纤维细胞,细胞阳性率可以达到90%以上,见图 1。Vimentin的分子量约为54 kDa,是一种在细胞中维持细胞骨架完整性的Ⅲ型中间丝蛋白,被广泛应用于鉴定心肌成纤维细胞的表面标志蛋白。
|
| 注:图A,细胞核染色结果;图B,细胞质染色结果;图C,细胞核与细胞质染色结果。 图 1 大鼠心肌成纤维细胞免疫荧光鉴定结果(×400) |
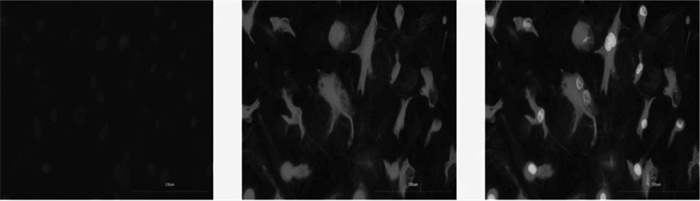
为了阐明细胞活力与高葡萄糖水平对渗透压升高的影响不具有关联性,因此选择与甘露醇进行比较。根据实验处理条件,将成纤维细胞分为对照组、甘露醇组、模型组。使用CCK-8法在不同时间节点检测各组细胞的增殖活性,提示葡萄糖的细胞活力在12 h开始显著升高,72 h后下降,而甘露醇对细胞具有损伤作用(P < 0.05)。因此,选择48 h进行下一步实验。见图 2。
|
| 注:相同时间节点与对照组比较,*P < 0.05。 图 2 不同时间节点细胞增殖活性结果(x±s) |
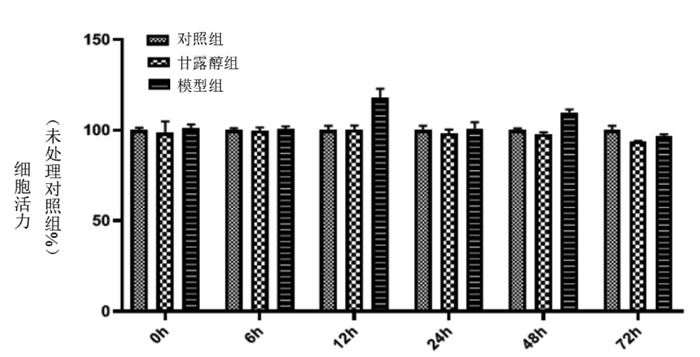
细胞培养48 h后,采用CCK-8法检测细胞增殖活性。模型组+对照组的心肌成纤维细胞增殖显著增加(P < 0.05),表明高葡萄糖水平可以诱导细胞增殖。加入通心络含药血清后,成纤维细胞增殖减弱(P < 0.05),中剂量通心络血清较为明显,说明通心络对成纤维细胞的增殖具有抑制作用。见图 3。
|
| 注:与对照组比较,*P < 0.05;与模型组比较,#P < 0.05。 图 3 通心络、缬沙坦含药血清对细胞增殖活性的影响(x±s) |
采用流式细胞仪检测不同浓度通心络含药血清对大鼠心肌成纤维细胞凋亡的影响,结果提示与对照组比较,模型组细胞凋亡率升高(P < 0.05)。与模型组比较,不同浓度通心络与缬沙坦含药血清能够降低细胞凋亡率(P < 0.05),表明含药血清对大鼠心肌成纤维细胞具有保护作用,且中剂量通心络含药血清处理后的细胞凋亡率最低。见图 4。
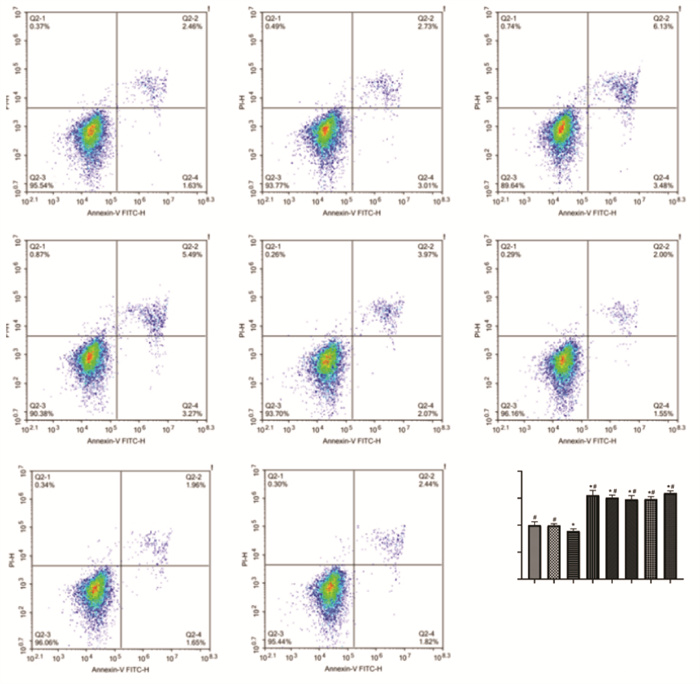
|
| 注:与对照组比较,*P < 0.05;与模型组比较,#P < 0.05。 图 4 细胞凋亡情况(x±s) |
采用ELISA法检测细胞上清液的TGF-β1蛋白表达及细胞内Caspase-3、Bcl-2、TGF-β1水平。与对照组比较,模型组Caspase-3蛋白表达升高(P < 0.05);与模型组比较,阳性药物含药血清组及不同浓度通心络含药血清组Caspase-3蛋白表达均降低(P < 0.05)。与对照组比较,模型组、不同浓度通心络含药血清组及阳性药物含药血清组Bcl-2升高(P < 0.05);与模型组比较,甘露醇组及中剂量通心络含药血清组Bcl-2表达偏低(P < 0.05)。与对照组比较,模型组细胞内TGF-β1及细胞上清液TGF-β1升高(P < 0.05);与模型组比较,不同浓度通心络含药血清组及阳性药物含药血清组TGF-β1蛋白表达降低(P < 0.05)。见图 5。

|
| 注:与对照组比较,*P < 0.05;与模型组比较,#P < 0.05。 图 5 Caspase-3、Bcl-2、TGF-β1蛋白表达情况(x±s) |
采用免疫荧光染色检测细胞中TGF-β1蛋白表达,细胞核为蓝色荧光,TGF-β1阳性表达为红色荧光。与对照组比较,模型组TGF-β1阳性表达呈升高趋势,高葡萄糖水平诱导心肌成纤维细胞促进了TGF-β1蛋白表达;与模型组比较,经阳性药物含药血清及不同浓度通心络含药血清处理后,TGF-β1阳性表达降低,表明含药血清对TGF-β1蛋白表达具有一定抑制作用。见图 6。
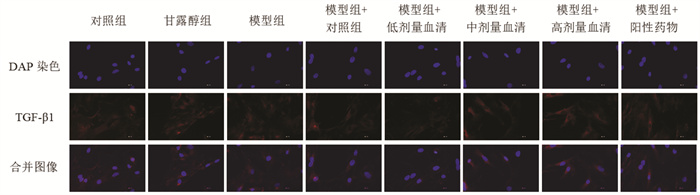
|
| 图 6 免疫荧光染色检测TGF-β1蛋白表达情况(×400) |
与对照组比较,模型组TGF-β1、p-p38MAPK、p-CREB蛋白表达升高(P < 0.05),提示高葡萄糖环境激活了TGF-β1/p38MAPK/CREB信号通路;与模型组比较,不同浓度通心络含药血清组及阳性药物含药血清组TGF-β1、p-p38MAPK、p-CREB蛋白表达降低(P < 0.05),表明含药血清对TGF-β1/p38MAPK/CREB信号通路的表达具有调控作用。见图 7。
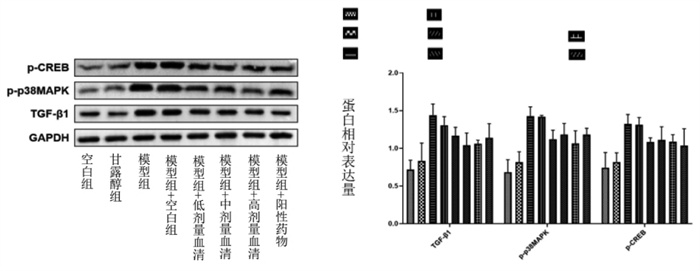
|
| 注:与对照组比较,*P < 0.05;与模型组比较,#P < 0.05。 图 7 Western blot法检测TGF-β1、p-p38MAPK、p-CREB蛋白表达情况(x±s) |
目前,DCM的具体发病机制尚不明确。由于缺乏对该病相关的临床研究,DCM的精准诊断与治疗存在困难,常被误诊为冠状动脉粥样硬化性心脏病[6]。DCM的组织学特征是心肌纤维化,系糖尿病的相关并发症之一。糖尿病诱导的心脏重塑可能参与舒张和收缩功能障碍,导致充血性心力衰竭[7]。心肌间质胶原沉积和成纤维细胞过度增殖是心肌纤维化的基本特征。心肌成纤维细胞是心脏中最丰富的细胞类型,在心肌纤维化及心脏重塑中发挥关键作用[8]。抑制成纤维细胞增殖和胶原分泌对预防与治疗DCM非常重要。高血糖水平通常会诱发心肌异常增生[9-10]。高葡萄糖水平可以导致糖尿病患者心肌TGF-β1及其受体的表达水平增强[11]。TGF-β1被认为是纤维化疾病发展的主要驱动因素,不仅可以诱导心肌成纤维细胞转化、增生,而且可以调节细胞增殖分化,提高胶原异常高表达,从而诱导心肌纤维化[12]。在此研究中,高葡萄糖环境促进心肌成纤维细胞增殖并增加TGF-β1蛋白表达。与甘露醇组比较的结果,证明高葡萄糖水平诱导的大鼠心肌成纤维细胞增殖,并非由于过量葡萄糖引起的渗透压增加造成。
在心脏纤维化过程中,复杂的分子机制在调节心脏成纤维细胞凋亡中起着关键作用,已经被证明与纤维化的发生密切相关。凋亡细胞作为纤维化过程的驱动因素,可以直接作用于心肌成纤维细胞,增强细胞增殖和促纤维化表型[13]。心肌成纤维细胞凋亡的发生可以由高葡萄糖水平诱导。胱天蛋白酶是细胞质溶胶中与细胞增殖、分化、迁移密切相关的半胱氨酸蛋白酶。Caspase-3是胱天蛋白酶家族中13种天冬氨酸特异性半胱氨酸蛋白酶之一,在细胞凋亡的执行中发挥核心作用,并且主要负责细胞凋亡过程中多聚腺苷二磷酸核糖聚合酶(PARP)的裂解[14]。Bcl-2是一种能够抑制细胞凋亡的原癌基因,主要因为其可以调节多种细胞增殖和凋亡的相关蛋白活性[15]。结果显示,在高葡萄糖环境下,心肌成纤维细胞的凋亡明显增加,Caspase-3的表达也明显增加,表明心肌细胞凋亡在DCM中较为常见,与既往研究结果一致[16]。凋亡会导致心力衰竭发展和心室功能慢性丧失,代偿性引起Bcl-2表达增加[17]。
中医药作为替代医学的重要补充,在DCM治疗中有着悠久的应用历史,是一种被广泛用于DCM治疗的较好策略[18]。通心络的功效为益气活血、通络止痛,主要由水蛭、全蝎、土鳖虫、蜈蚣、蝉蜕、人参、赤芍和冰片等药物组成。研究表明,通心络在临床治疗中具有改善心脏重构、射血功能、血流动力学和血糖水平的作用,但评价不一,报道有限。实验选用通心络含药血清,在心肌成纤维细胞培养基中加入20%不同浓度的通心络含药血清作用于细胞48 h后,发现高葡萄糖环境引起的细胞增殖和凋亡受到抑制,TGF-β1也受到抑制,TGF-β1蛋白的表达对心肌成纤维细胞具有明显的保护作用。
此外,文章还研究了TGF-β1/p38MAPK/CREB信号通路在DCM中的可能机制。p38MAPK通路在许多生物学过程中发挥作用,包括细胞迁移、凋亡、心肌病发展等。研究发现,受抑制的p38MAPK可以维持细胞的骨架结构,并且可以保护心肌免受损伤,而这主要是通过减轻氧化应激和炎症来实现的[19]。大量证据表明,高葡萄糖环境可以直接激活p38MAPK信号传导,并且p38MAPK与TGF-β1之间存在相互作用关系,由此可见TGF-β1与p38MAPK通路的激活相关[20]。p38MAPK通路的激活可以调节TGF-β1的转录与合成,更改通路的上游因子为TGF-β1,通过增强p38MAPK的活性发挥其生物学活性功能。p38MAPK是大鼠心脏CREB的上游调节剂。当p38MAPK被激活时,可以激活CREB等相关转录因子,CREB通过磷酸化调节细胞的增殖与分化[21-22]。研究表明,p38MAPK通过被各种刺激所激活,进而调控细胞的增殖、生长、分化[23]。TGF-β1的生物作用较为广泛,可以参与糖尿病肾病的发生发展过程。p38MAPK属于丝裂原活化蛋白激酶(MAPK)通路成员,参与细胞生物学行为过程,调节TGF-β1表达[24]。高葡萄糖环境可以激活p38MAPK/CREB通路,实验结果也证实了这一观点。在通心络含药血清的作用下,TGF-β1/p38MAPK/CREB信号通路被抑制。
综上所述,通心络含药血清对高葡萄糖环境下的心肌成纤维细胞具有保护作用,其保护机制可能是通过激活TGF-β1/p38MAPK/CREB信号通路实现的。中剂量的通心络含药血清对DCM的抑制作用尤其显著,但是细胞内的信号传导机制还有待进一步进行探索。
| [1] |
SALVATORE T, PAFUNDI P C, GALIERO R, et al. The diabetic cardiomyopathy: the contributing pathophysiological mechanisms[J]. Frontiers in Medicine, 2021, 8(11): 695-712. |
| [2] |
RITCHIE R H, ABEL E D. Basic mechanisms of diabetic heart disease[J]. Circulation Research, 2020, 126(11): 1501-1525. DOI:10.1161/CIRCRESAHA.120.315913 |
| [3] |
MURTAZA G, VIRK H U H, KHALID M, et al. Diabetic cardiomyopathy-a comprehensive updated review[J]. Progress in Cardiovascular Diseases, 2019, 62(4): 315-326. DOI:10.1016/j.pcad.2019.03.003 |
| [4] |
ZHENG D Z, ZHANG Y, HU Y H, et al. Long noncoding RNA Crnde attenuates cardiac fibrosis via Smad3-Crnde negative feedback in diabetic cardiomyopathy[J]. The FEBS Journal, 2019, 286(9): 1645-1655. DOI:10.1111/febs.14780 |
| [5] |
HAN S, HOU Y, LIU H M, et al. The efficacy and safety of traditional Chinese medicine treating diabetic cardiomyopathy: a protocol for systematic review and meta-analysis[J]. Medicine, 2022, 101(47): e31269-e31280. DOI:10.1097/MD.0000000000031269 |
| [6] |
LI W F, WANG P, LI H, et al. Oleanolic acid protects against diabetic cardiomyopathy via modulation of the nuclear factor erythroid 2 and insulin signaling pathways[J]. Experimental and Therapeutic Medicine, 2017, 14(1): 848-854. DOI:10.3892/etm.2017.4527 |
| [7] |
CHEN D L, RUAN X, LIU Y, et al. HMGCS2 silencing attenuates high glucose-induced in vitro diabetic cardiomyopathy by increasing cell viability, and inhibiting apoptosis, inflammation, and oxidative stress[J]. Bioengineered, 2022, 13(5): 11417-11429. DOI:10.1080/21655979.2022.2063222 |
| [8] |
ZHANG Y, LU Y, ONG'ACHWA M J, et al. Resveratrol inhibits the TGF-β1-induced proliferation of cardiac fibroblasts and collagen secretion by downregulating miR-17 in rat[J]. BioMed Research International, 2018, 201(8): 873-893. |
| [9] |
FALCÃO-PIRES I, PALLADINI G, GONÇALVES N, et al. Distinct mechanisms for diastolic dysfunction in diabetes mellitus and chronic pressure-overload[J]. Basic Research in Cardiology, 2011, 106(5): 801-814. DOI:10.1007/s00395-011-0184-x |
| [10] |
SHEN Y L, JIANG Y P, LI X Q, et al. ErHuang formula improves renal fibrosis in diabetic nephropathy rats by inhibiting CXCL6/JAK/STAT3 signaling pathway[J]. Frontiers in Pharmacology, 2019, 10(9): 1596-1605. |
| [11] |
SARRAZY V, KOEHLER A, CHOW M L, et al. Integrins αvβ5 and αvβ3 promote latent TGF-β1 activation by human cardiac fibroblast contraction[J]. Cardiovascular Research, 2014, 102(3): 407-417. DOI:10.1093/cvr/cvu053 |
| [12] |
ACCORNERO F, VAN BERLO J H, CORRELL R N, et al. Genetic analysis of connective tissue growth factor as an effector of transforming growth factor β signaling and cardiac remodeling[J]. Molecular and Cellular Biology, 2015, 35(12): 2154-2164. DOI:10.1128/MCB.00199-15 |
| [13] |
WANG L, ZHANG J. Exosomal lncRNA AK139128 derived from hypoxic cardiomyocytes promotes apoptosis and inhibits cell proliferation in cardiac fibroblasts[J]. International Journal of Nanomedicine, 2020, 15(18): 3363-3376. |
| [14] |
CHU H H, LI M, WANG X C. Capsaicin induces apoptosis and autophagy in human melanoma cells[J]. Oncology Letters, 2019, 17(6): 4827-4834. |
| [15] |
ZHANG J, ZHANG P, ZOU Q, et al. Co-delivery of gemcitabine and paclitaxel in cRGD-modified long circulating nanoparticles with asymmetric lipid layers for breast cancer treatment[J]. Molecules, 2018, 23(11): 2906-2919. DOI:10.3390/molecules23112906 |
| [16] |
WANG X M, MU C Z, MU T C, et al. Effects of Tongxinluo on myocardial fibrosis in diabetic rats[J]. Journal of the Chinese Medical Association, 2016, 79(3): 130-136. DOI:10.1016/j.jcma.2015.06.022 |
| [17] |
WANG Y, LI M, XU L, et al. Expression of Bcl-2 and microRNAs in cardiac tissues of patients with dilated cardiomyopathy[J]. Molecular Medicine Reports, 2017, 15(1): 359-365. DOI:10.3892/mmr.2016.5977 |
| [18] |
ZHANG S Y, YANG K L, LONG Z Y, et al. Use of a systematic pharmacological methodology to explore the mechanism of Shengmai Powder in treating diabetic cardiomyopathy[J]. Medical Science Monitor, 2020, 26(17): e9190-e9209. |
| [19] |
YU J H, WANG L Y, AKINYI M, et al. Danshensu protects isolated heart against ischemia reperfusion injury through activation of Akt/ERK1/2/Nrf2 signaling[J]. International Journal of Clinical and Experimental Medicine, 2015, 8(9): 14793-14804. |
| [20] |
WANG S, ZHOU Y, ZHANG Y, et al. Roscovitine attenuates renal interstitial fibrosis in diabetic mice through the TGF-β1/p38 MAPK pathway[J]. Biomedecine & Pharmaco- therapie, 2019, 115(11): 1088-1095. |
| [21] |
LIU B S, ZHANG R, WEI S J, et al. ALDH2 protects against alcoholic cardiomyopathy through a mechanism involving the p38 MAPK/CREB pathway and local renin-angiotensin system inhibition in cardiomyocytes[J]. International Journal of Cardiology, 2018, 257(1): 150-159. |
| [22] |
OUYANG S, WEI C, ZENG G F, et al. Cyanidin-3-O-β-glucoside protects against pulmonary artery hypertension induced by monocrotaline via the TGF-β1/p38 MAPK/CREB signaling pathway[J]. Molecular Medicine Reports, 2021, 23(5): 338-351. DOI:10.3892/mmr.2021.11977 |
| [23] |
覃春美, 李刚, 程宗华, 等. 山楂叶总黄酮调控肾组织p38MAPK信号通路干预糖尿病肾病大鼠氧化应激损伤的实验研究[J]. 检验医学与临床, 2019, 16(21): 3131-3134. DOI:10.3969/j.issn.1672-9455.2019.21.017 |
| [24] |
张和平, 谢荣, 刘佳丽, 等. 抑制P2X7受体表达对高糖诱导的肾间质成纤维细胞TGF-β1/p38MAPK信号通路的影响[J]. 中国老年学杂志, 2022, 42(14): 3537-3540. DOI:10.3969/j.issn.1005-9202.2022.14.046 |
 2025, Vol. 44
2025, Vol. 44